 ,1,31
,1,31 2
3
Regulation Function of Trehalose-6-phosphate Synthase Genes on Chitin Synthesis in Sogatella furcifera
ZHANG DaoWei1, YU YaYa2, PAN BiYing3, KANG Kui1, ZENG BoPing1, CHEN Jing2, TANG Bin ,1,31
,1,31 2
3
通讯作者:
责任编辑: 岳梅
收稿日期:2019-05-5接受日期:2019-06-10网络出版日期:2019-10-01
| 基金资助: |
Received:2019-05-5Accepted:2019-06-10Online:2019-10-01
作者简介 About authors
张道伟,E-mail:zhangdw1000@163.com。

摘要
关键词:
Abstract
Keywords:
PDF (1147KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
张道伟, 余亚娅, 潘碧莹, 康奎, 曾伯平, 陈静, 唐斌. 白背飞虱海藻糖合成酶基因调控几丁质合成的功能[J]. 中国农业科学, 2019, 52(19): 3357-3366 doi:10.3864/j.issn.0578-1752.2019.19.007
ZHANG DaoWei, YU YaYa, PAN BiYing, KANG Kui, ZENG BoPing, CHEN Jing, TANG Bin.
0 引言
【研究意义】水稻(Oryza sativa)是我国最重要的粮食作物之一,保障水稻的高产、稳产在我国粮食安全生产中占有极其重要的地位。然而,水稻害虫种类较多[1],其中稻飞虱已成为水稻的头号害虫[2],其主要包括褐飞虱(Nilaparvata lugens)、白背飞虱(Sogatella furcifera)和灰飞虱(Laodelphax striatellus)3种。飞虱为单食性害虫,仅对水稻产生危害,其具有生命周期短、繁殖速度快、迁飞扩散能力和环境适应性强等特点[3,4,5,6]。目前,白背飞虱已成为我国以及亚洲部分国家水稻上的首要害虫,也是水稻中前期重要的迁飞性害虫之一,危害范围广,防治难度大[7]。探究白背飞虱海藻糖合成酶基因(SfTPS)对几丁质合成的影响,对筛选适合的害虫控制靶标防治白背飞虱具有重要意义。【前人研究进展】海藻糖作为一种双糖,不仅存在于植物、真菌和细菌中,在无脊椎动物中也分布较广,特别是在昆虫血淋巴中,海藻糖含量非常高,作为昆虫的“血糖”,在昆虫的生长发育、变态和繁殖等过程中均具有非常重要的功能[8,9]。海藻糖的合成途径不止一种,在昆虫中主要利用底物葡萄糖,通过海藻糖合成酶(trehalose-6-phosphate synthase,TPS)途径在脂肪体中合成[10,11],在能量需求时通过海藻糖酶(trehalase,TRE)降解为葡萄糖,从而进入能量代谢和几丁质合成通路中[12,13,14]。众所周知,几丁质和相应的蛋白质是昆虫外骨骼的主要组成部分,并且昆虫表皮、气管和围食膜等结构的主要成分也是几丁质,当幼虫生长到特定的阶段时都需要重塑几丁质结构,完成蜕皮行为,这个过程主要由几丁质合成通路和几丁质酶及其复合体共同完成[15]。几丁质合成通路中,总共包含8个不同的基因家族,海藻糖酶为昆虫几丁质合成通路的第一个酶,几丁质合成酶(chitin synthase,CHS)为几丁质合成的最后一个酶,也是最为重要的[13,15]。CHEN等研究表明,TRE和CHS的表达被抑制后,昆虫的几丁质合成均会受到严重的阻碍,导致其蜕皮困难,不能完成正常的生长发育而死亡[12,16-17]。【本研究切入点】在褐飞虱和德国小蠊(Blattella germanica)中克隆和发现了2个不同的TPS家族基因[18,19],尤其在褐飞虱中存在着第3条TPS[14,20-21]。采用RNAi技术抑制TPS的表达,同样能够引起昆虫的蜕皮困难,并导致昆虫一定的死亡率[19,22],这表明TPS在几丁质合成中起着一定的调控作用,但对其具体的调控作用以及不同TPS之间是否存在差异的研究较少。在白背飞虱中同样发现存在2条不同的SfTPS[23],该基因是否能够调控几丁质合成以及如何调控几丁质合成尚未明确,因此选择白背飞虱为研究对象探究SfTPS的功能。【拟解决的关键问题】研究白背飞虱SfTPS在其几丁质合成通路中的调控功能,评估昆虫海藻糖合成途径与几丁质合成途径的关联性,探索TPS是否具备成为害虫防治的靶标基因的潜力,为开发白背飞虱等水稻害虫的生物农药提供理论依据。1 材料与方法
试验于2018年在遵义师范学院和杭州师范大学完成。1.1 供试虫源
白背飞虱来自遵义师范学院生物与农业科技学院饲养种群,水稻品种全部采用感虫水稻TN-1。白背飞虱基因功能试验从4龄开始统一收集,待其长至5龄若虫后,用于后期注射试验。1.2 试验方法
1.2.1 总RNA的抽提及cDNA合成 白背飞虱的虫体总RNA抽提采用Trizol法,严格依据试剂盒说明书进行。提取后用1.2%的琼脂糖检测总RNA的质量,并用NanoDropTM 2000分光光度计测定其纯度和浓度。cDNA合成依据PrimeScript?RT reagent Kit With gDNA Eraser试剂盒说明书进行。1.2.2 dsRNA的合成 根据已知的白背飞虱TPS核苷酸序列,选择2个SfTPS合适的dsRNA特异性片段进行引物设计与合成。具体引物序列见表1,dsRNA的合成方法参考T7 RiboMAXTM Express RNAi System试剂盒的说明进行。合成的dsRNA采用NanoDropTM 2000测定浓度。同时以GFP为模板,采用同样的方法合成GFP的dsRNA,作为对照组[17]。最后,用于白背飞虱显微注射的dsRNA片段长度分别为dsSfTPS1(523 bp)、dsSfTPS2(509 bp)以及作为对照的dsGFP(738 bp),其中SfTPS1、SfTPS2 dsRNA设计区域比较见图1。
Table 1
表1
表1dsRNA合成引物序列
Table 1
| 引物名称 Primer name | 上游引物 Forward primer (5′-3′) | 下游引物 Reverse primer (5′-3′) | 产物长度 Length (bp) |
|---|---|---|---|
| dsSfTPS1 | CCCGTTGTGGTGAGAAATA | CAAGGTGGGAATGGAATG | 473 |
| dsSfTPS1-T7 | T7-CCCGTTGTGGTGAGAAATA | T7-CAAGGTGGGAATGGAATG | 523 |
| dsSfTPS2 | CGCATAGACCGCAACAAC | TCGCAACGGAGTAACCAG | 459 |
| dsSfTPS2-T7 | T7-CGCATAGACCGCAACAAC | T7-TCGCAACGGAGTAACCAG | 509 |
| dsGFP | AAGGGCGAGGAGCTGTTCACCG | CAGCAGGACCATGTGATCGCGC | 688 |
| dsGFP-T7 | T7-AAGGGCGAGGAGCTGTTCACCG | T7-CAGCAGGACCATGTGATCGCGC | 738 |
新窗口打开|下载CSV
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1白背飞虱TPS1、TPS2核苷酸序列比对图
Fig. 1Comparison of nucleotide sequence of TPS1 and TPS2 in S. furcifera
1.2.3 白背飞虱的显微注射、观察统计及材料选取 用于显微注射的材料分为dsSfTPS1、dsSfTPS2以及作为对照的dsGFP。取5龄第1天的白背飞虱用于显微注射,显微注射仪参数调节为注射压强200 hPa,注射时间0.5 s,补偿压20 hPa,注射量为50 ng/头。注射后将飞虱放入含水稻的玻璃管中,用棉塞塞住管口,将玻璃管放入人工气候室,环境条件设置为温度(26±0.5)℃;光周期L﹕D=16 h﹕8 h,相对湿度(50±5)%。24 h后白背飞虱的存活数为有效注射数。注射后分成4批饲养,每批≥3个重复。第1批每隔24 h观察白背飞虱的发育情况,在48 h和72 h统计畸形数和死亡数;第2批注射后48 h和72 h分别取材,进行荧光定量(qRT-PCR)分析RNAi抑制效果及SfCHS表达;第3批在注射后48 h 和72 h,用于测定几丁质含量;最后一批待其蜕皮为成虫后,观察畸形情况并进行拍照。
1.2.4 RNAi后SfTPS抑制效果及SfCHS表达量测定 白背飞虱显微注射后48 h和72 h取虫体材料用于qRT-PCR检测,引物见表2,试验方法参照张露等[24]。
Table 2
表2
表2实时荧光定量PCR检测引物序列
Table 2
| 引物名称 Primer name | 上游引物 Forward primer (5′-3′) | 下游引物 Reverse primer (5′-3′) | 产物长度 Length (bp) |
|---|---|---|---|
| Q-SfTPS1 | CCGATTCGCTACATCTACG | GACAAACTCTTTCGCCACTAA | 123 |
| Q-SfTPS2 | GATGCTGAGGGCAAAGAC | TGTGGAAGCCGACAAAGT | 226 |
| Q-SfCHS1 | GATTGGTCATTGGCTTCAGA | GTAATGTCTTGCTTCGTCAG | 151 |
| Q-SfCHS1a | CTTCGGTGTTTGGTTTCTT | TGGGTAACATCATCATAGGA | 136 |
| Q-SfCHS1b | GAGAAGGCGAGAATAGCA | GCAGCAAGAACACGATTA | 103 |
| Q-18S rRNA | GCCCCGTAATCGGAATGAGT | GACAAGACGTCCCGCAAAAC | 205 |
新窗口打开|下载CSV
1.2.5 几丁质含量的测定 白背飞虱几丁质所占比例的检测方法参考文献[24,25]并做适当修改。主要步骤包括:(1)消化管:在一根长约30—50 cm的橡胶管两头接上两个玻璃管,再取一根试管配带孔橡胶塞,将橡胶管一端的玻璃管嵌入橡胶塞中,另一端则通入水中,预防碱液溅出;(2)样品量:将白背飞虱分为每组40头,平行3组,50℃烘箱内烘干至恒重;(3)将烘干的白背飞虱进行称重,记为W1;(4)把烘干后虫体倒入消化管中,加入5 mL饱和氢氧化钾溶液,160℃甘油浴,加热至虫体变透明薄膜;(5)用滤纸制成漏斗状过滤残渣,小心用水冲洗干净后置于50℃烘箱中烘干,称重并计为W2;(6)按照公式计算几丁质的相对含量。几丁质的相对含量(%)=(W2/W1)×1.26×100,其中1.26为乙酰氨基葡萄糖与氨基葡萄糖的相对分子质量之比。
1.2.6 数据统计与分析 通过qRT-PCR测定基因的CT值,每个生物学重复均设3个技术重复,3个技术重复的数值进行两两比较,数值相差在0.5以内可用,3个数值中有2个或3个接近,数值可用,否则重做。每次样品有3组生物学重复,即最后得到的数据为平均值±9个重复。再利用2-ΔΔCT法运算,以白背飞虱dsGFP注射组的CT值为对照组。最后将换算出的值
再进行具体分析。2-ΔΔCT计算公式[26]:
2-ΔΔCT=2-[(CT对照组-CT对照18S)- (CT待测组-CT待测组18S)]
应用Excel软件整理数据,并使用SPSS软件进行统计分析,One-Way ANOVA法进行差异显著性检验(P<0.05为差异显著,用*表示;P<0.01为差异极显著,用**表示),数据表示为平均值±标准误。处理后的数据采用SigmaPlot 10.0作图。
2 结果
2.1 RNAi后SfTPS表达及蜕皮情况
采用dsRNA注射到白背飞虱体内后,发现RNAi能够有效抑制SfTPS表达。在dsSfTPS1和dsSfTPS2注射后48 h与72 h,SfTPS1和SfTPS2的表达分别极显著低于注射dsGFP后的表达,表达量不足对照组的30%;注射dsSfTPS1或dsSfTPS2后,非靶标SfTPS的表达同样极显著降低(图2-A、2-B)。dsSfTPS1和dsSfTPS2均能够引起白背飞虱蜕皮为成虫后翅畸形(图2-C),但是表皮蜕皮障碍不明显。图2
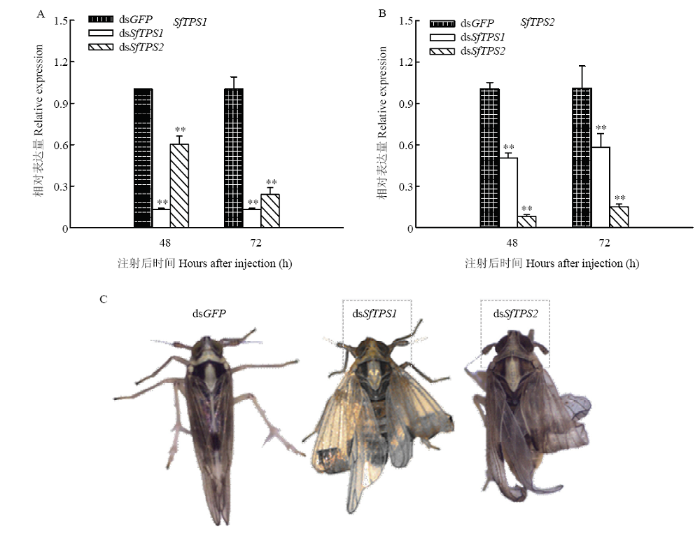 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2RNAi后白背飞虱TPS的相对表达量及成虫蜕皮情况
Fig. 2The relative expression of two TPSs and moulting of adults of S. furcifera after RNAi
2.2 RNAi抑制SfTPS表达后几丁质含量的变化
与对照组相比,dsSfTPS1注射后48 h和72 h几丁质含量极显著上升,而dsSfTPS2注射后72 h几丁质的含量同样极显著上升(图3)。结果表明,SfTPS表达下降反而促进了白背飞虱虫体中几丁质含量提高。图3
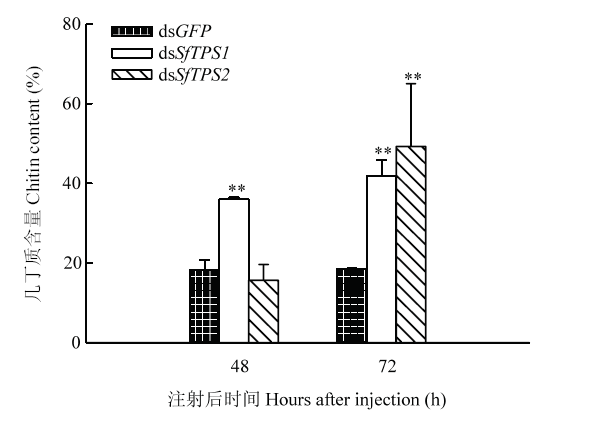 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3RNAi后白背飞虱体内几丁质的含量变化
Fig. 3Changes of chitin content in S. furcifera after RNAi
2.3 SfTPS RNAi后SfCHS及可变转录子表达变化
飞虱中不存在CHS2家族基因,但CHS1存在两个不同的间接变异体[27]。采用RNAi抑制SfTPS1和SfTPS2表达后,在mRNA水平上检测几丁质合成酶SfCHS1及其两个不同转录子SfCHS1a和SfCHS1b的表达。结果显示SfCHS1与SfCHS1a表达趋势一致,与对照注射dsGFP组相比,注射dsSfTPS1后72 h表达量极显著上升,而在48 h时无显著差异;注射dsTPS2后48 h和72 h时表达量均极显著上升(图4-A、4-B)。此外,注射dsSfTPS1和dsSfTPS2后能够有效提高SfCHS1b的表达,SfCHS1b在SfTPS1和SfTPS2表达被抑制后的48 h和72 h的表达量均为极显著升高(图4-C)。图4
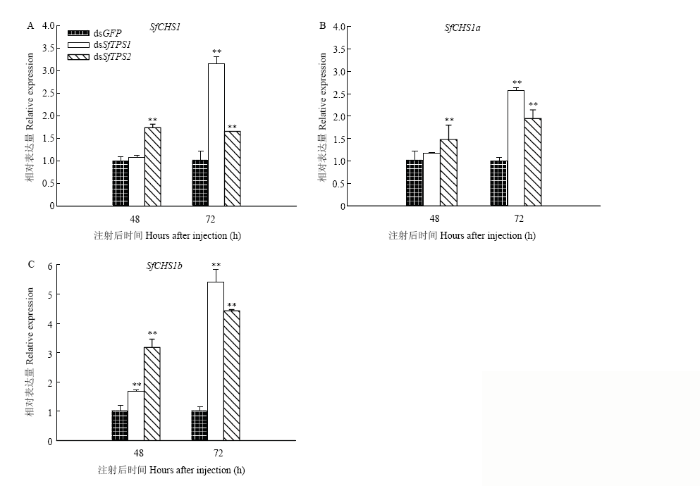 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4SfTPS RNAi后SfCHS及可变转录子的相对表达量
Fig. 4The relative expression of SfCHS and variants transcripts after SfTPS RNAi
2.4 SfTPS RNAi后白背飞虱的畸形率和死亡率
为了解几丁质合成提高对畸形率和死亡率的影响,测定了SfTPS1和SfTPS2表达被抑制后48 h和72 h的畸形率和死亡率。结果表明,尽管dsSfTPS1和dsSfTPS2注射后48 h和72 h白背飞虱死亡率相对较低,72 h内死亡率未超过10%,但与注射dsGFP组相比,均存在显著或极显著差异(图5-A);dsGFP组处理后,白背飞虱无畸形情况出现,但SfTPS1和SfTPS2表达被抑制后48 h畸形率显著或极显著上升,且在72 h均极显著上升(图5-B)。图5
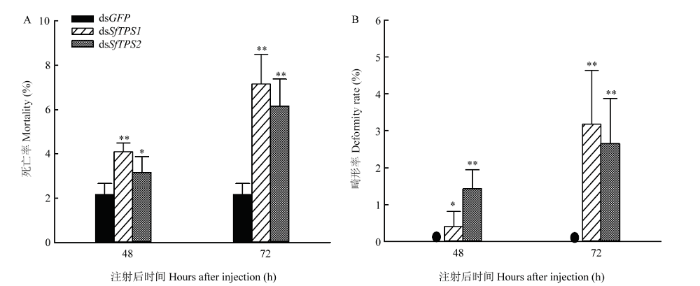 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5SfTPS RNAi后白背飞虱的畸形率和死亡率

Fig. 5Deformity rate and mortality of S. furcifera after SfTPS RNAi
The deformity rate of dsGFP control group is 0
3 讨论
海藻糖在脂肪体中合成后,会被释放到血淋巴中,通过淋巴循环输送到各个组织中发挥功能[22,28]。AVONCE等研究表明,海藻糖具有5种不同的潜在合成途径,昆虫主要通过海藻糖合成酶(TPS)/海藻糖-6-磷酸脂酶(TPP)途径[29],也很有可能能够直接通过单一的TPS来完成,TPS包含了TPS和TPP两个保守结构域,且不少物种未发现单独TPP [14]。目前,在德国小蠊、褐飞虱和白背飞虱中发现2个或2个以上的TPS [18,19],而在荒漠甲虫小胸鳖甲(Microdera punctipennis)的高通量测序中发现了5个潜在TPS的Unigenes[30],这些结果表明昆虫的海藻糖合成途径一直在进化中,但是如何进化以及具体的进化方向却研究较少。基于海藻糖的重要功能,TPS的研究也受到越来越多的关注,其功能研究的主要方法就是通过RNAi技术,采用注射dsRNA或siRNA抑制其基因的表达[31],探索其调控的潜在通路等。RNAi抑制通常具有沉默特定基因的功能,然而最新的研究发现当基因被敲低或敲除后,同家族基因会存在互补效应,即表达上升[32],这种现象在褐飞虱TRE中同样存在[33]。然而,在褐飞虱体内单独干扰TPS1和TPS2,结果表明无论干扰TPS1还是TPS2,TPS1与TPS2的转录量均减少[19];本试验中,当注射dsSfTPS1或dsSfTPS2后,另外一个SfTPS的表达同样受到抑制(图2-A、2-B),原因可能与SfTPS相对保守程度较高有关,需要进一步研究确定。当沉默昆虫发育的关键基因后,通常会在不同的组织表型上显示出来[34,35,36]。如甜菜夜蛾(Spodoptera exigua)TPS表达被抑制后48 h和204 h,其死亡率分别为50.94%和66.76%,显著低于dsGFP对照组[22]。同样,褐飞虱TPS1和TPS2表达被抑制后,成虫出现蜕皮障碍,翅不能完全形成,畸形率达到20%,而死亡率接近30%[19];褐飞虱TPS3表达被抑制后,同样出现类似的蜕皮畸形现象[21];而在白背飞虱中,未发现蜕皮困难的畸形,仅发现翅能够生长完整,但存在一定的畸形(图2-C),72 h内死亡率也比畸形率要高(图5)。综合褐飞虱和白背飞虱TPS的功能研究情况,表明部分飞虱在TPS表达被抑制后,无明显的畸形便死亡,其原因可能是肠道围食膜或气管的几丁质合成受到影响[37],更为可能的是由于能量代谢被调控而引起死亡[11]。
几丁质合成的通路始于海藻糖酶,终于几丁质合成酶(CHS),几丁质合成和降解的动态平衡在昆虫蜕皮中起着尤为重要的作用[13,15]。抑制褐飞虱CHS1、CHS1a和CHS1b表达后发现,对CHS1和CHS1a的干扰会导致褐飞虱翅畸形、细腰、表皮皱缩甚至死亡[27]。而当TRE表达被抑制时,昆虫同样会出现发育畸形、体重减轻、几丁质合成减少、生长受阻、飞行减少甚至死亡的现象[10],特别是采用海藻糖酶抑制剂处理褐飞虱后,其几丁质含量显著下降[38]。这些研究表明,TRE和CHS等表达抑制后,会降低几丁质含量,而本试验中发现白背飞虱TPS1和TPS2表达被抑制后,几丁质含量基本是显著上升的(图3),飞虱成虫翅发育为长翅,无缩小畸形等,也间接表明几丁质含量较高(图2-C)。而在赤拟谷盗(Tribolium castaneum)中,TPS表达抑制后,CHS1在72 h存在上升或显著上升,CHS2在48 h和72 h均显著下降,部分虫体不能正常化蛹,并且几丁质含量降低[39]。这是否说明TRE和TPS可能调控飞虱几丁质通路的结果或效果不同?TRE能够抑制CHS或提高几丁质酶(chitiase,Cht)的表达[25,33],打破合成的平衡,导致几丁质含量降低。而TPS表达抑制后,能够促进CHS的表达(图4),增加几丁质含量(图3),并且在时间节点上,干扰白背飞虱TPS1和TPS2后几丁质含量及CHS1a、CHS1b的变化趋势一致,而CHS1在时间节点的变化趋势有差异(图3、图4),这说明两个TPS对几丁质代谢的影响机制不完全相同。同样部分昆虫中TPS表达被抑制后也能够使几丁质的合成受到抑制[39],导致几丁质代谢平衡的紊乱。对褐飞虱TPS1和TPS2的功能研究发现,当TPS1和TPS2表达抑制后48 h,CHS1a和CHS1b表达降低或显著降低,而CHS1和CHS1a在72 h却表达上升或显著上升[33]。为什么在飞虱和赤拟谷盗中存在不一样的情况,可能与飞虱的短翅和长翅型有一定的关联,图2-C中白背飞虱为长翅型,其几丁质含量在上升,而褐飞虱短翅型中几丁质合成明显受到阻碍[19]。综上所述,当抑制白背飞虱几丁质合成通路中TPS或其他酶基因的表达,会导致几丁质含量降低从而导致蜕皮困难现象;而几丁质含量的上升也能导致昆虫翅发育畸形及死亡。
4 结论
海藻糖合成酶基因(TPS)作为海藻糖合成的关键基因,其能够介导几丁质合成酶基因(CHS)表达以调控几丁质合成,即当白背飞虱海藻糖合成途径中TPS表达被抑制后,会通过促进CHS的表达,提高几丁质含量,影响昆虫的生长及翅发育。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
Magsci [本文引用: 1]

海藻糖酶(Treh)是昆虫能量代谢必不可少的一类酶, 亦是昆虫体内几丁质合成通路的第一个酶。其基因表达和酶活性直接与正常发育、 蜕皮、 变态以及繁殖等昆虫重要生理过程密切相关。目前已有多种昆虫的海藻糖酶基因被成功克隆, 从而发现昆虫海藻糖酶基因家族由多个成员组成。海藻糖酶基因所编码的蛋白大多数具有一个信号肽前导区, 部分蛋白拥有1~2个跨膜结构域, 根据是否具有跨膜结构, 可将其分为可溶性海藻糖酶(Treh1)和膜结合型海藻糖酶(Treh2)两类, 膜结合型海藻糖酶具有2个特有的标签序列, 即“PGGRFREFYYWDSY”和“QWDYPNAWPP”。海藻糖酶的主要功能是将胞外和胞内的海藻糖降解成葡萄糖, 为昆虫的生命活动提供能量。具体表现为两个方面, 一是参与昆虫几丁质合成途径, 从而调控表皮、 中肠等处的几丁质合成; 二是通过与激素的协同作用, 调控昆虫体内海藻糖和葡萄糖等糖类物质的浓度变化, 从而有效保护体内细胞的适应并渡过相应的逆境环境, 并提高其抗逆能力。鉴于海藻糖酶的重要功能, 其已成为害虫控制的潜在新靶标。不同类型海藻糖酶的功能研究及酶抑制剂的研发与应用将进一步推动害虫生物防治的发展。
Magsci [本文引用: 1]

海藻糖酶(Treh)是昆虫能量代谢必不可少的一类酶, 亦是昆虫体内几丁质合成通路的第一个酶。其基因表达和酶活性直接与正常发育、 蜕皮、 变态以及繁殖等昆虫重要生理过程密切相关。目前已有多种昆虫的海藻糖酶基因被成功克隆, 从而发现昆虫海藻糖酶基因家族由多个成员组成。海藻糖酶基因所编码的蛋白大多数具有一个信号肽前导区, 部分蛋白拥有1~2个跨膜结构域, 根据是否具有跨膜结构, 可将其分为可溶性海藻糖酶(Treh1)和膜结合型海藻糖酶(Treh2)两类, 膜结合型海藻糖酶具有2个特有的标签序列, 即“PGGRFREFYYWDSY”和“QWDYPNAWPP”。海藻糖酶的主要功能是将胞外和胞内的海藻糖降解成葡萄糖, 为昆虫的生命活动提供能量。具体表现为两个方面, 一是参与昆虫几丁质合成途径, 从而调控表皮、 中肠等处的几丁质合成; 二是通过与激素的协同作用, 调控昆虫体内海藻糖和葡萄糖等糖类物质的浓度变化, 从而有效保护体内细胞的适应并渡过相应的逆境环境, 并提高其抗逆能力。鉴于海藻糖酶的重要功能, 其已成为害虫控制的潜在新靶标。不同类型海藻糖酶的功能研究及酶抑制剂的研发与应用将进一步推动害虫生物防治的发展。
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
DOI:10.3864/j.issn.0578-1752.2018.04.009Magsci [本文引用: 2]

海藻糖为一种非还原性糖,广泛存在于细菌、藻类、真菌、植物和无脊椎动物中。海藻糖被称为昆虫“血糖”,源于该糖为昆虫血淋巴中的主要糖类物质,在昆虫生长、发育、蜕皮等正常生理活动中有着重要的作用。昆虫的海藻糖先由海藻糖合成酶(trehalose-6-phosphate synthase,TPS)生成海藻糖-6-磷酸,然后通过海藻糖磷酸脂酶(trehalose-6-phosphate phosphatase,TPP)最终合成海藻糖,在能量需求时通过海藻糖酶(trehalase,TRE)降解为葡萄糖,用于能量供给。几丁质为昆虫表皮、中肠围食膜和气管系统的主要组成成分,昆虫在发育过程中需要蜕掉旧表皮,形成新的表皮,该过程一直是害虫控制的重要靶标途径。海藻糖酶为昆虫几丁质合成途径的第一个酶,在几丁质合成通路中有着重要的功能。那么海藻糖代谢又是如何调控几丁质合成途径来控制昆虫的蜕皮及几丁质代谢的呢?随着国内外海藻糖代谢相关基因功能研究的深入开展,研究结果表明昆虫海藻糖供给在几丁质合成中具有重要的作用,海藻糖酶分为可溶性和膜结合型两类,可溶性TRE和TPS在不同昆虫种类中具有多个同源基因,表明昆虫海藻糖代谢进化途径多样化。其次,海藻糖代谢直接调控几丁质合成途径,不论是海藻糖合成酶还是海藻糖酶基因的低表达,均能控制海藻糖使其供给不平衡,从而导致几丁质合成途径受阻,特别是几丁质合成酶基因表达降低而造成几丁质含量下降,该调控作用可进一步引起昆虫蜕皮困难、翅发育畸形等,甚至大量死亡。再次,海藻糖酶抑制剂能够抑制可溶性和膜结合型两类海藻糖酶活性、引起几丁质合成通路相关基因及几丁质酶基因表达的显著下降,导致几丁质含量显著降低,产生高比例的昆虫个体死亡。这些结果充分表明,一旦昆虫海藻糖代谢的供给平衡被打破,会直接影响到昆虫的几丁质合成乃至昆虫的蜕皮与发育过程。本文综述前人在海藻糖代谢调控几丁质合成方面的最新研究成果,为将来开发和利用海藻糖酶抑制剂及海藻糖合成酶抑制剂等绿色农药防治害虫提供理论依据。
DOI:10.3864/j.issn.0578-1752.2018.04.009Magsci [本文引用: 2]

海藻糖为一种非还原性糖,广泛存在于细菌、藻类、真菌、植物和无脊椎动物中。海藻糖被称为昆虫“血糖”,源于该糖为昆虫血淋巴中的主要糖类物质,在昆虫生长、发育、蜕皮等正常生理活动中有着重要的作用。昆虫的海藻糖先由海藻糖合成酶(trehalose-6-phosphate synthase,TPS)生成海藻糖-6-磷酸,然后通过海藻糖磷酸脂酶(trehalose-6-phosphate phosphatase,TPP)最终合成海藻糖,在能量需求时通过海藻糖酶(trehalase,TRE)降解为葡萄糖,用于能量供给。几丁质为昆虫表皮、中肠围食膜和气管系统的主要组成成分,昆虫在发育过程中需要蜕掉旧表皮,形成新的表皮,该过程一直是害虫控制的重要靶标途径。海藻糖酶为昆虫几丁质合成途径的第一个酶,在几丁质合成通路中有着重要的功能。那么海藻糖代谢又是如何调控几丁质合成途径来控制昆虫的蜕皮及几丁质代谢的呢?随着国内外海藻糖代谢相关基因功能研究的深入开展,研究结果表明昆虫海藻糖供给在几丁质合成中具有重要的作用,海藻糖酶分为可溶性和膜结合型两类,可溶性TRE和TPS在不同昆虫种类中具有多个同源基因,表明昆虫海藻糖代谢进化途径多样化。其次,海藻糖代谢直接调控几丁质合成途径,不论是海藻糖合成酶还是海藻糖酶基因的低表达,均能控制海藻糖使其供给不平衡,从而导致几丁质合成途径受阻,特别是几丁质合成酶基因表达降低而造成几丁质含量下降,该调控作用可进一步引起昆虫蜕皮困难、翅发育畸形等,甚至大量死亡。再次,海藻糖酶抑制剂能够抑制可溶性和膜结合型两类海藻糖酶活性、引起几丁质合成通路相关基因及几丁质酶基因表达的显著下降,导致几丁质含量显著降低,产生高比例的昆虫个体死亡。这些结果充分表明,一旦昆虫海藻糖代谢的供给平衡被打破,会直接影响到昆虫的几丁质合成乃至昆虫的蜕皮与发育过程。本文综述前人在海藻糖代谢调控几丁质合成方面的最新研究成果,为将来开发和利用海藻糖酶抑制剂及海藻糖合成酶抑制剂等绿色农药防治害虫提供理论依据。
[本文引用: 2]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 2]
Magsci [本文引用: 2]

【目的】海藻糖合成酶(trehalose-6-phosphate synthase, TPS)是参与昆虫血糖-海藻糖合成的关键酶。本研究旨在克隆德国小蠊 <em>Blattella germanica </em>TPS基因,研究TPS基因在德国小蠊不同组织中的表达模式及在不同温度处理下的表达情况。【方法】通过RACE技术克隆德国小蠊TPS基因全长序列,利用荧光定量PCR的方法检测TPS基因在德国小蠊5龄幼虫不同组织中的表达模式及在高温(40℃和46℃处理30 min)及低温(0℃和10℃处理1 h)逆境下的表达量变化。【结果】从德国小蠊中克隆获得2个TPS基因,分别命名为 <em>BgTPS</em>1 (GenBank登录号:KR050213) 和 <em>BgTPS</em>2 (GenBank登录号:KR050214)。其中,<em>BgTPS</em>1基因cDNA序列全长2 987 bp,开放阅读框 (ORF) 2 502 bp,编码833个氨基酸;<em>BgTPS</em>2基因cDNA序列全长3 212 bp,开放阅读框2 469 bp,编码822个氨基酸。<em>BgTPS</em>1和<em>BgTPS</em>2基因都主要在5龄幼虫脂肪体中表达,且<em>BgTPS</em>2基因的表达量为<em>BgTPS</em>1基因表达量的3.9倍。在两种不同极端温度诱导下,<em>BgTPS</em>1和<em>BgTPS</em>2基因mRNA均上调表达。其中,<em>BgTPS2 </em>的表达量始终显著高于 <em>BgTPS</em>1。在0℃时,<em>BgTPS</em>1和<em>BgTPS</em>2的表达量最高。【结论】德国小蠊5龄幼虫中存在2个TPS基因。两个TPS基因均在脂肪体中高表达,且<em>BgTPS</em>2基因的表达量显著高于<em>BgTPS</em>1基因;低温和高温诱导下均能促进两个基因的表达量上升。该结果为进一步明确昆虫海藻糖的合成途径及其在昆虫对温度逆境的反应中的作用研究奠定了基础。
Magsci [本文引用: 2]

【目的】海藻糖合成酶(trehalose-6-phosphate synthase, TPS)是参与昆虫血糖-海藻糖合成的关键酶。本研究旨在克隆德国小蠊 <em>Blattella germanica </em>TPS基因,研究TPS基因在德国小蠊不同组织中的表达模式及在不同温度处理下的表达情况。【方法】通过RACE技术克隆德国小蠊TPS基因全长序列,利用荧光定量PCR的方法检测TPS基因在德国小蠊5龄幼虫不同组织中的表达模式及在高温(40℃和46℃处理30 min)及低温(0℃和10℃处理1 h)逆境下的表达量变化。【结果】从德国小蠊中克隆获得2个TPS基因,分别命名为 <em>BgTPS</em>1 (GenBank登录号:KR050213) 和 <em>BgTPS</em>2 (GenBank登录号:KR050214)。其中,<em>BgTPS</em>1基因cDNA序列全长2 987 bp,开放阅读框 (ORF) 2 502 bp,编码833个氨基酸;<em>BgTPS</em>2基因cDNA序列全长3 212 bp,开放阅读框2 469 bp,编码822个氨基酸。<em>BgTPS</em>1和<em>BgTPS</em>2基因都主要在5龄幼虫脂肪体中表达,且<em>BgTPS</em>2基因的表达量为<em>BgTPS</em>1基因表达量的3.9倍。在两种不同极端温度诱导下,<em>BgTPS</em>1和<em>BgTPS</em>2基因mRNA均上调表达。其中,<em>BgTPS2 </em>的表达量始终显著高于 <em>BgTPS</em>1。在0℃时,<em>BgTPS</em>1和<em>BgTPS</em>2的表达量最高。【结论】德国小蠊5龄幼虫中存在2个TPS基因。两个TPS基因均在脂肪体中高表达,且<em>BgTPS</em>2基因的表达量显著高于<em>BgTPS</em>1基因;低温和高温诱导下均能促进两个基因的表达量上升。该结果为进一步明确昆虫海藻糖的合成途径及其在昆虫对温度逆境的反应中的作用研究奠定了基础。
[本文引用: 6]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.3864/j.issn.0578-1752.2019.03.007Magsci [本文引用: 2]

<p id="C2"><b>背景</b> 昆虫海藻糖合成酶基因是昆虫海藻糖合成的主要基因,大多数昆虫中只拥有一个海藻糖-6-磷酸合成酶(trehalose-6-phosphate synthase,TPS)基因,部分昆虫存在一个海藻糖-6-磷酸酯酶(trehalose-6-phosphate phosphatase,TPP)基因。前期研究发现褐飞虱(<italic>Nilaparvata lugens</italic>)中拥有两个<italic>TPS</italic>,对其功能研究发现<italic>TPS</italic>不仅能够调控海藻糖代谢,还可介导海藻糖酶调控几丁质合成与降解途径,控制昆虫的蜕皮过程。<b>目的</b> 通过对褐飞虱转录组测序分析获得了一个新的<italic>TPS</italic>,检测该基因在褐飞虱不同发育阶段的表达情况,探究该基因的功能与前期发现的两个<italic>TPS</italic>的区别。<b>方法</b> 对获得的新<italic>TPS</italic>基因序列采用克隆技术获得全长cDNA序列,经验证正确后,对其蛋白的一级、二级、三级结构及与其他昆虫的TPS进行比对分析,最后采用实时荧光定量PCR(qRT-PCR)技术测定3个不同<italic>TPS</italic>在褐飞虱不同发育阶段的表达,并采用RNA干扰(RNAi)技术抑制<italic>TPS3</italic>的表达。<b>结果</b> 在前期研究的基础上,克隆出一个新的<italic>TPS</italic>,并命名为<italic>TPS3</italic>。<italic>TPS3</italic>开放阅读框长度为2 352 bp,编码783个氨基酸,预测蛋白分子量为88.9 kD,等电点为5.47,具有亲水性结构。生物信息学分析表明,褐飞虱3个TPS蛋白具有较高的同源性,都具有TPS和TPP两个保守结构域及其他特征序列,并且<italic>α</italic>-螺旋、<italic>β</italic>-折叠和无规则卷曲所占的比例较为接近。褐飞虱不同发育阶段3条<italic>TPS</italic>的相对表达量不同,<italic>TPS1</italic>的相对表达量从4龄0 h开始逐渐上升,至成虫阶段达到最高,<italic>TPS2</italic>的相对表达量从4龄末期开始明显上升且在整个5龄阶段都有较高的表达,<italic>TPS3</italic>的相对表达量在5龄末期和成虫初期较高。单独干扰褐飞虱<italic>TPS3</italic> 48 h后被干扰基因的相对表达量下降,ds<italic>TPS3</italic>能有效抑制<italic>TPS3</italic>的表达。<b>结论</b> 在褐飞虱中发现一个新的<italic>TPS</italic>(<italic>TPS3</italic>),其与褐飞虱中已经报道的TPS1和TPS2具有较高的同源性。不同发育阶段表达结果表明,3个<italic>TPS</italic>在发育过程中行使的功能不同。RNAi能够有效抑制<italic>TPS3</italic>的表达并导致褐飞虱蜕皮障碍和翅发育畸形。</p>
DOI:10.3864/j.issn.0578-1752.2019.03.007Magsci [本文引用: 2]

<p id="C2"><b>背景</b> 昆虫海藻糖合成酶基因是昆虫海藻糖合成的主要基因,大多数昆虫中只拥有一个海藻糖-6-磷酸合成酶(trehalose-6-phosphate synthase,TPS)基因,部分昆虫存在一个海藻糖-6-磷酸酯酶(trehalose-6-phosphate phosphatase,TPP)基因。前期研究发现褐飞虱(<italic>Nilaparvata lugens</italic>)中拥有两个<italic>TPS</italic>,对其功能研究发现<italic>TPS</italic>不仅能够调控海藻糖代谢,还可介导海藻糖酶调控几丁质合成与降解途径,控制昆虫的蜕皮过程。<b>目的</b> 通过对褐飞虱转录组测序分析获得了一个新的<italic>TPS</italic>,检测该基因在褐飞虱不同发育阶段的表达情况,探究该基因的功能与前期发现的两个<italic>TPS</italic>的区别。<b>方法</b> 对获得的新<italic>TPS</italic>基因序列采用克隆技术获得全长cDNA序列,经验证正确后,对其蛋白的一级、二级、三级结构及与其他昆虫的TPS进行比对分析,最后采用实时荧光定量PCR(qRT-PCR)技术测定3个不同<italic>TPS</italic>在褐飞虱不同发育阶段的表达,并采用RNA干扰(RNAi)技术抑制<italic>TPS3</italic>的表达。<b>结果</b> 在前期研究的基础上,克隆出一个新的<italic>TPS</italic>,并命名为<italic>TPS3</italic>。<italic>TPS3</italic>开放阅读框长度为2 352 bp,编码783个氨基酸,预测蛋白分子量为88.9 kD,等电点为5.47,具有亲水性结构。生物信息学分析表明,褐飞虱3个TPS蛋白具有较高的同源性,都具有TPS和TPP两个保守结构域及其他特征序列,并且<italic>α</italic>-螺旋、<italic>β</italic>-折叠和无规则卷曲所占的比例较为接近。褐飞虱不同发育阶段3条<italic>TPS</italic>的相对表达量不同,<italic>TPS1</italic>的相对表达量从4龄0 h开始逐渐上升,至成虫阶段达到最高,<italic>TPS2</italic>的相对表达量从4龄末期开始明显上升且在整个5龄阶段都有较高的表达,<italic>TPS3</italic>的相对表达量在5龄末期和成虫初期较高。单独干扰褐飞虱<italic>TPS3</italic> 48 h后被干扰基因的相对表达量下降,ds<italic>TPS3</italic>能有效抑制<italic>TPS3</italic>的表达。<b>结论</b> 在褐飞虱中发现一个新的<italic>TPS</italic>(<italic>TPS3</italic>),其与褐飞虱中已经报道的TPS1和TPS2具有较高的同源性。不同发育阶段表达结果表明,3个<italic>TPS</italic>在发育过程中行使的功能不同。RNAi能够有效抑制<italic>TPS3</italic>的表达并导致褐飞虱蜕皮障碍和翅发育畸形。</p>
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
DOI:10.3864/j.issn.0578-1752.2017.06.006Magsci [本文引用: 2]

【目的】昆虫海藻糖酶能够调控几丁质代谢并控制蜕皮过程。本研究通过TRE表达被抑制后,检测褐飞虱(<em>Nilaparvata lugens</em>)蜕皮状况、几丁质含量及几丁质合成酶(chitin synthase,CHS)和几丁质酶(chitinase,Cht)基因表达情况,探究不同的海藻糖酶(trehalase,TRE)在褐飞虱表皮中对几丁质代谢的调控作用。【方法】采用RNAi技术,以实验室饲养种群褐飞虱为材料,通过向其体内注射双链RNA(dsRNA)分别抑制单个海藻糖酶基因或同时抑制多个海藻糖酶基因,注射48 h后通过Trizol法提取褐飞虱总RNA,反转录试剂盒合成第一链DNA后采用实时荧光定量PCR(qRT-PCR)技术检测该基因的表达情况,确定RNAi效果。氢氧化钾法测定48 h褐飞虱整体几丁质含量变化并对蜕皮困难虫体进行拍照;最后采用qRT-PCR检测褐飞虱CHS和Cht在mRNA水平上的相对表达量变化,分析TRE在调控几丁质代谢中的作用。【结果】与注射dsGFP相比较,其余各注射组褐飞虱整体几丁质含量显著下降,其中dsTRE1混合注射组与Validamycin注射组呈极显著下降,同时褐飞虱出现蜕皮困难等现象。qRT-PCR检测结果显示单个TRE的dsRNA注射后该基因的表达被抑制,但是部分TRE的表达有互补性上升。其中TRE1-2和TRE2在各注射组处理下表达均下降,dsTRE1s对TRE2的表达也有抑制效果,整体上dsTRE1混合注射组和海藻糖酶抑制剂Validamycin抑制效果明显;dsTRE注射组抑制CHS表达效果不明显,Validamycin能够显著降低CHS1和CHS1a在表皮中的表达,且2种dsTRE1注射后CHS1表达在上升,dsTRE1-2注射后表皮中的CHS1a的表达上升;Cht1和Cht8在dsTRE各注射组及Validamycin处理中表达下降或显著下降,dsTRE1-1注射后Cht2和Cht5表达显著上升;dsTRE1-2注射后Cht1、Cht6和Cht8表达下降,Cht2和Cht4表达显著上升;dsTRE2处理组中Cht1、Cht8和Cht10表达下降而Cht9表达显著上升;dsTRE1s注射后,Cht1和Cht5表达显著下降,而Cht9表达显著上升;Validamycin注射组中10个几丁质酶基因表达都显著或者极显著下降。【结论】TRE能够通过调控褐飞虱几丁质代谢途径来控制几丁质的合成,结果可为开展和筛选有效的海藻糖酶抑制剂控制褐飞虱等害虫提供理论依据。
DOI:10.3864/j.issn.0578-1752.2017.06.006Magsci [本文引用: 2]

【目的】昆虫海藻糖酶能够调控几丁质代谢并控制蜕皮过程。本研究通过TRE表达被抑制后,检测褐飞虱(<em>Nilaparvata lugens</em>)蜕皮状况、几丁质含量及几丁质合成酶(chitin synthase,CHS)和几丁质酶(chitinase,Cht)基因表达情况,探究不同的海藻糖酶(trehalase,TRE)在褐飞虱表皮中对几丁质代谢的调控作用。【方法】采用RNAi技术,以实验室饲养种群褐飞虱为材料,通过向其体内注射双链RNA(dsRNA)分别抑制单个海藻糖酶基因或同时抑制多个海藻糖酶基因,注射48 h后通过Trizol法提取褐飞虱总RNA,反转录试剂盒合成第一链DNA后采用实时荧光定量PCR(qRT-PCR)技术检测该基因的表达情况,确定RNAi效果。氢氧化钾法测定48 h褐飞虱整体几丁质含量变化并对蜕皮困难虫体进行拍照;最后采用qRT-PCR检测褐飞虱CHS和Cht在mRNA水平上的相对表达量变化,分析TRE在调控几丁质代谢中的作用。【结果】与注射dsGFP相比较,其余各注射组褐飞虱整体几丁质含量显著下降,其中dsTRE1混合注射组与Validamycin注射组呈极显著下降,同时褐飞虱出现蜕皮困难等现象。qRT-PCR检测结果显示单个TRE的dsRNA注射后该基因的表达被抑制,但是部分TRE的表达有互补性上升。其中TRE1-2和TRE2在各注射组处理下表达均下降,dsTRE1s对TRE2的表达也有抑制效果,整体上dsTRE1混合注射组和海藻糖酶抑制剂Validamycin抑制效果明显;dsTRE注射组抑制CHS表达效果不明显,Validamycin能够显著降低CHS1和CHS1a在表皮中的表达,且2种dsTRE1注射后CHS1表达在上升,dsTRE1-2注射后表皮中的CHS1a的表达上升;Cht1和Cht8在dsTRE各注射组及Validamycin处理中表达下降或显著下降,dsTRE1-1注射后Cht2和Cht5表达显著上升;dsTRE1-2注射后Cht1、Cht6和Cht8表达下降,Cht2和Cht4表达显著上升;dsTRE2处理组中Cht1、Cht8和Cht10表达下降而Cht9表达显著上升;dsTRE1s注射后,Cht1和Cht5表达显著下降,而Cht9表达显著上升;Validamycin注射组中10个几丁质酶基因表达都显著或者极显著下降。【结论】TRE能够通过调控褐飞虱几丁质代谢途径来控制几丁质的合成,结果可为开展和筛选有效的海藻糖酶抑制剂控制褐飞虱等害虫提供理论依据。
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
