 ,西南大学柑桔研究所/中国农业科学院柑桔研究所,重庆 400712
,西南大学柑桔研究所/中国农业科学院柑桔研究所,重庆 400712Cloning, Subcellular Localization and Expression Analysis of CitPG34 in Citrus
GE Ting, HUANG Xue, XIE RangJin ,Citrus Research Institute, Southwest University/Chinese Academy of Agricultural Sciences, Chongqing 400712
,Citrus Research Institute, Southwest University/Chinese Academy of Agricultural Sciences, Chongqing 400712通讯作者:
责任编辑: 赵伶俐
收稿日期:2019-05-5接受日期:2019-07-12网络出版日期:2019-10-01
| 基金资助: |
Received:2019-05-5Accepted:2019-07-12Online:2019-10-01
作者简介 About authors
葛廷,E-mail:m13364018674@163.com。

摘要
关键词:
Abstract
Keywords:
PDF (4331KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
葛廷, 黄雪, 谢让金. 柑橘CitPG34的克隆、定位与表达分析[J]. 中国农业科学, 2019, 52(19): 3404-3416 doi:10.3864/j.issn.0578-1752.2019.19.011
GE Ting, HUANG Xue, XIE RangJin.
0 引言
【研究意义】柑橘(Citrus)是全球重要的经济作物之一,但大量异常落花落果,严重影响了柑橘产量,降低了果农的收入[1,2]。植物多聚半乳糖醛酸酶(polygalacturonases,PGs)作为细胞壁水解酶之一,通过降解离层细胞中间层果胶,从而促进植物器官脱落[3]。本研究基于柑橘全基因组,克隆获得了柑橘CitPG34及其启动子序列,采用基因表达、亚细胞定位和遗传转化等方法对其进行分析,研究结果为进一步阐明CitPG34生物功能奠定了前期基础,同时也为深入解析柑橘幼果脱落机制提供参考。【前人研究进展】植物器官脱落发生在离层区(AZ),脱落过程中需要大量细胞壁水解酶参与,包括多聚半乳糖醛酸酶、β-1, 4-葡聚糖酶、纤维素酶、半纤维素酶以及扩展蛋白等[4]。其中,关于PGs的研究最为广泛,该酶含有4个典型的保守结构域,即结构域Ⅰ(NTD)、结构域Ⅱ(DD)、结构域Ⅲ(GHG)和结构域Ⅳ(RIK);结构域Ⅰ和结构域Ⅱ中的天冬氨酸(D)以及结构域Ⅲ中的组氨酸(H)参与了蛋白酶的催化功能[5]。PGs通过催化裂解果胶分子中的α-(1→4)-D-半乳糖苷键,导致细胞壁结构改变,从而参与果实成熟软化[6,7]、荚果开裂[8]、花粉发育[9]等植物生长发育过程。目前,关于PG参与果实脱落的研究主要集中在拟南芥[8]、苹果[10]、棕榈[11]和番茄[12]等植物上。JIANG等[12]利用TAPG1同源片段,通过VIGS技术,诱导番茄TAPGs基因沉默,结果导致番茄叶片明显延迟脱落。相反,超表达苹果MdPG1,造成转基因植株叶片中的果胶降低,使未成熟叶片异常脱落并导致成熟叶片形态及其气孔发育异常[10]。乙烯处理导致棕榈树果实大量脱落,随后通过表达分析从14个PG中鉴定出一个成员即EgPG4参与了脱落过程[11]。在荔枝中也有类似报道,从荔枝幼果离层中克隆获得LcPG1,研究发现该PG受乙烯诱导,却被2, 4-二氯苯氧乙酸(2, 4-dichlorophenoxyacetic acid,2, 4-D)抑制,环剥摘叶后发现LcPG1的表达水平与幼果脱落成正相关[13]。RIOV等[3]和RASCIO等[14]研究发现柑橘叶片和桃果实的脱落与PGs的活性变化有关,TAYLOR等[15]在接骨木叶片脱落过程中发现PGs活性的增强与其基因表达水平一致。KALAITZIS等[16]在番茄叶和花中克隆了TAPG1、TAPG2、TAPG4,表达分析发现TAPG1、TAPG2、TAPG4只在叶和花脱落区中表达,表明这些成员可能与脱落相关。上述结果表明,PGs在植物器官脱落过程中发挥着重要作用。【本研究切入点】目前,关于PGs参与器官脱落的研究主要集中在拟南芥、番茄、水稻等模式植物中。在柑橘中,关于PG参与脱落的研究仅有少量报道[17,18,19],特别是其在柑橘幼果脱落过程中发挥的生物功能还有待进一步解析。【拟解决的关键问题】克隆获得CitPG34及其启动子,通过生物信息学、基因表达、亚细胞定位和GUS化学组织染色等手段,了解CitPG34及其蛋白质的基本特性,初步明确CitPG34在柑橘幼果脱落过程中的生物功能,及其对脱落诱导因子的响应机制。1 材料与方法
试验于2018年1月至2019年1月在中国农业科学院柑桔研究所进行。1.1 试验材料
1.1.1 植物材料 选取10年生‘塔罗科’血橙(Citrus sinensis L. Osbeck)为试材,其砧木为枳橙(Citrus siinensis (L.) Osb.×Poncirus trifoliata (L.) Raf.);烟草W38(Nicotiana tabacum),均由笔者实验室保存。1.1.2 试验主要试剂 植物RNA提取试剂盒(RNA prep pure Kit)、植物基因组DNA提取试剂盒(Plant Genomic DNA Kit)、质粒提取试剂盒购自天根生化科技有限公司。高保真酶(PrimeSTAR Max Premix)、反转录试剂盒(Prime ScriptTM RT Reagent Kit)、胶回收试剂盒(MiniBEST Agarose Gel DNA Extraction Kit)、Marker、pMD19-T Vector、Sma I、Hind III和Nco I购自宝生物工程(大连)有限公司。qRT-PCR染料(iTaqTM Universal SYBR? Green Supermix)购于伯乐生命医学产品有限公司。植物PBI121表达载体和农杆菌EHA105菌株由笔者实验室保存,大肠杆菌DH5α和农杆菌GV3101购于全式金生物技术有限公司。
1.2 材料处理
花后一周,选取长势一致的有叶单果,从离层A下部4 cm处剪取,随后立即带回实验室。去除叶片和子房,用清水(对照)、2 mmol·L-1 IAA,2 mmol·L-1 ACC分别处理果梗后,在0、6、12、18和24 h收集离层A(ACC处理的果梗在18 h时已完全脱落,因此在24 h时未能收集离层A)。液氮速冻,-80℃保存。采集‘塔罗科’血橙的根(砧木)、叶、幼果(花后1周)、花、离层A及离层C用于研究CitPG34的组织特异性(图1),液氮速冻,-80℃保存。
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1用于CitPG34组织特异表达分析的不同组织
A:根(砧木);B:叶;C:幼果
Fig. 1Tissues used for the tissue specific expression of CitPG34
A: Root (Rootstock); B: Leaves; C: Fruitlet
1.3 总RNA提取与cDNA合成
参照RNA prep pure Kit试剂盒说明书提取样品总RNA,随后,在1.0%琼脂糖凝胶上电泳检测其质量。总RNA浓度由Denovix超微量紫外可见分光光度计DS-11(DS-11 Series Spectrophotometer/ Fluorometer)检测。根据Prime ScriptTM RT Reagent Kit试剂盒说明书,反转录合成第一条cDNA链,并置于-20℃冰箱中保存,用于检测目的基因的相对表达量。1.4 引物设计与合成
本试验所用引物由Primer5.0设计,英潍捷基生物技术有限公司(上海)合成。引物信息见表1。Table 1
表1
表1本试验所用引物
Table 1
| 引物名称 Primers name | 引物序列 Sequence of primers (5′→3′) | 目的 Purpose |
|---|---|---|
| OE-CitPG34-F | GCTTTGAAACCATGTCAACATC | 基因全长克隆 Full-length gene cloning |
| OE-CitPG34-R | TAGGAACTGCCTCTAAGTAAGC | |
| CitPG34-F | ATTAGCATCCGTAGATAGCC | 实时荧光定量 Real-time PCR |
| CitPG34-R | CACAGTCATCACCAGTCCC | |
| P- CitPG34-F | TGATTACGCCAAGCTTACCGTCTATGCTACTGATGTGA | 启动子克隆 Promoter cloning |
| P- CitPG34-R | AGGGACTGACCACCCTGATGTTGACATGGTTTCAAAGC | |
| Cit-Actin-F | CCCCATCGTTACCGTCCAG | 内参基因 Actin gene |
| Cit-Actin-R | CGCCTTGCCAGTTGAATATCC | |
| Sub-CitPG34-F | GGGGGACTCTTGACCATGTCAACATCAATGTCTTTGCC | 亚细胞定位 Subcellular localization |
| sub-CitPG34-R | CTAGTCAGATCTACCATGACACCAGAACCACCACCAGA ACCAGTCTTCAAGCAACTATTTGGAAG | |
| pCAMBIA1302-F | CCTTCACCCTCTCCACTGACAG | 亚细胞定位 Subcellular localization |
| pCAMBIA1302-R | CCTTCGCAAGACCCTTCCTCTA |
新窗口打开|下载CSV
1.5 柑橘CitPG34的克隆
利用cDNA为扩增模板获得CitPG34,反应体系为50 μL:cDNA 2 μL、上下游引物(OE-CitPG34-F/R)各1 μL、高保真酶25 μL、ddH2O 21 μL。反应程序为:94℃ 5 min;94℃ 30 s,56℃ 30 s,72℃ 1 min 30 s,38个循环;72℃ 5 min。产物经1.0%琼脂凝胶电泳检测,回收纯化。将回收产物与pMD19-T Vector连接,转化大肠杆菌感受态DH5α,涂板,挑取单克隆进行菌液PCR检测,将阳性克隆送英潍捷基生物技术有限公司测序验证。采用Editseq软件将测序正确的序列进行拼接,得到基因ORF全长。1.6 生物信息学分析
采用EXPASY(https://web.expasy.org/protparam/)分析CitPG34的理化性质。利用TMHMM(http://www. cbs.dtu.dk/services/TMHMM/)预测CitPG34蛋白跨膜结构。CitPG34蛋白的二级结构和三级结构分别由HNN(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl? page=/NPSA/npsa_hnn.html)和Phyre2(http://www.sbg. bio.ic.ac.uk/phyre2/html/page.cgi?id=index)预测;利用CELLO(http://cello.life.nctu.edu.tw)预测CitPG34蛋白的亚细胞定位。应用ClustalX软件对CitPG34蛋白进行多重序列比对。基于邻接法(NJ),利用MEGA5.2软件构建PGs的系统进化树(Bootstrap=1 000)。采用PlantCARE(http://bioinforma tics.psb.ugent.be/ webtools/plantcare/html/)对CitPG34启动子元件进行预测分析。1.7 CitPG34启动子克隆
利用Plant Genomic DNA Kit的试剂盒说明书提取柑橘叶片DNA,其质量和浓度分别用1.0%琼脂糖凝胶电泳和Denovix超微量紫外可见分光光度计DS-11检测。随后以该DNA为模板,克隆CitPG34启动子序列(CitPG34-P),反应体系为50 μL:cDNA 2 μL、上下游引物(P-CitPG34-F/R)各1 μL、高保真酶25 μL、ddH2O 21 μL。反应程序为:94℃ 5 min;94℃ 30 s,56℃ 30 s,72℃ 2min 10 s,38个循环;72℃ 5 min。经1.0%琼脂凝胶电泳检测,回收纯化,产物置于-20℃保存。1.8 基因表达分析
以柑橘Actin为内参基因,利用qPCR分析CitPG34在柑橘不同组织中以及吲哚乙酸(IAA)和1-氨基环丙烷羧酸(ACC)处理下的表达水平。反应体系为10 μL:5 μL iTaqTM Universal SYBR? Green Supermix、ddH2O 3 μL、引物各0.5 μL、cDNA 1 μL。反应程序为:95℃ 2 min;95℃ 15 s,53℃ 5 s,72℃ 15 s,共39个循环。每个处理3次重复。基因相对表达量采用2-??Ct法计算,用SPSS19.0对数据进行显著性分析,最后用Excel绘制图表。1.9 亚细胞定位
以cDNA为模板,用Sub-CitPG34-F/R引物(表1)克隆获得去除终止子的CitPG34全长,通过Nco I单酶切pCAMBIA1302-GFP表达载体,采用同源重组技术将其与去除终止子的CitPG34连接,转化大肠杆菌感受态DH5α,经测序验证,得到载体命名为pCAMBIA1302-CitPG34-GFP。将质粒pCAMBIA1302- CitPG34-GFP和pCAMBIA1302-GFP(对照)分别转化农杆菌GV3101,涂板,挑取单克隆利用引物Sub-CitPG34-F/R及pCAMBIA1302-F/R进行菌液检测。活化菌液,并用含有1 mol?L-1 MES、2.5 mol?L-1 MgCl2、100 mmol?L-1乙酰丁香酮的重悬液重悬,调整菌液OD600为0.75,分别将菌液注射到洋葱内表皮,暗培养3 d,用清水和0.3 g?mL-1蔗糖处理内表皮细胞并制作装片,置于倒置荧光显微镜下观测、拍照。1.10 CitPG34-P::gus表达载体的构建
用Hind III和Sma I酶切去除植物表达载体PBI121的35S启动子序列,随后用infusion重组技术将上述经PCR扩增回收后得到的CitPG34-P片段连接在PBI121表达载体上,连接产物转化大肠杆菌感受态DH5α,涂板,挑取单克隆进行菌液PCR检测,将阳性克隆送英潍捷基生物技术有限公司测序验证。测序正确的表达载体命名为CitPG34-P::gus。将载体CitPG34-P::gus提取质粒,利用冻融法转化农杆菌EHA105菌株,涂板,挑取单克隆,经PCR鉴定为阳性后保存菌种。1.11 烟草遗传转化
首先将含有CitPG34-P::gus载体的农杆菌活化,直至菌液OD600值在0.8—1.0,离心收集菌液,去掉上清液并加入重悬液MS。将烟草叶片切成大小约为1 cm2的方块,置于重悬液中7—10 min,期间摇晃2—3次,随后取出,用无菌滤纸吸干叶片残余菌液。将侵染后的烟草叶片置于MS共培养基中暗培养2 d,之后转到筛选培养基上继续培养,直到愈伤组织长出幼芽。切取幼芽插入生根培养基,约20 d后,将生根幼苗转移至营养土中继续培养4—5周。利用Plant Genomic DNA Kit的试剂盒说明书提取烟草叶片DNA,并用1.0%琼脂糖凝胶电泳检测转基因植株。1.12 GUS组织化学染色
利用打孔器,将转基因烟草叶片切成半径为0.25 cm的小圆片,置于滤纸上;用0和5 mmol?L-1乙烯利溶液处理,然后放入组培瓶中封闭;在25℃条件下处理72 h,取出圆片置入GUS溶液中避光染色;用75%酒精漂洗脱色后,光学显微镜观察。2 结果
2.1 CitPG34的克隆及生物信息学分析
以OE-CitPG34-F/R为引物进行PCR扩增检测,获得了CitPG34序列全长,其ORF长度为1 194 bp(图2-A),可编码397个氨基酸。生物信息学分析发现,CitPG34属于稳定蛋白,其相对分子量为41.47 kD,理论等电点为5.19,脂肪系数为88.78,不稳定系数为30.23;此外,在该蛋白7—29氨基酸之间存在跨膜结构。在CitPG34蛋白的二级结构中,α-螺旋结构约占15.37%,扩展链约占29.72%,无规则卷曲约占54.91%,其三级结构中α-螺旋结构占9%,β-链约占55%,TM螺旋占4%,其他结构约占8%。图3显示,CitPG34与其他植物PGs类似,含有典型的4个保守结构域,即SPNTDG(Ⅰ)、GDDC(Ⅱ)、CGPGHGISIGSLG(Ⅲ)、RIK(Ⅳ)。聚类分析显示,所有PG可划分为3个分支(A、B、C),其中CitPG34与西洋梨PcPG3亲缘关系最近(图4)。图2
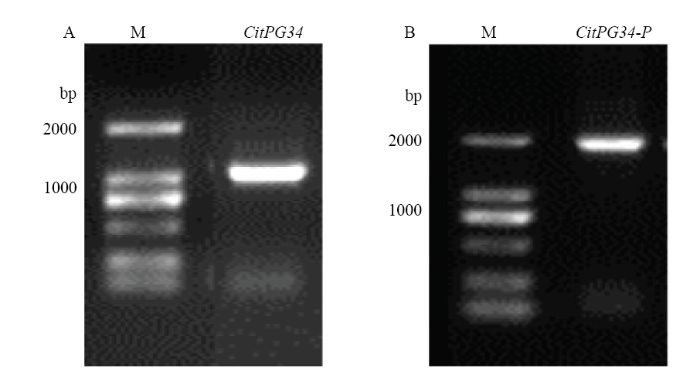 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2PCR扩增结果
M:DL2000分子标记。A:柑橘CitPG34;B:柑橘CitPG34的启动子
Fig. 2PCR amplified product
M: DL2000 maker. A: PCR amplified product of CitPG34; B: PCR amplified product of CitPG34 promoter
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3CitPG34与其他物种PG蛋白的氨基酸系列比对
AtPG1:拟南芥Arabidopsis thaliana,NP191310;AtPG2:拟南芥Arabidopsis thaliana,NP850359;AdPG:猕猴桃Actinidia deliciosa,L12019;BrnPG:欧洲油菜Brassica napus,NP001302495;CmPG1:甜瓜Cucumis melo,AF062465;CmPG2:甜瓜Cucumis melo,AF062466;CpPG4:番木瓜Carica papaya,GQ479796;DkPG3:柿Diospyros kaki,EU816199;LcPG:荔枝Litchi chinensis,AFW04075;GmPG6:大豆Glycine max,ABD62085;MaPG3:小果野蕉Musa acuminata,AY603339;NtPG1:烟草Nicotiana tabacum,AHG12641;MdPG:苹果Malus domestica,L27743;PaPG:杏Prunus armeniaca,ADT82706;PcPG:西洋梨Pyrus communis,CAH18935;PcPG1:西洋梨Pyrus communis,AB084461;PcPG3:西洋梨Pyrus communis,BAF42034;PdPG1:欧洲李Prunus domestica,DQ375247;PpPG:碧桃Prunus persica,EF568784;PpPG1:碧桃Prunus persica,BAH56488;PpPG2:碧桃Prunus persica,CAA54448;TAPG1:番茄Solanum lycopersicum,NM001246866;TAPG2:番茄Solanum lycopersicum,U70480;TAPG4:番茄Solanum lycopersicum,U70481;VvPG1:葡萄Vitis vinifera,AY043233;VvPG2:葡萄Vitis vinifera,EU078975;ZmPG:玉米Zea mays,P26216
I:SPNTDG结构域;II:GDDC结构域;III:CGPGHG结构域;IV:RIK结构域
Fig. 3Amino acid sequence alignment of CitPG34 with other PG proteins
I: SPNTDG domain, II: GDDC domain, III: CGPGHG domain, IV: RIK domain
图4
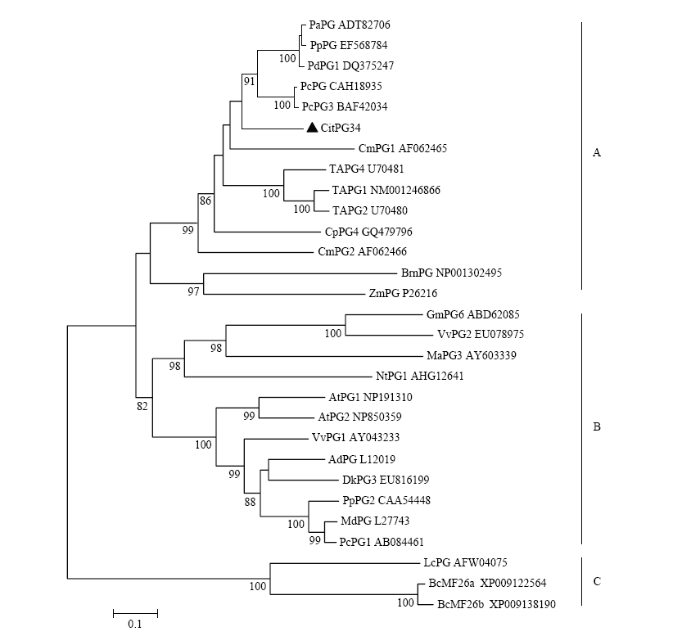 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4植物PGs蛋白系统进化树
Fig. 4Phylogenetic tree of plant PGs
2.2 CitPG34的表达分析
CitPG34在柑橘不同组织中的表达存在显著差异,即在花中表达量最高,其次为根,在离层A和C中表达量较低,在叶和幼果中几乎不表达(图5)。上述结果表明,CitPG34在柑橘花发育过程中发挥着重要作用。图5
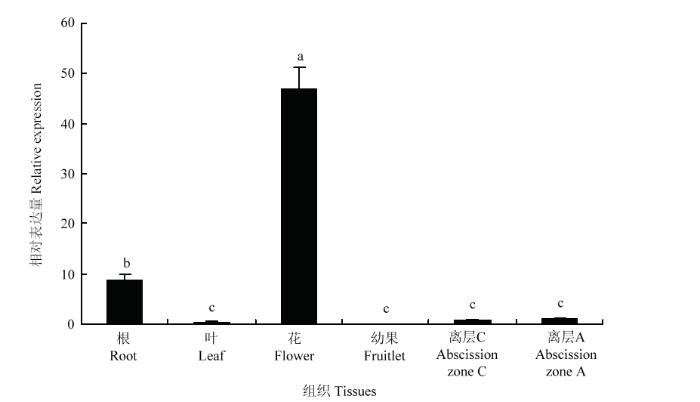 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5CitPG34在柑橘不同组织中的表达水平
不同小写字母表示差异显著(P<0.05)。下同
Fig. 5Expression levels of CitPG34 in different tissues
Different lowercase letters indicate significant difference (P<0.05). The same as below
在幼果第一次脱落过程中,CitPG34在离层A中的表达水平显著上升,在24 h达到最高水平;而在ACC处理后,其表达水平在12 h就受到明显诱导,在18 h达到最高水平,表明CitPG34受到了ACC诱导调控;相反,IAA处理后的离层A中CitPG34的表达水平始终保持在较低水平,说明该基因的转录受到了IAA的抑制(图6)。上述结果表明,CitPG34明显与柑橘幼果脱落相关。
图6
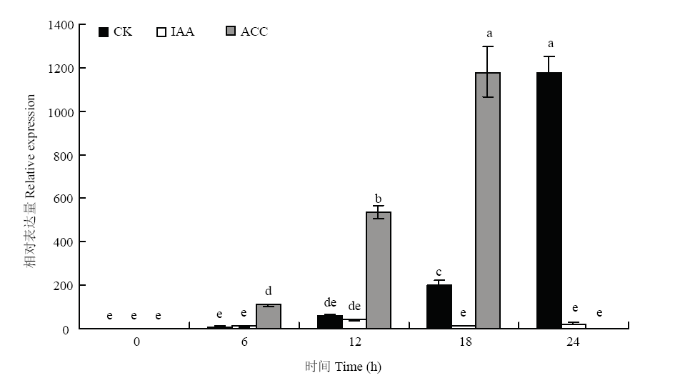 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6在柑橘幼果脱落过程中CitPG34的表达水平
Fig. 6Expression levels of CitPG34 during citrus fruitlet abscission
2.3 亚细胞定位
CELLO软件预测表明CitPG34属于胞外蛋白。为了进一步验证该分析结果,本试验利用洋葱表皮细胞对CitPG34进行了亚细胞定位。结果发现,在转入空白载体pCAMBIA1302-GFP的洋葱表皮细胞中,其细胞核、细胞质膜及细胞壁中均出现绿色荧光,而转入pCAMBIA1302-CitPG34-GFP的表皮细胞中,绿色荧光主要在细胞壁上(图7)。该结果与CELLO软件预测一致,表明CitPG34属于胞外蛋白,主要位于细胞壁上。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7CitPG34蛋白的亚细胞定位
A、B、C、D:表皮细胞未发生质壁分离;E、F、G、H:表皮细胞发生质壁分离;比例尺=100 μm
Fig. 7The subcellular localization of CitPG34 protein
A, B, C, D: Epidermal cells were not plasmolyzed; E, F, G, H: Epidermal cells were not plasmolyzed; Scale = 100 μm
2.4 CitPG34启动子的克隆与分析
以‘塔罗科’血橙DNA为模板,克隆获得CitPG34起始密码(ATG)前2 075 bp的启动子片段(CitPG34- P)。Plant CARE分析结果显示,CitPG34-P序列除包含启动子核心元件TATA-box和增强子保守元件CAAT-box外,同时还存在光响应元件、激素响应元件、逆境响应元件等,如Box4、ATCT-motif、ABRE、TGACG-motif、MBS、ARE和Box-W1等(表2)。Table 2
表2
表2CitPG34启动子序列主要顺式作用元件
Table 2
| 顺式作用元件 cis-element | 序列 Sequence | 功能 Function | 数量 Number |
|---|---|---|---|
| ABRE | CACGTG; ACGTG; AACCCGG | 脱落酸应答相关的顺式作用元件 Cis-acting element involved in the abscisic acid responsiveness | 7 |
| ARE | AAACCA | 厌氧诱导必须顺式作用元件 Cis-acting regulatory element essential for the anaerobic induction | 2 |
| CGTCA-motif | CGTCA | 甲基茉莉酸应答相关的顺式作用元件 Cis-acting regulatory element involved in the MeJA-responsiveness | 2 |
| MBS | CAACTG | 参与干旱诱导的MYB结合位点 MYB binding site involved in drought-inducibility | 3 |
| MBSI | aaaAaaC(G/C)GTTA | 类黄酮生物合成基因调控相关的MYB结合位点 MYB binding site involved in flavonoid biosynthetic genes regulation | 1 |
| MYB | TAACCA | 赤霉素作用元件 Gibberellin action element | 3 |
| MYB-like sequence | TAACCA | 赤霉素作用元件 Gibberellin action element | 3 |
| MYC | CATTTG; CATGTG | MYC结合位点 MYC binding site | 2 |
| TC-rich repeats | ATTCTCTAAC | 胁迫响应元件 Cis-acting element involved in defense and stress responsiveness | 1 |
| TCA-element | CCATCTTTTT | 水杨酸应答元件 Cis-acting element involved in salicylic acid responsiveness | 1 |
| TGACG-motif | TGACG | 茉莉酸甲酯调控元件 Cis-acting regulatory element involved in the MeJA-responsiveness | 2 |
| WUN-motif | AAATTTCCT | 机械伤应答元件 wound-responsive element | 1 |
| as-1 | TGACG | 茉莉酸甲酯调控元件 Cis-acting regulatory element involved in the MeJA-responsiveness | 2 |
| Box-W1 | TTGACC | 真菌诱导应答元件 Fungal induced response elements | 1 |
新窗口打开|下载CSV
通过农杆菌介导法,将CitPG34-P::gus表达载体导入烟草,获得CitPG34-P::gus转基因植株。GUS组织化学染色表明,在正常条件下,未能检测到转基因植株叶片中的GUS酶活力;然而,在乙烯利处理后,GUS酶
活力显著增强,其中叶脉和毛状体上最为明显(图8)。
图8
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8CitPG34-P::gus转基因植株的GUS组织化学染色
Fig. 8Histochemical staining of GUS expression in CitPG34 promoters
3 讨论
在植物细胞壁水解酶家族中,PGs由多基因编码,成员之间具有功能特异性,参与植物生长发育的多个过程,如器官脱落、果实成熟软化、种子萌发、花粉粒成熟、木质部细胞发育及花药或荚果开裂等[20,21,22,23,24]。目前,已有大量PG基因在不同物种中被鉴定,如苹果[25]、桃[26]、番茄[27]、拟南芥[28]、水稻[29]、大豆[30]、杨树[31]、番木瓜[32]、葡萄[33]等,但柑橘中相关基因的克隆和功能分析还鲜有报道。本研究成功克隆获得了CitPG34全长,经多重蛋白序列比对显示,CitPG34含有PGs基因家族典型的保守结构域,即SPNTDG(Ⅰ)、GDDC(Ⅱ)、CGPGHGISIGSLG(Ⅲ)、RIK(Ⅳ)。聚类分析发现,来自不同物种的29个PGs形成3个分支(A、B和C),这与HADFIELD和BENNETT[34]的结果一致,分支A中的PGs成员主要参与器官脱落和果实软化[35,36];分支B中PGs主要涉及果实软化以及荚果开裂[21,26];而分支C主要由参与花粉发育的PGs组成[37]。在本研究中,CitPG34位于分支A中,与PcPG3关系最近,推测该基因可能与柑橘果实软化或脱落相关。亚细胞定位表明CitPG34位于细胞壁,属于胞外蛋白,这与油菜BcMF26[37]、甘蓝BoMF25[9]和拟南芥PGX3[38]等的报道一致。在植物体内,PG在不同组织中的表达水平差异明显,具有一定的组织特异性。例如,在拟南芥中,PGX1在花中表达量最高,其次是叶和根,在茎中表达量较低[39];PGX3主要在花中表达,在荚果、茎、叶中次之,根最低[38];同样,ADPG1和ADPG2在荚果中表达较高,其次是花芽和根,在叶中几乎不表达[28]。LYU等[9]发现,甘蓝BoMF25在花序表达量最高,根次之,在茎、叶和荚果中表达量几乎不表达。与上述结果类似,CitPG34在柑橘花、根、叶、果等组织中均有表达,其中花中表达量最高,其次是根、离层A和C,在叶和果中表达量最低,由此推测CitPG34在柑橘的花发育过程中具有重要作用。
研究表明乙烯可以促进柑橘幼果脱落,而吲哚-3-乙酸(Indole-3-acetic acid,IAA)则相反[18,40-41]。VAN DOORN和STEAD[42]认为IAA之所以能抑制器官脱落,是因为IAA降低了离层细胞对乙烯的敏感性。MEIR等[43]利用基因芯片技术研究了番茄花脱落的分子机制,结果显示IAA处理能明显降低TAPG1、TAPG2以及TAPG4在花的离层中的表达。2-萘乙酸(Naphthaleneacetic acid,NAA)通过抑制苹果离层MdPG2的表达,从而明显降低了成熟果实脱落,表明MdPG2与果实脱落有关[44]。ZHU等[45]也在苹果上得到类似结果,即通过对苹果幼果喷施NAA后,造成幼果落果率显著增加,转录组分析进一步表明,MdPG2参与了幼果脱落。XIE等[18]通过转录组分析发现7个PGs成员与柑橘幼果脱落相关,CitPG34(orange1.1t02532)为其中成员之一。在本研究中,CitPG34在离层A中的表达水平明显受ACC诱导,却被IAA抑制,在幼果第一次脱落过程中显著上升,与柑橘幼果脱落呈现明显相关。
启动子作为基因结构的重要组成部分,能够调控基因表达的起始时间、空间和表达水平。因此,通过克隆并分析基因启动子序列,可以阐述基因的表达水平及其调控的分子机制。本研究中克隆获得了CitPG34起始密码(ATG)前2 075 bp的启动子片段(CitPG34-P)。顺式作用元件分析结果表明,CitPG34-P含有对光、干旱胁迫、厌氧胁迫、真菌诱导和激素(脱落酸、茉莉酸、赤霉素)应答元件,说明外界环境的变化可能会诱导CitPG34基因的转录活性发生相应的变化。HONG等[36]将番茄TAPG1、TAPG2以及TAPG4启动子连接报告基因GUS并转入番茄中,通过GUS染色分析发现,TAPG1、TAPG2以及TAPG4启动子对GUS活力的调控特征基本与相应基因的表达模式相一致。本研究中,CitPG34启动子的转基因烟草叶片经乙烯利诱导处理后,在叶脉和毛状体中的活性较强,暗示CitPG34受乙烯诱导,可能与叶脉和毛状体的生长发育有关。
4 结论
从‘塔罗科’血橙中克隆得到CitPG34及其启动子序列,其蛋白具有SPNTDG(Ⅰ)、GDDC(Ⅱ)、CGPGHGISIGSLG(Ⅲ)、RIK(Ⅳ)4个特征保守结构域。亚细胞定位分析显示CitPG34主要位于细胞壁。CitPG34在花中表达最高,根次之,在其他组织中表达极低或不表达;另外,其表达量受IAA抑制,被ACC诱导,说明该基因与柑橘幼果脱落相关。GUS组织化学染色结果表明,CitPG34受乙烯诱导,主要在叶脉和毛状体中表达。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
DOI:10.3864/j.issn.0578-1752.2018.16.010Magsci [本文引用: 1]

【目的】基于全基因组鉴定分析柑橘CEP基因(CitCEPs)家族成员,了解各成员的分类进化关系,研究各基因成员在不同组织中的表达特异性以及对激素和非生物胁迫的响应,为进一步研究CEP基因家族的生物学功能打下基础。【方法】利用BLASTp基于Phytozome数据库鉴定柑橘CEP家族成员,采用GSDS、ProtScale Tool、EXPASY、CLUSTALX、MEGA6.0、plantCARE、Cello等软件绘制家族成员基因结构图;分析预测蛋白的相对分子质量与等电点等理化性质;构建系统进化树及亚细胞定位预测等,利用实时荧光定量PCR技术(qRT-PCR)检测柑橘CEP基因家族各成员在‘资阳香橙’(‘<em>Citrus junos</em> Ziyang’)不同处理下的瞬时表达情况。【结果】柑橘CEP基因家族由11个成员组成,其中CitCEP10和CitCEP11含1个内含子,其余成员均无内含子;该基因家族成员均含有SPGV/IGH保守结构域序列,其预测蛋白均为亲水性蛋白,亲水性最强的氨基酸其值为3.711,亲水性最弱的氨基酸其值为-2.778;亚细胞定位预测结果显示该基因家族成员位于细胞不同位置,其中CitCEP1、CitCEP2、CitCEP4、CitCEP5、CitCEP6、CitCEP8定位于细胞外,CitCEP3和CitCEP7在细胞外和线粒体中均存在,CitCEP9位于细胞核中,CitCEP10在细胞质膜上,而CitCEP11位于线粒体和细胞核中;聚类分析发现,该家族成员分布于不同的分支中,分别与拟南芥CEP不同成员聚在一起,表明柑橘CEP成员间具有不同生物功能。表达分析显示,CitCEP2主要在茎、叶和子叶中表达,CitCEP3主要在根和子叶中表达,而CitCEP10和CitCEP11主要在果皮中表达,其余成员在上述组织中表达极低或不表达,体现了不同成员间组织特异性的差异。在干旱条件下,CitCEP2表达下调,CitCEP3、CitCEP10和CitCEP11的相对表达量均逐渐上调;而在盐胁迫下,CitCEP2、CitCEP10的响应模式与其所对应的干旱胁迫类似,CitCEP3和CitCEP11则呈现先升后降趋势。在乙烯(ETH)、脱落酸(ABA)处理下,CitCEP2的表达量明显受到抑制,而在茉莉酸甲酯(MeJA)、水杨酸(SA)、生长素(IAA)、赤霉素(GA3)处理下均表现为先上升、后下降的趋势;在6-苄氨基腺嘌呤(6-BA)、IAA、GA3、ABA处理下CitCEP3也表现出类似趋势。CitCEP10在ETH处理下表达量显著上升,在6-BA、SA、ABA处理下表达量呈现先下降后上升趋势,而在MeJA、IAA、GA3处理中无明显规律。CitCEP11在ETH、MeJA、SA、IAA、GA3、ABA处理下表达均呈现下调趋势,与CitCEP3在ETH、SA处理下的表达模式类似。在6-BA处理下,CitCEP11表达呈现先下降后上升趋势。【结论】从柑橘全基因组上鉴定出了11个CitCEP基因成员,各成员均为亲水蛋白,并含有SPGV/IGH保守结构域,位于细胞中不同位置。在不同逆境和激素处理下,CitCEP2、CitCEP3、CitCEP10和CitCEP11呈现不同程度的响应,而其余成员响应不明显或未响应。推测CitCEP2、CitCEP3、CitCEP10与CitCEP11在柑橘生长发育和逆境响应过程中可能起着重要作用。
DOI:10.3864/j.issn.0578-1752.2018.16.010Magsci [本文引用: 1]

【目的】基于全基因组鉴定分析柑橘CEP基因(CitCEPs)家族成员,了解各成员的分类进化关系,研究各基因成员在不同组织中的表达特异性以及对激素和非生物胁迫的响应,为进一步研究CEP基因家族的生物学功能打下基础。【方法】利用BLASTp基于Phytozome数据库鉴定柑橘CEP家族成员,采用GSDS、ProtScale Tool、EXPASY、CLUSTALX、MEGA6.0、plantCARE、Cello等软件绘制家族成员基因结构图;分析预测蛋白的相对分子质量与等电点等理化性质;构建系统进化树及亚细胞定位预测等,利用实时荧光定量PCR技术(qRT-PCR)检测柑橘CEP基因家族各成员在‘资阳香橙’(‘<em>Citrus junos</em> Ziyang’)不同处理下的瞬时表达情况。【结果】柑橘CEP基因家族由11个成员组成,其中CitCEP10和CitCEP11含1个内含子,其余成员均无内含子;该基因家族成员均含有SPGV/IGH保守结构域序列,其预测蛋白均为亲水性蛋白,亲水性最强的氨基酸其值为3.711,亲水性最弱的氨基酸其值为-2.778;亚细胞定位预测结果显示该基因家族成员位于细胞不同位置,其中CitCEP1、CitCEP2、CitCEP4、CitCEP5、CitCEP6、CitCEP8定位于细胞外,CitCEP3和CitCEP7在细胞外和线粒体中均存在,CitCEP9位于细胞核中,CitCEP10在细胞质膜上,而CitCEP11位于线粒体和细胞核中;聚类分析发现,该家族成员分布于不同的分支中,分别与拟南芥CEP不同成员聚在一起,表明柑橘CEP成员间具有不同生物功能。表达分析显示,CitCEP2主要在茎、叶和子叶中表达,CitCEP3主要在根和子叶中表达,而CitCEP10和CitCEP11主要在果皮中表达,其余成员在上述组织中表达极低或不表达,体现了不同成员间组织特异性的差异。在干旱条件下,CitCEP2表达下调,CitCEP3、CitCEP10和CitCEP11的相对表达量均逐渐上调;而在盐胁迫下,CitCEP2、CitCEP10的响应模式与其所对应的干旱胁迫类似,CitCEP3和CitCEP11则呈现先升后降趋势。在乙烯(ETH)、脱落酸(ABA)处理下,CitCEP2的表达量明显受到抑制,而在茉莉酸甲酯(MeJA)、水杨酸(SA)、生长素(IAA)、赤霉素(GA3)处理下均表现为先上升、后下降的趋势;在6-苄氨基腺嘌呤(6-BA)、IAA、GA3、ABA处理下CitCEP3也表现出类似趋势。CitCEP10在ETH处理下表达量显著上升,在6-BA、SA、ABA处理下表达量呈现先下降后上升趋势,而在MeJA、IAA、GA3处理中无明显规律。CitCEP11在ETH、MeJA、SA、IAA、GA3、ABA处理下表达均呈现下调趋势,与CitCEP3在ETH、SA处理下的表达模式类似。在6-BA处理下,CitCEP11表达呈现先下降后上升趋势。【结论】从柑橘全基因组上鉴定出了11个CitCEP基因成员,各成员均为亲水蛋白,并含有SPGV/IGH保守结构域,位于细胞中不同位置。在不同逆境和激素处理下,CitCEP2、CitCEP3、CitCEP10和CitCEP11呈现不同程度的响应,而其余成员响应不明显或未响应。推测CitCEP2、CitCEP3、CitCEP10与CitCEP11在柑橘生长发育和逆境响应过程中可能起着重要作用。
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 3]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
