 ,, 吴贤锋, 黄勤楼, 高承芳, 陈鑫珠, 张晓佩福建省农业科学院畜牧兽医研究所,福州 350013
,, 吴贤锋, 黄勤楼, 高承芳, 陈鑫珠, 张晓佩福建省农业科学院畜牧兽医研究所,福州 350013Transcriptome Analysis of Differentially Gene Expression Associated with longissimus doris Tissue in Fuqing Goat and Nubian Black Goat
LIU Yuan, LI WenYang ,, WU XianFeng, HUANG QinLou, GAO ChengFang, CHEN XinZhu, ZHANG XiaoPeiAnimal Husbandry and Veterinary Institute, Fujian Academy of Agricultural Sciences, Fuzhou 350013
,, WU XianFeng, HUANG QinLou, GAO ChengFang, CHEN XinZhu, ZHANG XiaoPeiAnimal Husbandry and Veterinary Institute, Fujian Academy of Agricultural Sciences, Fuzhou 350013通讯作者:
责任编辑: 林鉴非
收稿日期:2018-06-7接受日期:2019-05-9网络出版日期:2019-07-16
| 基金资助: |
Received:2018-06-7Accepted:2019-05-9Online:2019-07-16
作者简介 About authors
刘远,Tel:0591-87902045;E-mail: seayuan521@163.com。

摘要
关键词:
Abstract
Keywords:
PDF (2399KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
刘远, 李文杨, 吴贤锋, 黄勤楼, 高承芳, 陈鑫珠, 张晓佩. 福清山羊与努比亚黑山羊背最长肌比较转录组分析[J]. 中国农业科学, 2019, 52(14): 2525-2537 doi:10.3864/j.issn.0578-1752.2019.14.011
LIU Yuan, LI WenYang, WU XianFeng, HUANG QinLou, GAO ChengFang, CHEN XinZhu, ZHANG XiaoPei.
0 引言
【研究意义】随着人们生活水平的提高和保健意识的增强,对肉食品的质量有了更高的要求,畜禽肉质性状的遗传改良是当前的主要研究方向[1]。我国遗传资源丰富,地方山羊品种或资源58个,大多数品种具有肉质优良的优点[2]。研究地方山羊品种优质肉质性状的分子调理机理,挖掘、鉴定和充分利用控制山羊肉质性状的主效基因,并与传统选育方法结合共同改良山羊肉质性状具有重要意义[3]。【前人研究进展】转录组是特定组织或细胞在某一环境或生理条件下所转录表达的所有RNA总和,既包括编码蛋白的mRNA,也包括非编码RNA,是连接基因组遗传信息与蛋白质组生物功能的纽带[4]。高通量转录组测序技术(RNA sequencing,RNA-Seq)的发展和成熟为系统研究基因表达及调控提供了重要的手段和方法,在畜禽重要经济性状分子机制研究中得到了广泛使用[5,6,7,8]。基于RNA-Seq,研究者采用不同的策略开展了不同羊品种肉质性状候选基因的筛选。孟宪然等研究了不同年龄和不同性别绒山羊背最长肌之间的差异表达基因,筛选到3个可能参与肉品质重要的候选基因[9]。张春兰分别构建了生长性能存在显著差异的小尾寒羊和杜泊羊臂二头肌转录组文库,两个转录组文库间发现有1 300个差异表达基因[10]。赵珺比较了绒山羊3个骨骼肌的差异表达情况,挖掘到631个新基因[11]。王位等选用以肉质肌纤维密度差异较大的巴美肉羊与小尾寒羊的背最长肌进行高通量转录组测序,筛选了6个与肉质性状相关的候选基因[3]。上述研究为转录组层面阐述羊肉质性状形成的分子机制奠定了基础。【本研究切入点】虽然利用RNA-Seq技术发现了大量可能影响肉质性状的新候选基因,但研究的对象仅局限于我国北方的少数绵、山羊品种,而鲜见南方地区特色地方肉用品种的相关研究,大量品种优良肉质特性的遗传学基础仍需开展深入研究。【拟解决的关键问题】本研究拟选用肉用性能存在明显差异的福建地方山羊品种——福清山羊(中小体型肉用品种)和福建省引进的努比亚黑山羊(大体型肉用品种)为材料[12],采用RNA-Seq技术比较两者背最长肌的差异表达基因及新转录本分析,并对筛选的差异表达基因进行GO(gene ontology)、KEGG(kyoto encyclopedia of genes and genomes)功能富集和COG(cluster of orthologous groups of proteins)分类,挖掘控制福清山羊肉质和生长性状的相关候选基因,为地方品种种质资源的遗传机制研究提供理论依据。1 材料与方法
1.1 试验材料
本研究选用的福清山羊和努比亚黑山羊由福建省农业科学院福清市渔溪肉羊试验基地提供,试验于2016年9月至2017年9月进行。选择出生日期间隔不超过3天的胎产双羔羔羊作为试验羊,每个品种选4只,分别记录初生重,根据福清山羊和努比亚黑山羊商品羊的生产实际进行饲养管理(羯羊育肥、2月龄断奶、周岁上市)。试验公羔于15日龄统一去势,365日龄禁饲12h后称重,各品种随机挑选3只个体(福清山羊分别标记为F1、F2、F3,努比亚黑山羊分别标记为N4、N5、N6)按照国家实验动物处理饲喂准则屠宰,取第10—12胸椎处背最长肌,用于RNA提取的样品迅速用锡箔纸包裹后于液氮中速冻,置于-80℃超低温冰箱备用,另取20g左右样品用于肌内脂肪含量(inter-muscular fat, IMF)的测定。1.2 RNA提取、转录组文库构建及测序
利用TaKaRa MiniBEST Universal RNA Extraction Kit(TaKaRa,大连宝生物)提取每个样品背最长肌组织的总RNA,单个建池。为了保证数据准确性,采用Nanodrop检测RNA的纯度,Agilent 2100精确检测RNA的完整性。RNA样品检测合格后,送北京百迈克生物科技有限公司进行文库构建以及测序。文库构建完成后,对建成文库的质量进行检测。文库质量合格后,不同的文库利用Illumina HiSeq2500平台(Illumina,America),基于边合成边测序(sequencing by synthesis,SBS)技术进行高通量测序。1.3 转录组测序数据处理与分析
原始测序数据(Raw reads)经过去除含有接头和低质量数据过滤后获得高质量测序数据(clean reads)。利用TopHat2[13]软件将获得的Clean reads比对到山羊参考基因组(ftp://ftp.ncbi.nlm.nih.gov/genomes/all/GCF/ 001/704/415/GCF_001704415.1_ASM170441v1/GCF_001704415.1_ASM170441v1_genomic.fna.gz)[14],获取序列在参考基因组或基因上的位置信息,以及样品特有的序列特征信息。1.4 差异表达基因的筛选、功能注释和富集分析
参考JIANG等报道的数学模型[15],使用Cufflinks软件的Cuffquant和Cuffnorm组件,通过比对到的序列(Mapped Reads)在基因上的位置信息,对转录本和基因的表达水平进行定量。采用FPKM(Fragments Per Kilobase of transcript per Million fragments mapped)作为衡量转录本或基因表达水平的指标[16],即每百万个比对到的reads中比对到外显子的每千碱基上的片段数目。以努比亚黑山羊为对照,利用DEseq进行2个品种间的差异表达分析[17]。在差异表达基因(differentially expressed genes,DEGs)检测过程中,将差异倍数(Fold Change)≥2且FDR(False Discovery Rate,错误发现率)<0.01作为DEGs的筛选标准。绘制2个品种DEGs火山图(volcano plot)并进行聚类分析。利用GO数据库对DEGs进行功能注释[18]。COG数据库进行DEGs分类统计[19]。KEGG数据库进行DEGs的通路分析[20]。
1.5 荧光定量PCR验证
为了进一步验证高通量测序结果以及发现新基因(转录本)序列的准确性,以18S rRNA为内参基因,根据差异表达基因结果,随机挑选6个差异表达的基因(包括3个新发现转录本),2个非差异表达基因Ⅰ型肌球蛋白重链(Myosin heavy chain Ⅰ,MyHCⅠ)和Ⅱb型肌球蛋白重链(Myosin heavy chain Ⅱb , MyHCⅡb)基因,采用实时荧光定量PCR(qRT-PCR)验证基因表达量。内参基因、MyHCⅠ、MyHCⅡb基因引物参考文献[21]设计,其余差异表达基因引物根据测序序列信息由ABI公司的Primer Express Software v2.0设计,铂尚生物技术(上海)有限公司合成,基因名称及引物信息见表1。以1.2中各样品RNA池为模板,采用TAKARA PrimeScript? RT reagent Kit with gDNA Eraser(TaKaRa,大连宝生物)试剂盒逆转录后进行qRT-PCR扩增,扩增体系20μL:cDNA模板1μL,上、下游引物各1μL,2×SYBR? Select Master Mix 10μL,ddH2O 7μL。qRT-PCR扩增程序:95℃预变性2 min;95℃变性10s,60℃退火10s,72℃延伸40s,50个循环;最后72℃延伸5min;4℃保存。采用2-ΔΔCt法计算基因的相对表达量。Table 1
表1
表1实时荧光定量PCR引物信息
Table 1
| 基因名称 Gene | 上游引物 Forward primer(5′-3′) | 下游引物 Reverse primer(5′-3′) | 产物长度 Product size(bp) |
|---|---|---|---|
| 18S rRNA | GTAACCCGTTGAACCCCATT | CCATCCAATCGGTAGTAGCG | 151 |
| TMSSF2 | TAGGATCTCTGTGGCGCACC | TTCCGAATGGACTGGTTGGA | 108 |
| CD52 | AGAAGCACCCCCAATCCTTG | GAACCTCCCTGTGTCAGCCA | 105 |
| TASR 1 | ACAGGAGAGGCCAGGTTGTA | ACTGTGTCTCCCACAGTGCA | 101 |
| GN-1377 | CCCGATTCGGTGACATGTTC | TTCCGTCGGTTTTGGAGTTG | 105 |
| GN-1378 | GTCAGTGATCGTGTTCCGCA | TCTCAGGCTGTCGGTGACCT | 101 |
| GN-1272 | GGAGACCCAGAGAGCAAAGA | TGTTGACAGCGTCTGCTTTC | 117 |
| MyHCⅠ | AAGAACCTGCTGCGGCTG | CCAAGATGTGGCACGGCT | 250 |
| MyHCⅡb | GACAACTCCTCTCGCTTTGG | GGACTGTGATCTCCCCTTGA | 247 |
新窗口打开|下载CSV
1.6 数据处理与分析
EXCEL用于数据的初步统计以及作图,品种间表型差异采用SPSS17.0的“Independent-Sample T Test”程序计算分析。2 结果
2.1 样品的IMF、生长性状测定
IMF是影响羊肉品质的重要因素之一,其对羊肉大理石纹、嫩度、风味及膻味等均有重要影响。一般认为IMF含量超过3%的肌肉品质较好,福清山羊背最长肌的平均IMF含量为3.69%,显著高于努比亚黑山羊背最长肌的1.83%(P =0.003),表明本研究选用的2个品种样品间肉质表型存在明显差异(表2)。而努比亚黑山羊个体的初生重、宰前活重和平均日增重均显著高于福清山羊个体(P=0.000),品种间生长性状的差异较大(表2)。Table 2
表2
表2各样品IMF和生长性状分析
Table 2
| 样品 Sample | F1 | F2 | F3 | 平均值 Mean | N4 | N5 | N6 | 平均值 Mean | t | P值 P-value |
|---|---|---|---|---|---|---|---|---|---|---|
| 初生重 Birth weight (kg) | 1.31 | 1.24 | 1.37 | 1.31±0.07 | 3.25 | 3.47 | 3.52 | 3.41±0.14 | -23.14 | 0.000 |
| 宰前活重 Body Weight (kg) | 24.8 | 25.3 | 25.5 | 25.2±0.36 | 48.2 | 51.4 | 49.7 | 49.8±1.6 | -25.93 | 0.000 |
| 平均日增重 ADG(g.d-1) | 64.5 | 66.1 | 66.3 | 65.6±0.99 | 123.5 | 131.7 | 126.9 | 127.4±4.12 | -25.24 | 0.000 |
| IMF(%) | 3.11 | 3.94 | 4.03 | 3.69±0.51 | 1.79 | 1.73 | 1.97 | 1.83±0.12 | 6.18 | 0.003 |
新窗口打开|下载CSV
2.2 测序数据评估及对比分析
经过文库质量检测和测序质量控制,各样品均符合测序要求。6个样品共得到44.76Gb Clean Data,各样品Clean Data 均达到6.77Gb以上,获得Clean reads 22737051—26944107条。测序数据碱基质量质Q30碱基百分比为91.01%—92.01%,碱基GC含量为52.36%—53.87%,各碱基质量稳定在20%—30%之间,低质量碱基比例小,测序质量好。表明文库构建质量和测序质量高,测序数据准确可靠,满足后续分析条件。将获得的Clean reads与参考山羊基因组进行对比分析,结果表明各样品的Clean reads与参考基因组的比对效率在84.65%—86.17%之间,比对到参考基因组唯一位置的Reads占Clean Reads的百分比为79.50%—81.44%,多处位置的百分比为4.04%—5.53%(表3)。
Table 3
表3
表3测序数据与参考山羊基因组的序列比对结果统计
Table 3
| 样品 Sample | 总Reads Total reads | 可定位的Reads Mapped reads | 唯一定位Reads Uniq mapped reads | 多点定位Reads Multiple mapped reads |
|---|---|---|---|---|
| F1 | 48425148 | 41178058/85.03% | 38498938/79.50% | 2679120/5.53% |
| F2 | 52036998 | 44841490/86.17% | 42130532/80.96% | 2710958/5.21% |
| F3 | 45474102 | 38872827/85.48% | 37033407/81.44% | 1839420/4.04% |
| N4 | 47876820 | 40525347/84.65% | 38452657/80.32% | 2072690/4.33% |
| N5 | 52575764 | 44743681/85.10% | 42129626/80.13% | 2614055/4.97% |
| N6 | 53888214 | 45906932/85.19% | 43520461/80.76% | 2386471/4.43% |
新窗口打开|下载CSV
2.3 DEGs的筛选、功能注释和富集分析
2.3.1 DEGs的筛选 采用FPKM作为衡量转录本或基因表达水平的指标,计算得到了6个样本17 302个表达基因的FPKM值。根据差异基因筛选标准,获得了努比亚黑山羊和福清山羊背最长肌的DEGs608个,其中上调基因61个,下调基因547个,图1为差异表达基因火山图。进一步的选择与畜禽能量脂肪代谢、肌肉生长发育相关的基因,发现DEGs中类胰岛素一号增长因子(Insulin-like growth factor 1,IGF1)、长链酯酰辅酶A合成酶5(Long-chain fatty acyl-CoA synthetases 5,ACSL5)、磷酸烯醇丙酮酸羧激酶2(phosphoenolpyruvate carboxykinase 2,PCK2)、过氧化物酶体增殖激活受体γ共激活因子1α(Hepatic peroxisome proliferator-activated receptor gamma,coactivator 1 alpha,PPARGC1A)、Janus激酶2基因(Janus Kinase 2,JAK2)、信号转导子和转录激活子4(signal transducer and activator of transcription 4,STAT4)、干扰素调节因子8(interferon regulatory factor 8,IRF8)、有丝分裂原激活蛋白激激激激酶1(mitogen-activated protein kinase kinase kinase kinase 1,MAP4K1)可作为控制福清山羊肉质性状和生长性能的候选基因。图1
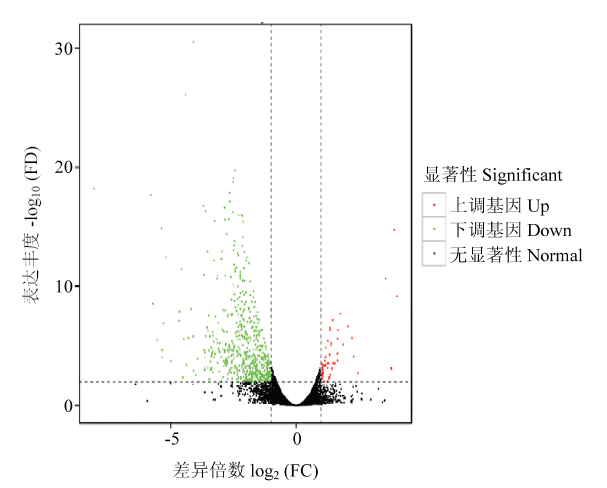 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1差异表达基因火山图
图中的每点表示一个基因。绿点表示表达量下调的基因,红点表示表达量上调的基因,黑点表示无显著性差异基因
Fig. 1Volcano plot of differentially expressed genes
Each dot represents a gene. Green dots are significantly down-regulated genes. Red dots are significantly up-regulated genes. Black dots are genes without differentially expression
进一步对筛选出的DEGs做层次聚类分析,将具有相同或相似表达模式的基因进行聚类,DEGs聚类结果见图2。图2的横坐标表明2个品种的3个生物学重复分别聚类在一起,说明同一品种的生物学重复样品间有很高的相关性;纵向DEGs分为明显的上调和下调两个基因簇,上调和下调基因簇内分别具有较高的相关性。说明本研究选用的样本生物学重复性好,样本分组合理。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2差异表达基因聚类分析热图
图中不同的列为不同的样品,不同行表示不同的基因,颜色表示基因在样品中表达量的FPKM对数值
Fig. 2Heat map of the differentially expressed genes
Columns indicate individual samples, the row represents each differentially expressed genes. The color scale represents log10(FPKM)
2.3.2 差异表达基因的GO功能富集 GO注释系统是一个有向无环图,包含3个主要分支,即:生物学过程(biological process, BP),细胞组分(cellular component, CC)和分子功能(molecular function, MF)。筛选出的608个DEGs中的518个基因能够被GO数据库注释,GO分类统计结果见图3。被注释的DEGs分别参与了BP、CC和MF的22、19和20个功能亚分类。在BP分类中,细胞过程、单一的生物过程和生物调节参与的DEGs最多,与肉质和生长性状相关联的发育过程和生长的DEGs也被注释。在CC分类中,DEGs参与细胞部分、细胞、细胞器的数量最多。在MF分类中,DEGs在结合中所占比例最高,其次为催化活性及分子传感器活性。
图3
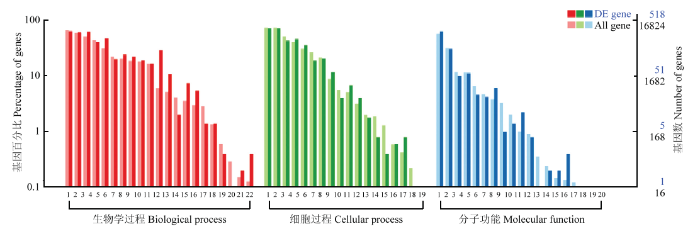 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3差异表达基因GO注释
生物学过程(Biological process):1细胞过程 Cellular process;2单一的生物过程 Single-organism process;3生物调节 Biological regulation;4代谢过程 Metabolic process;5刺激反应 Response to stimulus;6多细胞生物过程 Multicellular organismal process;7信号 Signaling;8定位 Localization;9发育过程 Developmental process;10组织或生物起源细胞组件 Cellular component organization or biogenesis;11免疫系统过程 Immune system process;12多生物体过程 Multi-organism process;13繁殖过程Reproductive process;14移动Locomotion;15生物粘附Biological adhesion;16繁殖Reproductive;17生长Growth;18有节奏的过程Rhythmic process;19激素分泌 Hormone secretion;20生物相 Biological phase;21细胞杀伤 Cell killing;22细胞聚集Cell aggregation
细胞过程(Cellular process):1细胞部分 Cell part;2细胞 Cell;3细胞器 Organelle;4膜 Membrane;5膜部分 Membrane part;6细胞器部分Organelle part;7高分子复合物 Macromolecular complex;8胞外区Extracellular region;9膜包围内腔Membrane-enclosed lumen;10细胞外区域部分Extracellular region part;11细胞连接Cell junction;12细胞外基质Extracellular matrix;13突触Synapse;14突出部分Synapse part;15细胞外基质部分 Extracellular matrix part;16胶原三聚体Collagen trimer;17细胞核Nucleoid;18病毒体Virion;19病毒体部分Virion part
分子功能(Molecular function):1结合 Binding;2催化活性 Catalytic activity;3分子传感器活性Molecular transducer activity;4受体活性Receptor activity;5运输活性Transporter activity;6核酸结合转录因子活性Nucleic acid binding transcription factor activity;7酶调节活性Enzyme regulator activity;8结构分子活性Structural molecule activity;9蛋白结合转录因子活性Protein binding transcription factor activity;10鸟嘌呤核苷酸交换因子活性Guanyl-nucleotide exchange factor activity;11电子载体活性Electron carrier activity;12抗氧化活性Antioxidant activity;13通道调节活性Channel regulator activity;14受体调节活性 Receptor regulator activity;15化学诱导物活性 Chemoattractant activity;16转录调节因子活性 Translation regulator activity;17金属伴侣活性Metallochaperone activity;18排斥活动Chemorepellent activity;19蛋白标签Protein tag ;20成形素活性 Morphogen activity
Fig. 3GO annotation of DEGs
2.3.3 差异表达基因的COG分类 利用COG数据库可以对基因产物进行直系同源分类。筛选的148个DEGs能够被COG数据库注释,分类统计结果见图4。其中一般的功能预测基因数目最多,其次为信号转导机制,转录和复制、重组与修复。
图4
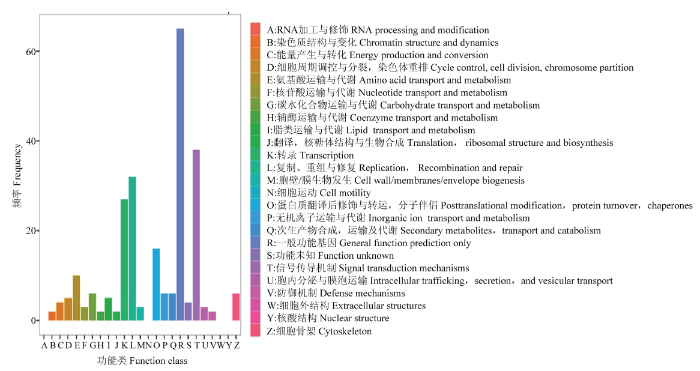 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4差异表达基因COG注释分类统计图
Fig. 4COG annotation classification statistics of DEGs
2.3.4 差异表达基因的KEGG注释 经过分析,可被注释到KEGG数据库的418个差异表达基因参与了近100个通路,将差异表达基因KEGG的注释结果按照KEGG中通路类型进行分类,分类图见图5。差异表达基因参与最多的是人类疾病相关的通路,其次是生物系统相关通路。可能与肉质性状和生长发育相关的通路有肌动蛋白细胞骨架调节、Jak-STAT信号转导通路、MAPK信号转导通路和Ⅰ型糖尿病通路等。
图5
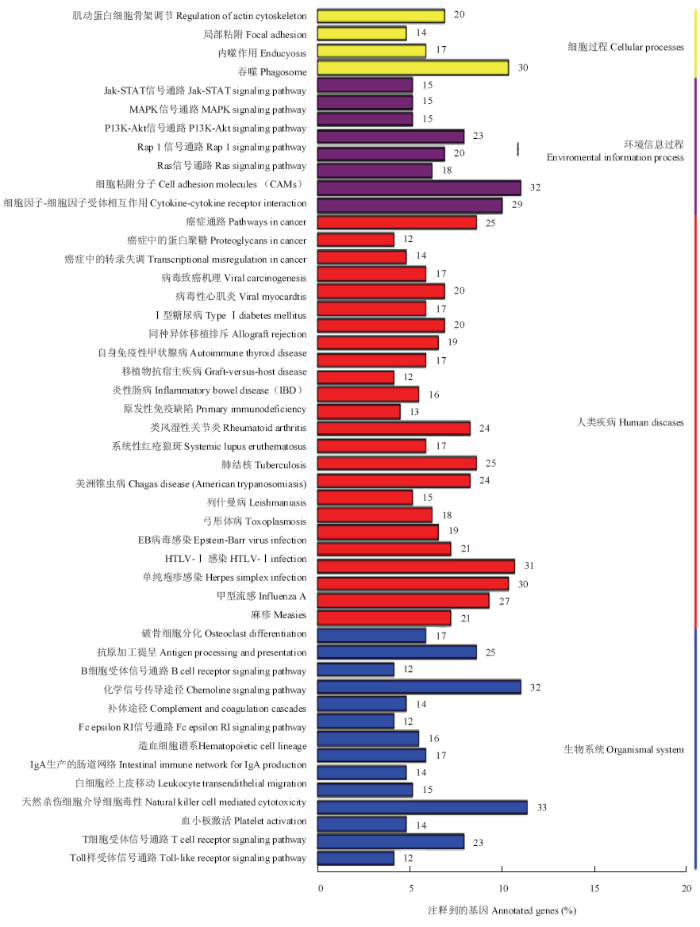 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5差异表达基因显著富集的KEGG通路
Fig. 5List of KEGG pathway for DEGs
以KEGG数据库总通路为单位,应用超几何检验,找出与整个基因组背景相比,在DEGs中显著性富集的通路。图6为DEGs的KEGG通路富集分析结果,图中呈现了显著性Q值最小的20个通路,富集显著性最可靠的通路大部分为人类疾病相关的通路。
图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6差异表达基因KEGG通路富集散点图
Fig. 6Enriched scatter map of DEGs KEGG pathway
2.4 新基因分析
基于所选参考基因组序列,使用Cufflinks软件对Mapped Reads进行拼接,并与原有的基因组注释信息进行比较,寻找原来未被注释的转录区,发掘该物种的新转录本和新基因,从而补充和完善原有的基因组注释信息。过滤掉编码的肽链过短(少于50个氨基酸残基)或只包含单个外显子的序列,共发掘707个新基因(转录本),其中15个为2个品种的差异表达基因。2.5 Real-time PCR验证测序
8个基因(转录本)的 qRT-PCR结果见表4,选择的目的基因在2个品种个体间表达变化模式与转录组测序结果一致,表明本研究利用转录组测序获得差异表达基因以及新基因(转录本)序列数据较为准确。Table 4
表4
表4测序结果的qRT-PCR验证
Table 4
| 基因 Gene | 转录组测序RNA-Seq | 荧光定量PCR Real-time PCR |
|---|---|---|
| 表达倍数(福清山羊/努比亚黑山羊) log2FC (Fuqing goats/Nubian Black goats) | 表达倍数(福清山羊/努比亚黑山羊) log2FC (Fuqing goats/Nubian Black goats) | |
| TMSSF2 | -2.41±0.93 | -2.90±2.51 |
| CD52 | 2.48±0.56 | 2.60±1.37 |
| TASR1 | 3.43±2.61 | 1.80±0.86 |
| GN-1377 | 2.51±1.20 | 0.98±0.76 |
| GN-1378 | 2.73±0.33 | 1.08±0.41 |
| GN-1272 | 1.22±1.00 | 1.07±0.68 |
| MyHcⅠ | -0.24±1.04 | -0.11±1.36 |
| MyHcⅡb | -0.62±0.39 | -0.51±1.22 |
新窗口打开|下载CSV
3 讨论
陈其新等应用综合指数法结合聚类分析法,对我国22个山羊品种的肉用生产力进行了评价,其中努比亚黑山羊生产指数的拟合度高,体型大、生长速度快、生产效率高,肉用性能优于波尔山羊,是适宜的杂交父本;而福清山羊的生产指数拟合度低,体型小、生长速度慢、生产效率低,属于肉用性能较差的品种[12]。本研究证实了在相同饲养条件下2个品种肉用性能存在明显差异,努比亚黑山羊的ADG极显著高于福清山羊(P=0.000)。目前有关福清山羊肉质特性的评价仅限于人们的主观印象,缺乏客观的科学数据。肌纤维类型和IMF含量是影响羊肉质特性的2个主要因素[22]。MyHCⅠ型和MyHC2b型肌纤维的含量差异会造成肉质差异,富含MyHCⅠ型肌纤维的肉品质优[21],2个品种背最长肌的高通量测序和qRT-PCR结果均未发现MyHCⅠ基因和MyHC2b基因的差异表达,初步表明肌纤维类型不是引起2品种肉质差异的主要原因,而背最长肌IMF含量的极显著差异(P=0.003)可能是品种间肉质差异的关键。
畜禽肉质、生长性状的表型主要取决于相互联系的肌纤维发育和IMF沉积的2个肌肉生长过程[23]。本研究利用RNA-Seq筛选的DEGs中,IGF1是肌糖原代谢的功能基因[24],PCK2、MAP4K1、JAK2、STAT4属于参与成肌细胞增殖、分化和肌纤维类 型转化的功能基因[23],这5个重要功能基因的差异表达可能影响2个品种的生长性状;ACSL5、PPARGC1A参与了脂肪细胞增殖、分化和脂类代谢调控[23],可能影响2个品种骨骼肌的IMF沉积,影响肌肉的肉质特性。
试验材料的类型(体现表型的组织或者组成表型的细胞)、品种或个体本身的差异以及DEGs的筛选标准等均会影响RNA-Seq差异表达基因的筛选结果[25]。本研究获得的DEGs类型、数量与王位等[3]、孟宪然等[9]研究其他肉羊品种骨骼肌研究结果存在一定的差异,且本研究中DEGs参与最多的是人类疾病相关的通路。除了材料不同造成的结果差异外,可能福清山羊和努比亚黑山羊在抗病、免疫性状方面也存在较大表型差异,有待进一步深入研究。
随着高通量测序技术的发展和广泛应用,动物遗传学从以前候选基因、单一性状为主的微观研究转向以物种进化构架内的全基因组水平、多性状、组学化的宏观研究,利用高通量测序技术研究畜禽主要经济性状取得了较大的研究进展[26]。基于转录组测序,肌动蛋白细胞骨架调节通路、MAPK信号转导通路、Jak-STAT信号通路等与畜禽肉质、生长性状相关的代谢通路也在不同物(品)种被相继发现。冯小婷等[27,28]分别利用高通量芯片研究瘦肉型和脂肪型猪品种背最长肌的差异基因表达谱,均发现DEGs富集到肌动蛋白细胞骨架调节通路;王颖萍[29]利用RNA-Seq技术研究猪脂肪沉积相关的miRNA,结果表明差异表达的miRNA的靶基因参与了肌动蛋白细胞骨架调节。XUE等[30]对不同生长阶段京海黄鸡腿肌进行RNA-Seq,发现肌动蛋白细胞骨架调节与生长发育相关。LIU等[31]利用蛋白质组学技术研究了北京油鸡肌内脂肪沉积的分子机制,认为肌动蛋白细胞骨架调节通路在肌内脂肪沉积中起到最重要的作用。利用RNA-Seq技术分别筛选小尾寒羊与巴美肉羊背最长肌组织[3]、小尾寒羊和杜泊羊臂二头肌组织[32]的DEGs的KEGG显著性富集分析均发现肌动蛋白细胞骨架调节通路,但不同年龄和不同性别绒山羊背最长肌[9]之间的DEGs未富集到该通路。
MAPK信号转导通路主要分为4类,第一类是胞外信号调节激酶(extracellular signal-regulated kinases,ERKs),第二类是c-Jun N端激酶(c-Jun N-terminal kinases, JNKs),第三类为p38,第四类为ERK5通路,不同的通路分别应答不同的胞外信号,产生不同的效应[33]。研究证实ERK1/2通路、JNK通路和p38通路对肌发生的过程都有调控作用,其中p38正调控肌细胞分化[34],JNKs[35,36]和ERKs[37]抑制肌细胞分化、促进肌细胞的增殖。冯小婷[27]、王颖萍[29]研究表明MAPK信号转导通路参与了猪脂肪沉积过程;HOU等[38]研究miR-378在肌肉发育过程中的生物学功能,发现过表达miR-378后出现下调的基因涉及MAPK信号转导通路;LUO等[39]研究表明MAPK通路活性在性连锁矮小鸡和正常鸡骨骼肌中存在显著差异是导致前者肌肉发育异常的潜在因素。孟宪然等[9]研究不同年龄和不同性别绒山羊背最长肌之间的DEGs,DEGs富集到MAPK信号转导通路,但相应的其他羊品种研究中未发现该通路[3,32]。
Jak-STAT信号通路是一条涉及多种细胞因子的信号转导途径,主要参与细胞增殖分化、细胞凋亡、免疫调节等过程。JAKs通过和受体聚集后的磷酸化而产生活性,再催化STATs上相应部位的酪氨酸残基使其磷酸化,后者再与STATs对应功能区相互作用活化STATs,具有活性的STATs进入细胞核与其他转录因子一起参与调控基因的转录[40]。研究表明该通路参与了猪肌肉发育过程,影响猪肉质性状的形成[27,38]。然而基于RNA-Seq技术筛选的不同羊品种肌肉间的DEGs尚未发现富集到该通路,也未发现本研究富集到的与能量代谢有关的Ⅰ型糖尿病通路[3,9,32],这2个通路对羊肌肉生长和发育的影响需要深入的研究。
4 结论
本研究通过对体型差异大的福清山羊和努比亚黑山羊的背最长肌进行RNA-Seq分析,在转录组水平上筛选出了与羊肉质和生产性能相关的608个DGEs,包括15个首次发现的新转录本(基因)。并且初步明确了肌动蛋白细胞骨架调节、Jak-STAT信号转导通路、MAPK信号转导通路和Ⅰ型糖尿病通路等4个可能与肉质性状和生长发育相关的通路。该研究为揭示福清山羊“生长速度慢”、“肉质优良”等种质资源特性形成的分子机制提供了线索,为开发和利用畜禽优良性状分子标记提供了参考依据。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 6]
[本文引用: 6]
[本文引用: 1]
.
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
DOI:10.11843/j.issn.0366-6964.2015.08.004URLMagsci [本文引用: 5]

<p>通过研究不同年龄和不同性别绒山羊背最长肌之间的差异表达基因,筛选影响绒山羊肉品质的候选基因。本研究基于RNA-Seq技术对4个绒山羊背最长肌的转录组进行高通量测序,在测序评估的基础上,对差异表达基因进行筛选、功能注释和富集分析。本研究通过CLC Genomics Workbench 6.0软件共找到263个候选基因,其中包含123个高表达有利基因和140个高表达有害基因。GO功能注释结果显示,高表达有利基因主要与骨骼肌的生长发育、细胞器的形成和蛋白结合功能有关;高表达有害基因主要与脂质代谢、细胞骨架以及结合功能有关。利用KEGG数据库作为参考,这些基因主要参与糖酵解/糖异生、丝裂原活化蛋白激酶、凝血-补体级联反应和色氨酸代谢等通路中。结合其他家畜基因组学研究,<em>ADIPOQ</em>、<em>PDK</em>4和<em>CD</em>36可能作为参与肉品质重要的候选基因。该结果为绒山羊肉品质的改善以及候选基因的研究提供了理论依据。</p>
DOI:10.11843/j.issn.0366-6964.2015.08.004URLMagsci [本文引用: 5]

<p>通过研究不同年龄和不同性别绒山羊背最长肌之间的差异表达基因,筛选影响绒山羊肉品质的候选基因。本研究基于RNA-Seq技术对4个绒山羊背最长肌的转录组进行高通量测序,在测序评估的基础上,对差异表达基因进行筛选、功能注释和富集分析。本研究通过CLC Genomics Workbench 6.0软件共找到263个候选基因,其中包含123个高表达有利基因和140个高表达有害基因。GO功能注释结果显示,高表达有利基因主要与骨骼肌的生长发育、细胞器的形成和蛋白结合功能有关;高表达有害基因主要与脂质代谢、细胞骨架以及结合功能有关。利用KEGG数据库作为参考,这些基因主要参与糖酵解/糖异生、丝裂原活化蛋白激酶、凝血-补体级联反应和色氨酸代谢等通路中。结合其他家畜基因组学研究,<em>ADIPOQ</em>、<em>PDK</em>4和<em>CD</em>36可能作为参与肉品质重要的候选基因。该结果为绒山羊肉品质的改善以及候选基因的研究提供了理论依据。</p>
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 2]
.
[本文引用: 2]
DOI:10.1186/gb-2013-14-4-r36URL [本文引用: 1]
[本文引用: 1]
DOI:10.1093/bioinformatics/btp113URL [本文引用: 1]
DOI:10.12688/f1000researchURL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1093/nar/28.1.33URL [本文引用: 1]
DOI:10.1093/nar/gkh063URL [本文引用: 1]
[D].
[本文引用: 2]
[D].
[本文引用: 2]
DOI:10.3724/SP.J.1005.2013.01081URLMagsci [本文引用: 1]

<p>骨骼肌卫星细胞是一种肌源性干细胞, 在骨骼肌的生长、发育及肌肉损伤修复中有着至关重要的作用。肌卫星细胞通过增殖、分化融合肌纤维形成新的肌核从而导致骨骼肌纤维的肥大以及骨骼肌纤维类型的相互转化, 进而影响肉品质的形成。文章从肌纤维的发育与肉品质形成、卫星细胞分化与肌纤维特征的相关性等方面, 对卫星细胞的Notch等经典遗传信号通路和miRNA等表观遗传调控及其对肉品质的影响进行了综述。</p>
DOI:10.3724/SP.J.1005.2013.01081URLMagsci [本文引用: 1]

<p>骨骼肌卫星细胞是一种肌源性干细胞, 在骨骼肌的生长、发育及肌肉损伤修复中有着至关重要的作用。肌卫星细胞通过增殖、分化融合肌纤维形成新的肌核从而导致骨骼肌纤维的肥大以及骨骼肌纤维类型的相互转化, 进而影响肉品质的形成。文章从肌纤维的发育与肉品质形成、卫星细胞分化与肌纤维特征的相关性等方面, 对卫星细胞的Notch等经典遗传信号通路和miRNA等表观遗传调控及其对肉品质的影响进行了综述。</p>
DOI:10.3969/j.issn.1006-267x.2014.10.009URLMagsci [本文引用: 3]

我国已连续多年成为世界第一猪肉生产大国和消费大国,但是我国猪肉品质的国际竞争力却不能与此相提并论。优良的猪肉品质所蕴含的经济价值毋庸置疑,而且生产优质猪肉也是养猪业的终极目标,因此提高猪肉生产的科技水平、改善猪肉品质,是增强我国养猪业科技含量,保证我国养猪业可持续发展的重要环节。优良的猪肉品质是建立在健康、安全、生态和注重动物福利的养猪基础上的高端畜产品的特性,畜牧科技工作者对它的追求和研究,已经从最初的劣质猪肉的发生或成因深入到了如何改善猪肉肉色、风味、嫩度、多汁性和系水力等富有人文色彩的猪肉品质方面。本文从影响猪肉品质的肌肉生物学特性的2个方面,即肌纤维发育和肌内脂肪沉积,探讨了优质猪肉形成的分子机制和营养调节,综述和回顾了近年国际上该领域的最新进展和发展方向,提出了我国****应在继承前人研究成果的同时,挖掘我国地方猪优质基因资源,利用营养基因组学和整合生理学的概念,促进我国优质猪肉研究、生产和发展的建议。
DOI:10.3969/j.issn.1006-267x.2014.10.009URLMagsci [本文引用: 3]

我国已连续多年成为世界第一猪肉生产大国和消费大国,但是我国猪肉品质的国际竞争力却不能与此相提并论。优良的猪肉品质所蕴含的经济价值毋庸置疑,而且生产优质猪肉也是养猪业的终极目标,因此提高猪肉生产的科技水平、改善猪肉品质,是增强我国养猪业科技含量,保证我国养猪业可持续发展的重要环节。优良的猪肉品质是建立在健康、安全、生态和注重动物福利的养猪基础上的高端畜产品的特性,畜牧科技工作者对它的追求和研究,已经从最初的劣质猪肉的发生或成因深入到了如何改善猪肉肉色、风味、嫩度、多汁性和系水力等富有人文色彩的猪肉品质方面。本文从影响猪肉品质的肌肉生物学特性的2个方面,即肌纤维发育和肌内脂肪沉积,探讨了优质猪肉形成的分子机制和营养调节,综述和回顾了近年国际上该领域的最新进展和发展方向,提出了我国****应在继承前人研究成果的同时,挖掘我国地方猪优质基因资源,利用营养基因组学和整合生理学的概念,促进我国优质猪肉研究、生产和发展的建议。
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 3]
[D].
[本文引用: 3]
[本文引用: 1]
[D].
[本文引用: 2]
[D].
[本文引用: 2]
DOI:10.1371/journal.pone.0173824URL [本文引用: 1]
DOI:10.1371/journal.pone.0159722URL [本文引用: 1]
DOI:10.1371/journal.pone.0072686URL [本文引用: 3]
[本文引用: 1]
DOI:10.1038/sj.emboj.7601587URL [本文引用: 1]
DOI:10.1210/en.2005-1541URL [本文引用: 1]
DOI:10.1016/j.cellsig.2007.07.002URL [本文引用: 1]
DOI:10.1158/0008-5472.CAN-05-3060URL [本文引用: 1]
DOI:10.1371/journal.pone.0052123URL [本文引用: 2]
DOI:10.3390/ijms17030276URL [本文引用: 1]
DOI:10.1016/S0898-6568(97)00129-0URL [本文引用: 1]
