 , 杨江伟
, 杨江伟 , 司怀军
, 司怀军Effect of Silencing C-3 Oxidase Encoded Gene StCPD on Potato Drought Resistance by amiRNA Technology
ZHOUXiang-Yan , YANGJiang-Wei
, YANGJiang-Wei , SIHuai-Jun
, SIHuai-Jun通讯作者:
收稿日期:2017-08-18
接受日期:2018-01-8
网络出版日期:2018-01-29
版权声明:2018作物学报编辑部作物学报编辑部
基金资助:
作者简介:
-->
展开
摘要
关键词:
Abstract
Keywords:
-->0
PDF (2037KB)元数据多维度评价相关文章收藏文章
本文引用格式导出EndNoteRisBibtex收藏本文-->
油菜素内酯(brassinosteroid, BR)是20世纪70年代末新发现的一类植物生长调节物质, 被称为第六大类植物激素[1]。在植物生长发育中起重要作用, 包括细胞伸长与分裂、维管束分化、光形态建成、叶和根的发育、衰老、育性以及对逆境胁迫的响应等[2]。CPD基因编码C-3氧化酶, 为BRs合成的限速酶[3,4]。BRs生物合成途径及其遗传调节是当今植物生物学研究的热点。目前已经取得了重要进展, 但主要集中在拟南芥、水稻等模式植物。近年来对BRs应用报道很多, 但对植物抵抗环境胁迫的能力, 特别是通过转基因手段提高植物抗逆性的研究报道较少。
RNA干扰(RNA interference, RNAi)技术是指将与靶基因转录产物mRNA存在同源互补序列的双链RNA (double strand RNA, dsRNA)导入细胞后, 能特异性地降解该mRNA, 最终导致目标基因转录后沉默的现象[5]。RNAi可以高效、特异性地使目的基因转录后沉默或剔除目标基因的表达, 获得功能丧失性突变个体, 用于基因功能研究, 已成为重要方法[6]。但RNAi经常会出现脱靶现象[7,8]。
人工microRNA技术是利用植物体内固有的通过microRNA进行基因沉默的系统, 以拟南芥miR319a的前体序列作为amiRNA 的基本骨架序列, 通过人工设计特异的miRNA, 经重叠PCR扩增将天然miR319a 的成熟序列替换成amiRNA的成熟序列来沉默目的基因的方法[9]。利用人工合成的microRNA技术进行植物基因沉默的研究最先是由Alvarez等[10]、Niu等[11]、Schwab等[12]开创的。由于人工microRNA技术克服了以往的RNA干扰技术易脱靶的弱点, amiRNA不仅可以高效沉默基因, 同时具有很高的特异性[13], 其靶标基因易于预测, 已被用于拟南芥、烟草、水稻、小立碗藓等物种[14]的研究中。
本研究以pRS300载体为基础, 通过设计用于沉默马铃薯BR合成限速酶基因CPD (StCPD)的amiRNA, 并构建表达载体pCPB121-amiRcpd, 采用农杆菌介导技术将其导入马铃薯栽培品种“紫花白”, 得到StCPD基因干扰表达的转基因植株, PEG模拟干旱胁迫处理StCPD基因干扰表达的马铃薯试管苗, 用qRT-PCR法测定不同处理时间StCPD基因的相对表达量, 同时分析其MDA和脯氨酸等指标及其表型变化, 明确StCPD基因干扰表达对马铃薯抗旱能力的响应, 为进一步研究BR合成相关基因的功能奠定基础。
1 材料与方法
1.1 实验材料
植物表达载体pBCPD(CaMV 35S启动子)抗性标记为卡那霉素(Kan), 用于遗传转化的马铃薯栽培品种“紫花白”的试管苗由本实验室保存。根癌农杆菌(Agrobacterium tumefaciens)菌株LBA4404选择标记为利福平(Rif), 由甘肃省作物遗传改良与种质创新重点实验室提供; 大肠杆菌(Escherichia coli)菌株为DH5α和载体pMT18-T购自宝生物工程(大连)有限公司; 模板载体pRS300[15]; 辅助载体pC121以pMT18-T为基础构建, 含有源自pBI121[16,17]的d35S-TL启动子区和终止子序列, 在d35S-TL和终止子序列之间重新设计了与pRS300衔接的多克隆位点。卡那霉素(Kan)、吲哚乙酸(IAA)、羧苄青霉素(Carb)、利福平(Rif)、6-苄氨基腺嘌呤(6-BA)、赤霉素(GA3)、反式玉米素(ZT)和特美汀均购自中科瑞泰(北京)生物科技公司; 酵母提取物、胰蛋白胨和Taq DNA聚合酶、Total RNA Kit、T4 DNA Ligase、RNase和Sac I、Kpn I限制性核酸内切酶、5×PrimeScript RT Master Mix试剂盒、DL2000 Marker和Spin柱式DNA胶回收试剂盒均购自生工(上海)生物工程有限公司; 由生工(上海)生物工程有限公司完成PCR引物合成和DNA测序。其他各种试剂均为国产分析纯产品。
1.2 人工microRNA的分子设计及克隆
利用在线软件WMD (http://wmd2.weigelworld. org/)设计针对StCPD基因的amiRNA, 其序列为5′-TATTATGTTAGCGATTCGCAC-3′, 以amiRNA序列设计用于over-lapping PCR的引物I、II、III、IV (表1)。通用引物A (5′-CTGCAAGGCGATTAAGTTGG GTAAC-3′)和B (5′-GCGGATAACAATTTCACACA GGAAACAG-3′)分别与pRS300质粒中MIR319a外围序列配对。Table 1
表1
表1重叠PCR引物
Table 1List of over-lapping PCR primers
| amiRNA /amiRNA | 引物序列 Primer sequences (5′-3′) |
|---|---|
| I | GATATTATGTTAGCGATTCGCACTCTCTCTTTTGTATTCC |
| II | GAGTGCGAATCGCTAACATAATATCAAAGAGAATCAATGA |
| III | GAGTACGAATCGCTATCATAATTTCACAGGTCGTGATATG |
| IV | GAAATTATGATAGCGATTCGTACTCTACATATATATTCCT |
新窗口打开
以质粒pRS300为模板[15], 通过重叠PCR把质粒pRS300中内源miR319a的20个核苷酸替换为我们设计选择的21个核苷酸的amiRNA序列。在第一轮PCR中, 首先扩增出amiRNA前体的5′臂(片段a)、中心环(片段b)和3′臂(片段c)[15]。PCR 体系: 含模板 DNA 20 ng、正反向引物(表2)各0.5 pmoL、dNTP 1 mmol L-1、Taq DNA聚合酶2.5 U和10×buffer 1 μL, 用灭菌双蒸水补足 10 μL。PCR条件为95°C预变性2 min; 95°C变性30 s, 52°C复性30 s, 72°C延伸40 s, 进行40个循环; 72°C延伸7 min。利用2%琼脂糖凝胶电泳纯化产物a、b、c。
Table 2
表2
表2产生amiRNA前体的标准反应体系
Table 2Standard reaction system for producing amiRNA precursor
| PCR反应 PCR reaction | 正向引物 Forward primer | 反向引物 Reverse primer | 模板 Template | 产物长度 Length of PCR product (bp) |
|---|---|---|---|---|
| (a) | A | IV | pRS300 | 272 |
| (b) | III | II | pRS300 | 171 |
| (c) | I | B | pRS300 | 298 |
| (d) | A | B | (a) + (b) + (c) | 701 |
新窗口打开
以a、b、c这3个片段的纯化DNA混合物为模板, 以A和B为引物扩增覆盖整个前体d[12]。PCR体系: 含模板 DNA 20 ng、正反向引物(表2)各 0.5 pmoL、dNTP 1 mmol L-1、Taq DNA聚合酶2.5 U 和10×buffer 1 μL, 用灭菌双蒸水补足 10 μL。PCR条件为95°C预变性2 min; 95°C变性30 s, 55°C复性30 s, 72°C延伸90 s, 进行40个循环; 72°C延伸7 min。利用1%琼脂糖凝胶电泳回收纯化片段d, 连接到克隆载体pMT18-T中, 转化感受态DH5α, 挑取阳性克隆, 以菌落PCR和酶切验证鉴定并测序, 测序正确的质粒被命名为pT-amiRcpd。
1.3 植物表达载体构建
对测序正确的质粒pT-amiRcpd用限制性内切酶Kpn I和Sac I双酶切, 回收长度约512 bp的小片段; 同时将pCPB121质粒用Kpn I和Sac I双酶切, 回收大片段; 将小片段分别与回收的载体大片段按DNA摩尔比3∶1混合, 加入T4 DNA连接酶1 μL, 2×T4 DNA ligase buffer 1 μL, 无菌重蒸水补充体积到10 μL, 将样品混匀后瞬时离心, 置16℃连接过夜。取5 μL连接产物转入大肠杆菌DH5α感受态细胞, 并涂布在Kan抗性平板上进行阳性筛选。酶切、测序验证正确后命名为pCPB121-amiRcpd。然后将pCPB121-amiRcpd质粒用冻融法转化农杆菌感受态细胞。1.4 根癌农杆菌介导的马铃薯茎段和薯片遗传转化
接种马铃薯茎段于含有3%蔗糖的MS固体培养基上, 置培养箱光照培养30 d左右, 将试管苗作为转化的受体材料。接种茎段于含有8%蔗糖的MS液体培养基上, 待试管苗长至瓶口时, 转入黑暗条件下培养约35 d后开始结薯, 薯块长至大约1 cm时, 适宜作为转化的受体材料。参照Zhou等[18]的根癌农杆菌转化法进行马铃薯试管苗茎段的遗传转化[19]。1.5 转基因植株PCR检测
从转化马铃薯植株中提取基因组总DNA[20], 以未转化NT植株作为阴性对照进行PCR检测。根据pCPB121上的NTP II序列设计引物, 上、下游引物分别是NTP II-1 5'-GCTATGACTGGGCACAACA G-3'和NTP II-2 5'-ATACCGTAAAGCACGAGGA A-3', 预期扩增片段大小为676 bp。反应体系含模板DNA 20 ng、正反向引物各0.5 pmoL、dNTP 1 mmol L-1、Taq DNA聚合酶2.5 U和10×buffer 1 μL, 用灭菌双蒸水补足10 μL。反应条件为94℃预变性3 min; 94℃变性45 s, 57℃复性45 s, 72℃延伸1 min, 35个循环; 72℃延伸5 min。以1%琼脂糖凝胶电泳检测。
1.6 转基因植株qRT-PCR表达分析
用实时荧光定量PCR (qRT-PCR)检测StCPD基因在转基因马铃薯整个植株及其不同组织、不同处理时间的表达情况。以18S RNA作为内参基因, 参照One Step PrimeScript1 miRNA cDNA synthesis kit说明书设计amiRcpd的特异引物, 试剂盒提供的通用引物见表3。Table 3
表3
表3马铃薯qRT-PCR分析相关基因引物
Table 3Gene-specific primers sequences for qRT-PCR analysis of potato
| 引物Primer | 引物序列Primer sequence (5'-3') |
|---|---|
| amiRcpd 正向引物 amiRcpd forward primer | TACGAATCGCTATCATAAT |
| 18S RNA | TTAGAGGAAGGAGAAGTCGTAACAA |
| 通用反向引物 Universal reverse primer | miRNA cDNA synthesis试剂盒提供 miRNA cDNA synthesis kit provided |
新窗口打开
参照One Step PrimeScript1 miRNA cDNA synthesis kit说明书, PCR体系含2×SYBR Premix Ex Taq II (2×) 10 µL、10 µmol L-1引物各 1 µL, cDNA模板 2µL, 加RNase-free ddH2O至终体积20 µL。PCR条件为95℃预变性10 s; 95℃ 5 s, 60℃ 25 s, 40个循环。以1%琼脂糖凝胶电泳检测, 染色剂为GoodView II。利用SYBR荧光染料法进行转基因植株的qRT-PCR检测与分析, 根据2-∆∆Ct方法计算基因的相对表达量[21]。重复3次试验, 取平均值。
1.7 马铃薯植株的表型分析
将基因表达量较低的株系(Ci1、Ci3和Ci4)在MS培养基上继代培养, 每个品系6瓶, 每瓶接4个茎段, 光照温度为(24±1)℃, 30 d后比较和观察其形态特征, 包括转基因与野生型试管苗的株高(根原基以上部分长度)、根长(根系长度平均值)、茎粗(距离茎基部2 cm处测定纵横二项直径的平均值)、植株鲜重(从培养基中取出整个植株, 用蒸馏水洗净, 滤纸吸干水分后的重量)等指标。每个株系取长势均匀的10株, 用螺旋测微仪测量株高、根长、茎粗, 用电子天平称量植株鲜重。试验重复3次, 取平均值。1.8 模拟干旱胁迫处理
试管苗生长15 d时, 在超净工作台上, 将培养瓶中液体培养基替换为含有20% PEG-8000的50 mL MS培养基[22], 以不加PEG的MS培养基作为对照, 分别进行干旱胁迫处理0、2、4和6 d。每次处理后, 在超净工作台上取马铃薯叶片, 迅速用液氮冷冻, 放于-80℃冰箱保存, 用于基因表达量分析。胁迫处理15 d的植株, 一部分用于表型分析, 即从3个株系Ci1、Ci3和Ci4中, 分别取长势均匀的5株, 用于株高、根长、茎粗、植株鲜重等形态指标分析。另一部分更换为MS液体培养基(含8%蔗糖)诱导试管薯, 在(24±1)℃全黑暗条件下, 40 d收获, 从3个株系Ci1、Ci3和Ci4中分别选取大小均匀的10个微型薯, 测定薯鲜重(从培养基中取出微型薯, 用蒸馏水洗净, 滤纸吸干水分后的重量)和直径(从培养基中取出微型薯, 用蒸馏水洗净, 滤纸吸干水分后的直径)。重复3次试验, 取平均值。1.9 马铃薯植株的生理生化指标测定
PEG-8000胁迫处理15 d后, 取植株所有叶片参考Bates等[23]的比色法测定脯氨酸(Pro)含量, 参考Ding等[24]的硫代巴比妥酸法测定丙二醛(MDA)含量。混合每瓶4株植株所有叶片为1个处理。重复3次, 取平均值。1.10 数据分析
采用Microsoft Excel 2007整理与统计数据, 用SPSS 17.0软件进行方差分析, 用Duncan’s法进行显著性差异分析(P <0.05)。2 结果与分析
2.1 马铃薯pCPB121-amiRcpd表达载体的构建
以质粒pRS300为模板, 通过重叠PCR在第1轮的PCR中扩增出了5'臂(片段a)、中心环(片段b)和3'臂(片段c), 其长度分别为272、171和298 bp。利用2%琼脂糖凝胶电泳纯化片段a、b、c (图1)。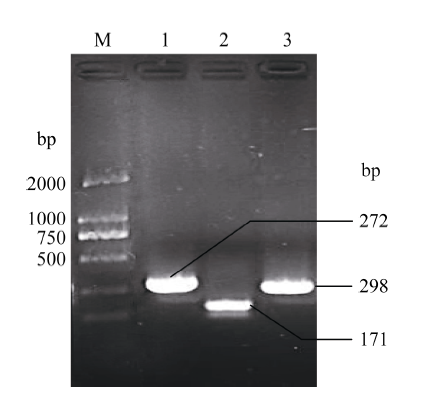 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1合成amiRNA前体a、b和c片段的PCR扩增产物
M: DL2000 marker; 1: 片段a; 2: 片段b; 3: 片段c。
-->Fig. 1PCR products of recombinant plasmid amiRNAs of a, b, and c
M: DL2000 marker; 1: fragment a; 2: fragment b; 3: fragment c.
-->
以3个DNA片段a、b和c的混合物作模板, 以A和B为引物扩增产物d, 其长度为701 bp (图2-a)。通过测序确认产物d为目的片段, 分别用Kpn I和Sac I双酶切载体pCPB121和amiRNAs前体, 回收酶切后的目的片段, 并进行连接构建pCPB121-amiRcpd表达载体。表达载体pCPB121- amiRcpd的酶切鉴定, 表达载体双酶切结果在512 bp处有条带(图2-b), 说明pCPB121-amiRcpd的amiRNAs表达载体构建成功。如图3进一步测序结果, 质粒pRS300中内源miR319a的20个核苷酸替换为我们设计选择的21个核苷酸的amiRNAs序列。
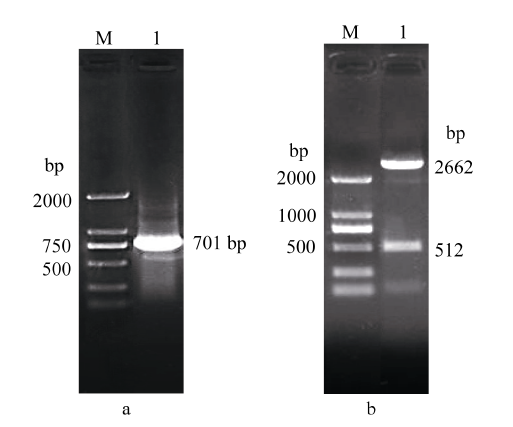 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2合成amiRNAs前体d片段检测
a: d片段菌落PCR扩增产物; b: 双酶切验证。M: DL2000 marker; 1: 片段d。
-->Fig. 2Test of recombinant plasmid amiRNAs of fragment d
a: PCR products of fragment d; b: Kpn I/Sac I double enzyme digestion products of fragment d; M: DL2000 marker; 1: fragment d.
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3合成amiRNA前体d片段的测序结果
上面蓝色部分代表原pRS300载体上miR319a的成熟序列和其反向序列; 下面红色部分代表经PCR扩增后替换的StCPD成熟序列和其反向序列。
-->Fig. 3Sequencing results of recombinant plasmid amiRNA of fragment d
The blue section represents the mature sequence of miR319a on the original pRS300 vector and its reverse sequence, the red part represents the mature sequence of potato miR167 and its reverse sequence after PCR amplification.
-->
2.2 根癌农杆菌介导的马铃薯茎段和薯片遗传转化
试管苗茎段在分化培养基上培养40 d左右再生出绿色小芽试管薯薄片在分化培养基上培养35 d后再生出绿色小芽, 当绿芽长到1 cm左右时, 转接到含100 mg L-1 Kan和200 mg L-1 Carb的选择性生根培养基中, 大约10 d左右部分生根。将生根植株转接入含有3%蔗糖的普通MS培养基中扩繁。2.3 转基因马铃薯株系PCR检测
用npt II特异性引物进行PCR扩增反应, 共有5株转化株系获得与预期676 bp相符的目标条带, 而NT植株中无该条带, 说明其为转amiRcpd基因阳性植株(图4)。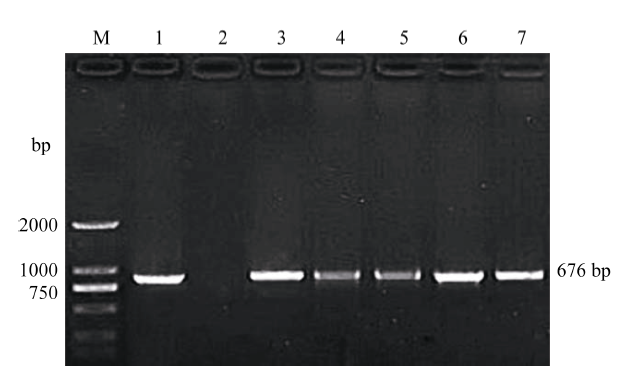 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4以PCR法检测转基因植株
M: DL2000 marker (TaKaRa); 1: pBI121质粒阳性对照; 2: 非转基因植株阴性对照; 3~7: 转基因植株。
-->Fig. 4Verification of transgenic plants by PCR assay of nptII gene
M: DL2000 marker (TaKaRa); 1: plasmid pBI121 as a positive control; 2: untransformed potato plant as a negative control; 3-7: transgenic potato plants.
-->
2.4 转基因试管苗的qRT-PCR检测
StCPD基因在转基因植株(Ci1~Ci5)中的表达量较NT植株都显著降低, 没有检测到假阳性转基因株系。从相对表达量来看, Ci1、Ci3的干扰程度最大, 其StCPD基因的干扰程度分别高达78%和90% (图5)。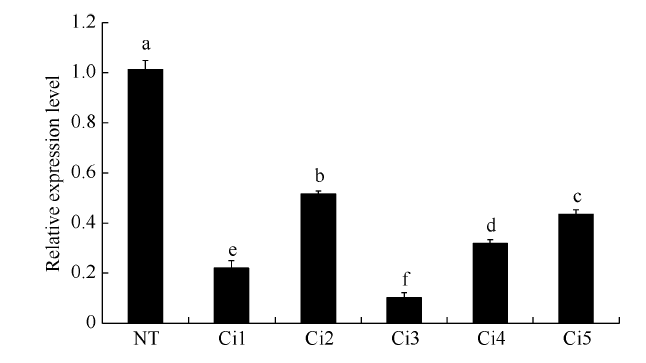 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5转基因植株StCPD基因表达的qRT-PCR检测
NT: 非转基因植株; Ci1~Ci5: 5个不同的转基因株系。
-->Fig. 5 StCPD gene expression level in the transgenic plants tested by qRT-PCR
NT: non-transgenic plant; Ci1-Ci5: five different transgenic plant lines.
-->
2.5 StCPD基因在马铃薯中的组织表达特异性分析
分别提取StCPD基因表达量较低的3个马铃薯株系(Ci1、Ci3和Ci4)的叶、茎和根的总RNA, 以18SRNA为内参, qRT-PCR结果表明, StCPD在马铃薯试管苗不同组织(根、茎和叶)中均有表达, 其相对表达量为叶>茎>根, 叶中StCPD基因表达量是茎和根中表达量的3.05倍和1.65倍(图6)。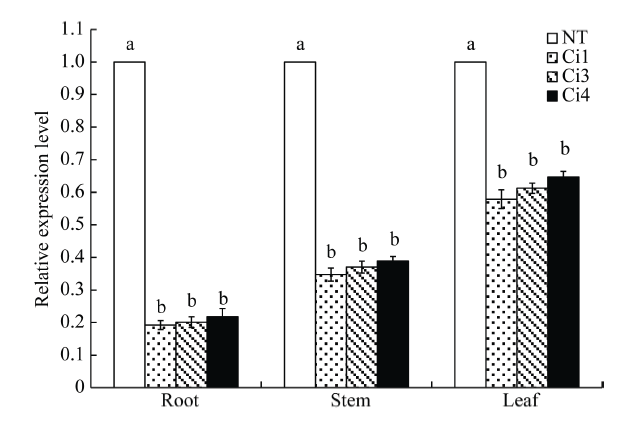 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6qRT-PCR分析StCPD 基因组织表达特异性
NT: 未转基因植株; Ci1, Ci3, Ci4: 转基因植株; NT: 非转基因植株; Ci1、Ci3和Ci4: 3个不同转基因株系; 显著性分析采用邓肯氏新复极差法, 同列不同小写字母表示在0.05水平差异显著性。误差线表示标准误(n = 9, 即3个生物学重复×3次技术重复)。
-->Fig. 6Tissue-specific expression level of StCPD gene in transgenic and NT potato plants tested by qRT-PCR
NT is untransformed potato plants; Ci1, Ci3, and Ci4 are three different transgenic plant lines. Significant differences among means over the different tissues were determined according to Duncan’s test at P<0.05. The line bars are standard errors (n = 9, i.e., three replicates × three runs of the experiment).
-->
2.6 转基因马铃薯植株表型分析
由表4可知, 转基因植株Ci1、Ci3和Ci4的株高、茎粗、根长、植株鲜重等指标均较NT下降, 且差异显著, 说明StCPD基因干扰表达后, 植株的长势明显受到抑制。Table 4
表4
表4 StCPD干扰表达转基因植株表型分析
Table 4Phenotypic analysis of StCPD amiRNA expressed transgenic potato plants
| 株系 Plant line | 株高 Plant height (mm) | 茎粗 Stem thickness (cm) | 根长 Root length (mm) | 植株鲜重 Fresh weight of plant (g) |
|---|---|---|---|---|
| NT | 79.16±1.23 a | 0.29±0.07 a | 38.60±1.00 a | 0.37±0.06 a |
| Ci1 | 57.84±1.91 b | 0.12±0.04 b | 18.52±1.40 b | 0.30±0.02 b |
| Ci3 | 55.02±3.18 c | 0.15±0.04 c | 13.82±1.65 c | 0.25±0.04 c |
| Ci4 | 52.56±4.00 d | 0.11±0.05 b | 19.21±0.86 b | 0.20±0.02 d |
新窗口打开
2.7 不同处理时间下试管苗StCPD基因的qRT-PCR检测
不同干旱胁迫处理的StCPD基因干扰表达和NT马铃薯植株的基因相对表达量差异显著, 干旱处理的转基因和NT植株基因表达量均较对照增加, 且随着胁迫时间的延长基因表达量呈持续增强趋势。转基因植株的StCPD基因相对表达水平明显低于NT植株, 尤其是干旱处理6 d时, StCPD基因表达量是NT的0.68倍(图7-A~B)。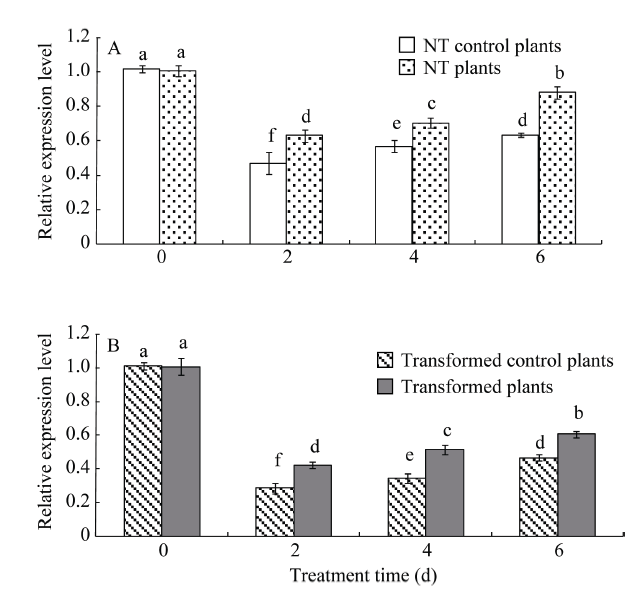 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7干旱胁迫对未转基因(NT, A)和转基因(B)马铃薯StCPD基因相对表达量的影响
不同处理时间(d)的显著性差异采用邓肯氏新复极差法分析, 柱上不同小写字母表示在0.05水平差异显著。误差线表示标准误(n = 9, 即3个生物学重复×3次技术重复)。
-->Fig. 7Effects of drought stress treatments on relative expression levels of the StCPD gene in non-transgenic (NT, A) and transgenic (B) potato plants
Significant differences among means over the period (d) of drought-stress treatments were determined according to Duncan’s test at P<0.05. The line bars are standard errors (n = 9, i.e., three replicates × three runs of the experiment).
-->
2.8 马铃薯植株生理生化指标分析
2.8.1 MDA含量变化 干旱胁迫下, 转基因和NT马铃薯植株的MDA含量均显著高于其对照植株, 随着胁迫时间的延长, MDA的含量呈逐渐增加趋势(图8)。无论干旱处理还是对照, StCPD基因干扰表达马铃薯植株较NT植株的MDA含量显著升高, 干旱胁迫下, 前者是后者的1.07~1.17倍, 而对照处理前者是后者的1.02~1.29倍(图8)。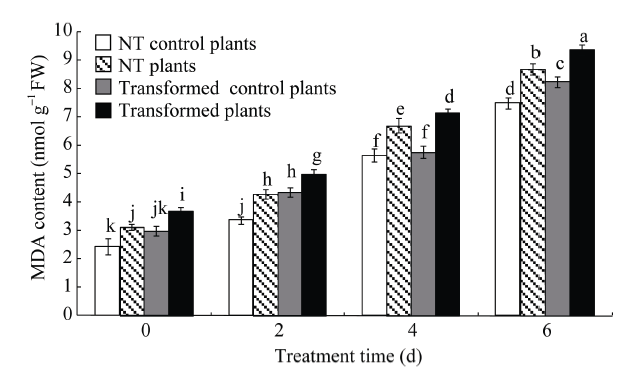 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8转基因马铃薯和未转基因(NT)马铃薯丙二醛含量
MS培养基中培养4周后, 未转基因与转基因株系各自分为两组, 其中一组用新的MS培养基进行对照培养, 另一组用含有20% PEG-8000的MS培养基培养0~6 d。不同处理时间(d)的显著性差异采用邓肯氏新复极差法分析, 柱上不同小写字母表示在0.05水平差异显著。误差线表示标准误(n = 9, 即3个生物学重复×3次技术重复)。
-->Fig. 8MDA contents in transgenic and non-transgenic (NT) potato plants
The NT and transgenic plant lines were divided into two groups, a control group under normal conditions and another group soaked in 20% PEG-8000 for 0-6 d after growing in MS medium for 4 weeks. Significant differences among means over the period (d) of drought-stress treatments were determined according to Duncan’s test at P<0.05. The line bars are standard errors (n = 9, i.e., 3 replicates × 3 runs of the experiment).
-->
2.8.2 游离脯氨酸含量变化 在对照和干旱条件下, StCPD基因干扰表达的马铃薯脯氨酸含量分别是NT植株的0.55~0.90倍和0.57~0.84倍。干旱处理后, 转干扰StCPD基因和NT马铃薯脯氨酸含量都显著高于对照, 随着胁迫处理时间的延长, 脯氨酸含量呈增加趋势(图9)。
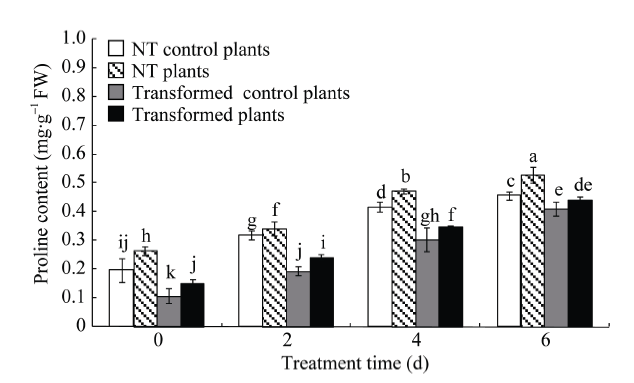 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9转基因马铃薯和未转基因(NT)马铃薯脯氨酸含量
MS培养基中培养4周后, 未转基因与转基因株系各自分为两组, 其中一组用新的MS培养基进行对照培养, 另一组用含有20% PEG-8000的MS培养基培养0~6 d。不同处理时间(d)的显著性差异采用邓肯氏新复极差法分析, 柱上不同小写字母表示在0.05水平差异显著。误差线表示标准误(n = 9, 即3个生物学重复×3次技术重复)。
-->Fig. 9Proline contents in transgenic and non-transgenic (NT) potato plants
The NT and transgenic plant lines were divided into two groups, a control group under normal conditions and another group soaked in 20% PEG-8000 for 0-6 d after growing in MS medium for 4 weeks. Significant differences among means over the period (d) of drought-stress treatments were determined according to Duncan’s test at P<0.05. The line bars are standard errors (n = 9, i.e., 3 replicates × 3 runs of the experiment).
-->
2.9 干旱胁迫对StCPD基因干扰表达马铃薯植株表型的影响
在干旱处理15 d后, 转基因植株的株高、茎粗、根长、鲜重及薯的大小和鲜重等指标都明显低于NT植株(图10和表5)。NT植株的平均株高为转基因系Ci的2.08倍, 平均茎粗为1.92倍, 平均根长为1.21倍, 平均薯鲜重为1.81倍, 平均薯直径为1.70倍。说明StCPD基因干扰表达后, 植株的长势明显受到抑制, 对干旱胁迫的抵抗能力下降。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图10转基因植株试管苗在模拟干旱胁迫处理前后表型
Ci1和Ci3: 对照处理的转基因株系; Ci1’和Ci3’: 干旱胁迫下的转基因株系。图中的标尺为1 cm。
-->Fig. 10Phenotypic difference between the transgenic test-tube plants under drought stress and control treatment
Ci1, Ci3: transgenic plants of control; Ci1’, Ci3’: transgenic plants under drought stress. The scale bar is 1 cm.
-->
Table 5
表5
表5干旱胁迫对StCPD基因干扰表达植株表型影响
Table 5Effects of drought stress on the phenotype of StCPD interference-expressing potato plants
| 株系 Plant line | 株高 Plant height (mm) | 茎粗 Stem thickness (cm) | 根长 Roots length (mm) | 植株鲜重 Fresh weight of plant (g) | 薯鲜重 Fresh weight of tuber (g) | 薯直径 Diameter of tuber (cm) |
|---|---|---|---|---|---|---|
| NT1’ | 76.34±3.22 a | 0.23±0.03 a | 20.53±0.56 b | 0.35±0.03 b | 0.42±0.04 b | 0.67±0.07 b |
| NT2’ | 73.41±2.87 b | 0.22±0.01 a | 23.29±1.21 a | 0.33±0.01 bc | 0.44±0.06 b | 0.77±0.08 a |
| NT3’ | 77.32±11.56 a | 0.25±0.05 a | 22.31±0.37 a | 0.41±0.02 a | 0.57±0.02 a | 0.80±0.05 a |
| Ci1’ | 35.16±0.25 d | 0.10±0.01 b | 18.82±1.34 bc | 0.28±0.02 c | 0.25±0.07 d | 0.51±0.04 c |
| Ci3’ | 36.77±0.55 c | 0.11±0.02 b | 19.17±0.88 b | 0.22±0.03 d | 0.23±0.02 de | 0.38±0.01 e |
| Ci4’ | 37.15±0.37 c | 0.15±0.01 b | 16.65±1.94 c | 0.24±0.02 d | 0.31±0.03 c | 0.43±0.02 d |
新窗口打开
3 讨论
RNA干扰技术在分子生物学研究中发挥了极其重要的作用。与其他RNAi基因沉默技术比较, amiRNA具有独特之处, 因为amiRNA前体会形成一个长度合适的“发夹”结构, 最终生成一个amiRNA, 对靶基因具有很强的特异性, 脱靶率显著降低。此外, 由于amiRNA与靶基因的结合位点处常会有几个碱基的错配, 因而可以同时对多个序列相似的基因(如基因家族的一个成员)进行沉默[25]。因此, 利用amiRNA技术可以专一、高效地沉默目的基因, 更易获得具有新表型的转基因植物, 已被普遍用于多种植物的研究[26]。鉴于amiRNA的精准性、高效性及应用的广泛性, amiRNA介导的基因沉默已经越来越普遍地应用于基因功能的研究或对经济植物遗传改良[27]。根据Schwab等[12]提出的amiRNA设计标准, 本研究设计了针对马铃薯油菜素内酯合成限速酶编码基因StCPD的人工miRNA (amicpd), 以包含拟南芥miR319a前体序列的载体pRS300为模板, 经重叠PCR, 合成amicpd前体序列, 然后将其与表达载体pCPB121连接, 构建了StCPD基因干扰表达载体pCPB121-amiRcpd, 并利用根癌农杆菌介导法, 分别以茎段和薯片两种受体外植体, 将StCPD基因RNA干扰载体转入马铃薯栽培品种“紫花白”中, 获得了转基因阳性植株, 对生理生化指标进行分析。
qRT-PCR分析表明, StCPD基因在马铃薯根、茎和叶中均有表达, 且叶中的表达量高于茎和根中, 这可能与StCPD基因参与光合作用有关[28]。StCPD基因干扰表达使植株的长势明显受到抑制, 由于BRs可以促进细胞的生长和分裂, 当BR合成途径中的限速酶基因干扰表达时, 促使BR合成受限, 使植株的长势明显受到抑制。通过StCPD基因的干扰表达, 进一步分析该基因对马铃薯抗旱性的影响, 将为研究农作物的抗旱功能提供科学依据。
通过PEG处理马铃薯试管苗, 研究干旱胁迫下StCPD基因的表达情况, 测定MDA和脯氨酸含量。结果表明, 转StCPD基因植株的基因相对表达水平明显低于NT植株, 随着胁迫时间的延长, StCPD基因表达量呈持续增强趋势, 说明干旱处理时可以诱导StCPD基因的表达。干旱胁迫和对照处理下, 转StCPD基因马铃薯植株较NT植株MDA含量增加; 脯氨酸降低。转基因植株的株高、茎粗, 根长, 鲜重及薯的大小和鲜重等指标都明显低于NT植株。
在干旱、盐碱等非生物胁迫下, 植物体内会产生大量超氧自由基(ROS), 造成植物细胞膜的过氧化损伤, MDA作为膜脂过氧化的产物之一, 是衡量氧化胁迫的重要标志, 用来评估氧化胁迫对膜的损伤程度[29,30]。本研究中转基因株系叶片中MDA含量高于NT植株, 说明干扰表达StCPD基因可以增强膜脂过氧化作用, 增强对膜系统的损伤, 降低马铃薯植株对PEG胁迫的抗性。
4 结论
StCPD基因在转基因植株(Ci1~Ci5)中的表达量较NT植株显著降低, 且该基因在马铃薯根、茎、叶中均有表达, 叶中表达量最高。StCPD基因干扰表达后, 植株的长势明显受到抑制。干旱胁迫下, StCPD基因的表达情况影响马铃薯的生长发育和MDA与Pro含量, 调控马铃薯对干旱胁迫的抵抗能力, 研究结果为进一步研究BRs对马铃薯生长发育和对干旱胁迫的响应奠定了基础。The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | . |
| [2] | . |
| [3] | . |
| [4] | . |
| [5] | . |
| [6] | . |
| [7] | . |
| [8] | . |
| [9] | . |
| [10] | . |
| [11] | . |
| [12] | . |
| [13] | . . |
| [14] | . . |
| [15] | . |
| [16] | . |
| [17] | . |
| [18] | . |
| [19] | . . |
| [20] | . |
| [21] | . |
| [22] | . . |
| [23] | . |
| [24] | . . |
| [25] | . |
| [26] | . . |
| [27] | . . |
| [28] | . |
| [29] | . |
| [30] | . . |
