 ,2,*
,2,*Genetic analysis and molecular characterization of a new allelic mutant of silky1 gene in maize
WANG Xiao-Juan1,**, PAN Zhen-Yuan2,**, LIU Min2, LIU Zhong-Xiang1, ZHOU Yu-Qian1, HE Hai-Jun1, QIU Fa-Zhan ,2,*
,2,*通讯作者:
第一联系人:
收稿日期:2019-02-26接受日期:2019-05-12网络出版日期:2019-06-03
| 基金资助: |
Received:2019-02-26Accepted:2019-05-12Online:2019-06-03
| Fund supported: |
作者简介 About authors
王晓娟,E-mail:wangxj839@sina.com;。
潘振远,E-mail:panzhenyuandawood@163.com。

摘要
关键词:
Abstract
Keywords:
PDF (3928KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
王晓娟, 潘振远, 刘敏, 刘忠祥, 周玉乾, 何海军, 邱法展. 一个新的玉米silky1基因等位突变体的遗传分析与分子鉴定[J]. 作物学报, 2019, 45(11): 1649-1655. doi:10.3724/SP.J.1006.2019.93009
WANG Xiao-Juan, PAN Zhen-Yuan, LIU Min, LIU Zhong-Xiang, ZHOU Yu-Qian, HE Hai-Jun, QIU Fa-Zhan.
植物典型的花器官的构造分为4层,由外而内依次为花萼、花瓣、雄蕊以及雌蕊, 而每一层花器官都是由不同的基因所控制的, 因此前人提出了经典的花器官发育的ABCE模型来解释决定花器官的遗传机制[1,2]。依据这个模型, A类基因单独地决定着花萼的形成, A和B两类基因一起决定着花瓣的形成, B和C这两类基因一起决定着雄蕊的形成, C类基因单独决定着雌蕊的形成, 而E类基因在上述4层花器官的建成中都起着重要的作用[2,3,4]。Silky1是玉米中第一个被分离到的B功能基因, 它的克隆是人们对玉米B功能基因认识的一次飞跃[5]。Silky1是一个B功能DEF/AP3类同源基因, 原位杂交分析显示Silky1首先在内/外稃原基被激活表达, 随后在浆片原基和雄蕊原基中表达, 并在它们的整个发育过程中都表达。Silky1基因的突变造成雄花不育, 浆片以及花药退化为膜状结构, 并在末端形成了丝状突出物; 雌花可育, 花丝增多[6]。
真核生物的基因组包含大量的不能被翻译成蛋白质的非编码序列。前体RNA中就含有大量的内含子, 这些内含子必须经过剪切才能形成成熟mRNA, 以进行下一步的翻译和调控。在前体RNA的剪切过程中, 内含子通过2个外显子的连接而被精确切除, 剪切过程是由剪切体(spliceosome)介导的。前体RNA的剪切需要两步转酯反应, 第一步是靠近内含子3°端分支点的A残基的2’-OH对5°端的磷酸基团进行亲核攻击, 形成2’-5°磷酸二酯键连接的套环结构; 接着发生第2步转酯反应, 被剪接的外显子3°核苷酸的-OH进攻3’内含子末端的磷酸基团, 最后在3°内含子外显子剪接点处断开, 套索结构释放, 2个外显子连接[7,8,9,10]。在整个剪接过程中, 剪接位点起着关键的作用, 并且研究发现, 内含子/外显子剪接位点的序列也是相当保守的。剪接位点的变异很可能造成转录本外显子的丢失或者一些隐藏的剪接位点的激活, 从而产生异常的转录本[11]。内含子5°端供体位点AG/ GTAAG (外显子/内含子交接处)的序列非常保守, 位于内含子的5个碱基与U1 RNA的互补配对结合是RNA剪接的首要条件[12,13]。前2个碱基GT是最为保守的, 这2个碱基的突变通常会造成错误的剪接。虽然+5处的碱基G也是相当保守的, 但只有20%的突变会造成错误的剪接发生[11]。
本研究发现了一个玉米雄性不育突变体材料, 命名为msm-6, 通过对该突变体的遗传分析和基因定位, 最终发现msm-6是一个新的Silky1基因等位突变体。在msm-6突变体中Silky1的第6个内含子5°端供体位点AG/GTAAG (外显子/内含子交接处)的序列+1位G突变为C, 从而导致了第6外显子被错误地剪切掉, 造成不完整转录本, 从而导致Silky1基因功能的丧失。该突变的发掘为进一步深入解析玉米穗花器官决定提供丰富的实验材料, 同时也为RNA加工过程中剪接位点保守性提供重要证据。
1 材料与方法
1.1 试验材料
玉米雄性不育突变体(male sterile mutant)为田间发现的来源于黄早四(HZ4)背景的自然突变体, 被命名为msm-6, 该突变体表现为雄穗不育、雌穗花丝增多; silky1-mum3为转座子插入的silky1突变体, 源于Clinton J. Whipplea (Department of Biology, Brigham Young University, Provo, Utah 84602); 自交系B73和HZ4, 以及msm-6与自交系B73和HZ4分别杂交构建的F2群体。1.2 突变体的表型鉴定和遗传分析
由于纯合雄性不育突变体不能够自交繁殖, 只能利用杂合基因型自交后代分离出msm-6。因此随机选取来源于雄性不育姊妹株的正常可育的植株自交繁殖, 自交后代鉴定有雄性不育株, 然后再取正常植株自交种植, 以此连续多代自交观察该突变体表型。对于突变体表型的遗传分析, 采用msm-6分别与自交系HZ4和B73杂交构建F2群体, 散粉期统计可育单株与不育单株的分离比, 利用卡方测验确定遗传模式。1.3 目的基因的初定位
Bulk Segregant Analysis (BSA)是突变体/主效QTL快速定位的一个重要方法。利用分离群体野生型和突变体2个DNA池进行全基因组的多态性分析, 寻找和目标基因紧密连锁的分析标记, 进行快速初定位[14]。在本实验中, 利用BSA的方法对雄性不育突变位点进行初定位。首先, 将msm-6与B73杂交, 产生F1, 并将F1自交, 构建F2分离群体。散粉期, 从田间选取15株不育表型植株, 分别提取DNA等量混合, 构建一个“突变体池”; 同时, 另外选取15株表型正常的植株, 分别提取DNA等量混合, 构建了一个“野生型池”。利用本实验室已经合成的均匀覆盖玉米基因组的1000对SSR引物, 对2个混池DNA样品进行扩增, 毛细管电泳检测PCR产物, 筛选多态性标记, 在突变体DNA混池和野生型DNA混池间存在多态性的标记即为与突变基因紧密连锁的标记。随后, 利用444株F2分离个体组成的群体对获得的多态性标记进行共分离验证并定位突变位点。1.4 定位区间基因检索及等位测验
根据msm-6基因的初定位区间, 在MaizeGDB数据库网站上(http://www.maizegdb.org/)检索区间内的基因注释信息, 发现已经报道的玉米雄穗不育、雌穗花丝增多的silky1基因位于该区间内[15]。为检测msm-6和silky1是否等位, 利用silky1杂合基因型单株和msm-6不育单株杂交, 统计后代不育单株数目以及可育单株与不育单株的分离比例。1.5 基因组DNA提取、PCR扩增和序列分析
在散粉期, 用CTAB法分别提取突变体msm-6、silky1-mum3、B73和HZ4的基因组DNA[16]。根据Silky1基因组序列, 利用Primer3软件(http://primer3. ut.ee/)在线设计5对引物Silky1-F1/R1~Silky1-F5/R5) (表1), 扩增产物覆盖Silky1基因组序列。以WT (HZ4和B73)与msm-6基因组DNA为模板, 分别扩增Silky1基因片段, 将PCR产物送武汉天一辉远生物技术有限公司测序。使用CLC软件比对分析测序结果, 确定基因突变情况。根据转座子插入位置两端序列设计特异引物silky1-mum3-F/R, 并结合转座子序列末端侧翼序列的简并引物TIR6 (表1)进行silky1-mum3基因型分析: 仅silky1-mum3_F/R有扩增条带为纯合野生型(+/+), 只有silky1-mum3-F和silky1-mum3-R分别与TIR6结合扩增出条带则为纯合突变体(silky1- mum3/silky1-mum3), 若3对标记都有扩增条带则为杂合基因型(+/silky1-mum3)。试验采用南京诺唯赞生物科技有限公司的PCR反应试剂, 扩增体系为2×PCR Mix 15 μL, 引物(10 μmol L-1) 0.5 μL, 模板DNA 2 μL, 补超纯水至30 μL。PCR扩增条件为94°C预变性5 min; 94°C变性30 s, 58°C退火30 s, 72°C延伸1 min, 34个循环; 68°C延伸5 min。用1%琼脂糖凝胶电泳检测目的条带。Table 1
表1
表1 Silky1基因相关的引物
Table 1
| 引物名称 Primer | 序列 Sequence (5°-3°) | 用途 Use |
|---|---|---|
| Silky1_F1 | TCTGTCGCCGAGTATTGGTAT | Silky1 gene |
| Silky1_R1 | CGCGTTTCCAATCAATCC | Silky1 gene |
| Silky1_F2 | GAAGCCAAAACCGTGCTAAC | Silky1 gene |
| Silky1_R2 | CGGATCCATCCCTCGTAGTA | Silky1 gene |
| Silky1_F3 | TGGTCTGCGCACAGAGATTA | Silky1 gene |
| Silky1_R3 | AGCTCTCAAACTTGCCCAAT | Silky1 gene |
| Silky1_F4 | CAGCACCGTTGGATGTAGAG | Silky1 gene |
| Silky1_R4 | GATGAGCTGGATGCAACGTA | Silky1 gene |
| Silky1_F5 | GAGGTATGGAAATGGGACTCA | Silky1 gene |
| Silky1_R5 | TGTTTTTCGGGCAAAAATTG | Silky1 gene |
| Silky1-cDNA_F | TCCCAACTCCCAAGTCCCAT | Silky1 cDNA |
| Silky1-cDNA_R | GACGATGCATGAGCGAACTA | Silky1 cDNA |
| silky1-mum3_F | TTGTCCTTGCTTGCTTCCTT | silky1-mum3 |
| silky1-mum3_R | CGGATCCATCCCTCGTAGTA | silky1-mum3 |
| TIR6 | AGAGAAGCCAACGCCAWCGCCTCYATTTCGTC | silky1-mum3 |
新窗口打开|下载CSV
1.6 RNA的提取及转录本的扩增
根据基因型取纯合野生型以及突变体雄穗幼穗, 用植物总RNA提取试剂盒提取RNA。利用反转录试剂盒(北京全式金生物技术有限公司, Cat# AU311-02)反转录为cDNA, 以cDNA为模板, 设计特异引物Silky1-cDNA-F/R (表1), 进行CDS扩增并测序(反应体系同上)。2 结果与分析
2.1 突变体msm-6的表型和遗传分析
msm-6主要表现为雄穗不育, 雌穗花丝增多(图1-A, B)。通过对花器官进一步的解剖观察发现, msm-6突变体雄花不开裂, 花药退化为膜状结构并在末端形成了丝状突出物, 从而造成雄花不育的表型(图1-C); 雌花花丝增多, 每一个子房对应2~4个花丝(图1-D)。利用杂合基因型自交后代的分离对msm-6进行繁殖, 经过连续自交发现该突变表型能够稳定遗传; 将该突变体与HZ4和B73分别杂交, F1表现为野生型, 统计F1自交得到的2个F2群体中野生型和突变体的数目, 经卡方检验其分离比例都符合3∶1 (表2), 表明msm-6雄性不育性状是受单个隐性核基因控制。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1msm-6突变体雄穗和雌穗表型
A: 野生型(上)和msm-6突变体(下)的雄穗表型; B: 野生型(左)和msm-6突变体(右)的雌穗表型; C: 野生型(左)和msm-6突变体(右)的雄花表型; D: 野生型(左)和msm-6突变体(右)的雌花表型。A图, 标尺=5 cm; B图, 标尺=3 cm; C图, 标尺=3 mm; D图, 标尺=3 cm。
Fig. 1Tassel and ear phenotype of msm-6 mutant
A: Tassel of WT (up) and msm-6 (down); B: Ear of WT (left) and msm-6 (right); C: Male flower of WT (left) and msm-6 (right); D: Female flower of WT (left) and msm-6 (right). Bar = 5 cm in Fig. A; bar = 3 cm in Fig. B; bar = 3 mm in Fig. C; bar = 3 cm in Fig. D.
Table 2
表2
表2F2分离群体的卡方测验
Table 2
| 群体 Population | 观察值Observations | 期望值Expectations | 卡方检验 Chi-square | ||
|---|---|---|---|---|---|
| 野生型WT | 突变体Mutant | 野生型WT | 突变体Mutant | ||
| msm-6 × 黄早4 F2 | 140 | 48 | 141 | 47 | 0.87 |
| msm-6 × B73 F2 | 335 | 109 | 333 | 111 | 0.83 |
新窗口打开|下载CSV
2.2 msm-6基因定位
利用F2群体, 采用BSA方法在1000对SSR标记中共筛选4对多态性标记, 分别为C6-24、C6-30、C6-34和C6-40; 根据B73 V4版本参考基因组信息, 这4对标记都位于玉米第6染色体上, 物理位置分别为68453519、87429100、98078061、107626979 (表3和图2)。4对标记在野生型DNA池中都扩增出双带, 而在突变体DNA池中只扩增出单带, 初步推测这4对标记与msm-6突变位点紧密连锁。进而对444个F2单株的基因型分析表明, C6-24、C6-30、C6-34和C6-40与突变性状表型相关的交换频率分别为0.045、0、0.011和0.034 (表3), 此结果不仅验证了BSA结果的真实性, 而且确定突变位点与C6-30更紧密连锁, 最终根据交换单株的基因型信息将msm-6的突变位点定位于标记C6-24与C6-34之间约30 Mb的物理区间内(表4)。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2BSA筛选到的与msm-6连锁标记
Fig. 2Linkage markers analysis with msm-6 mutation loci via BSA
Table 3
表3
表3连锁标记信息以及与突变位点的交换频率
Table 3
| 标记Primer | 左引物序列 Left sequence (5°-3°) | 右引物序列 Right primer sequence (5°-3°) | 物理位置 Physical location | 交换频率 Exchange frequency |
|---|---|---|---|---|
| C6-24 | ATTCGATCTAGGGTTTGGGTTCAG | GATGCAGTAGCATGCTGGATGTAG | 68,453,519 | 0.045 |
| C6-30 | GGAGGAGTACGGCTTCGAG | AAGTGGTTGCTGTTGTGGTG | 87,429,100 | 0 |
| C6-34 | CTGATCGTGGATATCCCCTCC | GACTCGAAGCCAAAACCAACTC | 98,078,061 | 0.011 |
| C6-40 | CGCTGAGGCTTAAGATGGTGTT | AACGCCTTTACGAGCACGAAC | 107,626,979 | 0.034 |
新窗口打开|下载CSV
Table 4
表4
表4重组单株基因型以及表型信息
Table 4
| 标记Marker | 单株数 Plant number | 表型 Phenotype | |||
|---|---|---|---|---|---|
| C6-24 | C6-30 | C6-34 | C6-40 | ||
| H | B | B | B | 12 | 突变体Mutant |
| B | B | H | H | 3 | 突变体Mutant |
| B | B | B | H | 8 | 突变体Mutant |
| H | H | H | B | 7 | 野生型WT |
| H | H | B | B | 2 | 野生型WT |
| B | H | H | H | 8 | 野生型WT |
新窗口打开|下载CSV
2.3 msm-6和silk1等位测验
采用基因型为+/silky1-mum3杂合单株的花粉和msm-6/msm-6纯合突变体杂交, 杂交后代出现了silky突变表型(图3), 在调查的106个单株中, 表现为野生型表型的为56个, 突变体表型的50个, 卡方检验分析表明野生型植株与突变体植株的分离比为1︰1 (P = 0.56), 证明了msm-6可能为silky1新的等位突变体。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3msm-6与silky1突变体等位测验
A: 以杂合+/ silky1-mum3单株和mus-6突变体杂交后代的野生型; B: 以杂合+/ silky1-mum3单株和msm-6突变体杂交后代的突变体。
Fig. 3Allelism test of msm-6 and silky1
A: The wild-type plant from msm-6/msm-6×+/silky1-mum3; B: The mutant plant from msm-6/msm-6×+/silky1-mum3.
2.4 msm-6突变位点鉴定
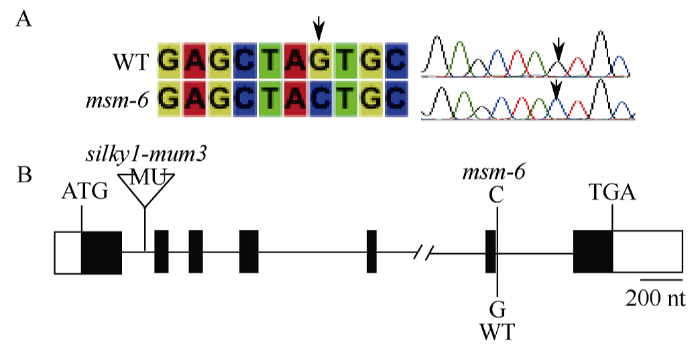
为进一步验证msm-6和silky1是等位基因并确认msm-6的突变位点, 根据B73参考基因组序列共设计5对特异引物对Silky1基因启动子以及基因区进行PCR扩增, 扩增模板为WT(HZ4)和msm-6基因组DNA, 扩增产物从1237 bp到1562 bp跨叠式覆盖了Silky1基因组序列(表1)。对扩增产物测序分析发现, msm-6突变体中第6个内含子5'端供体位点AG/GTAAG (外显子/内含子交接处)的序列+1位G突变为C (图4-A, B)。而已报导的Silky1突变体silky1-mum2、silky1-mum3和silky1-mum4均由转座子的插入造成, 以上研究结果充分证实msm-6是Silky1一个新的等位突变体。图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4msm-6突变位点鉴定
A: 野生型以及msm-6突变体的序列分析; 箭头指示突变位点。B: Silky1基因结构示意图及2个突变体的突变位置。
Fig. 4Identification of msm-6 mutation sites.
A: The sequence analysis of WT and msm-6; The arrow indicates the mutation site. B: Gene structure of Silky1 and mutation site of two mutants.
2.5 Silky1基因在msm-6突变体中的转录本扩增
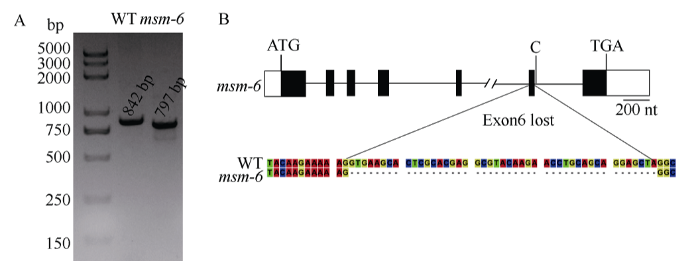
分别取纯合msm-6突变体和纯合野生型雄穗幼穗提取RNA, 反转录为cDNA, 对Silky1转录本进行扩增, 结果显示, 与野生型相比, 突变体msm-6转录本变小(图5-A)。通过进一步的测序分析发现, msm-6突变体中Silky1转录本第6个外显子缺失(图5-B)。转录本的不完整性造成了该基因的功能缺失, 产生相关的突变表型。图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5msm-6突变体中Silky1转录本Exon6的缺失
A: Silky1转录本在野生型和msm-6突变体中的扩增; B: Silky1转录本在野生型和msm-6突变体中的序列分析。
Fig. 5Loss of exon 6 of Silky1 transcript in msm-6 mutant
A: PCR product of Silky1 transcript between WT and msm-6; B: The sequence analysis of Silky1 transcript between WT and msm-6.
3 讨论
BSA是突变体/主效QTL快速定位的一个重要方法[16]。利用分离群体野生型和突变体2个DNA池进行全基因组的多态性分析, 就能够快速找到与基因/QTL连锁的分子标记, 确定基因/QTL所在区间位置, 该方法简单快速, 并且节约成本, 得到了广泛应用[17,18]。在玉米上, 通过BSA的方法定位及克隆了许多基因/位点。Cai等[19]采用1000个覆盖玉米全基因组的SSR标记对突变体以及野生型DNA混池进行基因型分析, 成功定位克隆了一个控制玉米籽粒发育的基因emp10。Zhao等[20]鉴定到了一个雌穗无花丝的突变体sk-A7110, 通过构建DNA混池, 并结合228个覆盖玉米全基因组的SSR标记将sk-A7110定位于第2染色体, 并通过进一步精细定位将其成功克隆。Strable等[21]利用BSA的方法将控制叶片下垂的突变基因drl1以及drl2分别定位于第1染色体短臂以及9号染色体长臂, 同样通过精细定位成功将其克隆。本研究采用F2分离群体的野生型和突变体各15株, 及BSA策略快速将msm-6定位于第6染色体68.5~98.1 Mb的区间内, 实验结果真实可靠。等位测验是通过杂交试验对杂交后代性状的分离进行统计分析, 确定基因之间的等位性。本研究中, 由于雄性不育突变体不能产生后代, 因此, 只能利用+/silky1-mum3杂合单株的花粉和msm-6/msm- 6纯合突变体杂交进行初步的等位性检测, 初步验证了msm-6和silky1的等位性。进而利用基因序列分析鉴定真实的突变位点, 结合Silky1基因在msm-6突变体中的转录本扩增结果, 充分证明msm-6是silky1的一个新等位基因。
剪接位点的识别是RNA内含子剪接加工过程中非常关键一步, 而且剪接位点的序列在各物种间都是相对比较保守的, 因此剪接位点的变异很可能会造成mRNA的错误加工, 导致基因功能的丧失。dystrophin基因的第32个内含子第5位碱基由G突变为A (4518+5G > A), 造成了剪接位点的失活, 从而形成了错误的剪接以及转录的提前终止, 导致杜氏肌萎缩症发生[22]。胆固醇转移蛋白基因(Cholesterol Ester Transfer Protein)第1个内含子剪接供体位点的突变, 造成蛋白的移码突变, 从而导致高α脂蛋白血症发生[23]。在水稻中, wax基因的第1个内含子的剪接位点前2个碱基由GT突变为TT, 从而影响了转录本的正常剪接, 导致蛋白功能的缺失[24]。玉米中, brittle-2的等位突变体bt2-7503是Brittle-2第3个内含子的5°端剪接位点由GT突变为AT造成的, 该碱基的突变造成了该剪接位点的失活以及另外2个临近剪切位点的激活, 从而产生了包含第3个内含子的转录本以及缺失第3个外显子的转录本, 而这2种转录本都不能翻译成有功能的蛋白, 造成胚乳发育缺陷表型[25]。本研究发现, 在msm-6中, Silky1基因第6个内含子的剪接供体位点第1个碱基由G突变为C, 造成了剪接位点不能被正常识别, 导致第6个外显子连同第6个内含子一起被剪切掉, 形成了1个第6个外显子缺失的不完整转录本, 导致silky表型产生。
Ambrose等[6]采用分离转座子侧翼序列标签法从si1-mum2、si1-mum3和si1-mum4共3个突变体中成功分离克隆了Silky1基因。在这3个突变体中, 转座子分别插入在Silky1第3个内含子、第1个内含子以及第2个外显子, 并影响了该基因的转录, 造成雄花不育, 浆片以及花药退化为膜状结构, 并在末端形成了丝状突出物、雌花可育、花丝增多的突变表型。根据蛋白同源分析发现该基因编码1个B功能DEF/ AP3蛋白, 其同源基因在拟南芥和金鱼草中早有报道, 同样参与花器官的决定, 会造成突变体花瓣转化为萼片以及雄蕊[26]。本研究获得了1个新的silky1等位突变体mum-6, 该突变体和已报道的silky1突变体具有相似的表型。该突变体的突变位点位于第6个内含子第1个碱基, 由G突变为C, 导致转录本不能够正常剪切, 第6个外显子缺失, 影响转录后加工过程, 与前人报道的基因影响转录过程不同。
4 结论
发现了一个玉米雄性不育突变体材料msm-6, msm-6是Silky1基因的一个新等位突变体。在msm-6突变体中, Silky1的第6个内含子5°端供体位点AG/GTAAG (外显子/内含子交接处)的序列+1位G突变为C, 导致第6外显子被错误地剪切掉, 产生不完整转录本, 丧失Silky1基因功能。msm-6的发现与鉴定为进一步深入解析玉米穗花器官决定的遗传机理提供丰富的试验材料, 同时也为RNA加工过程中剪接位点保守性提供重要证据。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
