 ,3,*
,3,*Effects of photoperiods and temperatures on physiological characteristics and chlorophyll synthesis precursors of adzuki bean seedlings
HE Ning1, WANG Xue-Yang1, CAO Liang-Zi1, CAO Da-Wei1, LUO Yu1, JIANG Lian-Zi2, MENG Ying1, LENG Chun-Xu1, TANG Xiao-Dong1, LI Yi-Dan1, WAN Shu-Ming1, LU Huan1, CHENG Xu-Zhen ,3,*
,3,*通讯作者:
第一联系人:
收稿日期:2018-01-4接受日期:2018-12-24网络出版日期:2019-01-05
| 基金资助: |
Received:2018-01-4Accepted:2018-12-24Online:2019-01-05
| Fund supported: |

摘要
关键词:
Abstract
Keywords:
PDF (1846KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
何宁, 王雪扬, 曹良子, 曹大为, 洛育, 姜连子, 孟英, 冷春旭, 唐晓东, 李一丹, 万书明, 卢环, 程须珍. 光温处理对小豆苗期生理性状及叶绿素合成前体的影响[J]. 作物学报, 2019, 45(3): 460-468. doi:10.3724/SP.J.1006.2019.84002
HE Ning, WANG Xue-Yang, CAO Liang-Zi, CAO Da-Wei, LUO Yu, JIANG Lian-Zi, MENG Ying, LENG Chun-Xu, TANG Xiao-Dong, LI Yi-Dan, WAN Shu-Ming, LU Huan, CHENG Xu-Zhen.
小豆[Vigna angularis (Willd) Ohwi & Ohashi]是我国主要食用豆类作物之一[1], 与其他豆类作物相比是耐寒性较差的低温敏感作物[2]。黑龙江省是我国小豆主产省之一, 由于地处高纬度, 冷空气活动频繁, 尤其近几年来春季和夏季低温频发, 给小豆的生产带来很大的危害。
小豆的低温冷害发生在苗期、生育初期和开花期。出苗时处于长期低温和日照不足, 引起叶片向内翻转的碗形症状并枯死; 四至五叶生育初期遭遇低温冷害引起生育障碍(生长点停止生长); 开花期遭遇低温冷害引起花粉不育导致结荚障碍[2]。研究表明, 植物在生长过程中, 温度骤然变化会引起叶绿素退色、叶片坏死等现象[3,4]。小豆苗期由于低温寡照, 初生叶叶绿素合成受阻, 引起叶片发育延迟, 影响光合作用, 进而幼苗营养枯竭, 最终不能恢复而枯死[3]。叶绿素以及前质体是导致活性氧发生的光增感剂, 而活性氧可引起细胞内膜、蛋白质损伤、光合作用阻碍等生理障碍[5]。一旦叶绿素破坏就会引起叶绿素退色、叶片坏死等现象[6]。
超氧化物歧化酶(SOD)、抗坏血栓过氧化物酶(APX)和过氧化氢酶(CAT)等在植物体内具有清除超氧自由基, 防止膜脂过氧化物伤害的作用, 它们是植物体内的保护酶[7,8]。研究表明, 在田间持续1个月的低温寡照, 小豆幼苗就会黄化死苗及生育延迟, 而黄化源自叶绿素含量下降[1,2,3,4]。低温造成的黄化现象可能引起叶绿素合成受阻或分解加剧, 但叶绿素的分解可能不是叶绿素含量下降的主要原因[9]。
本研究针对小豆低温冷害发生频率较高的苗期, 选择2个对温度和光照反应不同的日本小豆品种, 利用人工气候室再现小豆苗期的低温障碍, 分析抗氧化酶活性水平和对叶绿素合成中间产物, 探讨小豆苗期冷害发生的机制和黄化苗影响叶绿素合成的可能位点, 旨在为小豆耐寒新品种选育及栽培提供理论依据。
1 材料与方法
1.1 试验材料
选用日本北海道地区最具代表性的苗期耐低温品种赤根大纳言(Akanedainagon)和苗期不耐低温品种斑小粒系-1 (Buchisyouryukei-1)。1.2 试验方法
采用塑料盆无菌粒状棉栽培, 粒状棉充分吸水后, 间隔2 cm播种1粒小豆种子, 行距5 cm, 每盆约100粒。设4种栽培模式(表1), 每个处理设置3次重复。Table 1
表1
表14种栽培模式在小豆苗期的不同光温处理
Table 1
| 栽培模式 Cultivation mode | 出苗条件 Seedling conditions | 苗期光照和低温处理 Illumination and low temperature treatment at seedling stage | 绿化处理 Greening treatments | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 温度 Temp. (°C) | 光照Illumination | 温度 Temp. (°C) | 光照 Illumination (μmol m-2 s-1) | 处理时间 Treatment time (d) | 温度 Temp. (°C) | 光照 Illumination (μmol m-2 s-1) | 处理时间 Treatment time (h) | |||
| I | 20-25 | Dark | 10-13 | 72% shading | 18, 28 | 20-25 | Natural light | 3, 8, 28 | ||
| II | 25 | Dark | 10 | 50 | 1, 3, 5, 7 | 25 | 62.5 | 24 | ||
| III | 25 | Dark | 25 | Dark | 1, 3, 5, 7 | 25 | 62.5 | 24 | ||
| IV | 25 | Dark | 25 | Dark | 7 | 25 | 62.5 | 0, 6, 12, 24 | ||
新窗口打开|下载CSV
1.2.1 栽培模式I 播种后将20盘小豆置温室(昼夜20~25°C)黑暗条件下培养, 出苗后[2]移到人工气候室, 分别在低温条件下(昼夜10~13°C、72%遮光)生长18 d和28 d, 整个生育期间由自动灌水装置定期浇水。低温遮光处理后的幼苗, 移到昼夜20~25°C的自然光室(晴天)内进行3 h、8 h和28 h的绿化处理。之后分别采集0.3 g初生叶用于测定SOD、APX、CAT, 采集5 g初生叶用于测定H2O2含量, 采集0.3 g初生叶用于测定叶绿素含量。
1.2.2 栽培模式II 播种后将10盘小豆置温室25°C恒温和100%黑暗条件下, 对出苗1 d后的幼苗分别以低温(10°C, 光照50 μmol m-2 s-1)处理1 d、3 d、5 d、7 d, 再绿化处理24 h (25°C, 光照62.5 μmol m-2 s-1)。之后分别采集0.2 g初生叶测定叶绿素含量。
1.2.3 栽培模式III 播种后将10盘小豆置温室25°C恒温和100%黑暗条件下, 黑暗出苗1 d、3 d、5 d、7 d后, 再分别进行24 h的绿化处理(25°C, 光照62.5 μmol m-2 s-1)。之后分别采集0.2 g初生叶测定叶绿素含量。
1.2.4 栽培模式IV 播种后将14盘小豆置25°C恒温和100%黑暗条件下, 出苗7 d后分别进行0 h、6 h、12 h、24 h的绿化处理(25°C, 光照62.5 μmol m-2 s-1)。之后分别采集0.3 g初生叶测定叶绿素前体物质含量(δ-氨基酮戊酸、原卟啉IX、Mg-原卟啉IX、原叶绿素酸)及叶绿素含量。
以上采集的样品用电子天平称量记录后立刻置冰盒, 然后置-80°C低温冰柜保存。
1.3 测定指标及方法
1.3.1 过氧化氢含量(H2O2)的测定 参考Erich等[9]的方法测定H2O2含量。1.3.2 酶液制备 称取冷冻的叶片(0.3 g)放研钵中加入液体氮研磨。每1 g粉碎的叶片加入3.5 mL的提取液[0.4 mmol L-1 EDTA, 1 mmol L-1抗坏血酸, 2% PVP含有25 mmol L-1磷酸钾缓冲液(pH 7.0)]搅拌均匀, 于4°C下14,000 r min-1离心25 min后得到的上清液即为酶液。
1.3.3 抗氧化酶SOD、APX、CAT活性的测定 按沈利星[10]方法测定SOD、APX、CAT三种抗氧化酶。
1.3.4 酶液蛋白质的测定 按沈利星[10]方法测定酶液蛋白质。
1.3.5 叶绿素含量的测定 按加藤荣[11]方法测定叶绿素含量。
1.3.6 δ-氨基酮戊酸、原卟啉IX、Mg-原卟啉IX、原叶绿素酸的测定 按加藤荣[11]方法测定δ-氨基酮戊酸(ALA)、原卟啉IX (Proto IX)、Mg-原卟啉IX (Mg-Proto IX)、原叶绿素酸(Pchl)。
应用SPSS统计软件进行显著性统计测验及品种之间差异的t测验。
2 结果与分析
2.1 低温处理对小豆苗期叶片叶绿素含量、过氧化氢及酶活性的影响
2.1.1 低温处理引起的叶绿素含量变化 2个品种对低温遮光处理后再绿化的反应不同, 其中耐低温品种赤根大纳言在低温遮光18 d (短期)和28 d (长期) 2种处理再绿化后, 初生叶均迅速绿化, 而不耐低温品种斑小粒系-1处理18 d后, 绿化速度延迟, 处理28 d未经绿化处理前的枯死率为20%, 随绿化处理时间加长植株枯死率逐渐增高, 绿化处理3 h的枯死率为30%, 8 h为35%, 28 h为40% (图1和表2)。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1低温遮光处理后绿化恢复情况
A: 低温处理18 d绿化0 h; B: 低温处理18 d绿化3 h; C: 低温处理18 d绿化8 h; D: 低温处理18 d绿化28 h; E: 低温处理28 d绿化0小时; F: 低温处理28 d绿化3 h; G: 低温处理28 d绿化8 h; H: 低温处理28 d绿化28 h。
Fig. 1Greening recovery after low temperature shading treatments
A: Low temperature treatment 18 days greening 0 hour; B: Low temperature treatment 18 days greening 3 hours; C: Low temperature treatment 18 days greening 8 hours; D: Low temperature treatment 18 days greening 28 hours; E: Low temperature treatment 28 days greening 0 hour; F: Low temperature treatment 28 days greening 3 hours; G: Low temperature treatment 28 days greening 8 hours; H: Low temperature treatment 28 days greening 28 hours.
Table 2
表2
表2小豆苗期不同低温、绿化处理后叶片中叶绿素、过氧化氢含量及抗氧化酶活性
Table 2
| 品种 Variety | 低温处理 Low temperature treatment (d) | 绿化处理 Greening treatment (h) | Chl 含量 Chlorophyll content (μg g-1) | H2O2含量 H2O2 content (mmol kg-1 FW) | SOD活性 SOD activity (Unit mg-1) | APX 活性 APX activity (μmol min-1 mg-1) | CAT 活性 CAT activity (μmol min-1 mg-1) |
|---|---|---|---|---|---|---|---|
| 赤根大纳言 | 18 | 0 | 32.1±2.0 cC | 0.640±0.12 eD | 0.0116±0.000 gG | 0.166±0.03 bcAB | 0.209±0.02 dE |
| Akanedainagon | 3 | 32.5±5.0 cC | 1.838±0.31 dD | 0.0296±0.002 bB | 0.191±0.02 abAB | 0.675±0.13 cDE | |
| 8 | 46.8±2.4 bB | 1.541±0.33 deD | 0.0306±0.002 aA | 0.202±0.00 aA | 1.867±0.28 aAB | ||
| 28 | 115.6±8.2 aA | 0.469±0.10 eD | 0.0168±0.001 cC | 0.106±0.01 deD | 0.927±0.02 bcCD | ||
| 斑小粒系-1 | 18 | 0 | 12.6±2.3 eD | 1.354±0.31 deD | 0.0141±0.001 eE | 0.157±0.01 cBC | 0.794±0.13 cCDE |
| Buchisyouryukei-1 | 3 | 14.7±0.8 deD | 7.523±1.51 aA | 0.0139±0.001 fF | 0.153±0.03 cBC | 1.947±0.22 aA | |
| 8 | 22.0±2.3 dCD | 5.367±0.56 bB | 0.0106±0.001 hH | 0.117±0.01 dCD | 1.318±0.21 bBC | ||
| 28 | 23.2±0.3 dCD | 3.759±0.12 cC | 0.0166±0.001 dD | 0.078±0.01 eD | 1.035±0.12 bcCD | ||
| 赤根大纳言 | 28 | 0 | 19.9±00.3 cBC | 0.269±0.01 eE | 0.0129±0.001 eE | 0.079±0.01 dC | 0.413±0.05 eD |
| Akanedainagon | 3 | 32.6±11.3 bA | 0.656±0.01 deDE | 0.0353±0.006 bcBC | 0.126±0.01 bcdBC | 0.703±0.04 cdeBCD | |
| 8 | 38.7±12.8 aA | 0.322±0.02 eDE | 0.0461±0.002 bAB | 0.200±0.00 aA | 1.188±0.19 bAB | ||
| 28 | 38.8±02.4 aA | 0.251±0.00 eE | 0.0194±0.000 deCDE | 0.139±0.01 bcABC | 0.812±0.03 cdBCD | ||
| 斑小粒系-1 | 28 | 0 | 13.7±0.5 dCD | 17.780±0.36 aA | 0.0623±0.008 aA | 0.089±0.02 cdC | 0.544±0.14 deCD |
| Buchisyouryukei-1 | 3 | 13.2±3.2 dD | 7.106±0.91 bB | 0.0156±0.000 eDE | 0.092±0.02 cdC | 1.593±0.16 aA | |
| 8 | 0 | 0 | 0 | 0 | 0 | ||
| 28 | 0 | 0 | 0 | 0 | 0 |
新窗口打开|下载CSV
耐低温品种和不耐低温品种在长、短期低温处理后的叶绿素含量比较接近, 但是, 随着绿化处理时间的延长, 同一处理条件下耐低温品种比不耐低温品种的叶绿素含量显著增加, 短期低温处理的叶绿素含量远远高于长期低温处理, 不同处理之间也有很大差别。不耐低温品种在长期低温处理再经绿化处理8 h之后没有检测到叶绿素含量, 这表明长期低温胁迫导致叶绿素含量下降。
2.1.2 低温处理引起的H2O2含量变化 植株体内存在的O2-和H2O2会产生毒性很强的羟基游离基, 给植物细胞造成伤害。耐低温品种和不耐低温品种在短期低温处理后(18 d)的H2O2含量差异不显著。而长期低温处理后(28 d)未绿化处理前两品种间H2O2含量差异显著, 不耐低温品种斑小粒系-1中的H2O2含量(17.78 mmol kg-1 FW)是赤根大纳言(0.27 mmol kg-1 FW)约66倍, 绿化处理3 d后两品种相差约11倍。但绿化处理8 h之后斑小粒系-1没有检测到H2O2, 而耐低温品种赤根大纳言绿化处理28 h后H2O2含量水平基本恢复到绿化处理前水平(表2)。说明不耐低温品种由于低温遮光胁迫产生大量的O2-, 导致H2O2含量急剧增加, 造成不可逆的伤害。说明小豆出苗期耐冷性与H2O2生成量有着密切关系。
2.1.3 低温处理对SOD、APX、CAT活性的影响
植物遭遇低温胁迫后H2O2的生成量与SOD、APX以及CAT活性有着密切的关系[7], 光系统I的O2-的增加使SOD迅速作用后转换成H2O2, 从而导致SH基氧化, 造成不可逆的酶活性失活, 最终造成植株枯死[12]。
从表2可以看出, 在低温遮光处理18 d中, 2个品种初生叶的SOD和APX活性几乎显示了相同的水平。经过绿化处理后的耐低温品种赤根大纳言有所上升, 而不耐低温品种斑小粒系-1略有减少趋势。但是, 斑小粒系-1短期低温处理后CAT活性显示了较高水平, 是耐低温品种赤根大纳言的3.76倍, 且绿化处理后CAT活性上升较快。
在低温遮光处理28 d中, 斑小粒系-1的SOD活性显著高于赤根大纳言, 是耐低温品种的4.77倍, 绿化处理后斑小粒系-1的SOD活性显著下降, 说明由于长期低温遮光处理不耐低温品种生成大量H2O2, 引起SOD活化。但APX和CAT活性两品种处于相同水平, APX活性相同, 但CAT活性显著增加。绿化处理8 h后3种酶的活性全部消失。与斑小粒系-1相比, 赤根大纳言的SOD、APX、CAT三种酶在绿化8 h之前均显著上升, 之后有所下降, 并保持一定的活性水平。耐低温品种赤根大纳言长期低温遮光处理的SOD和CAT活性高于短期低温遮光处理, 而APX活性却低于短期处理。耐低温品种无论是低温遮光长期处理还是短期处理, 绿化处理后3种保护酶活性均呈“先上升后下降的趋势”, 且在绿化处理8 h时达到最大值。可见, 同一品种不同处理之间也有很大的差别, 这说明在低温伤害较轻的情况下, 植物代谢系统通过增加保护酶的活性来减轻低温的危害, 而随着低温胁迫时间延长, 植物受到伤害的程度加剧, 超过一定的限度, 植物体内保护酶合成系统受到破坏, 从而导致保护酶的活性降低。这说明小豆出苗期SOD活性对低温条件的反应更敏感, SOD活性可能与小豆苗期耐冷性的关系更密切。
2.2 不同的低温、暗处理及绿化处理对黄化初生叶叶绿素含量的影响
低温和暗处理均可导致小豆初生叶片的叶绿素含量降低, 产生黄化(表3)。随着低温和暗处理时间的延长, 小豆叶片叶绿素含量逐渐降低。Table 3
表3
表3不同的低温和暗处理后小豆初生叶片的叶绿素含量
Table 3
| 日数 Treatment days | 低温处理叶绿素含量 Content of chlorophyll under low temperature treatment | 暗处理叶绿素含量 Content of chlorophyll under shading treatment | |||
|---|---|---|---|---|---|
| 赤根大纳言 Akanedainagon | 斑小粒系-1 Buchisyouryukei-1 | 赤根大纳言 Akanedainagon | 斑小粒系-1 Buchisyouryukei-1 | ||
| 1 d | 645.9±61.7 aA | 621.5±50.0 aA | 325.7±39.1 aA | 419.1±32.4 aA | |
| 3 d | 612.2±55.8 abA | 547.5±49.9 aA | 268.0±38.7 bAB | 343.7±38.9 bB | |
| 5 d | 536.6±36.3 bcAB | 388.4±39.0 bB | 198.9±23.2 cBC | 96.7±32.5 cC | |
| 7 d | 459.3±59.1 cB | 299.2±14.0 cB | 138.3±7.4 dC | 49.1±5.7 cC | |
新窗口打开|下载CSV
在低温胁迫下, 耐低温品种的叶绿素含量普遍高于不耐低温品种, 且随着低温胁迫时间的延长, 两品种叶绿素含量均明显下降。其中, 低温处理3 d、5 d、7 d时, 耐低温品种叶绿素含量分别下降了5.22%、16.92%和28.89%, 而不耐低温品种分别下降了11.91%、37.51%和51.86%, 耐低温品种叶绿素含量降低程度显著低于不耐低温品种。
在暗处理下, 两品种的叶绿素含量变化同样均呈显著下降趋势, 其中, 耐低温品种在暗处理3 d、5 d、7 d时, 叶绿素含量分别下降了17.72%、38.93%和57.54%, 而不耐低温品种叶绿素含量分别下降了17.99%、76.93%和88.28%。可见, 随着暗处理时间的延长, 不耐低温品种的叶绿素含量降低速度远远大于耐低温品种。可以看出, 两种不同处理模式的同一品种在相同处理日数条件下, 暗处理的叶绿素含量远远低于低温处理。说明低温胁迫条件对小豆苗期叶绿素合成能力会带来一定影响, 但是, 暗生育时间的长短才是造成耐冷性不同两品种叶绿素合成能力差异的主要原因。
2.3 黄化初生叶的绿化处理对叶绿素合成途径前质体的影响
叶绿素的生物合成是一系列酶学催化过程[13,14]。其中任何一步受阻, 都将影响叶绿素的生物合成, 从而引起叶色变化。研究表明金属离子插入原卟啉IX (Proto IX)是叶绿素与血红素和植物色素合成的分支点, Mg离子在Mg离子螯合酶的催化下插入Proto IX形成叶绿素分支, Fe离子在Fe离子螯合酶的催化下插入Proto IX则形成血红素和植物色素分支, 在分支点处Mg离子螯合酶和Fe离子螯合酶竞争Proto IX[15]。鉴于δ-氨基酮戊酸(ALA)是叶绿素和四吡咯环形成的直接前体, 也是一个关键的中间产物, 本研究测定了ALA和由分支点Proto IX 形成叶绿素的镁分支途径的主要前质体。从表4、图2可以看出, 在暗处理出苗7 d后, 2个品种叶片中ALA的含量在所有合成前体中最少, 且随着绿化处理均呈逐渐增加的趋势, 但品种之间无显著差异。而Proto IX、Mg-Proto IX、Pchl和叶绿素的含量在暗处理出苗7 d后, 不耐低温品种均高于耐低温品种。但经绿化处理后, 耐低温品种各前质体含量呈显著上升趋势, 而不耐低温品种呈显著下降趋势。其中, 绿化处理24 h后, 耐低温品种Proto IX、Mg-Proto IX、Pchl和叶绿素的含量比绿化前分别增加了3.0、6.6、6.8和10.0倍, 而不耐低温品种斑小粒系-1却分别减少了61.4%、47.3%、51.2%和43.1%。且耐低温品种中这些前质体的含量是不耐低温寒品种的7.37~13.19倍, 其中, 叶绿素的含量差异最大。这表明引起不抗寒品种斑小粒系-1叶绿素含量下降的原因可能是由ALA向叶绿素合成过程中某种酶促反应引起活性降低, 从而阻碍了由ALA向Proto IX以及其他中间合成产物的转化。
Table 4
表4
表4暗处理7 d的黄化苗经绿化处理后主要叶绿素前质体的含量
Table 4
| 品种 Variety | 绿化处理 Greening treatment (h) | Δ-氨基酮戊酸 ALA | 原卟啉IX Proto IX | Mg-原卟啉IX Mg-Proto IX | 原叶绿素酸 Pchl | 叶绿素 Chl |
|---|---|---|---|---|---|---|
| 赤根大纳言 | 0 | 1.2±0.3 eE | 88.4±2.5 cdCD | 9.3±0.8 cC | 5.7±0.7 cC | 23.4±3.7 dD |
| Akanedainagon | 6 | 2.6±0.1 dD | 103.9±12.1 cBCD | 16.7±1.8 cC | 10.0±0.9 cC | 68.1±7.1 cC |
| 12 | 4.1±0.8 bBC | 157.4±12.3 bB | 31.0±8.9 bB | 19.8±6.1 bB | 142.3±10.5 bB | |
| 24 | 5.1±0.5 aA | 353.8±38.2 aA | 70.5±12.8 aA | 44.5±8.2 aA | 227.7±10.5 aA | |
| 斑小粒系-1 | 0 | 2.5±0.1 dD | 124.5±7.4 bcBC | 12.9±2.8 cC | 8.2±2.0 cC | 30.6±0.1 dD |
| Buchisyouryukei-1 | 6 | 3.4±0.1 cC | 78.1±13.0 cdCD | 11.1±3.6 cC | 6.0±1.9 cC | 26.2±5.5 dD |
| 12 | 3.6±0.1 bcC | 54.9±5.8 dD | 7.8±0.6 cC | 4.5±0.4 cC | 18.8±1.2 dD | |
| 24 | 4.8±0.1 aAB | 48.0±12.8 dD | 6.8±1.3 cC | 4.0±1.0 cC | 17.4±1.0 dD |
新窗口打开|下载CSV
图2
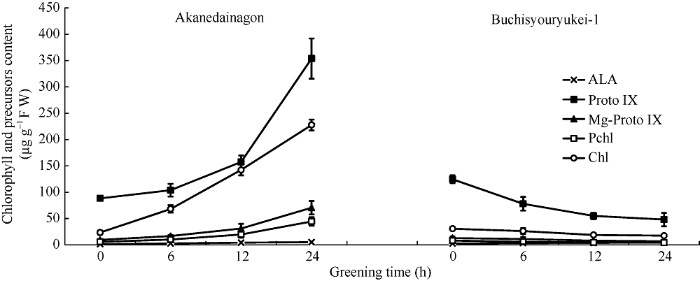 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2黄化初生叶的绿化处理对叶绿素合成途径前质体的影响
Fig. 2Influence from greening treatment of etiolated primary leaf to chlorophyll synthesis precursors
3 讨论
本研究发现, 低温处理28 d不耐低温品种的H2O2含量和SOD活性比耐低温品种显著增加。Okuda等[16]报道低温处理小麦叶后H2O2含量会增加; Shen等[8]发现黄瓜叶经低温处理后不耐低温品种的H2O2含量比耐低温品种多; 而Fridovich等[17]指出细胞内的O2-增加会引起SOD活化。本研究中不耐低温品种斑小粒系-1初生叶的H2O2含量和SOD活性的增加, 是由于低温遮光生成了大量的超氧自由基(O2-), 为了清除这些自由基, SOD活性增加, 造成H2O2含量的积累(表2)。低温胁迫条件下叶绿体内的H2O2浓度上升会导致APX失去活性[18]。把植物从暗处理移到正常光照条件下, CAT活性会显著增加[7,19-20]。CAT是把H2O2迅速分解成H2O和O2的酶, CAT活性的增加可以避免光造成的伤害[21], 但是, 如果长时间受强光所产生的O2-伤害, 就会造成不可逆的CAT失活[8]。低温遮光处理28 d的斑小粒-1在绿化处理后CAT活性迅速减少, 推测是不耐低温品种斑小粒-1在低温遮光条件下O2-和H2O2的增加导致了CAT失活, 使细胞质被氧化而伤害到其他生物功能。而耐低温品种赤根大纳言幼苗在低温胁迫后的绿化恢复过程中SOD、APX、CAT保护酶活性均呈先上升后下降的趋势, 说明在低温伤害较轻的情况下, 植物代谢系统通过增加保护酶的活性来减轻低温的危害, 而不耐低温品种斑小粒-1在短期低温遮光处理18 d后CAT活性显示了与抗寒品种相同的变动, 但是, 在长期低温遮光处理28 d后再经绿化处理后, 不耐低温品种的3种保护酶活性均呈下降的趋势, 说明不耐低温品种受到伤害的程度加剧, 超过一定的限度时植物体内保护酶合成系统受到破坏, 从而导致保护酶活性降低, 直至检测不出, 致使植株枯死。叶绿素是绿色植物叶绿体内参与光合作用的重要色素, 在光合作用的能量捕获及能量传递中起着重要作用[22]。目前研究认为环境条件如光、抑制剂、温度及营养状况等对叶绿素的合成都有影响[23]。本研究表明, 长期低温遮光胁迫条件下, 不耐低温品种随着绿化时间增加叶片白化现象和枯死率逐渐加重(绿化28 h枯死率40%), 直至检测不到叶绿素含量, 最终植株枯死。比较暗处理和低温处理对叶绿素降低的影响发现, 耐低温品种暗处理叶绿素降低的程度比低温处理略高, 而不耐低温品种暗处理对叶绿素含量的影响显著高于低温处理。可见, 暗处理时间的长短可能是造成不同耐冷性品种叶绿素合成能力差异的主要原因, 说明在低温和寡照等不良条件同时存在时, 寡照的抑制现象会更严重。
在叶绿素的合成过程中, 如果某一步合成出现障碍, 其前体物质会积累, 而其后的前体物质会减少[14]。不耐低温品种斑小粒系-1随着绿化时间的延长ALA逐渐增加, 而Proto IX却急剧减少。ALA是叶绿素等四吡咯环色素形成的第一个直接前体[24], 绿色的丧失主要是卟啉大环结构丧失造成的, 这一步被认为是叶片衰老黄化的关键一步[22]。Pchl是叶绿素a合成的最直接前体, Mg-Proto IX形成之前的合成都在叶绿体基质中进行, 之后则在内囊体膜上进行[12]。抗性不同的两品种除ALA以外, 其上游的中产物Proto IX、Mg-Proto IX、Pchl在光照后叶绿素合成途径发生了不同的改变, 由此推测小豆苗期叶绿素的合成影响可能发生于叶绿体基质的各种合成反应中, 在叶绿体基质的转化反应中, 影响不耐低温品种斑小粒系-1 ALA向Proto IX 的转化, 导致叶绿素合成受阻, 叶绿素含量下降。不耐低温品种斑小粒系-1的叶绿素合成中除ALA在绿化后有少量的积累外, Proto IX及其他中间物都急剧下降, 这表明引起不耐低温品种斑小粒系-1叶绿素含量下降的原因可能是PBG→UroIII向Proto IX的转化受阻。叶绿素中间代谢物质的积累, 有时可以防御对植物的伤害作用[13]。可以推测黄化初生叶在经过绿化处理后, 耐低温品种赤根大纳言的叶绿素前体物质在向叶绿素转换过程中, 由于趋于领先位置的Proto IX大量积累及其他中间代谢物也有少量的恢复, 最终才合成了叶绿素。对小豆2个不同性质品种叶绿素合成中产物的研究表明, 影响小豆叶绿素合成的是在叶绿体基质中由ALA向Proto IX 的转化, 叶绿素合成受阻导致叶绿素含量下降, 使小豆在低温并伴随寡照时出现黄化和枯死现象。
4 结论
小豆出苗期耐冷性与H2O2生成量和SOD活性关系密切, 与低温胁迫相比, 遮光处理是造成耐冷性不同品种叶绿素合成能力差异的主要原因, 小豆叶绿素合成受阻于Proto IX的转化。说明位于光合作用代谢途径中Proto IX 在小豆苗期叶绿素合成中起着非常重要的作用。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
URL [本文引用: 2]

以375份小豆核心种质为试验材料,利用从小豆及其近缘种SSR引物中筛选出的13对引物进行遗传多样性分析。检测结果显示,小豆种质资源具有丰富的遗传多样性,共检测到133个等位变异,每对SSR引物检测到等位变异4~19个,平均10.23个,国内各省多态信息含量(PIC)平均为0.561,多态位点比例(PP)平均为93.523%。聚类结果表明,小豆资源遗传关系与生态分区间有明显的联系,且东北地区资源与中南部资源遗传关系较近。湖北、安徽、陕西3省资源的PIC较高,且基本位于主坐标三维图的中心区域,推断湖北、安徽和陕西是中国栽培小豆的起源地或多样性中心。该结果有助于更好地对小豆种质资源进行收集、保护和利用。
URL [本文引用: 2]

以375份小豆核心种质为试验材料,利用从小豆及其近缘种SSR引物中筛选出的13对引物进行遗传多样性分析。检测结果显示,小豆种质资源具有丰富的遗传多样性,共检测到133个等位变异,每对SSR引物检测到等位变异4~19个,平均10.23个,国内各省多态信息含量(PIC)平均为0.561,多态位点比例(PP)平均为93.523%。聚类结果表明,小豆资源遗传关系与生态分区间有明显的联系,且东北地区资源与中南部资源遗传关系较近。湖北、安徽、陕西3省资源的PIC较高,且基本位于主坐标三维图的中心区域,推断湖北、安徽和陕西是中国栽培小豆的起源地或多样性中心。该结果有助于更好地对小豆种质资源进行收集、保护和利用。
[本文引用: 4]
[本文引用: 4]
[本文引用: 3]
[本文引用: 3]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/ppl.1988.72.issue-3URL [本文引用: 3]
[本文引用: 3]
DOI:10.1016/0031-9422(82)80073-3URL [本文引用: 2]

The chemiluminescence of luminol (3-aminophthalhydrazide) with H 2O 2 has been used to quantify endogenous amounts of H 2O 2 in plant tissues. The reaction is linear over at least three orders of magnitude between 10 615 and 10 612M H 2O 2. Interference by coloured compounds in the crude extract is calibrated by a purification step with Dowex AG 1-X8. The extract is calibrated with an internal H 2O 2 standard, and the specificity verified by H 2O 2 purging with catalase. The minimum delectability for H 2O 2 of this assay is at least 1 ng, corresponding to 0.1–1 g fresh material. Data are presented for the levels of H 2O 2 in potatoes after treatment with oxygen and ethylene, in tomatoes before and after ripening and in untreated germinating castor beans as well as in beans treated with aminotriazol to inhibit catalase activity. Though data using the titanium test are generally confirmed, the method presented here has the advantage of higher sensitivity and specificity.
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
DOI:10.1105/tpc.107.050633URL [本文引用: 2]
[本文引用: 2]
DOI:10.3321/j.issn:1000-4025.2009.03.032URL [本文引用: 1]

叶绿素是植物叶绿体内参与光合作用的重要色素,其功能是捕获光能并驱动电子转移到反应中心.整个叶绿素生物合成过程(L-谷氨酰-tRNA→叶绿素a→叶绿素b)需要15步反应,涉及15种酶,迄今在模式植物拟南芥中已分离到27个编码这些酶的基因,完成了以拟南芥为代表的被子植物叶绿素生物合成全部基因的克隆.本文主要对近年来国内外有关植物叶绿素的生物合成过程及相关酶基因的克隆、生物合成途径中2个关键步骤(σ-氨基酮戊酸(ALA)合成和Mg离子插入原卟啉Ⅸ的调节)、影响叶绿素生物合成的主要因素(光、温度、营养元素等),以及叶绿素生物合成相关酶的其他生物学功能等的研究进展进行综述.
DOI:10.3321/j.issn:1000-4025.2009.03.032URL [本文引用: 1]

叶绿素是植物叶绿体内参与光合作用的重要色素,其功能是捕获光能并驱动电子转移到反应中心.整个叶绿素生物合成过程(L-谷氨酰-tRNA→叶绿素a→叶绿素b)需要15步反应,涉及15种酶,迄今在模式植物拟南芥中已分离到27个编码这些酶的基因,完成了以拟南芥为代表的被子植物叶绿素生物合成全部基因的克隆.本文主要对近年来国内外有关植物叶绿素的生物合成过程及相关酶基因的克隆、生物合成途径中2个关键步骤(σ-氨基酮戊酸(ALA)合成和Mg离子插入原卟啉Ⅸ的调节)、影响叶绿素生物合成的主要因素(光、温度、营养元素等),以及叶绿素生物合成相关酶的其他生物学功能等的研究进展进行综述.
DOI:10.1104/pp.97.3.1265URLPMID:16668520 [本文引用: 1]

After cold treatment of seedlings of winter wheat (Triticum aestivum L.), levels of hydrogen peroxide in the leaves were measured. The concentration of hydrogen peroxide increased to about three times the control level within a few minutes, and returned to the normal level in 15 to 20 minutes. The elevated level of hydrogen peroxide was found to be equivalent to 1.5 micromoles per gram fresh weight tissues of leaves.
DOI:10.1016/0003-9861(86)90526-6URLPMID:3010872 [本文引用: 1]

Can the superoxide radical exert deleterious effects independent of participating with H 2O 2 in the production of the hydroxyl radical? Examination of the superoxide-related literature reveals data suggesting an affirmative answer to this question.
[本文引用: 1]
[本文引用: 1]
DOI:10.1034/j.1399-3054.1998.1040217.xURL [本文引用: 1]

A catalase‐deficient mutant (RPr 79/4) and the wild‐type (cv. Maris Mink) barley ( Hordeum vulgare L.) counterpart, were grown for 3 weeks in high CO 2 (0.7%) and then transferred to air and ozone (120 nl 1 611 ) in the light and shade for a period of 4 days. Leaves and roots were analysed for catalase (CAT, EC 1.11.1.6), superoxide dismutase (SOD, EC 1.15.1.1) and glutathione reductase (GR, EC 1.6.4.2) activities. CAT activity in the leaves of the RPr 79/4 catalase‐deficient mutant was around 5‐10% of that determined in Maris Mink, but in the roots, both genotypes contained approximately the same levels of activity. CAT activity in Maris Mink increased in the leaves after transferring plants from 0.7% CO 2 to air or ozone, reaching a maximum of 5‐fold, after 4 days in shade and ozone. For the catalase‐deficient mutant, only small increases in CAT activity were observed in light/air and light/ozone treatments. In the roots, CAT activity decreased consistently in both genotypes, after plants were transferred from 0.7% CO 2 . The total soluble SOD activity in the leaves and roots of both genotypes increased after plants were transferred from 0.7% CO 2 . The analysis of SOD isolated from leaves following non‐denaturing PAGE, revealed the presence of up to eight SOD isoenzymes classified as Mn‐SOD or Cu/Zn‐SODs; Fe‐SOD was not detected. Significant changes in Mn‐ and Cu/Zn‐SOD isoenzymes were observed; however, they could not account for the increase in total SOD activity. In leaves, GR activity also increased in Maris Mink and RPr 79/4, following transfer from 0.7% CO 2 ; however, no constant pattern could be established, while in roots, GR activity was reduced after 4 days of the treatments. The data suggest that elevated CO 2 decreases oxidative stress in barley leaves and that soluble CAT and SOD activities increased rapidly after plants were transferred from elevated CO 2 , irrespective of the treatment (light, shade, air or ozone).
DOI:10.1111/j.1755-3768.1966.tb08068.xURL [本文引用: 1]

The subject is covered in an interdisciplinary manner, with contributing authors encouraged to provide personal perspectives on their topics whilst discussing them in depth. The following chapters are included:(1) Oxygen metabolism and the regulation of photosynthetic electron transport, by C. H. Foyer and J. Harbinson.(2) The role of oxygen in the photoinhibition of photosynthesis, by G. H. ...
[本文引用: 1]
[本文引用: 1]
DOI:10.3969/j.issn.1004-7549.2010.02.004URL [本文引用: 2]

叶绿素是地球上最重要的光合色素。叶绿素的生物合成代谢途径现已阐明,而叶绿素降解代谢研究,近年也取得了突破性进展,本文对此作一介绍。
DOI:10.3969/j.issn.1004-7549.2010.02.004URL [本文引用: 2]

叶绿素是地球上最重要的光合色素。叶绿素的生物合成代谢途径现已阐明,而叶绿素降解代谢研究,近年也取得了突破性进展,本文对此作一介绍。
DOI:10.1016/j.bbrc.2004.11.049URLPMID:15582600 [本文引用: 1]

Chlorophyllide a oxygenase (CAO) that converts chlorophyllide a to chlorophyllide b was overexpressed in tobacco to increase chlorophyll (Chl) b biosynthesis and alter the Chl a/b ratio. Transgenic plants along with their wild-type cultivars were grown in low and high light intensities. In low light there was 20% increase in chlorophyll b contents in transgenic plants, which resulted in 16% reduction in the Chl a/b ratio. In high light, total Chl contents were 31% higher in transgenic plants than those of wild type. The increase in Chl a was 19% and that of Chl b was 72% leading to 31% decline of Chl a/b ratio. The increase in Chl b contents was accompanied by enhanced CAO expression that was highly pronounced in low light. As compared to low light, in high light Lhcb1 and Chl a/b transcripts abundance was significantly increased in transgenic plants suggesting a close relationship between Chl b synthesis and cab gene expression. However, there was a small increase in expression of LHCII proteins, which did not correspond to 72% increase in Chl b content in transgenic line, implying that LHCPII has the ability to bind more Chl b molecules.
[本文引用: 1]
[本文引用: 1]
