 , 王晓雯, 田维江, 张孝波, 孙莹, 李杨羊, 谢佳, 何光华, 桑贤春
, 王晓雯, 田维江, 张孝波, 孙莹, 李杨羊, 谢佳, 何光华, 桑贤春
* 通讯作者(Corresponding author): 桑贤春, E-mail: sangxianchun@163.com 第一作者联系方式: E-mail: zxq1964265210@163.com
收稿日期:2017-04-05 接受日期:2017-07-23网络出版日期:2017-08-07基金:
摘要
关键词:水稻( Oryza sativa L.); 叶夹角; LAZY1/S524; 油菜素内酯(BR)信号传导; BU1
LAZY1 Regulates Development of Rice Leaf Angle through Brassinolide Pathway
ZHANG Xiao-Qiong
 , WANG Xiao-Wen, TIAN Wei-Jiang, ZHANG Xiao-Bo, SUN Ying, LI Yang-Yang, XIE Jia, HE Guang-Hua, SANG Xian-Chun
, WANG Xiao-Wen, TIAN Wei-Jiang, ZHANG Xiao-Bo, SUN Ying, LI Yang-Yang, XIE Jia, HE Guang-Hua, SANG Xian-Chun
Fund:
Abstract
Keyword:Rice ( Oryza sativa L.); Tiller angle; LAZY1/S524; Signal transduction of brassinolide (BR); BU1
Show Figures
Show Figures







水稻产量除受外界不可控的环境因素影响外, 还与水稻的株型相关, 而叶夹角和分蘖角度是水稻株型的重要组成。叶夹角和分蘖角度通常会影响植物的光合效率以及植株间的温度和气体的含量, 是水稻品种选育、栽培研究和生产实践上的重要性状。通常认为分蘖角度属于数量性状, 已定位Td[1]、qTA-9a[2]、qTA-9b[2]、qTA-9[3]等多个主效QTL, 并克隆了TAC1[4]。也有研究表明分蘖角为质量性状, 并克隆了其调控基因LAZY1[5, 6]和LIC1[7]。TAC1表达具有时空性, 主要在分蘖基部不伸长节、茎的节部与叶鞘交接部位的叶鞘枕处表达, 属于发育时期调控基因, 其过量表达可导致分蘖角度增大[4]; LAZY1通过调节生长素极性运输影响水稻地上部的向重性, 最终控制分蘖角的大小[5, 6], 属于重力信号传导途径基因; LIC1是油菜素内酯(BR)响应途径中的负向调节子, 抑制LIC1的表达, 会导致叶夹角和分蘖角度明显增加[7]。
叶夹角对外界的信号比较敏感, 光、植物激素等都可能改变其大小。目前研究认为, 叶夹角主要与植物激素有关, 已克隆了LC1[8]、LC2[9]、ARF19[10]等多个基因; 另外叶夹角还受重力响应和叶枕机械强度等因素的影响, 相关基因如LPA1[11]、ILA1[12]等。LC1对生长素不敏感, 但对外源BR异常敏感, 可通过BR的合成和信号传导途径调节叶枕近轴面细胞大小, 影响叶夹角发育[8]; LC2的表达受脱落酸、赤霉素、生长素、BR等多激素的诱导[9], 控制近轴面细胞的分裂速度, 最终影响叶夹角大小; ARF19介导生长素与BR信号传导通路的交叉网络, 共同增强叶枕近轴面细胞的分裂[10]; LPA1编码一个具有独特保守特征的ID蛋白, 调控淀粉质体沉降率, 进而影响胚芽鞘的重力感应和信号转导[11]; ILA1在叶枕维管束中表达, 其与一个核蛋白家族的互作调节叶枕机械组织的形成, 影响叶枕机械强度, 调控叶夹角[12]。这些叶角度、分蘖角度相关基因的定位克隆与功能研究为揭示水稻株型发育的分子机制奠定了良好基础, 但仍有待更深入的研究。
从EMS诱变籼型水稻保持系西大1B后代中鉴定到一个叶角度变大的散生突变体s524, 我们对其进行了形态鉴定、细胞学分析和基因精细定位等研究, 发现它是新的LAZY1等位突变体, 通过BR信号传导途径影响叶夹角发育。
1 材料与方法1.1 试验材料连续种植2代, s524突变性状均能稳定遗传。
1.2 农艺性状鉴定田间种植和常规管理条件下, 全生育期观察野生型和s524的株型变化。成熟期随机选择中间10株, 测量株高和节间长, 并调查穗长、有效穗、穗粒数、穗实粒数、结实率、千粒重等主要农艺性状。
1.3 组织表型分析取三叶期野生型和突变体全展叶的叶枕, 依据文献[13]稍作改动进行石蜡切片分析。即FAA固定液固定后, 依次用一定梯度浓度的乙醇脱水、二甲苯透明、石蜡包埋、切片、烘干和番红固绿染色, 最后中性树胶封片, 显微镜下观察并拍照。
1.4 遗传分析和定位群体构建在西南大学水稻研究所歇马基地配制日本晴/s524杂交组合, 同年秋在海南加代种植F1, 观察植株形态并收获F2种子。次年夏在西南大学水稻研究所歇马基地种植杂交组合的亲本和F2群体, 进行遗传分析; 同时, 利用日本晴/s524杂交组合的F2隐性单株进行基因定位。
1.5 DNA的提取采用改进后的CTAB法[14]提取亲本、F2正常植株基因池、F2突变株基因池及定位群体单株的基因组DNA。
1.6 PCR分析根据日本晴和1B的DNA序列差异, 参照http://www.gramene.org/microsat/等网站设计SSR和InDel标记。PCR体系总体积12.5 μ L, 包括1.0 μ L的模板DNA, 1.0 μ L的10 μ mol L-1引物, 0.65 μ L的25 mmol L-1 MgC12, 0.5 μ L 2.5 mmol L-1 dNTPs, 8.0 μ L ddH2O, 1.25 μ L的10 × PCR 缓冲液和0.1 μ L的5 U μ L-1Taq DNA聚合酶。PCR程序为94℃预变性5 min, 94℃变性20 s, 56℃退火20 s, 72℃延伸40 s, 35个循环后, 72℃再充分延伸10 min。PCR产物经10%的非变性聚丙烯酰胺凝胶电泳, 0.1%质量浓度的AgNO3染色10 min, 去离子水漂洗2次, 再以1%质量浓度NaOH和0.1%体积质量浓度甲醛的混合液显色, 观察记录带型并照相。
1.7 BR敏感实验取野生型和突变体种子, 催芽露白后播种至营养土中, 分别进行黑暗和正常培养。至三叶一心期时, 调查长势正常的野生型和突变体植株的叶夹角, 进行统计分析。同时, 剪取正常培养的野生型和突变体植株叶枕处前后2 cm左右的材料, 分别置0、0.01、0.1、1和10 μ mol L-1 24-表油菜素内酯(24-eBL)溶液中, 暗培养3 d后统计各浓度下叶夹角大小。以上实验均3次生物学重复。
1.8 RNA提取及qPCR三叶一心期, 分别取野生型和突变体植株的叶枕, 放进无核酸酶的2 mL离心管中, 液氮速冻后研磨成粉, 根据试剂盒描述的方法提取RNA并反转录成cDNA, 试剂盒购自天根生化科技(北京)有限公司, 然后再参照文献[13]的方法对BR信号传导途径相关基因BU1[15]、BZR1[16]、ILI1[17]、TUD1[18]和BR合成相关基因DWARF4[19]、D2[20]进行qPCR定量分析。qPCR引物序列见表1。
表1
Table 1
表1(Table 1)
| 表1 qPCR定量引物序列 Table 1 Primer sequences used for qPCR analysis |
2 结果与分析2.1 表型鉴定田间种植条件下, 突变体s524整个生育期均表现叶夹角增大和植株散生。三叶期, 野生型的叶夹角为10.31° , s524的则是41.62° , 相比野生型, 突变体的叶夹角增大4倍, 达极显著差异水平; 进入分蘖期, s524的分蘖角度显著大于野生型, 且随生长发育进程变得更大(图1-A, B); 灌浆期整个植株呈匍匐状(图1-D)。而野生型西大1B整个生育期株型均保持紧凑, 分蘖角度正常(图1-C)。与野生型相比, s524除叶夹角和分蘖角度显著变大外, 株高、有效穗、穗长、穗粒数、穗实粒数、结实率、千粒重等农艺性状均无显著变化(表2)。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 突变体s524和野生型的表型观察 A: 分蘖期野生型, Bar=10 cm; B: 分蘖期突变体, Bar=10 cm; C: 灌浆期野生型, Bar=15 cm; D: 灌浆期突变体, Bar=15 cm; E: 为图1C和图1D灌浆期放大的分蘖基部。Fig. 1 Phenotypes of the s524 and the wild type A: plant phenotype of the wild type at tillering stage, Bar=10 cm; B: plant phenotype of the s524 at tillering stage, Bar=10 cm; C: plant phenotype of the wild type at filling stage, Bar=15 cm; D: plant phenotype of the s524 at filling stage, Bar=15 cm; E: magnified tiller base at filling stage in Figs. 1C and 1D. |
表2
Table 2
表2(Table 2)
| 表2 突变体s524与野生型(WT)的农艺性状 Table 2 Agronomic traits of the s524mutant and the wild type (WT) |
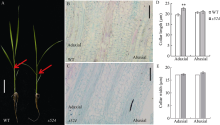
2.2 细胞学分析形态学观察表明s524的叶夹角变大, 为进一步分析其原因, 利用石蜡切片观察了三叶期倒一全展叶叶枕部位的细胞结构(图2-A)。结果显示, 野生型(图2-B)近轴面细胞长度平均为19.63 μ m, 突变体s524(图2-C)的约为22.49 μ m, 即相对于野生型, 突变体近轴面细胞长度增加10%, 达显著差异水平; 野生型植株远轴面细胞长度为20.72 μ m, 相应的突变体s524的约为21.01 μ m, 比野生型增加1%, 差异不显著(图2-D); 野生型与突变体的近轴面细胞宽度分别为17.08 μ m和17.38 μ m, 远轴面细胞宽度分别是17.11 μ m和18.01 μ m (图2-E), 细胞宽度变化均不显著。由此推测, 突变体叶夹角变大可能是由近轴面细胞变长导致的。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 近轴面细胞变长导致s524叶夹角变大 A: 三叶一心期野生型(WT)和突变体, 箭头所指为叶枕部位, Bar=10 cm; B, C: 野生型(B)和突变体(C)的叶枕细胞, Bar=50 μ m; D, E: 野生型和突变体近轴端与远轴端细胞长度(D)和宽度(E)统计图。3次生物学重复; n=50。* * 在0.01水平上差异显著(t测验)。Fig. 2 Longer adaxial cells responding to larger leaf angle of s524 A: plant phenotype of the wild type(WT) and mutant type at stage with three whole and one under-developing leaf blades, Bar=10 cm; B and C: comparison of the leaf occipital cells of WT(B) and s524mutant(C), Bar=50 μ m; D and E: statistical chart of length (D) and width (E) of the adaxial and abaxial cells in WT and s524. The experiments are biologically repeated three times and the data are presented as means± SE, n=50. * * Significant difference at P< 0.01 by t-test. |
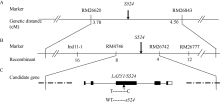
2.3 基因的精细定位日本晴/s524杂交组合的F1群体正常; F2群体中有2564株正常单株和826株突变单株, 突变单株均表现为散生和叶夹角变大, 卡方检验(χ 2=0.73< χ 20.05= 3.84)显示该性状受1对隐性核基因调控。利用在日本晴和s524间呈现多态性的123对标记分析正常基因池和突变基因池, 挑选正常池和突变池也呈现多态性差异的标记。利用10株典型的F2隐性单株进行验证, 交换值小于25%的初步判定为连锁, 并进一步利用70个F2隐性单株进行检验, 初步将S524定位在第11染色体SSR标记RM26620和RM26843之间(图3-A)。在初步定位的基础上又合成了新的SSR和Indel标记, 进一步分析826株日本晴/s524的F2隐性单株, 结果发现, 标记Ind11-1 (上游引物: 5′ -TGCTACAAGCACTAGCTGTCC-3′ ; 下游引物: 5′ -CTTCACTTGCCCAGCAAAG-3′ )和RM4746的交换株分别为16个和8个, 而RM26742和RM26777的交换株分别为4个和12个, 且前2个标记和后2个标记的交换株不同, 最终将S524限定在第11染色体SSR标记RM4746和RM26742之间约324 kb的物理范围内, 其中有一注释基因为LAZY1。克隆目的基因比对发现, LAZY1的第428处碱基由野生型的T变成了突变体中的C, 从而导致缬氨酸突变为丙氨酸。因此认为s524是LAZY1的新等位突变体。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 LAZY1/S524在水稻第11染色体上的分子定位Fig. 3 Molecular mapping of LAZY1/S524 gene on rice chromosome 11 |
2.4 油菜素内酯响应实验油菜素内酯(BR)是一种高效的植物生长调节剂, 广泛存在于花、茎和根部, 生理活性极强, 是植物第六大激素, 尤其在单子叶植物叶夹角发育中具有重要功能[21]。不同植株对BR的敏感程度不同, 引起的叶夹角变化也不相同。随着外施24-eBL浓度的升高, 野生型和突变体的叶夹角都随之变大; 当浓度增大至10 μ mol L-1时, 野生型的夹角度数继续增大, 而突变体的则保持不变(图4-A)。在1 μ mol L-1浓度下, 突变体s524叶夹角即达到最大值, 其叶夹角变化量(∆ S)为野生型(∆ B)的60%, 达极显著差异水平(图4-B)。这表明s524对BR敏感性降低。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 s524叶夹角对外源BR的敏感性降低 A: 野生型和突变体s524叶夹角对激素BR的敏感性检测; B: 野生型和突变体叶夹角变化。∆ B和∆ S分别为1 μ mol L-1外源24-eBL处理前后野生型和突变体叶夹角的差值。* * 在0.01水平上差异显著(t测验)。Fig. 4 Decreased sensitivity of the leaf angle to exogenous BR in s524 A: BR sensitivity tests of the wild type and mutant type; B: comparison of the leaf inclination of WT and s524mutant. ∆ B and ∆ S represent the difference between the angle of the wild type and the mutant respectively, under 1 μ mol L-1 24-eBL treatment. * * Significant difference at P < 0.01 by t-test. |
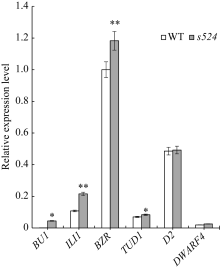
qPCR分析表明, 与野生型相比, BR信号传导途径基因BU1、BZR1、ILI1和TUD1在突变体中的表达量均极显著或显著上调, 其中, BU1在s524中的表达量近乎为野生型的10倍; 但BR合成途径调控基因DWARF4和D2在突变体s524和野生型之间的表达变化则未达到统计学差异水平(图5)。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 与叶夹角相关BR合成与信号传导途径中的基因在野生型(WT)和突变体s524的表达分析 ACTION基因作为内参, 3次生物学重复。* * 在0.01水平上差异显著; * 在0.05水平上差异显著(t测验)。Fig. 5 Expression of genes related to leaf angle in BR synthesis and signaling pathway between the wild-type and s524 Comparison of the expression of genes related to leaf angle in BR signalling. Using ACTION gene as a reference and the experiments are biologically repeated three times. * * Significant difference at P < 0.01 by t-test; * significant difference at P< 0.05 by t-test. |
3 讨论叶夹角和分蘖角是水稻理想株型育种的重要选择指标, 本文EMS诱变鉴定了一个散生且叶夹角变大的突变体s524, 精细定位及候选基因分析表明其为LAZY1的等位突变体。目前已经报道了5个LAZY1的等位突变体, la1-ZF802在第4外显子上有8个碱基的缺失, 导致蛋白质翻译提前终止[5]; la1-Shiokari的开放阅读框则整体丢失[5]; lazy1-1、lazy1-2和lazy1-3为T-DNA插入突变体, 在LAZY1基因内部发生了大片段的插入或/和缺失[6]。s524突变体仅在第3外显子区域发生一个碱基的替换, 导致氨基酸的转换, 是一个LAZY1弱等位突变体, 其散生性状与已报道的等位突变体类似, 但株高、有效穗和穗粒数等农艺性状无显著变化。
突变体s524除植株散生外, 另一典型特征是叶夹角变大。目前已报道了LC1[8]、CYC U4; 1[21]、MDP1[22]等多个叶夹角发育调节基因。其中LC1编码一个生长素氨基合成酶GH3-1, 通过增加近轴面细胞的长度调控叶夹角大小[8]; LC2 编码一个类VIL3蛋白, 叶枕近轴面上表皮细胞分裂能力增强导致叶角变大[9]; CYC U4; 1是一个细胞周期调控基因, 表达量降低致使水稻叶片远轴面细胞数量减少, 进而叶夹角变大[23]; MDP1的功能缺失会导致XTR1表达上调(XTR1编码一个木葡聚糖内糖基转移酶, 是细胞伸长过程中使细胞壁松弛所必需的酶), 进而引起植株叶枕近轴面细胞膨大使叶夹角增大[22]。与已报道的lc1突变体类似, s524叶角处远轴面细胞与野生型相比无明显变化, 近轴面细胞则极显著变长, 从而导致突变体s524叶夹角变大。
油菜素内酯是调控单子叶植物叶夹角发育的重要激素。油菜素内酯响应实验表明lazy1/s524对BR的敏感性降低, 暗示LAZY1/S524可能参与BR的信号传导途径。qPCR分析显示, BR生物合成基因DWARF4、D2在s524和野生型中的表达差异不显著, BR信号传导基因BU1、BZR1、ILI1和TUD1在突变体中的表达量均上调, 进一步佐证了LAZY1/S524通过BR信号传导途径调控水稻叶夹角发育的推测。
BU1是BR信号途径中的早期应答基因, 参与BRI1和RGA1介导的BR信号传导通路。抑制BU1的表达使水稻叶片出现直立的表型, 而过量表达该基因则导致叶夹角变大[15]。本研究发现, BU1在突变体中的表达量与野生型相比升高了近10倍(图5)。因此推测S524可能通过影响BU1等BR信号传导上游通路基因调控叶枕近轴面细胞的发育, 进而影响水稻叶夹角的大小。
4 结论s524全生育期均表现叶夹角变大和植株散生, 农艺性状无显著变化。叶枕近轴面细胞变长是导致突变体叶夹角变大的主要原因。该性状受单隐性核基因调控, 定位在第11染色体SSR标记RM4746和RM26742之间约324 kb的物理范围内。s524是LAZY1的新等位突变体, 在第3外显子上产生了一个T到C的碱基替换, 致使第143位氨基酸由野生型的缬氨酸变为了突变体的丙氨酸。s524对BR的敏感性降低, 上游途径基因BU1的表达上调了近10倍, 推测LAZY1/S524可能通过影响BR信号传导通路调控水稻叶夹角的发育。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] |
