
*通讯作者(Corresponding author): 王心宇, E-mail: xywang@njau.edu.cn 收稿日期:2015-04-13 接受日期:2015-07-20网络出版日期:2015-08-28基金:
摘要
关键词:芝麻; 青枯雷尔氏菌; 富含脯氨酸的蛋白; 诱导表达; 亚细胞定位
Cloning and Characterization of a Novel Gene Encoding Proline-Rich Protein in Sesame
LÜ Gao-Qiang, WU Xiang-Yang, WANG Xin-Yu

Fund:
Abstract
Keyword:Sesame ( Sesamum indicum); Ralstonia solanacearum; Proline-rich protein; Induced expression; Subcellular localization
Show Figures
Show Figures












芝麻(Sesamum indicum)属胡麻科(Pedaliaceae)胡麻属(Sesamum Linn), 是世界上重要的优质油料作物之一。芝麻产品具有较高的应用价值, 其种子含油量高达50%~60%, 且富含蛋白质和一些天然抗氧化类物质。我国是世界上4个芝麻主产区(印度、中国、苏丹、缅甸)之一, 芝麻及其产品的市场需求量呈增长趋势, 而由青枯雷尔氏菌引起的芝麻青枯病制约了我国南方芝麻的生产[1]。青枯雷尔氏菌(Ralstonia solanacearum)是一种革兰氏阴性细菌, 其地理分布及寄主范围极为广泛, 可侵染200余种植物, 包括马铃薯、番茄、烟草、香蕉、花生、辣椒、茄子、芝麻等许多经济作物[2]。青枯雷尔氏菌是一种土传细菌, 从根部侵入植物, 进入木质部导管后在维管束系统中大量繁殖并向地上部分扩散, 并产生多糖类物质堵塞导管, 阻碍了水分运输而导致植物萎焉和死亡[3]。由于青枯病的土传特性, 使得该病的防治异常困难, 迄今尚无有效的防治方法。芝麻中还未发现高抗青枯病的种质资源, 开展芝麻-青枯雷尔氏菌互作机制的研究, 阐明病菌致病以及植物感病的机理有助于探索新的抗病育种策略。
植物细胞壁位于植物细胞最外层, 在植物-病原物互作中起非常重要的作用[4]。细胞壁的结构和组成始终处于动态变化中, 不同类型、不同发育阶段的细胞(组织), 以及在生物和非生物胁迫下, 其结构和组分都会相应变化。例如在病原物入侵时, 植物细胞将增加木质素合成来加厚细胞壁, 同时改变细胞壁中结构蛋白的类型或状态进而增加细胞壁的强度[5, 6]。已有研究表明, 细胞壁中结构蛋白的类型及其活性氧介导的交联与植物抗病性关系非常密切[7]。细胞壁中的结构蛋白主要有3类[8]、即富羟脯氨酸糖蛋白(HRGP, 包括富羟脯氨酸凝集素、阿拉伯半乳聚糖及伸展蛋白等)、富脯氨酸蛋白(PRP)和富甘氨酸蛋白(GRP)。HRGP和PRP都富含脯氨酸或羟脯氨酸, 它们在进化上相关, 与植物-病原物互作的关系也非常密切[9]。已有研究表明, 在拟南芥[10]和番茄[11]中过量表达伸展蛋白(extensins)可提高植物的抗病性; 当谷子受病原物侵染时, 细胞壁中的HRGP蛋白含量提高, 显著增加谷子的抗病性[5]; 用真菌激发子处理豌豆或大豆细胞, 发现细胞壁中的一种PRP蛋白发生了活性氧介导的氧化交联, 这种细胞壁中结构蛋白的修饰(变化)属于植物细胞最早期的防卫反应[12]。研究也发现一个豌豆PRP蛋白基因在病原物诱导时表达下调, 推测该蛋白不利于增强细胞壁的强度[13]。在烟草和辣椒中也发现一个HyPRP在抗病中起负调控作用[14]。因此不同物种中编码不同类型PRP蛋白的基因, 其功能存在多样性, 与植物抗病性的关系需做进一步研究。
本文研究芝麻受青枯雷尔氏菌侵染后的基因表达变化, 在芝麻茎部cDNA中发现一个编码富含脯氨酸蛋白的基因(命名为SiPRP, Sesamum indicumProline-rich Protein)受病菌诱导后表达明显下调, Blast分析表明该基因编码蛋白与动植物中已报道的PRP蛋白同源性很低(< 40%), 其氨基酸序列中富含新型的脯氨酸重复基序, 推测其为新型PRP蛋白。亚细胞定位表明该蛋白定位于细胞膜, 推测其在芝麻与青枯雷尔氏菌相互作用中具有重要功能。研究结果将为有效防治芝麻青枯病危害提供基因资源及理论参考。
1 材料与方法1.1 试验材料芝麻品种E1180, 由河南省农业科学研究院芝麻研究中心提供。青枯雷尔氏菌为江西患病芝麻植株上分离得到的菌株。感染青枯病菌的芝麻病株由江西省农业科学研究院饶月亮研究员提供。
1.2 青枯雷尔氏菌的分离及鉴定2013年8月, 于江西采集芝麻发病植株, 剪取3~4段5 cm左右的病症严重的茎部, 经75%酒精消毒、灭菌水冲洗后, 剪去两端可能浸入酒精的部分, 于装有50~100 mL无菌水的广口瓶中静置2 h, 待悬浮液变浑浊。用接种环蘸取适量悬浮液在含有TTC (2, 3, 5-三苯基氯化四氮唑)的TZC平板(含蛋白胨10 g L-1, 酪蛋白水解物1 g L-1, 葡萄糖5 g L-1, 琼脂粉15 g L-1)上画线, 28℃培养3~4 d。致病性强的青枯雷尔氏菌菌落形态呈不规则圆形, 中间显亮红色, 周围为白色且具有流动性。挑取致病性强的菌落再次纯化, 于TZC液体培养基中28℃、180转 min-1振荡培养16 h。加甘油至终浓度40%, 于-70℃保存[1]。
参考Schonfeld等[15]检测方法进行青枯雷尔氏菌分子生物学鉴定。扩增青枯雷尔氏菌编码鞭毛蛋白的基因fliC的部分序列, 引物Rsol-fliC-F和Rsol-fliC- R信息见表1。
参照《分子克隆》[16]进行基因克隆、筛选、质粒提取。由南京金斯瑞生物科技有限公司合成引物和测序。在GenBank数据库(http://www.ncbi.nlm.nih. gov/)中完成序列的Blast同源性分析。
1.3 芝麻接菌、总RNA提取及反转录将保存的青枯雷尔氏菌菌株在含有TTC的TZC培养基上活化, 挑取致病力强的克隆摇菌繁殖, 选取芝麻40 d幼苗采用伤根灌注法[1]接病。
参照RNAiso Plus (TaKaRa, Japan)实验手册提取总RNA及芝麻茎部总RNA。以500 ng总RNA为模板, 用Oligo d(T)引物合成cDNA第1条链。参照Promega反转录酶说明书(Promega, USA)进行反转录。
1.4 RAPD分析随机引物长度为11碱基。PCR扩增体系含10× PCR buffer 2.5 μ L、25 mol L-1 MgCl22 μ L、2.5 mol L-1 dNTPs 2 μ L、10 μ mol L-1随机引物1 μ L、单链cDNA模板20 ng、Taq酶1 U, 加ddH2O至25 μ L。扩增程序为95℃预变性3 min; 然后94℃ 40 s, 37℃ 40 s, 72℃ 90 s 35个循环; 最后72℃ 7 min。PCR产物经1%琼脂糖凝胶电泳检测, 用凝胶成像观察系统(Bio-Rad, USA)照相分析差异条带。
1.5 目的基因克隆与生物信息学分析RAPD分析得到的基因序列在NCBI芝麻WGS (whole-genome shotgun contigs)数据库[Sesamum indicum (taxid:4182)]进行Blast比对, 得到同源基因全长序列。根据该同源序列信息, 利用Primer Premier5设计基因专化引物SiPRP-F和SiPRP-R (表1), 经降落式PCR技术获得基因全长。PCR程序为95℃预变性4 min; 然后以94℃ 40 s, 60℃ 40 s, 72℃ 2 min为一个循环, 每3个循环降低退火温度1℃, 进行30次循环, 最后在退火温度50℃进行5个循环, 共35次循环; 72℃ 7 min。回收扩增产物进行克隆及测序分析。
表1
Table 1
表1(Table 1)
| 表1 本研究所用引物及其序列 Table 1 Sequences of primers used in this study |
采用NCBI (http://www.ncbi.nlm.nih.gov/)的BlastN、BlastP和BlastX进行核酸和氨基酸残基同源序列比对分析。采用SeqHunter1.0、BioXM、DNAMAN等软件进行序列处理、多序列比对、蛋白质翻译及酶切位点分析。利用Predict protein (http://www.predictprotein.org/)和SignalP (http://www.cbs.dtu.dk/services/ SignalP/)分别预测跨膜区、功能位点和信号肽。用ProtParam (http://web.expasy.org/protparam/)进行蛋白质的氨基酸残基组成分析。
1.6 半定量及荧光定量PCR分析1.6.1 内参基因的选择
Wei等[17]研究了芝麻在不同组织和发育阶段以及不同逆境条件一些内参基因的表达, 认为SiDNAJ(DnaJ protein-like)基因在尖孢镰刀菌胁迫下表达较为稳定, 可作为病原物胁迫下的内参基因进行定量PCR分析。本研究比较了芝麻SiDNAJ和翻译延伸因子EF1a基因(JP631636.1)在青枯雷尔氏菌胁迫下的表达, 发现后者的表达更稳定, 故在本研究中选择EF1a作为内参基因进行半定量和实时定量PCR分析。
1.6.2 定量及半定量PCR引物
用于半定量的内参基因引物为SiEF-RT-F/R, 目的基因引物为SiPRP- RT-F/R。用于定量的内参基因引物为SiEF-qRT-F/R, 基因特异引物为SiPRP-qRT-F/R (表1)。
1.6.3 定量PCR试剂、PCR反应程序及分析方法
定量PCR试剂为FastStart Universal SYBR Green Master (Roche, Switzerland)。反应体系含2× SYBR Green Master 10 μ L、10 μ mol L-1上下游引物各1 μ L、50~100 ng cDNA模板、加ddH2O至20 μ L。使用7500 Real-time PCR进行荧光定量PCR, 程序分为3步, 预变性阶段为95℃ 10 min; 循环阶段为95℃ 15 s, 58℃ 15 s, 72℃ 30 s, 40个循环; 熔解曲线分析阶段为95℃ 15 s, 60℃ 1 min, 95℃ 30 s, 60℃ 15 s。反应结束后分析荧光变化曲线和溶解曲线, 采用2-Δ Δ CT法分析, 用SigmaPlot 10.0作柱形图, 用Paswstat分析差异显著性。
1.7 基因的亚细胞定位1.7.1 表达载体构建
烟草瞬时表达载体为pCAMBIA1300s-YFP。以SiPRP-1300F及SiPRP-1300R引物(表1)扩增目的基因, 经纯化后, 参考Vazyme公司ClonExpressII试剂盒说明书通过同源重组的方法将目的基因插入载体BamH I位点, 构建成pCAMBIA 1300s-SiPRP-YFP融合蛋白表达载体, 然后将载体转入农杆菌EHA105菌株, -70℃保存备用。
洋葱瞬时表达载体以PBI-220载体作为骨架构建。将SiPRP-YFP表达框用Hind III/EcoR I从pCAMBIA1300s-SiPRP-YFP载体中酶切, 重组入PBI-220载体, 获得PBI-220-SiPRP-YFP表达载体。以同样的方法构建对照载体PBI-220-YFP。
1.7.2 烟草注射及观察
将保存的菌株在LB固体培养基上画线, 28℃培养2~3 d, 挑取单克隆在含有3 mL LB液体培养基的10 mL管中摇菌, 220转 min-1、28℃振荡培养12 h; 转入含有50 mL LB液体培养基的250 mL锥形瓶内, 220转 min-1、28℃培养至菌液OD600为1.5; 然后转入50 mL离心管, 2600× g离心5 min, 弃上清液后用20 mL 10 mmol L-1 MgCl2重新悬浮沉淀, 2600× g离心5 min, 丢弃上清液用10 mmol L-1 MgCl2再次悬浮, 2600× g离心5 min, 用10 mmol L-1 MgCl2重新悬浮, 将悬浮液OD600值调至0.6~0.8, 28℃保存备用。
注射所用烟草品种为本氏烟, 选用30~40 d生长状况良好的幼苗。先用针头在叶片扎个小孔, 然后用1 mL无针头的注射器在针孔处注射。注射完成后24~72 h, 使用激光共聚焦显微镜(TCS SP2, Leica)观察照相, 分析SiPRP-YFP的表达定位。
1.7.3 洋葱瞬时表达方法 采用基因枪法将表达载体引入洋葱表皮细胞, 具体方法参见BIO-RAD公司生产的基因枪(型号PDS-1000/He)说明手册。轰击后的洋葱内表皮于16 h后用激光共聚焦显微镜(TCS SP2, Leica)观察照相。
2 结果与分析2.1 芝麻受青枯雷尔氏菌侵染前后差异表达基因的筛选及克隆利用RAPD (randomly amplified polymorphic DNA)方法分析芝麻受青枯雷尔氏菌诱导前(CK)和诱导后(Induction)的基因表达差异。为提高稳定性, 采用长度为11 bp的随机引物, 共筛选50条随机引物。对诱导前后扩增产物有差异的引物进行重复验证, 发现随机引物G53 (序列为5° -TGGTGGCGTT G-3° )在对照中可以扩增出分子量约350 bp条带(图1), 而在病菌诱导的样品中无扩增产物或存在很弱的条带。
将分子量为350 bp的差异条带进行回收、克隆及测序, 序列信息在芝麻基因组数据库中进行比对分析, 得到一段同源性很高DNA序列。该序列含一个连续的开放阅读框(open reading frame, ORF), 无内含子。根据该ORF侧翼序列设计基因特异引物SiPRP-F和SiPRP-R, 在芝麻cDNA中扩增验证。序列分析表明该基因ORF长1458 bp (图2), 编码486个氨基酸残基, 其N端富含脯氨酸, 因此将其命名为SiPRP(Sesamum indicumproline-rich protein)。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 引物G53在RAPD分析中的扩增结果 前3个泳道为对照, 后3个泳道分别为诱导5~7 d的样品。Fig. 1 RAPD results amplified with primer G53 The three-lane Samples are controls (CKs), the samples from 5 to 7 days are treatments. |
2.2 SiPRP蛋白生物信息学及特征分析Signal IP 4.0分析结果表明SiPRP蛋白N端前19个氨基酸残基为信号肽, 剪切位点在氨基酸序列第19位A和第20位S之间(图2); 去掉预测的信号肽后, 利用ProtParam分析SiPRP蛋白的氨基酸残基, 序列显示, 其分子量为48.4912 kD, 理论等电点为10.10, 富含Pro (24.8%), Ala (11.1%), Ser (10.9%); 包含53个碱性氨基酸残基, 28个酸性氨基酸残基; 平均亲水系数(grand average of hydropathicity, GRAVY)为-0.703。
SiPRP蛋白中脯氨酸残基含量很高, 且主要分布在N端, 属富含脯氨酸的蛋白质(proline-rich protein, PRP)。动植物中已发现含2个结构域(图3-A)和3个结构域(图3-B)的PRPs蛋白。结构域分析表明SiPRP蛋白含3个结构域(图3-C), 分别为信号肽结构域(1~19位氨基酸残基)、N端富含脯氨酸结构域(20~257位氨基酸残基)和C端结构域(258~486位氨基酸残基), 但其C端结构域不含半胱氨酸残基。在SiPRP的N端富含脯氨酸结构域中包含的基序有3个八肽(或十肽) PTPAPA(PA)PP、3个六肽(PVAPPA)、2个七肽(PQPSPSR), 以及3个PPPP和1个PPPPP (图2), 分析发现这些基序与植物中已报道的PRPs中的基序有所不同。另外, 在N端富含脯氨酸结构域的238个氨基酸残基中含有98个脯氨酸残基, 所占比率为41.2%。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 芝麻SiPRP基因编码区及推测的氨基酸序列 箭头所示位置为预测信号肽的剪切位点; 同一种下画线表示同一类型富含脯氨酸的重复基序。Fig. 2 Coding region and putative amino acid sequence of SiPRP The arrow indicates the predicted cleavage site for the signal peptide. The different types of underlines represent the related repeat motifs containing proline-rich sequences. |
Blast (NCBI)结果表明, 与SiPRP同源的蛋白其氨基酸序列一致性(identity)较低, 且大多为推测的PRP蛋白。例如, SiPRP与芝麻中一个伸展蛋白(XP_ 011093095.1)的一致性为47%, 与其他物种中推测的PRP蛋白的一致性分别为蓖麻(XP_002533331.1) 36%、棉花(KJB41597.1) 37%、马铃薯(XP_006361533.1) 37%、番茄(XP_004245212.1) 38%、可可(XP_00705 1472.1) 35%。在Pfam网站(http://pfam.xfam.org/)进行蛋白家族分析未能找到SiPRP所属的蛋白家族; 在Phytozome (http://phytozome.jgi.doe.gov/)网站进行Blast比对亦未能在已测序的植物物种中找到同源基因。根据上述分析结果, 推测SiPRP属于新型PRP蛋白。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 PRP蛋白的基本结构 A: 典型的PRP蛋白, 包含2个结构域; B: 杂合PRP蛋白, 包含3个结构域; C: C端无半胱氨酸的PRP蛋白的基本结构。Fig. 3 Domain organization of proline-rich proteins A: typical PRPs are composed of two domains; B: hybrid proline-rich proteins (HyPRP) are composed of three main domains; C: structure of HyPRP like proteins which lack cysteine residues at the C terminus. |
2.3SiPRP基因在受青枯雷尔氏菌诱导前后的表达分析
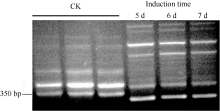
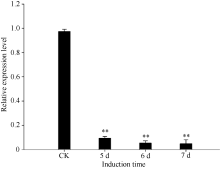
RAPD研究结果表明SiPRP在青枯雷尔氏菌诱导后表达量显著降低。为进一步验证其表达特征, 设计该基因专化的引物进行基因诱导表达的半定量(图4)和实时荧光定量PCR分析(图5), 结果与RAPD分析结果一致。qPCR分析显示, 受青枯雷尔氏菌诱导后, 芝麻SiPRP基因表达量显著降低。与对照相比, 其表达量降低了8~9倍。
2.4 SiPRP蛋白的亚细胞定位蛋白的亚细胞定位与其功能关系密切。为确定本研究克隆的SiPRP蛋白的亚细胞定位, 在洋葱表皮及烟草表皮细胞中瞬时表达了SiPRP-YFP融合蛋白。如图6所示, SiPRP-YFP融合蛋白在质壁分离的洋葱表皮细胞(图6-B)中主要分布在细胞膜上。随着表达时间延长, 可以观察到少部分蛋白分泌到胞外(图6-C)。烟草瞬时表达结果表明, SiPRP主要分布定位于两相邻细胞的特殊结构内, 该结构可能是细胞膜上的特殊通道, 也可能是一种正在分泌的囊泡(图7-A, C)。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 半定量PCR分析芝麻SiPRP基因受病菌诱导后的表达Fig. 4 Expression of sesame SiPRP after induction (5, 6, and 7 days) by Ralstonia solanacearum analyzed by semi-quantitative RT-PCR |
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 定量PCR分析芝麻受青枯菌诱导前后SiPRP基因的表达Fig. 5 Expression of sesame SiPRP before (CK) and after induction (5, 6, and 7 days) by Ralstonia solanacearum analyzed by quantitative RT-PCR * * shows the significant difference (P< 0.01) |
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 SiPRP在洋葱表皮细胞中的定位 A: YFP空载体对照; B: 质壁分离后SiPRP的定位; C: SiPRP后期表达定位。Fig. 6 Subcellular localization of SiPRP protein in onion epidermal cells A: YFP empty vector as control; B: subcellular localization of SiPRPprotein in cells after plasmolysis; C: subcellular localization of SiPRP protein at later stage. |
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 SiPRP蛋白在烟草表皮细胞中的定位 CK: YFP空载体对照; A、B和C: SiPRP-YFP融合蛋白在烟草表皮细胞中的定位, 红色信号是叶绿体自发荧光Fig. 7 Subcellular localization of SiPRP protein in tobacco epidermal cells CK: YFP empty vector was used as a control; A, B, C: subcellular localization of SiPRP-YFP fusion protein. Red signal is the chloroplast autofluorescence. 。 |
3 讨论PRP蛋白广泛存在于真核及原核生物[18], 植物中亦发现大量PRP蛋白[19, 20]。Jose和Puigdomenech[21]将PRP分为3个亚类: a. 整个蛋白质富含Pro-rich的重复序列, 但缺少半胱氨酸; b. 不含Pro-rich的重复序列, 只含小的Pro基序; c. HyPRP-Hybrid PRPs。不同植物中发现的PRP, 其重复序列有所不同。本研究在芝麻茎cDNA中分离了一个受青枯雷尔氏菌诱导后表达明显下调的基因SiPRP, 对该基因编码蛋白的氨基酸序列分析表明, SiPRP与上述三类PRP的共同之处是富含脯氨酸, 然而SiPRP无法归为这3类中的任何一类。SiPRP蛋白含有信号肽序列, 这与前人报道的大部分PRP相同, 具有锚定蛋白质或分泌蛋白质的作用; 富含脯氨酸的重复单元大部分都集中在N端, 包含PTPAPA(PA)PP、PVAPPA和PQPSPSR等重复序列, 以及一些P的连续序列, 如PPP、PPPP等, 且这些P连续序列周围, PA两种氨基酸残基出现的频率很高。这些富含脯氨酸的重复序列与已发现的植物PRP中存在的重复单元不同[22]; C端结构域中缺少半胱氨酸和重复序列, 且脯氨酸含量也相对较少。Blast分析表明SiPRP与其他植物中PRP的同源性均低于40%, 基因家族研究发现无法对SiPRP归类, 推测SiPRP属于新型的植物PRP蛋白。
植物中PRP基因的表达通常受伤害、真菌、乙烯、干旱和光照等环境影响, 很多PRP都表现为上调[23, 24, 25], 少数呈下调表达。Jose-Estanyol等[26]研究发现, ABA诱导玉米后, ZmHyPRP基因表达下调; 菜豆PvPRP1基因的mRNA在真菌激发子(Elicitor)处理后含量也迅速减少, 研究发现其含量减少的原因是在其mRNA 3° 端非编码区存在一个U-rich序列, 该序列包含27个核苷酸(AUCUUAAUAUUUAUGUGUUUU CCGUUU), U的含量占60%, 它可以促进mRNA 3° 端非编码区与一个50 kD的蛋白结合, 进而导致mRNA降解, 其含量下降, 而mRNA的转录效率并未发生变化[27]。进一步验证发现3° 端ploy(U)含量越高, mRNA越容易受到调控; ploy(A-U)效率明显低于ploy(U), 而ploy(A)、ploy(G)以及ploy(C)不受调控。在本研究中, 通过RAPD、半定量RT-PCR以及qRT-PCR结果综合分析, SiPRP基因受青枯雷尔氏菌诱导后在芝麻茎中的表达显著下降。SiPRP基因3° 端的序列特征分析表明, 在SiPRP终止密码子后的300 bp核苷酸序列中A+T占62%; 将PvPRP1基因mRNA的27个U-rich核苷酸序列与这300 bp序列比对得到一段同源性较高的序列(5′ -AAGTTATGGATTCTGA TTCTTCAATTT-3′ ), 该序列T含量占48%, A+T占74%, 推测这段序列可能与SiPRP受青枯雷尔氏菌诱导下调有关, 需做进一步分析。Corbin等[6]发现, 大豆细胞壁中富含脯氨酸的蛋白Hyp2.11受真菌激发子诱导下调, 而其同一个家族的Hyp2.13、Hyp3.6及Hyp4.1则病菌诱导后上调表达, 分析发现上调的3个蛋白中酪氨酸含量很高, 介于12%~17%之间, 而Hyp2.11中酪氨酸含量很低。有研究表明蛋白质内的酪氨酸之间可交联形成异二酪氨酸(Isodityrosine)而增加细胞壁的强度[28], 故Sugar等[29]认为Hyp2.11酪氨酸含量低, 不能交联形成异二酪氨酸, 所以细胞在应对胁迫时, 减少了Hyp2.11的表达量。分析SiPRP的486个氨基酸残基, 只有4个酪氨酸残基, 占氨基酸总量的0.8%。因此推测SiPRP中的低酪氨酸含量与芝麻受菌诱导后降低SiPRP表达量有关。
植物体内发现的富含脯氨酸的蛋白大多是细胞壁结构蛋白, 如在大豆中发现的SbPRP1、SbPRP2及SbPRP3[30], 它们在不同的植物器官中表达量不同, 与植物发育相关; 烟草细胞壁蛋白CELP[31]家族成员在花中特异表达, 可能在胚珠和花粉管的发育中起作用; 烟草中另一个富含脯氨酸的蛋白NtProPR1, 不仅定位在细胞壁, 还可分泌到细胞外基质, 该基因参与调控花粉管的生长以及胚珠的生成, 将其沉默后花粉管和胚珠的生长受阻, 推测是花粉管生长过程中的胁迫响应因子[32]。少数富含脯氨酸的蛋白定位在细胞壁以外的其它结构中。Li等[33]发现定位于质膜的PRP蛋白(DOUBLE HYBRID PROLINE- RICH PROTEIN 1), 在拟南芥系统获得性抗性过程中发挥正调控作用; 棉花纤维特异表达基因GhPRP5编码蛋白最初被认为是细胞壁蛋白, 后来证明定位于细胞膜, 在棉花纤维的生长中起负调控作用。将其沉默后, 可促进棉花纤维的生长[34]。玉米ZmHyPRP则定位于囊泡内膜, 在植物有性繁殖中起重要作用, 参与调节花粉管的生长和胚胎早期发育[26]。本研究中, 洋葱表皮亚细胞定位实验结果表明, SiPRP主要定位于细胞膜, 但在表达后期可观察到有少量蛋白分泌到胞外。烟草亚细胞定位进一步证明SiPRP1-YFP定位于细胞膜, 但表达后期其定位发生了变化, SiPRP蛋白呈颗粒状分散或聚集在两细胞之间, 推测其可能定位在细胞膜上某种特殊的结构上, 其确切的定位特征需做进一步研究。
尽管20世纪80年代已在植物中发现PRP蛋白, 但研究清楚其功能的基因还为数不多。富含脯氨酸的蛋白最早在胡萝卜贮藏根中发现[35], 认为是外界伤害诱导的基因产物。后来的研究显示, 在双子叶植物和单子叶植物中都广泛存在PRP[18], 它们参与植物生长发育的不同方面。如烟草中的NtProRP1[32]和玉米中的ZmHyPRP[26]在植物有性繁殖中起重要作用, 参与调节花粉管的生长, 在花粉管生长和胚胎发育早期起重要作用。水稻OsPRP基因参与调控花的细胞外基质构成, 而过表达后可增强植物的抗寒性[36]。拟南芥中的SIC基因[37]与microRNA产生及内含子的剪切后降解有关, 同时SIC的突变体对冷胁迫和盐胁迫表现出更高的敏感性。拟南芥的另一个基因AtPRP1编码蛋白定位于根部生毛细胞的细胞壁, 与细胞的伸长有关, 过表达后有助于根毛的伸长[38]。综上所述, 植物PRP在进化过程中发生了较大的分化, 呈现功能的多样性。每一个 PRP均需在具体条件下揭示其功能特征。芝麻中尚未见有关PRP功能的报道, 本研究报道了一个受青枯雷尔氏菌诱导下调的芝麻富含脯氨酸新基因SiPRP, 其在青枯雷尔氏菌-芝麻互作过程中的功能将通过转基因及基因敲除等方法做进一步研究。
4 结论从芝麻中分离出一个受青枯雷尔氏菌诱导下调的编码富含脯氨酸蛋白的基因SiPRP。该基因编码蛋白含486个氨基酸残基, 分为信号肽结构域, N端富含脯氨酸的结构域以及C端结构域, 脯氨酸含量占24.8%。SiPRP表达受青枯雷尔氏菌诱导显著下调。SiPRP与植物中已发现的富含脯氨酸蛋白同源性很低, 主要定位于细胞膜, 后期可以分泌到细胞外。推测SiPRP属于新型PRP蛋白, 在病原菌与植物的互作中行使重要功能。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] | |
| [33] | |
| [34] | |
| [35] | |
| [36] | |
| [37] | |
| [38] |
