 , 孟庆林
, 孟庆林
* 通讯作者(Corresponding authors): 王志英, E-mail: zyw0451@sohu.com, Tel: 13069873855; 张匀华, E-mail: yhzhang9603@126.com, Tel: 13603639603 第一作者联系方式: E-mail: maligong0@163.com, Tel: 13644577229
收稿日期:2015-04-20 接受日期:2015-07-20网络出版日期:2015-08-11基金:
摘要
关键词:向日葵; 病程相关蛋白1; 基因克隆; 功能分析
Cloning and Function Analysis of Pathogenesis Related Protein Gene HaPR1 from Sunflower ( Helianthus annuus)
MA Li-Gong
 , MENG Qing-Lin
, MENG Qing-Lin
Fund:
Abstract
Keyword: Helianthus annuus; Pathogenesis-related protein 1; Gene clone; Function analysis
Show Figures
Show Figures














向日葵(Helianthus annuus)是我国重要的经济和油料作物, 在生长发育过程中易受核盘菌、盐碱、干旱等病原生物和环境因素的危害, 严重影响向日葵的品质和产量, 所以研究向日葵抗逆和胁迫机制及分离鉴定防卫相关基因对向日葵抗逆分子育种具有重要意义。
病程相关蛋白(pathogenesis-related proteins, PRs)是植物受逆境胁迫后产生的一类蛋白质的总称[1], 在植物防卫体系中具有重要作用。这些蛋白能通过细胞壁加厚、抗菌活性、信号转导等方式参与植物抗病反应[2]。根据其结构、生物活性等特性主要分为个17个亚类[3], 其中PR1家族基因含量最为丰富, 并且高度保守, 参与多种生物和非生物胁迫的响应, 被认为是植物系统获得性抗性(systemic acquired resistance, SAR)的标志基因[4, 5]。在模式植物中外源SA能够引起植物产生SAR并诱导PR1基因的表达[6, 7]。有****研究发现某些植物PR1基因对病原菌表现出了一定的抗性。Alexander等[8]将PR1-a基因转入烟草发现, PR1基因以组成型高效表达的方式增强了对疫霉属和斜尖状孢子菌属的抗性; Niki等[9]将PR1基因转入拟南芥过量表达增强了对油菜霜霉病毒的抗性, 且发现该基因的诱导表达与水杨酸的积累密切相关; Sarowar等[10]将辣椒PR1蛋白基因转入烟草, 该基因过量表达后不仅增强了对重金属胁迫的抗性, 也增强了对烟草黑胫病菌和野火病菌等多种病原菌的抗性。植物PR1蛋白基因是多基因家族, 但不是所有PR1基因都具有抗病功能。Li等[11]研究发现, 葡萄中只有碱性蛋白VvPR1b1基因对烟草野火病菌有抗病功能; Bonasera等[12]将PR-1a、PR-1b和PR-1c转入苹果后, 发现苹果幼苗没有表现出抗病功能。PR蛋白基因除抗病功能外, 在植物正常生长、非生物逆境胁迫、抗衰老和激素诱导等机制中也发挥着重要作用。Seo等[13]研究发现, 干旱胁迫下, 拟南芥的PR1、PR2和PR5转录水平明显提高。盐胁迫下, 烟草的PR-5c受诱导表达[14]。Agrawal等[15, 16]和Livak等[17]研究发现, 水稻OsPR1a和OsPR1b基因不仅受茉莉酸(JA)、水杨酸(SA)、过氧化氢(H2O2)、蛋白酶抑制剂斑蝥素(CN)和稻瘟病菌(Magnaporthe grisea)的诱导, 还对光、伤害及磷酸酶抑制剂等化学和环境胁迫作出反应。
在前期工作中, 本课题通过高通量测序方法从核盘菌诱导向日葵转录组文库中分离了一个受核盘菌诱导上调表达的向日葵病程相关蛋白1基因HaPR1。本研究拟从向日葵中克隆完整编码区的HaPR1基因的cDNA, 通过时空表达特性分析, 遗传转化烟草及检测转基因烟草的抗病性和防御酶活性, 进一步明确HaPR1基因的功能, 为向日葵抗病育种应用奠定基础。
1 材料与方法1.1 试验材料1.1.1 植物材料及处理
以龙食葵2号为材料, 选取饱满、一致的种子, 用1%次NaClO3浸泡10 min并用无菌水冲洗5~6次后放入发芽盒28℃催芽, 3 d后将生根的芽放入Hogland营养液于光照培养箱中培养, 条件为25℃/18℃(昼/夜), 光照时间14 h, 光照强度600 μ mol m-2 s-1。对培养至四叶期的向日葵幼苗进行胁迫试验。(1)核盘菌诱导处理。取长满核盘菌菌丝的PDA菌碟接种到幼苗第2片真叶上, 每株接1块菌碟, 保湿培养。(2)核盘菌代谢产物和草酸诱导处理。将核盘菌代谢产物和100 mmol L-1草酸分别均匀喷洒在叶片上, 每株5 mL。将PDA培养基上生长7 d的核盘菌接种到PDA液体培养基中, 25℃振荡培养15 d, 用纱布过滤菌丝即得核盘菌代谢产物, 置4℃备用。(3)干旱和盐胁迫处理: 将向日葵幼苗的根分别放入15% PEG-6000和150 mmol L-1 NaCl的溶液中处理。以上各胁迫处理后0、6、12、24和48 h分别剪取叶片和根约0.2 g, 置-80℃备用。组织特异性表达分析所用的各个组织材料取自黑龙江省农业科学院植保所大田种植的龙食葵2号。
1.1.2 菌种、质粒及试剂
核盘菌[Sclerotinia sclerotiorum (Lib)de Bary]、大肠杆菌Escherichia coliTOP10和植物表达载体pROK2由本实验室保存。植物RNA提取试剂盒TRIzol购自Invitrogen公司。Taq聚合酶、DNaseI、反转录试剂盒购自宝生物工程有限公司; 胶回收、质粒提取、酶切产物回收试剂盒均购自Omega公司; 草酸, 氯化钠、PEG-6000、乙酸钠、氯仿、异丙醇、无水乙醇等生化试剂均为国产分析纯试剂。
1.2 HaPR1全长cDNA的克隆与序列分析根据对本实验室已完成的核盘菌诱导向日葵转录组cDNA文库分析, 发现一个Unigene序列在核盘菌诱导后变化较大, 该基因功能注释(Nr-annotation)为病程相关蛋白1 (pathogenesis-related protein 1), 根据此序列设计克隆该基因全长特异引物HaPR1F1和HaPR1R1 (表1)。采用Invitrogen公司植物RNA试剂盒提取核盘菌诱导向日葵叶片的总RNA, 参照宝生物公司反转录试剂盒说明书合成RNA并反转录成cDNA。然后以cDNA为模板进行PCR扩增。PCR扩增程序为94℃ 5 min; 94℃ 30 s, 57℃ 30 s, 72℃ 1 min, 35个循环。72℃ 7 min, 4℃ 15 min。将PCR扩增目的条带回收纯化后与pMD18-T载体连接并转化到大肠杆菌TOP10, 挑取阳性克隆、提取质粒, 送上海生工生物工程公司测序。
1.3 生物信息学分析对该cDNA序列及其编码蛋白进行生物信息学分析, 包括利用ORF (open reading frame finder, ORF)查找该基因开放读码框; 用ProtParam (http://www. expasy.ch/tools/protparam.html)网站分析编码蛋白的基本理化性质; 使用PSORT (http://psort.hgc.jp/form. html)、MitoProt (http://ihg.gsf.de/ihg/mitoprot.html)在线软件对蛋白进行亚细胞定位预测; 用BlastP预测保守区, 蛋白家族; SignalP (http://www.cbs.dtu. dk/services/SignalP)分析其信号肽序列; 通过(http:// www.ebi.ac.uk/Tools/pfa/iprscan/)网站分析蛋白保守结构域; 选取相似性高的序列用CLUSTAL 2.1进行多序列比对; 用MEGA5.1构建系统发育树, 设Bootstrap值为1000。
1.4 HaPR1基因表达模式分析在向日葵开花后期采集同一植株的根、茎、叶、种子、盘和花组织并提取RNA; 分别提取核盘菌、代谢产物、草酸、PEG-6000和NaCl处理后向日葵叶和根的RNA。取1 μ g以各处理提取的RNA反转录合成cDNA后稀释100倍作为qRT-PCR分析的模板; 利用Primer5.0软件设计HaPR1基因的荧光定量PCR引物HaPR1F2和HaPR1R2、内参基因actin的引物actin-F1和actin-F1 (表1)。荧光定量PCR扩增程序为, 94℃预变性3 min; 94℃变性5 s, 57℃退火1 min, 72℃延伸30 s后测定荧光值, 40个循环, 最后计算溶解曲线。每个处理3次重复。采用相对定量法, 对所得数据以2-Δ Δ Ct法[18]计算不同胁迫条件下HaPR1基因相对于内参基因的表达倍数变化趋势。
表1
Table 1
表1(Table 1)
| 表1 试验使用的引物 Table 1 Primer used in this study |
1.5 植物表达载体构建及转化烟草以向日葵叶cDNA为模板, 用HaPR1F3和HaPR1R3引物(表1)进行PCR扩增, 回收的片段与pMD18-T Vocter载体连接, 构建pMD-HaPR1。用Xba I和Kpn I双酶切重组质粒pGM-HaPR1和植物表达载体pROK2质粒, 通过T4连接酶将获得目标基因片段和载体大片段连接, 然后将重组载体转化到大肠杆菌TOP10感受态细胞。筛选出阳性的转化子, 并命名为pROK2-HaPR1。用冻融法将以上重组质粒转化根癌农杆菌EHA105, 挑取阳性克隆进行PCR鉴定。通过叶盘法将含有质粒pROK2-HaPR1转化无菌的烟草苗。提取转化烟草的DNA进行PCR鉴定, 提取RNA反转录成cDNA进行RT-PCR鉴定, 组培扩繁鉴定成功的转HaPR1基因的烟草无菌苗叶片。
1.6 转基因烟草的抗病性及防御酶活性测定取生长2个月且长势一致的野生型和转HaPR1基因过量表达的烟草株系鉴定抗病性。用核盘菌PDA菌碟接种叶片后保湿培养, 处理后0、24和48 h分别剪取叶片进行防御酶活性测定。采用氮蓝四唑(NBT)光还原法[19]测定超氧化物歧化酶(SOD)活性; 采用愈伤木酚法[20]测定过氧化物酶(POD)活性; 采用分光光度法[21] 测定过氧化氢酶(CAT)活性; 采用TBA反应法[22]测定丙二醛含量。以上试验每处理3次重复。用SPSS.11.0软件统计分析。
2 结果与分析2.1HaPR1全长cDNA的获得与序列分析
通过对核盘菌诱导向日葵转录组数据分析, 获得一个功能注释为病程相关蛋白1基因的全长unigene序列。为确认该序列的准确性, 根据其两端非编码区设计特异引物, 以向日葵叶总RNA的逆转录产物cDNA为模板, 进行PCR扩增, 获得1条约600 bp的cDNA特异扩增条带。对重新测序获得的HaPR1基因cDNA序列的ORF finder分析表明该基因的开放阅读框(ORF)长489 bp, 编码162个氨基酸, GenBank登录号为KR071874。
ProtParam预测该基因编码蛋白分子量约为17.52 kD, 理论等电点为8.19, 为碱性蛋白。携带负电荷的氨基酸(Asp+Glu)的总数目为6, 正电荷(Arg+Lys)的数目为8。该蛋白分子式为C761H1139N223O235S11, 原子总数2369, 为稳定蛋白。信号肽预测表明HaPR1蛋白的第1~第25个氨基酸为信号肽序列, 具有6个保守的半胱氨酸结构基序列, 含有4个保守的allergen V5/Tpx-1 related结构域(图1)。BlastP分析该蛋白具有完整的SCP超家族保守结构域, 属于PR1-like蛋白。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 HaPR1与其他植物PR1蛋白氨基酸序列同源性比较Fig. 1 Alignment of full-length amino acid residues among |
BlastP序列比对后发现HaPR1与多条蛋白质序列有不同程度的相似, 选择与向日葵HaPR1相似程度高的10种其他植物PR1蛋白进行多序列比对发现, HaPR1蛋白与其他物种PR1蛋白的氨基酸序列的一致性为58.39%~66.46%, 信号肽间的相似性较低, 而成熟肽之间的相似性较高(62.77%~72.46%)。系统进化树分析表明, 向日葵PR1蛋白与咖啡Coffea canephora(AGK89727)和茶树Camellia sinensis(AHA56682)的进化关系最近, 属于同一个分支(图2)。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 不同植物PR1蛋白的系统进化分析 黑点表示从向日葵中克隆的HaPR1氨基酸序列。Fig. 2 Phylogenetic analysis of PR1 from different plant species Black dot stands for HaPR1 amino acid sequences from H. annuus. |
2.2HaPR1在向日葵不同组织表达特性分析
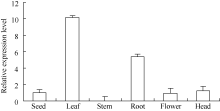
在向日葵开花后期, 取同一植株的根、茎、叶、花、盘和种子, 提取RNA并逆转录为cDNA进行不同组织表达特性分析。设种子中的HaPR1基因表达量为1, 比较分析HaPR1基因在向日葵不同器官中的表达特性。实时荧光定量PCR分析表明, HaPR1基因在向日葵叶中表达量最高, 其次是根、盘、种和花, 在茎中的表达量最低(图3)。其中, 在叶中表达水平分别是根、盘、种、花和茎的1.90、8.13、10.13、10.67和634.55倍。
2.3HaPR1在生物和非生物胁迫条件的表达
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 qRT-PCR分析向日葵不同器官中HaPR1基因的表达Fig. 3 Expression of HaPR1 gene in various sunflower organs by qRT-PCR |
取各种胁迫处理后的向日葵叶片和根提取RNA, 进行实时荧光定量PCR分析表明(图4), 当向日葵叶片受到核盘菌诱导时, HaPR1基因的表达量随着胁迫时间的延长呈现先升高后降低的趋势, HaPR1基因的表达量12 h达到最高, 此后随着时间的延长, 表达水平逐渐降低, 12 h表达量为对照的4.07倍。当向日葵叶片受到核盘菌代谢物诱导时, HaPR1基因的表达量24 h达到最高, 24 h表达量为对照的7.75倍。当向日葵叶片受草酸胁迫时, HaPR1基因表达量随着胁迫时间的延长逐渐升高, 于24 h达到最高, 为对照的14.52倍, 此后随时间延长, 表达量下降。当向日葵根受到盐(NaCl)和干旱(PEG-6000)胁迫时, HaPR1基因表达量均随着胁迫时间的延长逐渐升高, 12 h达到最高, 分别是对照的1.82倍和1.64倍, 此后随时间延长, 表达量逐渐下降。由此可以看出, 干旱、盐、草酸、核盘菌及其代谢物均能诱导向日葵HaPR1的表达, 其中草酸、核盘菌及其代谢物均显著诱导叶片HaPR1基因的上调表达, 表达量较对照提高4.07~14.52倍, 而盐(NaCl)和干旱(PEG- 6000)胁迫时, HaPR1表达量较对照提高1.64~1.82倍(图4)。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 以qRT-PCR分析生物和非生物胁迫处理对HaPR1表达的影响 设0 h的表达量为1, 数据为3次独立试验的平均值± 标准误不同字母表示差异显著(P < 0.05)。Fig. 4 Effect of biotic and abiotic stresses on HaPR1expression by qRT-PCR The 0 h expression level is assigned a value of 1. Values are the mean ± SE of three biological replicates. Bars with different letters show significant difference at P< 0.05. |
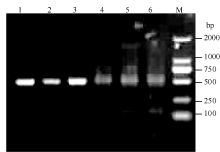
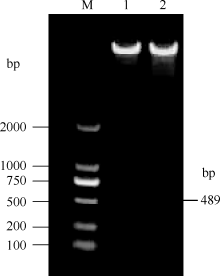
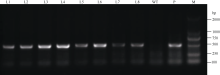
2.4 植物表达载体构建及转基因烟草的获得将pROK2质粒和目的基因的双酶切产物连接, 转入大肠杆菌TOP10感受态中, 涂布于含有卡那霉素的LB培养平板上, 37℃培养16 h, 长出转化菌TOP10-pROK2-HaPR1, 随机挑取单菌落进行菌液PCR检测, 电泳结果如图5; 将菌液PCR检测为阳性的转化子提取质粒, 用Xba I和Kpn I限制性内切酶进行双酶切鉴定, 电泳结果如图6。由此可知, HaPR1基因成功整合到植物表达载体当中。然后用叶盘法将HaPR1转化烟草, 通过抗性筛选, 获得具有卡那霉素抗性的烟草, 提取转HaPR1基因烟草的RNA, 反转录成cDNA, 进行RT-PCR鉴定, 结果表明获得了能够正常转录的转基因植株(图7)。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 HaPR1转化大肠杆菌的菌液PCR检测 M: DL2000; 1~6: TOP10-pROK2-HaPR1菌液PCR产物。Fig. 5 Bacteria liquid PCR identification of HaPR1 transformed to Escherichia coli M: DL2000; 1-6: Product of colonial PCR of TOP10-pROK2-HaPR1. |
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 重组质粒pROK2-HaPR1酶切鉴定 M: DL2000; 1, 2: 重组质粒pROK2-HaPR1。Fig. 6 Identification of recombinant plasmid pROK2-HaPR1 by restriction enzyme M: DL2000; 1, 2: pROK2-HaPR1. |
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 转基因烟草RT-PCR检测 M: DL2000; L1~L8: 转基因烟草株系; WT: 非转基因烟草株系; P: 阳性对照。Fig. 7 RT-PCR identification of transgenic tobacco plants M: DL2000; L1-L8: Transgenic lines; WT: non-transgenic line; P: positive plamid. |
2.5 转基因烟草抗病性及防御酶活性测定对8株转HaPR1基因烟草进行了抗菌核病测定, 其中有2株(L3和L5)表现较好的抗病性, 叶面不发病或与菌碟交界处只出现少量小斑点, 而野生型烟草则出现明显的病斑(图8)。为了明确转基因烟草叶片的抗病机制, 对L3和L5进行了防御酶活性测定, 结果表明(图9), 在接种核盘菌前, 转基因烟草叶片(L3和L5)中POD和CAT活性显著高于对照(WT), 当接种核盘菌后, 转基因烟草的CAT活性随时间的延长逐渐升高, 而对照烟草则显著下降; 转基因烟草和对照烟草叶片的POD活性均随时间延长逐渐下降, 但转基因烟草POD活性下降速度显著快于对照; 在未接核盘菌前, 转基因烟草和对照烟草叶片的SOD活性无显著差异, 当接种核盘菌后, 转基因烟草和对照烟草的SOD活性12 h后逐渐升高, 24 h达到最高, 48 h后逐渐降低, 但在核盘菌侵染过程中, 转基因烟草SOD活性显著高于对照; 在接种核盘菌前以及接菌后, 转基因烟草叶片中MDA含量显著低于对照(图9)。以上结果表明, 烟草中导入的HaPR1基因通过提高与抗性相关的酶(SOD、POD和CAT)活性和降低植物体内MDA含量来提高对核盘菌的抗病性。
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 转基因烟草(L3和L5)和非转基因烟草(WT)接种核盘菌48 h后叶片症状Fig. 8 Symptom of transgenic tobacco (L3 and L5) and nontransgenic tobacco (WT) at 48 hours after inoculation |
图9
Fig. 9
| Figure OptionViewDownloadNew Window | |
 | 图9 核盘菌对转基因烟草防御酶活性及丙二醛含量的影响 数据为3次独立处理试验的平均值± 标准误, 不同字母表示差异显著(P < 0.05)。Fig. 9 Defense enzyme activity and MDA content in transgenic tobacco treated by S. sclerotiorum Values are the mean ± SE of three biological replicates. Bars with different letters show significant difference at P< 0.05. |
3 讨论目前, 研究发现PRs基因家族中的PR1基因在多种植物中能被病原菌、生物因素和非生物因素诱导, 通常被认为是植物系统获得抗性的标记基因。本试验以向日葵龙食葵2号为材料, 克隆得到了HaPR1基因cDNA全长序列。生物信息学分析表明, 该基因的氨基酸序列与其他植物的PR1基因具有高度同源性, 长度也基本相似, 成熟肽序列与其他植物有很高的相似性, 但信号肽序列构成上有较大差异。该基因C端含有典型的SCP_PR1_like结构域, 说明PR1基因在不同植物中具有一定的保守性。前人研究表明, 碱性PR1蛋白具有更高的抗真菌活性。本研究中HaPR1蛋白预测理论等电点为8.19, 属于碱性蛋白, 理论上具有较强的抑菌活性, 但由于不同植物的PR1基因的功能存在较大差异, 仅从氨基酸序列和结构推测其功能是不可靠的, 对此需要进一步的研究和验证。
研究表明, 许多PR基因在植物不同组织及不同生育期表达存在差异, 例如水稻JIOsPR10基因在根、茎、花中表达, 而在叶中不表达[23]; 湖北海棠MhPR8基因在根中的表达量最大, 其次是茎, 在叶片中的表达最低[24]; 小麦TaLr35PR2基因在叶中表达量最高, 其次是茎, 在根中不表达[25]。这种组织特异性表达不仅说明PR基因参与了不同类型的免疫反应, 也表明该基因在植物正常生长发育过程中发挥一定作用。本研究发现, HaPR1基因主要在向日葵叶片中表达, 这与大多数PR蛋白能在叶片中表达相一致, 推测其在向日葵叶片的生长发育或防御反应中具有重要的作用。
大量报道已证明, PR1基因不仅受生物和非生物因素的诱导, 同时也受植物生长调节剂等物质的调控。PR1基因的表达能够增加植物抵御病害和其他各种胁迫的能力。侯丽霞等研究发现, 葡萄PR1基因表达受霜霉病菌、低温、盐和干旱胁迫显著诱导, 同时SA、ABA、JA、NO、H2O2和H2S等也可诱导其大量表达[26]; 王艳等[27]也研究表明, 猪毛菜SfPR-1基因不仅响应盐、干旱、冷害和H2O2的诱导, 同时也受SA、JA、ABA和乙烯的调控。本研究发现, HaPR1可响应多种胁迫, 干旱、盐、草酸、核盘菌及其代谢物均能诱导HaPR1上调表达, 其中由核盘菌及其代谢产物和核盘菌主要的致病因子草酸诱导后HaPR1的表达量能提高4.07~14.52倍, 而受盐和干旱胁迫时, HaPR1表达量较对照提高了1.64~ 1.82倍, 该结果说明HaPR1能够响应核盘菌及其毒素的侵袭。此外, 对过量表达HaPR1转基因烟草叶片进行菌核病抗性测定, 试验结果同样证明HaPR1过量表达可以提高植株对核盘菌的抗性。由此说明, 该基因在向日葵抗病机制中具有重要作用。
目前, 通过转基因方法确定了某些PR1基因具有抗病功能[8, 9, 10]。PR1基因是多基因家族, 但并非所有PR1基因都具有抗病功能。研究表明PR1基因家族中只有少数成员表现出抗菌功能, 有的PR1基因参与发育调控, 多数具有未知的生物学功能。本研究表明HaPR1基因的表达受核盘菌、草酸等致病因子显著诱导, 那么HaPR1基因是否参与向日葵对菌核病的防御过程?为更多了解HaPR1基因的功能, 构建了植物表达载体pROK2-HaPR1, 并获得了转HaPR1基因的烟草植株, 对转基因烟草进行抗核盘菌测定发现转化烟草对核盘菌具有较高的抗性。通过对转基因烟草防御酶活性及丙二醛含量的测定, 发现转基因烟草叶片较对照显著提高了SOD、POD和CAT活性, 并降低了丙二醛含量。从而推断HaPR1基因具有抗核盘菌的功能。植物与病原物互作中, 不同的病程相关蛋白参与不同的信号传导途径, HaPR1基因是否参与其他病害的防御过程以及具有别的生物学功能还需进一步研究。
4 结论克隆了1个向日葵病程相关蛋白1基因HaPR1的cDNA全长序列, 其OFR为489 bp, 编码162个氨基酸, 具有6个保守半胱氨酸, 4个保守的allergen V5/Tpx-1结构域。HaPR1的相对表达量在向日葵叶中最高, 根中其次, 茎中最低。干旱、盐、草酸、核盘菌及其代谢物均可显著诱导其表达。该基因在烟草中过量表达提高了对核盘菌的抗性, 转基因烟草叶片在核盘菌胁迫下显著提高SOD、POD和CAT活性, 降低MDA含量。初步推断HaPR1具有抗核盘菌的功能。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] |
