 , 张杰道
, 张杰道
*通讯作者(Corresponding authors): 董树亭, E-mail: stdong@sdau.edu.cn; 张杰道, E-mail: jdzhang@sdau.edu.cn 收稿日期:2014-12-19 基金:
摘要
关键词:玉米; 小分子热激蛋白; 高温; 胁迫抗性
Cloning and Function Analysis of Small Heat Shock Protein Gene ZmHSP17.7 from Maize
SUN Ai-Qing
 , ZHANG Jie-Dao
, ZHANG Jie-Dao
Abstract
Keyword:Maize; Small heat shock protein; High temperature; Stress resistance
Show Figures
Show Figures












玉米是我国主要的粮食、饲料和工业原料作物, 生育期遭遇高温是造成黄淮海夏玉米产区玉米品质和产量下降的重要原因。最近50年内全球气温上升了大约1.0~4.5℃, 并有逐年上升的趋势[1]。近年来, 我国华北、西北以及黄淮地区每年出现气温普遍升高的现象, 而气温每超过玉米正常生长温度1℃, 能够引起产量下降3%~4%[2]。长期高温常常伴随干旱发生, 使危害更加严重。
在高温胁迫下, 植物细胞中的各种酶和功能蛋白容易发生构象改变, 甚至变性。在植物进化过程中形成蛋白质量控制系统, 能够对损伤蛋白进行修复和清除[3]。其中, 热激蛋白(HSP, heat shock protein)就是蛋白质量控制系统成员的典型代表[4]。热激蛋白主要是作为分子伴侣, 辅助蛋白正确折叠和运输, 维持蛋白的构象和功能稳定。根据相对分子量可以把植物热激蛋白分成HSP100、HSP90、HSP70、HSP60、HSP40和小分子热激蛋白(sHSP, small molecular HSP)共6种类型[5, 6]。
小分子热激蛋白的分子量在12~45 kD之间, 也是保守性最低的一类热激蛋白。与其他类型的分子伴侣不同, 小分子热激蛋白不能单独使非变性蛋白再折叠, 但可以和未折叠蛋白及其他热激蛋白组成复合物。所有小分子热激蛋白都有一个保守的C端α -crystalline结构域[7, 8, 9, 10]。根据氨基酸序列、胞内定位和免疫学交叉反应特性, 被子植物中的小分子热激蛋白至少可分为11类, 6种定位于细胞质和(或)细胞核, 称之为胞质I、II、III、IV、V、VI类(CI~CVI); 2种定位于线粒体, 即线粒体I、II类(MTI、MTII); 其他3类分别定位于内质网(ER)、叶绿体(CP)和过氧化物酶体中(Px), 在N端都有相应的信号肽[11, 12]。
小分子热激蛋白在植物胁迫防御中常发挥重要作用, 具有丰富的功能和遗传多样性。AtHSP17.6A在种子发育过程中受高温和渗透胁迫诱导表达, 超表达该基因能够增强拟南芥对干旱和盐的抗性[13]。过量表达叶绿体HSP21基因也能增强拟南芥的强光和高温胁迫抗性[14]。超表达莲NnHSP17.5能提高拟南芥种子活力[15]。超表达水稻Hsp17.7则可以提高水稻对干旱、高温和UV-B的抗性[16, 17]。表达RcHsp17.8的大肠杆菌、酵母、拟南芥都表现出对高盐的抗性[18]。玉米中只有HSP16.9、HSP17.0、HSP17.3、HSP18.2和HSP22等少数几个小分子热激蛋白基因的研究报道, 这些小分子热激蛋白基因的过量表达能够增强转基因植物的抗热性或激素敏感性[19, 20, 21, 22]。
我们从玉米基因组中分离了一个小分子热激蛋白基因, 对其在高温和干旱两种非生物逆境中的表达特性进行了分析, 并通过拟南芥异源超表达对其在胁迫防御中的功能进行了鉴定。
1 材料与方法1.1 试验材料及处理玉米材料为国际玉米小麦改良中心(CIMMYT)提供的热带玉米种质POB21的自选系, 拟南芥为哥伦比亚生态型(Col-0), 大肠杆菌和根癌农杆菌菌株分别为DH5α 和GV3101。克隆载体为pMD18-T vector, 植物表达载体为pBI121。DL2000 DNA Marker、DNA聚合酶、DNA连接酶、限制性内切酶购自TaKaRa公司; 质粒提取试剂盒购自Omega公司; 卡那霉素、氨苄青霉素等化学试剂购自上海生工生物工程有限公司; 带正电荷尼龙膜(Hybond N+)购自Amersham公司; DIG Northern Starter Kit购自Roche公司。
表1
Table 1
表1(Table 1)
| 表1 引物序列 Table 1 Primer sequence |
参考Cao等[21]和Todorov等[23]的方法。取饱满一致的玉米种子, 播种于沙床上, 25℃光照培养(12 h d-1) 10 d, 以生长整齐一致的健壮玉米幼苗为材料, 分别进行高温(38℃)、15% PEG-6000模拟干旱、高温干旱复合胁迫和100 µ mol L-1 ABA处理, 处理时间分别为1 h、3 h、6 h和12 h, 未经处理的正常培养幼苗作为对照。胁迫处理结束后取植株的完全展开叶片混合, 于液氮中保存, 用于基因克隆和表达特性分析。
1.2 基因克隆及载体构建以TRIzol法提取叶片总RNA, 进行一步法RT-PCR扩增, 所使用的引物对为ZmHSP17.7/F和ZmHSP17.7/R (表1)。PCR反应条件为, 50℃反转录30 min; 94℃预变性2 min; 94℃变性1 min, 53℃退火1 min, 72℃延伸2 min, 32个循环; 72℃延伸5 min。PCR产物经凝胶电泳回收后, 按照pMD18-T克隆载体构建操作说明进行TA克隆连接, 构建重组克隆载体并转化大肠杆菌 DH5α , 通过50 mg L-1氨苄青霉素抗性筛选和菌落PCR鉴定阳性克隆, 测定序列。
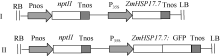
通过BamH I和Sac I双酶切和体外连接, 将ZmHSP17.7基因取代植物表达载体pBI121上的gusA报告基因, 构建ZmHSP17.7超表达植物表达载体(图1-I), 转化农杆菌GV3101, 用于拟南芥遗传转化。利用ZmHSP17.7/F和ZmHSP17.7/2R引物对扩增, 在基因的起始密码和终止密码的上游分别引入BamH I和Xho I酶切位点, 通过双酶切和体外连接构建pBI121-ZmHSP17.7:GFP融合基因植物表达载体(图1-II), 用于洋葱表皮细胞的蛋白亚细胞定位分析。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 ZmHSP17.7基因超表达载体和ZmHSP17.7:GFP融合表达载体图谱Fig. 1 Schematic diagram of the overexpression vector ofZmHSP17.7 and ZmHSP17.7:GFPfusion expression vector |
1.3 基因表达特性分析采用地高辛(DIG)-Northern杂交分析基因表达特性。以ZmHSP17.7/F和ZmHSP17.7/3R引物扩增DNA片段作为制备RNA探针的模板, 以TRIzol法提取叶片总RNA, 进行甲醛变性凝胶电泳和印迹转膜, 参照DIG Northern Starter Kit说明书进行探针的合成和DIG标记等杂交检测步骤。
1.4 蛋白洋葱表皮细胞亚细胞定位分析参考Xu等[24]的方法, 将洋葱表皮切成2 cm × 2 cm方块, 平铺在MS固体培养基上, 将pBI121- ZmHSP17.7: GFP融合表达载体质粒DNA包裹金粉颗粒, 利用PDS-1000基因枪轰击洋葱表皮, 在固体培养基上恢复培养20 h后, 在荧光显微镜下观察细胞中的GFP绿色荧光。
1.5 生物信息学分析采用在线工具ProtComp v.9.0 database (http://www.softberry.com/)预测蛋白的亚细胞定位。参考玉米基因组数据库(http://www.maizesequence.org/)基因序列设计引物, 水稻小分子热激蛋白序列来自NCBI公共数据库(http://www.ncbi.nlm.nih.gov/), 拟南芥小分子热激蛋白序列来自TAIR数据库(http://www.arabidopsis.org/)。用DNAman5.0软件翻译cDNA序列并对蛋白序列进行相似性分析, 采用ExPASy在线工具(http://web.expasy.org/compute_pi/)预测蛋白分子量和等电点, 利用ClustalX和MEGA4.0软件分析基因同源性并构建进化树。
1.6 拟南芥转化和鉴定参考Zhang等[25]的方法转化拟南芥。将拟南芥花序用农杆菌渗透液浸泡, 在保湿和低光强下生长1~2 d后, 转入正常光照条件下生长, 成熟后收集种子。种子经3%次氯酸钠消毒后, 在含50 mg L-1卡那霉素的MS固体生根培养基上进行抗性筛选, 将抗性苗转移至基质中正常光照条件下生长, 提取转基因植株的总DNA为模板, 通过PCR扩增进行鉴定。连续筛选3代, 以获得转基因纯合系。参考改进的Zhou等[15]方法鉴定转基因拟南芥的高温抗性, 采用40℃高温胁迫鉴定种子萌发过程抗性。以3周龄野生型和转基因拟南芥植株为材料, 分别进行干旱、高温和复合胁迫抗性鉴定。干旱胁迫为自然干旱脱水处理7 d, 高温胁迫为42℃高温处理6 h后恢复生长7 d, 复合胁迫为自然干旱胁迫与高温胁迫的叠加, 以正常生长条件下培养的拟南芥植株作为对照。处理7 d后观察并照相。
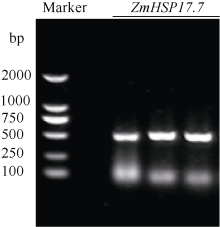
2 结果与分析2.1 玉米小分子热激蛋白基因ZmHSP17.7的克隆 利用基因芯片分析38℃热激处理的玉米幼苗叶片的基因表达谱, 检测到一个小分子热激蛋白基因在热激后高水平表达。根据玉米基因组参考基因ZmHSP17.4(EU962980.1)序列设计特异引物, 以玉米总RNA反转录产物为模板, 对目的基因进行高保真扩增, 琼脂糖凝胶电泳显示扩增产物片段为500 bp左右, 与预期长度一致(图2)。回收目的片段并连接到pMD18-T克隆载体上, 转化大肠杆菌DH5α , 从中挑选重组子测序。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 玉米ZmHSP17.7 cDNA片段扩增Fig. 2 PCR amplification ofZmHSP17.7cDNA fragment in maize Marker: DL2000. |
测序结果表明, 目的基因编码区(CDS)序列全长477 bp, 编码158个氨基酸(图3)。利用ExPASy pI/Mw在线预测蛋白的等电点为5.36, 分子量为17.746 kD。该基因核酸序列与EU962980.1基因的cDNA序列在编码区相似性达98%, 只有11个碱基变异; 蛋白氨基酸序列相似性达96%, 有5个氨基酸差异。表明已经成功克隆到所需小分子热激蛋白基因, 根据分子量将其命名为ZmHSP17.7, 将序列提交GenBank数据库, 序列号为KJ789381。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 玉米ZmHSP17.7cDNA及编码蛋白序列Fig. 3 cDNA and protein sequence of ZmHSP17.7in maize |
2.2 ZmHSP17.7基因序列相似性和同源性分析利用该基因编码的蛋白序列在NCBI公共数据库中进行BlastP在线搜索发现, 高粱、水稻、二穗短柄草、大麦、谷子、大豆和拟南芥等基因组中都有其相似基因(图4)。这些相似基因编码蛋白的氨基酸序列相似性在62%~96%, 分子量在17.0~18.5 kD范围内。各相似蛋白序列在N端保守性较低, 在中部和C端相对保守, 几个单子叶植物的相似蛋白序列在N端比双子叶植物(拟南芥和大豆)蛋白序列少6个氨基酸。在ZmHSP17.7的54~157氨基酸区是HSP20亚家族小分子热激蛋白典型的ACD (Alpha crystallin domain)结构域(pfam00011)。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 ZmHSP17.7及其直系同源基因编码蛋白的相似性分析Fig. 4 Protein sequence alignment of ZmHSP17.7 and orthologous genes BdHSP17.9 (XP_003558276.1), HvHSP17 (ADW78607.1), OsHSP17.3 (ADR30404.1), PgHSP17.9 (ACR78191.1), SbHSP17.4 (XP_002468126.1), GmHSP18.5 (NP_001235177.1), AtHSP17.4 (At3g46230.1); Zm, Zea mays; Sb, Sorghum bicolor; Pg, Pennisetum glaucum; Os, Oryza sativa; Bd, Brachypodium distachyon; Hv, Hordeum vulgare; Gm, Glycine max; At, Arabidopsis thaliana. |
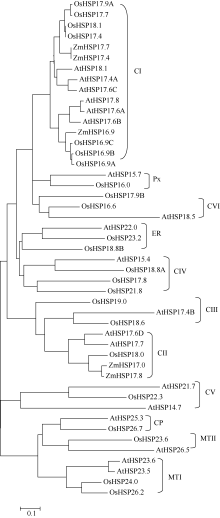
利用ClustalX和MEGA4.0软件, 根据拟南芥和水稻基因组中小分子热激蛋白家族成员的氨基酸序列同源性构建进化树, 将玉米ZmHSP17.7及其基因组数据库的参考序列ZmHSP17.4和已报道的玉米小分子热激蛋白HSP16.9、HSP17.0、HSP17.8整合到进化树上[19, 20]。结果表明, ZmHSP17.7与参考序列同源性最高, 与拟南芥和水稻16.9~18.1 kD的小分子热激蛋白家族成员位于进化树的同一大分支上, 此分支均为胞质I类(CI类)小分子热激蛋白。其中, ZmHSP17.7与水稻CI类成员OsHSP17.9A、OsHSP17.7、OsHSP18.1和OsHSP17.4有更高的同源性(图5)。说明ZmHSP17.7属于CI类小分子热激蛋白。CI类小分子热激蛋白定位于细胞质和(或)细胞核内, 常参与盐、高温、低温和氧化胁迫等多种逆境响应[16, 17, 18, 19, 26], 暗示该玉米ZmHSP17.7基因可能参与调控玉米对高温等非生物胁迫的响应, 在植物防御非生物胁迫的过程中起着非常重要的作用。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 玉米ZmHSP17.7与拟南芥和水稻sHSP基因家族的进化分析Fig. 5 Phylogenetic relationship of ZmHSP17.7 with other sHSP gene family from Arabidopsis and rice |
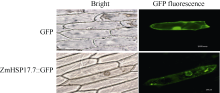
2.3 蛋白亚细胞定位分析为了更进一步了解ZmHSP17.7蛋白的亚细胞定位, 构建了CaMV35S启动子驱动下的35S-ZmHSP17.7: GFP融合蛋白表达载体(图1)。提取融合蛋白表达载体质粒DNA, 通过基因枪轰击洋葱表皮细胞, 恢复培养20 h后在荧光显微镜下检测绿色荧光, 进行亚细胞定位分析。转35S-GFP对照载体的洋葱细胞中GFP基因为组成型表达, 绿色荧光在细胞核和细胞质中均有分布, 细胞核中荧光信号强于细胞质, 无论是在细胞核中还是在细胞质中, 荧光分布较均匀。与之相似, ZmHSP17.7:GFP融合蛋白的绿色荧光在细胞质和细胞核中都有分布, 但荧光分散不均匀, 细胞质中有聚集的现象, 细胞核中的核仁区没有荧光分布(图6)。此结果与莲NnHSP17.5:GFP的亚细胞定位结果一致[15], 说明尽管融合蛋白比GFP分子量增大了17.7 kD, 但不影响其进入细胞核, 荧光聚集可能来自热激蛋白的寡聚化[26]。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 玉米ZmHSP17.7:GFP融合蛋白在洋葱表皮中的亚细胞定位分析Fig. 6 Subcellular localization of the ZmHSP17.7:GFP fusion protein in onion epidermal cells |
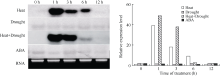
2.4 ZmHSP17.7基因表达特性分析利用DIG Northern Blot检测ZmHSP17.7基因的表达特性表明, 该基因在15%PEG模拟干旱胁迫条件下杂交信号很弱, 且随胁迫时间延长没有明显变化, 说明单一干旱胁迫对基因表达没有影响(图7)。在38℃高温胁迫下, 处理1 h时杂交信号最强, 随着处理时间延长信号逐渐减弱, 到12 h时与对照一致, 几乎检测不到杂交信号。这说明ZmHSP17.7基因能快速响应高温胁迫而表达上调, 但高温只诱导其mRNA在短期内积累, 不会随热激时间延长无限制增加, 且在诱导一定时间后, 基因的诱导表达会被抑制, mRNA被降解。高温和干旱复合胁迫下杂交信号强度在1 h和3 h高于高温单独胁迫, 但6 h后表达下降更快, 说明复合胁迫下干旱增强了高温的诱导效果, 同时也加快了后期的表达抑制进程。在100 µ mol L-1ABA处理下, 杂交信号变化与干旱胁迫下表现一致, 即ZmHSP17.7表达不受外源ABA影响。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 玉米ZmHSP17.7基因的表达特性分析Fig. 7 Analysis of gene expression of ZmHSP17.7 in maize |
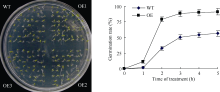
2.5 超表达ZmHSP17.7基因提高种子萌发高温抗性 利用农杆菌介导的花序浸染法将超表达ZmHSP17.7基因导入拟南芥, 将野生型和转基因种子平铺到MS培养基上, 高温处理6 h后转移至正常生长温度下培养, 比较鉴定萌发率表明, 40℃高温胁迫时差异最明显, 转基因种子萌发高峰出现在第2天, 萌发率增加67.7%, 此后3 d只增加了12.3%, 最终达到91.5%。而野生型种子萌发集中在第2天到第3天, 分别增加了30.2%和17.7%, 此后2 d增加了6.3%, 最终达到56.5% (图8)。由此说明, 超表达ZmHSP17.7基因增强了种子对高温胁迫的耐受能力, 使高温胁迫下转基因种子不仅比野生型拟南芥种子萌发提前, 而且萌发率提高。
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 超表达ZmHSP17.7基因(OE)对高温胁迫下拟南芥种子萌发的影响 WT: 野生型植株; OE: 超表达ZmHSP17.7的转基因株系; OE1、OE2和OE3分别代表3个独立转化系。Fig. 8 Effect of overexpression of ZmHSP17.7gene on seed germination of Arabidopsis under heat stress WT: wild-type plants; OE: transgenic lines over-expressingZmHSP17.7; OE1, OE2, and OE3 represent three independent transgenic lines. |
2.6 超表达ZmHSP17.7提高植株旱热复合抗性 以3周龄野生型和转基因拟南芥植株为材料, 进行不同干旱高温逆境处理, 比较超表达ZmHSP17.7基因对植株抗逆性的影响。在自然脱水干旱条件下, 随基质中含水量的不断下降, 野生型植株逐渐萎蔫死亡, 转基因植株仍能正常生长, 表现出更强的脱水耐受能力(图9)。在42℃高温处理6 h后的恢复生长过程中, 野生型植株逐渐青枯死亡, 而超表达ZmHSP17.7基因的植株仍能够恢复正常。在高温和干旱复合胁迫时, 野生型植株比高温或干旱单一胁迫下死亡更快, 而转基因植株虽然也表现出胁迫伤害, 但损伤程度明显低于野生型植株。以上结果表明ZmHSP17.7基因的异源超表达能够显著改善拟南芥植株对高温、干旱胁迫的耐受能力, 降低胁迫对植物生长的影响。
图9
Fig. 9
| Figure OptionViewDownloadNew Window | |
 | 图9 超表达ZmHSP17.7基因对拟南芥转基因植株高温和干旱耐受能力的影响Fig. 9 Effect of overexpression of ZmHSP17.7 on heat and drought tolerance of Arabidopsis plants |
3 讨论植物热激蛋白是一类代表性的高温响应蛋白, 广泛参与多种逆境防御机制[27, 28]。小分子热激蛋白是热激蛋白基因家族中一个重要亚家族, 在细菌、古细菌和一些单细胞真核生物中一般有1~2个小分子热激蛋白基因, 而在一些高等真核生物中小分子热激蛋白基因数目则较多, 如拟南芥基因组中检测到19个小分子热激蛋白基因, 水稻基因组中有个23个小分子热激蛋白基因[11]。这些成员中大部分蛋白的分子量在20 kD左右, 又称之为HSP20家族[28]。在已有研究的几个玉米小分子热激蛋白基因中, 尽管它们分子量接近, 且都受高温诱导表达, 但在进化分类、表达特性和功能等方面有明显差异[19, 20, 21, 22]。如HSP16.9和HSP17.7属于CI类, 而HSP17.0和HSP17.8属于CII类, HSP22从蛋白亚细胞分布上属于线粒体小分子热激蛋白。HSP16.9和HSP17.7能够提高超表达转基因植株对高温的抗性, 而超表达HSP18.2能够提高转基因植株对激素CTK的敏感性。HSP17.0和HSP17.8尽管同属CII类热激蛋白, 但HSP17.0的分子伴侣活性较弱, 且表达受发育调节。
我们从玉米中分离的ZmHSP17.7基因属于CI类小分子热激蛋白。此基因的表达呈典型的高温诱导特性, 能够快速响应高温胁迫。这种高温诱导特性与其他小分子热激蛋白基因的表达特性是一致的, 其诱导表达水平通常受胁迫温度和胁迫时间的共同影响。胁迫温度越高, 即胁迫强度越大, 基因表达响应越快, 表达产物积累高峰出现所需时间越短。反之, 胁迫强度小, 则mRNA积累减缓, 积累高峰时间后移。但mRNA产物不随胁迫时间的延长无限积累, 在达到积累高峰后很快下降, 直至完全消失[19, 29, 30]。鉴于ABA在植物响应非生物胁迫过程中的重要功能, 常常把响应非生物胁迫的基因按照其表达是否受ABA调控分为两类[31, 32]。ZmHSP17.7基因的表达不受外源ABA调节, 暗示其可能属于不依赖ABA的胁迫响应基因, 但还需要进一步就内源ABA是否影响其表达进行验证。尽管ZmHSP17.7的基因表达不受PEG模拟的干旱调节, 但在干旱和高温复合胁迫时, 干旱可以改变基因的热诱导表达水平, 这种协同作用说明不同非生物胁迫在调控基因表达上既有相对的独立性, 又有紧密的相互作用, 通过其共同的代谢反应可以相互影响。
超表达ZmHSP17.7基因不仅可以提高拟南芥对高温胁迫的耐受能力, 也能改善其干旱胁迫抗性。而且在我们的抗性鉴定中, 超表达ZmHSP17.7基因的干旱胁迫抗性改良效果比高温胁迫抗性更显著, 这可能是拟南芥中内源小分子热激蛋白基因在高温和干旱胁迫下的表达差异造成的。对拟南芥基因组数据库基因芯片数据分析表明, 其内源的6个CI类小分子热激蛋白基因均受热胁迫诱导表达, 且在1~3 h内达到高峰, 但都不受干旱诱导。在高温胁迫的早期, 拟南芥内源的CI类小分子热激蛋白基因同样受诱导快速表达, 使得超表达ZmHSP17.7的作用效果相对较小; 而在高温胁迫的后期和恢复过程中, 内源基因不再表达时, 组成型超表达ZmHSP17.7的效果才能体现出来。干旱胁迫不诱导拟南芥内源的CI类小分子热激蛋白基因表达, 而在组成型超表达ZmHSP17.7的转基因拟南芥中ZmHSP17.7在整个干旱胁迫过程中始终发挥作用, 这可能是超表达ZmHSP17.7的转基因拟南芥抗旱性显著提高的重要原因。根据多年来对植物抗逆机制的研究结果, 拟南芥对干旱、高温胁迫的响应是一个复杂的综合反应机制, 小分子热激蛋白基因对干旱、高温胁迫应激的差异可能只是该综合反应机制的一个方面。高温诱导表达的小分子热激蛋白基因可以在干旱胁迫防御中发挥作用, 因此在对植物进行非生物逆境抗性遗传改良过程中, 可能不仅要考虑改变胁迫防御基因的表达水平, 还要考虑对这些基因表达模式的调节。
4 结论玉米ZmHSP17.7基因编码分子量约17.7 kD的小分子热激蛋白, 属CI类亚家族成员。ZmHSP17.7基因表达受高温快速诱导, 干旱不诱导该基因表达, 但能增强复合胁迫下该基因对高温的响应, 外源ABA不改变基因表达水平。增强该基因表达可以提高转基因拟南芥植株对高温、干旱胁迫的耐受能力。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] |
