 , 金筱耘
, 金筱耘
*通讯作者(Corresponding author): 余茂德, E-mail:yumd@163.com, Tel:023-68251309 第一作者联系方式: E-mail:lvruihua1987@163.com, Tel: 023-68251309
收稿日期:2014-09-30 基金:
摘要
关键词:果桑; 油菜; 菌核病菌; 交叉侵染; SRAP分子标记
Cross Infection, Biological Characteristics and Genetic Relationship between Pathogens of Hypertrophy Sorosis Sclerotenisis from Mulberry and Sclerotinia Stem Rot from Oilseed Rape
LÜ Rui-Hua
 , JIN Xiao-Yun
, JIN Xiao-Yun
Abstract
Keyword:Mulberry; Oilseed rape;
Show Figures
Show Figures









果桑和油菜是2种重要的经济作物, 然而果桑菌核病(mulberry fruit sclerotiniosis)是制约果桑发展的重要病害, 其发病率高达30%~90% [1]。果桑菌核病分肥大性、小粒性和缩小性3种[2], 其中果桑肥大性菌核病的发病率最高。而且油菜菌核病也已成为油菜的第一大病害, 有的发病率高达80%以上, 病株减产可达10%~73%, 严重影响油菜的产量和品质, 给我国油菜生产造成很大的经济损失[3]。果桑菌核病菌和油菜菌核病菌(Sclerotinia sclerotiorum in oilseed rape)的主要感染时期均在开花期, 引起这2种病害的病原菌均属于核盘菌科(Sclerotiniaceae)。加之菌核在土壤表面的存活力可长达8年以上[4], 因此, 研究菌核病在果桑和油菜之间是否相互传染, 及其传染能力如何, 对其综合防控具有重要参考价值。1959年杨新美[5]用从被感染的油菜植株分离的菌核病菌与从二月兰、甘蓝、冬葵、芥菜、苦菜等12种植物上分离的菌核病菌的菌丝作室内交互接种试验, 除了红兰花与油菜外, 其余植物病菌都能与油菜菌核病菌的菌丝互相感染。郭文信等[6]通过多年研究发现, 油菜茬种大豆, 菌核病发病率10%~25%, 大豆茬种油菜, 菌核病发病率10%~25%, 小麦茬种油菜, 菌核病发病率4%~5%, 在菌核病的防治方面轮作是经济有效的方法。果桑肥大性菌核病菌[Ciboria shiraiana (P. Hennings) Whetzel)]和油菜菌核病菌菌[Sclerotinia sclerotiorum (Lib.) De Bary in oilseed rape]同属于核盘菌科(Sclerotiniaceae)。但是果桑肥大性菌核病菌归为杯盘菌属(Ciboria), 桑实杯盘菌(Ciboria shiraiana); 油菜菌核病菌属于核盘菌属(Sclerotinia), 核盘菌[Sclerotinia sclerotiorum (Lib.) de Bary][7], 在长江流域, 果桑和油菜的开花期几乎都为2月下旬至3月下旬, 植株被菌核病菌感染的初始传染源均为子囊孢子[8, 9, 10, 11], 最易侵染的器官是桑树雌花和油菜花瓣和叶片。
本研究用纯化的果桑肥大性菌核病菌与油菜菌核病菌的子囊孢子为研究对象, 将两种病原进行交叉接种实验, 观察其相互传染特性, 分析其流行性学关系, 旨在为两大经济作物在菌核病防控领域提供参考依据。
1 材料与方法1.1 果桑肥大性菌核病菌、油菜菌核病菌及其子囊孢子的获得果桑肥大性菌核病菌从西南大学果桑资源圃的果桑品种嘉陵30 (属于广东桑种, Morus atropurpureaRoxb.)病果分离获得, 菌株编号为CCTCCAF 2014019, 登记保存于中国典型培养物保藏中心, 接种所用的果桑品种为大十, 属于广东桑种, Morus atropurpureaRoxb.。
将人工培养条件下产生的成熟菌核常规消毒, 转至水分饱和的河沙中, 于4℃冰箱中放置6周[12, 13, 14]。取出后在15℃、相对湿度> 90%的条件下培养至子实体长出, 参照方中达[15]的方法对子囊盘进行表面消毒。在超净工作台里用匀浆器研磨子囊盘, 使子囊盘里面的子囊孢子释放出来, 用血细胞计数板调节子囊孢子的浓度, 在光学显微镜下面观察子囊和子囊孢子的形态特征。
油菜菌核病菌由西南大学农学与生物科技学院重庆市油菜工程技术研究中心提供[16], 油菜菌核病子囊孢子参照分离果桑肥大性菌核病菌子囊孢子的方法获得。接种所用的油菜品种为中双10号。
1.2 果桑肥大性菌核病菌与油菜菌核病菌子囊盘外囊被的解剖结构横切观察子囊盘被解剖结构是分属的重要特征[7]。于2014年2月对本实验室纯化的果桑肥大性菌核病菌, 经有性培养获得子囊盘外囊盘被进行切片显微观察。油菜菌核病菌也按照前述方法进行子囊盘外囊盘被的切片显微观察。
1.3 果桑肥大性菌核病菌与油菜菌核病菌子囊孢子交叉试验2012年1月开始盆栽油菜苗, 2月移栽至人工气候箱。将配制好的果桑肥大性菌核病菌的子囊孢子液(× 105孢子mL-1)采用针刺法接种到油菜叶片、茎干上, 以保鲜膜包裹保湿, 25℃、85%湿度条件下培养, 观察其发病症状, 以接种油菜菌核病菌子囊孢子液的植株为阳性对照, 接种无菌水的油菜植株为阴性对照。
2013年2月中旬, 当桑树冬芽脱苞, 叶片刚开始露出冬芽时, 用硫酸纸袋将其套住以排除外界干扰。3月初, 用配制好的油菜菌核病菌的子囊孢子液(× 105孢子mL-1)采用喷雾法接种刚萌发的桑果, 以保鲜膜包裹保湿。以接种果桑肥大性菌核病菌子囊孢子的桑椹为阳性对照, 以接种无菌水的桑椹为阴性对照, 观察、记录、拍照。
1.4 SRAP分子标记采集重庆市北碚区斑竹村西大油菜试验地(Sclerotinia1)、北碚区斑竹村西大桑树资源圃(Ciboria 2)、西南大学后山新桑园(Ciboria 3)、四川省南部县楠木镇五村果桑园(Ciboria 4)、重庆市北碚区歇马镇西大油菜试验地(Sclerotinia 5)、四川省南部县碧龙乡二村油菜地(Sclerotinia 6)、四川省南部县楠木镇五村油菜地(Sclerotinia 7)、涪陵区焦石镇悦来村果桑园(Ciboria 8)、涪陵区百胜镇齐曲村果桑园(Ciboria 9)。参照方中达的方法[15]培养, 并鉴定所有菌株的形态学、生理生化特性。采用改良的CTAB法[17]提取其基因组并扩增每种材料的LSU rRNA, 从分子生物学方面进行鉴定, 分离出果桑肥大性菌核病菌和油菜菌核病菌, 用作SRAP分子标记的供试材料。SRAP-PCR所用的正向引物、反向引物如表1所示, 由北京六合华大基因有限公司合成。PCR程序为95℃预变性1 min, 94℃变性45 s, 35℃退火45 s, 72℃延伸1 min, 6个循环; 94℃变性45 s, 57℃退火45 s, 72℃延伸45 s, 32个循环; 最后72℃延伸10 min, 4℃保温。扩增产物经12%变性聚丙烯酰胺凝胶(聚丙烯酰胺∶ 甲叉双丙烯酰胺=29∶ 1)以150 V电压预电泳20 min, 每个样孔点样2 μ L, 150 V恒压电泳210~240 min, 结束后银染。
表1
Table 1
表1(Table 1)
| 表1 SRAP引物编号与序列 Table 1 List of SRAP primers and their sequences |
对获得的可重复的DNA条带在同一迁移率上, 有带的计为“ 1” , 无带的计为“ 0” , 采用NTSYS-pc 2.1e版本软件按照SAHN进行聚类分析。
2 结果与分析2.1 果桑肥大性菌核病菌与油菜菌核病菌无性繁殖特征果桑肥大性菌核病菌与油菜菌核病菌在PDA培养基上均为可生长, 呈现白色有隔菌丝, 多核, 紧贴培养基生长。当菌丝生长到培养基周边时, 相互聚集缠绕形成15~22个菌丝团, 通过复杂的生理生化结合形成坚硬的菌核。在形成菌核的过程中, 菌丝团上面出现无色液体, 当坚硬的菌核形成时菌核上面的液体消失。果桑菌核病菌的菌核分布在PDA培养基的外周外缘, 靠近培养皿壁, 菌核直径为2.1~3.5 mm (图1-A)。油菜菌核病菌菌核分布在PDA培养基的外周内, 距离培养皿壁1~2 cm, 菌核直径为1.8~3.0 mm (图1-E)。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 果桑肥大性菌核病菌与油菜菌核病菌无性生殖阶段和有性生殖阶段生长差异Fig. 1 Differences of asexual and sexual reproduction between pathogens of hypertrophy sorosis sclerotenisis from mulberry and sclerotinia stemrot from oilseed rape |
2.2 果桑肥大性菌核病菌与油菜菌核病菌有性繁殖特征果桑肥大性菌核病菌与油菜菌核病菌的菌核均在低温诱导后第4天萌发出柄, 2周之后柄的顶端膨大形成子囊盘。果桑肥大性菌核病菌的子囊盘为杯状或盘状, 直径为5~12 mm, 柄高9~24 mm, 子实层褐色(图1-B, C); 油菜菌核病菌子囊盘圆盘状, 子实层米色, 淡褐色, 直径为2~7 mm, 柄高为4~7 mm (图-F, G)。2种病原菌子实层均含有子囊和侧丝, 每个子囊里面均含有8个椭圆形的子囊孢子, 子囊孢子在子囊内靠近顶端呈线性排列。本实验分离纯化获得的果桑肥大性菌核病菌子囊孢子的形态与《中国桑树栽培学》[18]和《日本桑树病害图说》[19]描述的一致。
2.3 果桑肥大性菌核病菌与油菜菌核病菌子囊盘外囊被的解剖结构横切观察结果图1所示, 果桑肥大性菌核病菌子囊盘外囊被的横切细胞解剖结构是由圆胞组织构成(图1-D), 油菜菌核病菌子囊盘外囊盘被的横切细胞解剖结构则是由角胞组织组成(图1-H)。试验表明, 我们使用的果桑肥大性菌核病菌纯化菌株与油菜菌核病菌纯化菌株的细胞解剖结构, 显现出杯盘菌属和核盘菌属重要的分类特征。
2.4 果桑肥大性菌核病菌与油菜菌核病菌子囊孢子交叉感染试验2.4.1 以果桑肥大性菌核病菌子囊孢子传染油菜
油菜经人工接种果桑肥大性菌核病菌子囊孢子, 在25℃条件下培养5 d后表现出典型的油菜菌核病特征, 茎干、叶片呈水渍状, 开始腐烂, 上面长满白色絮状菌丝(图2-A); 第10天时, 茎干、叶片病斑面积扩大, 并开始干枯(图2-B); 第15天时, 叶柄底部、根的上部及茎干里面均长满黑色的菌核(图2-C), 油菜整株干枯; 与阳性对照结果相同(图2-D), 无菌水对照组生长正常(图2-E)。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 油菜接种果桑肥大性菌核病菌子囊孢子后植株发病症状Fig. 2 Symptoms in oilseed rape inoculated with ascospores of pathogen of hypertrophy sorosis sclerotenisis from mulberry |
2.4.2 以油菜菌核病菌子囊孢子传染果桑 人工接种油菜菌核病菌子囊孢子的果桑15 d后开始表现发病症状, 病椹膨大, 小核果变色发黄(图3-A); 接种18 d后花被肿厚, 部分小核果开始膨大、呈灰色(图3-B), 弄破病果后散发出臭味, 里面生有大量的分生孢子梗和分生孢子; 接种20 d后, 整个桑椹的小核果全部被感染, 开始转变为灰白色(图3-C), 每个小核果里面含有一个坚硬的菌核, 其发病症状与接种果桑肥大性菌核病菌子囊孢子的病桑椹症状相同(图3-D), 而接种无菌水的阴性对照, 桑椹表现正常(图3-E)。取油菜核盘菌感染桑椹20 d的桑椹观察发现, 发病的桑椹中生有分生孢子梗和大量的分生孢子, 分生孢子梗的分枝基部稍粗, 先端细小, 分生孢子卵形, 无色(图3-F), 这与果桑菌核病病果里面观察到的分生孢子和分生孢子梗基本相同(图3-G)。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 桑椹接种油菜菌核病菌子囊孢子后植株发病症状症状Fig. 3 Mulberry fruit symptoms after inoculated with ascospores of pathogens of sclerotinia stem rot from oilseed rape |
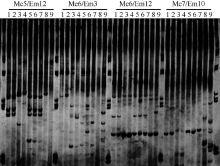
2.5 遗传关系分析从已有的72对引物组合中筛选出4条前引物和5条后引物, 组成10对引物组合对9个样品进行扩增, 共扩增出83个条带, 其中有多态性条带74条, 占总条带的88.1% (图4)。据此绘制聚类图(图5)。共聚为两大类, I类大部分为油菜菌核病菌, 其遗传相似系数(GS)在0.60~0.95之间, 平均为0.77, 种间遗传差异较大; II类为果桑菌核病菌, 其GS在0.68~0.92之间, 平均为0.80, 品种间的遗传基础相对狭窄。但在I类群体中, 采自重庆市北碚区斑竹村西大油菜试验地的菌核病菌(Sclerotinia1)和北碚区斑竹村西大桑树资源圃(Ciboria 2) 的果桑菌核病菌聚为一个小的分支, 表现特别。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 部分引物在9个样品中的多态性表现Fig. 4 Polymorphism of partial primers used in nine samples |
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 采自中国西南地区9个不同菌株的SRAP基因型聚类分析树状图Fig. 5 Dendrogram for SRAP genotypes of nine strains from southwest area of China |
3 讨论果桑肥大性菌核病菌和油菜菌核病的病原菌同属于核盘菌科(Sclerotiniaceae), 其病原菌的传染发病始于其子囊孢子侵染被感植株的易感组织(如桑椹和油菜花瓣), 重庆市和四川省的桑树雌花开放与油菜开花时间都在2月下旬到3月下旬, 此时也正是果桑菌核病和油菜菌核病的越冬菌核萌发子实体及子囊盘的盛期, 这就为果桑肥大性菌核病菌和油菜菌核病菌的子囊孢子相互交叉传染果桑和油菜奠定了吻合的时间基础。本研究发现, 这2种病原菌能相互传染果桑和油菜。这为2种作物菌核病的农业防控提供了有用的依据, 即在果桑种植区域不要间套种植油菜, 在油菜种植区域也不要间套种植果桑和开雌花的桑树; 也为果桑肥大性菌核病的流行病学研究提供了实验依据。在生产中, 初次种植果桑的农户第1年的果桑均能丰产, 第2年可能发生菌核病导致减产, 如缺乏科学防控措施, 第3年将会被菌核病严重危害, 甚至绝收。初次种植果桑的农户或地区, 逐年发生和加重菌核病危害, 其初始病源一直深受关注?本试验结果表明, 该病原可能来自油菜等十字花科的菌核病菌的交叉感染, 可能是果桑肥大性菌核病的病源和加重原因之一。
2007年Sung等[20]研究果桑菌核病菌时, 提出菌丝在PDA培养基上面生长到后期阶段可以产生大量的小分生孢子。Kimura[19]在发病的果桑肥大性菌核病病果中发现有分生孢子梗和分生孢子, 这也与《中国桑树栽培学》[18]的论述一致。在PDA培养基上, 果桑肥大性菌核病菌在菌丝形成菌核的整个过程中始终未观察到有分生孢子梗与分生孢子的产生。庄文颖[7]在油菜菌核病菌的菌核形成过程中没有观察到分生孢子梗和分生孢子, 本研究观察油菜秆内的油菜菌核病菌也无分生孢子梗和分生孢子的产生。但是, 用油菜菌核病菌接种到桑椹上, 却在桑果中发现了分生孢子梗和分生孢子。这一研究结果提示, 大田中桑椹感染菌核病在形成菌核的过程中, 因果桑菌核的形成需有基物存在以形成基物子座, 即果桑菌核是由寄主组织和菌丝组成, 使菌丝在生长中产生分生孢子梗和分生孢子。然而, 菌核病菌在油菜中及在培养基上生长, 由菌丝形成菌核的过程中没有基物, 菌核只为菌丝单独组成, 属于菌核子座, 所以不能产生分生孢子梗和分生孢子, 这也是果桑、油菜菌核病菌在田间由菌丝形成菌核过程中的一个显著区别。
果桑肥大性菌核病菌子囊盘外囊被的横切细胞解剖结构是由圆胞组织构成, 其结果与《中国真菌志》[7]核盘菌科分类中的杯盘菌属所述一致; 油菜菌核病菌子囊盘外囊盘被的横切细胞解剖结构则是由角胞组织组成; 与庄文颖[7]给出的油菜核盘菌子囊盘外囊盘被的解剖图相一致, 这也是核盘菌属与杯盘菌属在分类上的一个最大区别。从而使得在分类上果桑肥大性菌核病菌归为核盘菌科(Sclerotiniaceae), 杯盘菌属(Ciboria), 桑实杯盘菌(Ciboria shiraiana)。而油菜菌核病菌分类归属于核盘菌科(Sclerotiniaceae), 核盘菌属(Sclerotinia)。
SRAP分子标记结果表明, 10对引物可对果桑、油菜菌核病菌基因组DNA的83个位点扩增出条带, 多态性条带比例为88.1%, 在分子水平上表明, 中国西南地区桑椹和油菜菌核病菌的亲缘关系比较近; 同时表明, 桑果和油菜菌核病菌的DNA存在丰富的SRAP多态性, 其遗传多样性与地理来源相关性不明显, 这与王仲怡等[21]的研究一致。
4 结论果桑肥大性菌核病菌与油菜菌核病菌的子囊孢子能相互传染, 提示在栽培中果桑和油菜不能间套种。菌核病菌的子囊孢子在侵染桑椹的过程中均可产生分生孢子梗和分生孢子, 而在侵染油菜的过程中不产生分生孢子梗和分生孢子, 这与其菌核形成过程中是否有基物存在有关。2种菌核病菌间具有丰富的遗传多样性, 其亲缘关系与各自菌种及寄主种类相关性较显著, 与采集地点相关性不大。
The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] |
