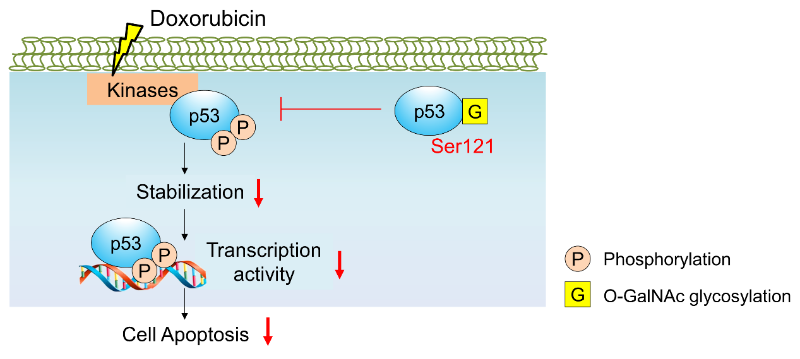
糖基化修饰是蛋白质常见的翻译后修饰,具有重要的生物学意义。O-连接N-乙酰氨基半乳糖(O-GalNAc)糖基化修饰被普遍认为只发生在细胞膜蛋白或分泌蛋白质上。我校张延团队长期聚焦蛋白质O-糖基化修饰研究,在他们的前期工作中首次发现细胞内的胞浆或核蛋白质上可能存在O-GalNAc糖基化修饰(Proteomics 2017,DOI: 10.1002/pmic.201600485)。在本发表论文中,通过细胞糖生物学和化学生物学技术手段首次证明肿瘤抑制因子p53蛋白上具有O-GalNAc糖基化修饰;同时发现在肿瘤细胞中p53蛋白Ser121位的O-GalNAc糖基化修饰抑制了p53的磷酸化水平,下调p53蛋白的稳定性从而抑制p53诱导的细胞凋亡。该文揭示了p53蛋白上的O-GalNAc糖基化修饰在肿瘤细胞抑制细胞凋亡中具有重要意义。核内蛋白p53上O-GalNAc糖基化修饰的确认,为胞内蛋白具有新型O-GalNAc糖基化修饰提供了首个具体例证;刷新了人们对糖基化修饰复杂性和多样性的认知,为糖基化在生命体中扮演的角色提供了新的见解。
张延教授为本论文通讯作者,博士后许之珏为第一作者。该研究得到科技部、国家自然科学基金委等项目的支持。
原文链接:https://doi.org/10.1016/j.bbagen.2020.129635
