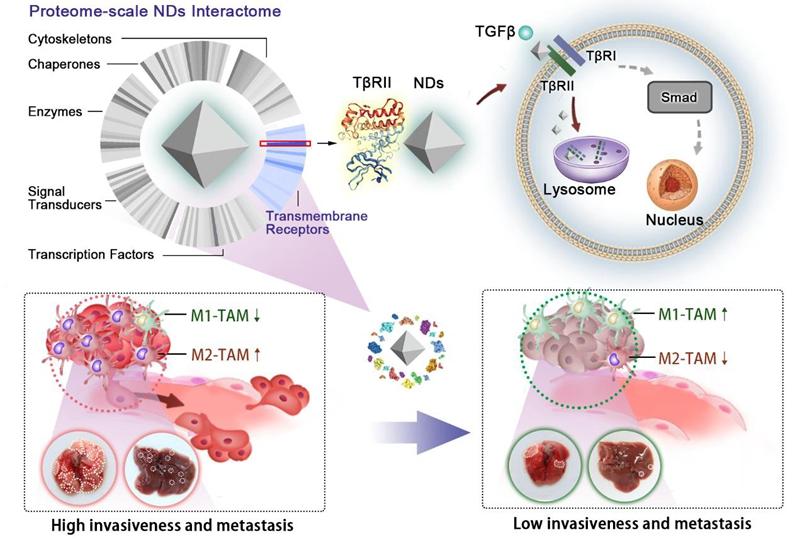
纳米结构作为药物、生物大分子和成像探针的载体,或者光热信号的接收和转换者,已经广泛应用于医学研究和疾病治疗。近年来,人们发现一些纳米结构在“空载”的状态下,即能依靠自身的生物学效应产生一定的疗效。纳米金刚石具有优良的药物递送能力和较好的生物相容性,但通常被视为一种不具备生物活性的纳米载体。
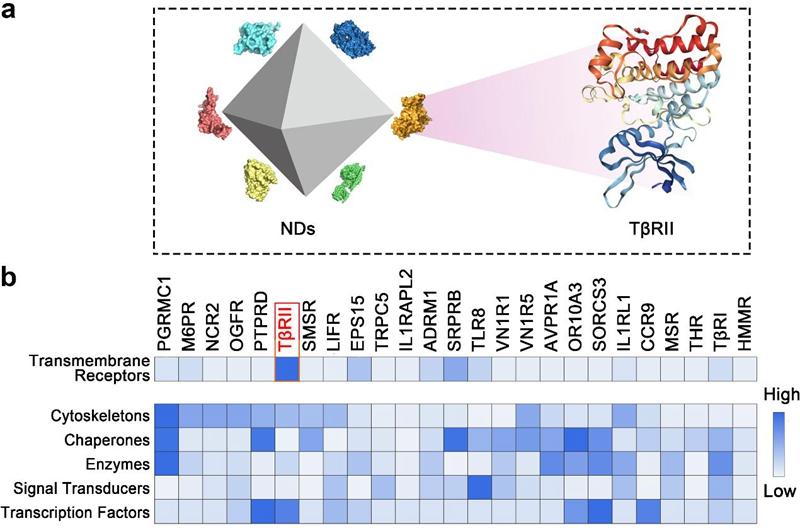
在本项工作中,研究人员首先利用蛋白质组学的方法分析了纳米金刚石进入细胞的动态过程中与之相互作用的蛋白质网络,发现在与纳米金刚石结合的跨膜受体蛋白中,转化生长因子 (TGF )的II型受体(T RII)占据了最高的比例。进一步的研究显示,这种相互作用干扰了TGF 受体的循环利用并促进其进入溶酶体降解途径,从而抑制TGF 引发的信号转导。
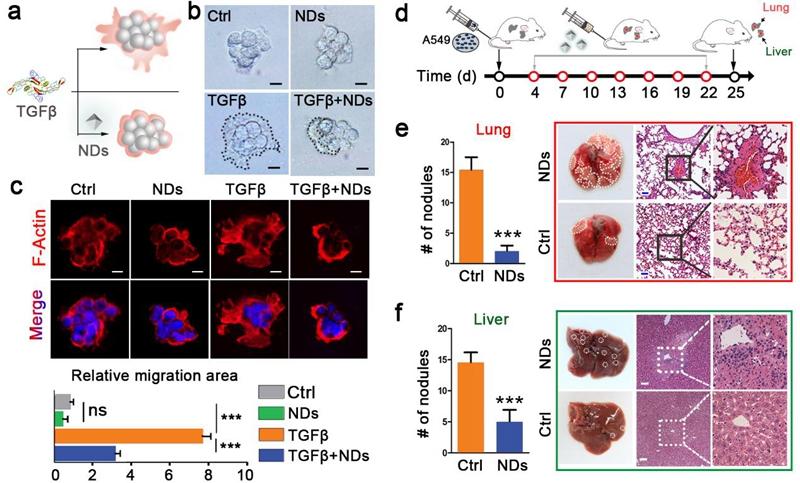
TGF 信号通路的异常激活能够促进肿瘤转移和诱导免疫抑制。在TGF 作用下,浸润到肿瘤组织的巨噬细胞极化成M2型肿瘤相关巨噬细胞(M2-TAM)是肿瘤逃避免疫效应的重要途径之一。研究人员通过在体外培养的癌细胞、3D培养的肿瘤球状体和小鼠肿瘤模型中的测试,发现向肿瘤细胞及其微环境递送纳米金刚石能有效地抑制肿瘤细胞的迁移能力、侵袭能力和驯化巨噬细胞的能力。因此,纳米金刚石不仅可以作为药物载体,还能主动地参与对细胞功能的调控,从而在疾病治疗过程中发挥更积极的作用。
刘唱、胡兴杰和李晓娇为文章的共同第一作者。该研究工作得到国家自然科学基金委、中国博士后科学基金和上海市教委的资助。
