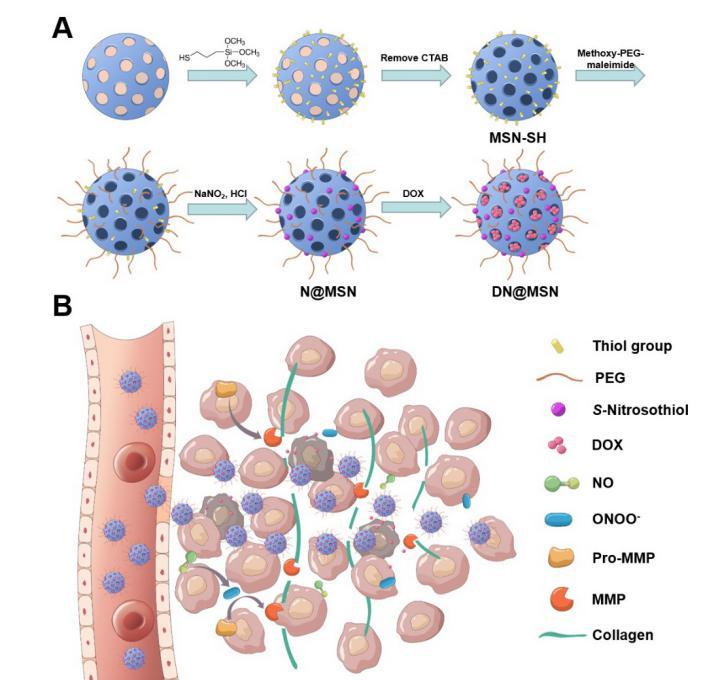
当前,基于纳米技术的肿瘤靶向治疗是肿瘤基础和临床研究的热点。FDA已经批准上市了多种抗肿瘤纳米药物(Doxil、Abraxane、Onivyde等),然而这些纳米药物对患者生存期的延长作用仍十分有限。研究发现,纳米药物虽可通过EPR(Enhanced Permeation and Retention)效应聚集在肿瘤部位,却由于肿瘤基质(胶原、透明质酸等)的阻碍大多数仅滞留在肿瘤血管周边,进一步向肿瘤深部渗透的作用很弱。因此,表观的纳米药物肿瘤靶向分布“掩盖”了深部肿瘤细胞缺乏有效药物暴露的微观困境,导致疗效不佳,这也成为限制纳米药物临床转化的主要瓶颈问题。
有研究报道采用外源性蛋白酶(如菠萝蛋白酶Bromelain或透明质酸酶hyaluronidase)降解肿瘤基质,促进纳米药物肿瘤深部渗透。本研究中,课题组发明了一种“Protein-free”的基于一氧化氮(NO)的胶原降解新策略。课题组设计构建了共递送一氧化氮(NO)供体(亚硝基硫醇S-nitrosothiol)和阿霉素(DOX)的基于介孔二氧化硅的纳米系统 — DN@MSN。以原位小鼠乳腺肿瘤为模型,DN@MSN静脉给药以后,通过EPR效应聚集在肿瘤组织中,亚硝基硫醇分解释放NO,通过NO → ONOO-(过氧亚硝酸盐)→基质金属蛋白酶(MMP)通路显著增强肿瘤微环境MMP-1,-2的表达量和活性,有效消解(deplete)肿瘤基质胶原,促进纳米药物肿瘤深部渗透和抗肿瘤疗效。另一个重要发现在于,NO介导的胶原消解可通过周细胞(pericyte)非依赖的方式扩张肿瘤内部被基质挤压的血管,促进纳米药物在肿瘤深部的血流灌注和EPR效应。
上海交通大学基础医学院博士研究生董霄为该论文的第一作者。上海交通大学基础医学院方超教授为该论文的通讯作者。上海交通大学基础医学院陈红专教授和University at Buffalo(State University of New York)的Jonathan F. Lovell教授给予了重要支持。该研究获得国家自然科学基金委、上海市科委和教委项目的资助。该工作也是方超课题组于2017年以来在国际著名期刊Adv Funct Mater、Adv Sci、ACS Nano上发表关于肿瘤多模式治疗“智能”纳米系统等多项成果后的又一重要进展。
论文链接:https://pubs.acs.org.ccindex.cn/doi/10.1021/acs.nanolett.8b04236
