
PGAM1作为糖酵解通路的重要酶之一, PGAM1催化糖酵解通路中3-磷酸甘油酸(3-PG)转化生成2-磷酸甘油酸(2-PG),促进葡萄糖代谢和能量生成,通过调节3-PG与2-PG的转化平衡来影响其他代谢通路,参与细胞内生物大分子合成和维持氧化还原稳态,促进肿瘤细胞增殖。不仅如此,PGAM1还能不依赖于其代谢酶活性,与α-平滑肌肌动蛋白(α-smooth muscle actin, ACTA2)相互作用,促进肿瘤细胞转移。研究表明,PGAM1在多种恶性肿瘤包括非小细胞肺癌中普遍高表达,且与不良预后呈负相关,在肿瘤发生发展中都起着重要作用。因此,PGAM1可作为肿瘤代谢调控的新靶标,其抑制剂的研发受到越来越多的关注。
研究团队通过共晶结构解析,对先导化合物优化改造,得到了一种新型的PGAM1别构抑制剂(命名为HKB99),具有高选择性、高活性、低毒性优势。药理学研究表明:HKB99巧妙避开了与3-PG直接竞争底物结合位点,与PGAM1邻近底物结合口袋的别构位点相互作用,抑制3-PG向2-PG转化,显著降低PGAM1代谢酶活性;同时,HKB99别构结合PGAM1,“锁住”了201-210段氨基酸的构象,大大削弱PGAM1与ACTA2相互作用,从而抑制非小细胞肺癌和分子靶向药物厄洛替尼耐药的肺癌细胞的生长和转移。进一步研究表明HKB99通过上调细胞中活性氧(ROS)水平,激活JNK/c-Jun信号通路诱导非小细胞肺癌细胞凋亡;使p-AKT和p-ERK激活减少,抑制非小细胞肺癌细胞的增殖。该研究工作首次阐明别构调节PGAM1,能同时抑制PGAM1代谢酶活性和非代谢酶依赖的蛋白-蛋白相互作用,发挥抗肿瘤作用的分子机制;揭示PGAM1作为抗肿瘤药物新靶标,为靶向代谢酶的抗肿瘤药物设计和开发提供新思路。
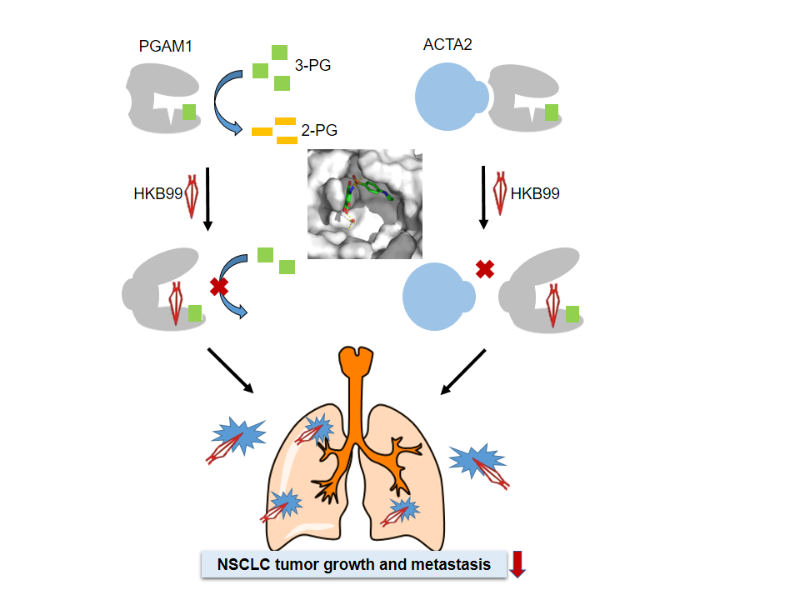
PGAM1新型别构抑制剂HKB99作用模式图
该工作联合复旦大学药学院和上海中医药大学合作完成。上海交通大学基础医学院沈瑛副研究员、复旦大学药学院周璐副教授和上海中医药大学陈红专教授为该论文共同通讯作者。复旦大学药学院2013级博士研究生黄科、上海交通大学医学院2018级博士研究生梁倩和2016级硕士研究生周烨为论文共同第一作者,其中梁倩由陈红专教授和沈瑛副研究员共同指导。来自上海市转化医学协同创新中心、中国科学院上海药物研究所、国家癌基因和相关基因重点实验室、教育部细胞凋亡和分化重点实验室、芝加哥大学化学系等单位的多位专家参与了这项工作,受到国家自然科学基金、上海市教委一流学科建设等的支持。
近年来,沈瑛副研究员聚焦肺癌代谢调控和靶向药物耐药性的机制研究,已作为通讯作者在Theranostics(2018,2019,影响因子8.063)等国际杂志发表重要成果。HKB99已申请国家发明专利(PGAM1别构抑制剂HKB99在制备治疗肺腺癌药物中的应用,申请号:201910284333.4)。
全文链接请见:https://doi.org/10.1016/j.cmet.2019.09.014
