

江南大学 生物工程学院工业生物技术教育部重点实验室,江苏 无锡 214122
收稿日期:2020-10-27;接收日期:2021-02-08;网络出版时间:2021-02-18
基金项目:国家自然科学基金(No. 31800671),国家重点研发计划(No. 2018YFA0901600) 资助
摘要:微生物重组表达胶原蛋白来源清洁,同时具有序列设计灵活和高产量高纯度等优点,作为生物材料在组织工程等领域具有广泛的应用前景。然而如何促进重组胶原分子交联,使其形成更加稳定的空间结构是设计重组胶原纳米材料需要克服的难点。文中通过双质粒系统将非天然氨基酸O-(2-溴乙基)-酪氨酸引入细菌胶原蛋白序列中,并对其发酵条件进行优化,结果表明在25 ℃下,以终浓度为0.5 mmol/L的IPTG和0.06%的阿拉伯糖诱导24 h可以获得高纯度含非天然氨基酸的胶原蛋白。将含非天然氨基酸的胶原蛋白与含半胱氨酸的胶原蛋白在pH为9.0的NH4HCO3缓冲液中进行交联,形成了最大分子粒径可达1 μm的聚集体,为重组胶原蛋白生物材料的设计提供了新思路。
关键词:重组胶原蛋白非天然氨基酸表达优化硫醚键交联
Optimization of unnatural amino acid incorporation in collagen and the cross-linking through thioether bond
Yaru Hou*, Meng Zhang*, Fei Xu


Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: October 27, 2020; Accepted: February 8, 2021; Published: February 18, 2021
Supported by: National Natural Science Foundation of China (No. 31800671), National Key Research and Development Program of China(No. 2018YFA0901600)
Corresponding author: Fei Xu. Tel/Fax: +86-510-85197571; E-mail: feixu@jiangnan.edu.cn.
*These authors contributed equally to this study.
Abstract: The source of recombinant collagen is clean, and it has the advantages of flexible sequence design, high yield and high purity, so it has a wide application prospect as biomaterials in tissue engineering and other fields. However, how to promote the cross-linking of recombinant collagen molecules and make them form a more stable spatial structure is the difficulty to be overcome in the design of recombinant collagen nanomaterials. Unnatural amino acid O-(2-bromoethyl)-tyrosine was incorporated into collagen by two-plasmid expression system. The results showed that high-purity collagen incorporated with unnatural amino acid could be obtained by induction with final concentration of 0.5 mmol/L IPTG and 0.06% arabinose at 25 ℃ for 24 hours. The intermolecular cross-linking through thioether bond was formed between collagen molecule incorporated with unnatural amino acid and collagen molecule with cysteine mutation in pH 9.0 NH4HCO3 buffer, which formed aggregates with the largest molecular size up to 1 micrometre. The results pave the way for the design of recombinant collagen biomaterials.
Keywords: recombinant collagenunnatural amino acidexpression optimizationcross-linking through thioether bond
胶原蛋白是哺乳动物体内含量最丰富的蛋白质,人体内胶原蛋白的含量占其总蛋白含量的25%–35%,是细胞外基质最普遍的组成部分[1]。胶原蛋白是由3条多肽链缠绕形成三股螺旋的结构蛋白[2],并通过组装、交联等方式形成胶原纤维、胶原网状蛋白等高阶结构蛋白[3-4]。由于其特殊的结构和组成特点,胶原具有组织修复、支撑以及止血等能力,在食品、生物医学和组织工程等领域具有重要的应用[5-7]。目前畜禽源动物组织是人类获取天然胶原蛋白的主要途径,然而其潜在的生物安全性问题,限制了天然胶原的应用[8]。为了降低动物胶原蛋白生产可能引发的疾病传播风险,研究人员采用微生物重组表达的方式生产胶原蛋白。Brodsky团队研发的化脓性链球菌Streptococcus pyogenes来源的重组胶原蛋白在大肠杆菌中高效表达,无须进行脯氨酸的羟基化修饰即可得到高纯度、高产量的胶原蛋白,其Tm可以接近、甚至略高于人类体温[8-12],且被证实无细胞毒性和非免疫原性[8]。
由于缺乏三股螺旋分子间的作用力,重组胶原蛋白只能形成离散的纤维结构,难以自组装成规则胶原纤维或网状胶原蛋白等高阶结构[10],因此需利用外界交联方式进行重组胶原分子内/分子间交联,使其组装成高阶结构蛋白。传统的交联方式有物理交联和化学交联。其中物理交联包括紫外交联和重度脱水等方式,但物理交联往往交联度低、一致性较差[13-15];化学交联通常使用戊二醛等交联剂进行交联,但添加化学交联剂会导致胶原蛋白不稳定,且交联剂的剂量不易控制。常用的交联方式还包括特殊共价键交联,例如Asai等[16]设计含有半胱氨酸残基的重组弹性蛋白样多肽,低浓度的过氧化氢促使半胱氨酸形成二硫键,溶液反应5 min形成水凝胶;Zhou等[17]合成含有半胱氨酸残基的重组丝弹性蛋白(cSELP),37 ℃温和氧化条件下形成水凝胶。这种共价键的形成需要提供氧化环境,且序列中过多半胱氨酸易导致表达过程中胶原蛋白在周质空间沉积,影响外源表达。
引入非天然氨基酸可以赋予蛋白质新的特性,在生物催化、生物医学等方面具有广泛的应用,如:含非天然氨基酸的蛋白质可用于制备靶向杀死癌细胞的化疗药物结合物以及制备生物聚合物等[18]。对于引入非天然氨基酸遗传操作体系的构建,Deiters等[19]在2003年筛选出可识别终止密码子的大肠杆菌氨酰tRNA合成酶/tRNA对突变体用于标记蛋白质,但其在细菌体内标记效率较低。Wang等[20]引入来源于詹氏甲烷球菌Methanocaldococcus jannaschii的氨酰tRNA合成酶/tRNA对,在大肠杆菌中可以准确识别终止密码子并引入非天然氨基酸。为了进一步提高标记蛋白的产量,Young等[21]对该氨酰tRNA合成酶/tRNA对基因进行优化并构建载体pEVOL,通过优化双质粒系统将引入非天然氨基酸的标记蛋白产量提高了2.5倍。随后,研究人员进一步拓展了该遗传操作体系的应用,Bionda等[22]通过引入O-(2-溴乙基)-酪氨酸(O-(2-bromoethyl)-tyrosine,O2beY) 与多肽链内半胱氨酸反应形成硫醚键,实现大环肽的胞内合成。Moore等[23]通过计算设计在肌红蛋白特定位点引入O2beY和半胱氨酸,二者在蛋白表达过程中自发形成硫醚键,使肌红蛋白Tm值提高了18.0 ℃。目前通过遗传操作引入非天然氨基酸在多肽环化和提高蛋白质稳定性领域得到了初步应用。
本研究以来源于Streptococcus pyogenes的胶原蛋白三股螺旋区的片段B (CL) 为对象进行序列设计,该胶原蛋白片段中脯氨酸含量高,具有较高的稳定性。此来源的胶原蛋白研究较为成熟,可在大肠杆菌中高效表达并形成三股螺旋结构[24],且CL被证实无细胞毒性和非免疫原性,除此之外,CL可通过序列设计引入功能位点。在CL基因序列N端引入终止密码子(NZ),利用双质粒体系在蛋白翻译过程中引入O2beY,并通过发酵优化获得高纯度突变体。另外在CL基因序列两端引入半胱氨酸(2C),对两种突变体的体外交联进行条件优化,为纤维蛋白的组装提供基础。
1 材料与方法1.1 材料1.1.1 菌株与质粒大肠杆菌Escherichia coli BL21(DE3) 菌株及质粒pCold-Ⅲ购于Invitrogen公司,质粒pEVOL由斯克利普斯研究所Peter G. Schultz教授惠赠。基因片段由苏州金唯智生物科技有限公司合成。
1.1.2 培养基与主要试剂胰蛋白酶(Trypsin) 购于赛国生物科技有限公司;蛋白Marker购于TaKaRa公司;异丙基-β-d硫代半乳糖苷(IPTG)、l-阿拉伯糖、氯霉素和氨苄青霉素均购于生工生物工程(上海) 股份有限公司,其余试剂均为市售分析纯。
LB培养基(g/L):酵母粉5,蛋白胨10,氯化钠10。
LB固体培养基(g/L):酵母粉5,蛋白胨10,氯化钠10,琼脂粉15。
TB培养基(g/L):酵母粉24,蛋白胨12,甘油4,K2HPO4 12.54,KH2PO4 2.31。
1.2 方法1.2.1 胶原蛋白在单质粒系统中的异源表达载体构建及转化:将基因片段(V-CL、V-NZ和V-2C) 连接至pCold-Ⅲ载体,构建pCold-CL及pCold-NZ、pCold-2C质粒,利用化学转化法导入E. coli BL(DE3) 感受态中。
种子培养:挑取E. coli BL21(DE3)/pCold-CL及pCold-NZ、pCold-2C的单菌落接种至20 mL LB培养基中,37 ℃、200 r/min培养12 h。
摇瓶发酵:将种子液按1%的接种量接种至100 mL TB培养基中,置于37 ℃、200 r/min摇床培养24 h后,加入1 mL终浓度为1 mmol/L的IPTG,放入25 ℃、200 r/min摇床诱导发酵10 h,再转入15 ℃、200 r/min发酵14 h。根据需要,在以上培养基中加入终浓度为100 μg/mL的氨苄青霉素。
1.2.2 V-NZ在双质粒系统中的异源表达载体转化:将E. coli BL21(DE3)/pCold-NZ制备成感受态,并用化学转化法将质粒pEVOL转化至E. coli BL21(DE3)/pCold-NZ感受态中。
种子培养:挑取带有pCold-NZ和pEVOL的双质粒体系的E. coli BL21(DE3) 单菌落接种至20 mL LB培养基中,37 ℃、200 r/min培养12 h。
摇瓶发酵:将种子液按1%的接种量接种至100 mL TB培养基中,置于37 ℃、200 r/min摇床培养24 h后,同时加入1 mL终浓度为1 mmol/L的IPTG、1 mL终浓度为1 mmol/L的非天然氨基酸O2beY以及1 mL终浓度为0.06%的阿拉伯糖,放入25 ℃、200 r/min摇床诱导发酵10 h,再转入15 ℃、200 r/min发酵14 h。根据需要,在以上培养基中加入终浓度为100 μg/mL的氨苄青霉素和氯霉素。
1.2.3 V-NZ在双质粒系统中的表达优化阿拉伯糖浓度的优化:按照上述摇瓶发酵的方法,将诱导剂阿拉伯糖浓度分别设置为0.02%、0.04%、0.06%、0.08%、0.10%和0.20%,探究阿拉伯糖的浓度对目的胶原蛋白表达的影响。
诱导温度及时间的优化:在上述最优条件基础上,将诱导温度及时间分别设置为25 ℃诱导12 h、15 ℃诱导12 h、25 ℃诱导24 h、15 ℃诱导24 h,探究诱导温度及时间对目的胶原蛋白表达的影响。
IPTG浓度对表达的影响:在上述最优条件基础上,分别用终浓度为0.5 mmol/L、0.7 mmol/L的IPTG诱导,探究IPTG浓度对目的胶原蛋白表达的影响。
1.2.4 胶原蛋白的纯化6 000 r/min离心10 min收集菌体,加入结合缓冲液A (20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、10 mmol/L咪唑、pH 7.4) 重悬菌体,冰浴超声破碎(功率300 W,破碎2 s,间歇3 s,破碎30 min),4 ℃、12 000 r/min离心20 min,收集上清,经0.22 μm滤膜过滤。His TrapTM HP用5倍柱体积结合缓冲液A平衡后,将过滤上清以1 mL/min上样。上样结束后,用洗脱缓冲液B (20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、500 mmol/L咪唑、pH 7.4) 进行梯度洗脱获得目的蛋白,SDS-PAGE分析纯化情况。
1.2.5 胰蛋白酶酶切将纯化后的胶原蛋白与胰蛋白酶混合(混合摩尔比例分别为25︰1,250︰1,2 500︰1),15 ℃酶切24 h,之后使用HiTrap Desalting脱盐柱以超纯水为流动相,流速为5 mL/min进行脱盐,经SDS-PAGE验证后进行真空冷冻干燥。
1.2.6 MALDI-TOF质谱法检测将冻干后的样品溶解成1 mg/mL的胶原蛋白溶液进行质谱鉴定。
1.2.7 圆二色谱检测将冻干后的样品用10 mmol/L、pH 7.4的PBS缓冲液溶解成1 mg/mL的胶原蛋白溶液,4 ℃平衡24 h后进行热稳定性测定。
1.2.8 交联反应条件的优化将冻干后的NZ和2C突变体(混合摩尔比例为1︰1) 分别使用pH 7.4的PBS缓冲液、pH 8.5的HEPES缓冲液以及pH为9.0的NH4HCO3缓冲液溶解成2.5 mmol/L的溶液,在15 ℃恒温箱内反应。上述缓冲液浓度均为50 mmol/L。
1.2.9 浊度测定将CL、NZ、2C以及MIX (NZ和2C混合摩尔比例为1︰1) 使用pH 9.0的50 mmol/L NH4HCO3缓冲液溶解成5 mmol/L的溶液,在15 ℃恒温箱内反应,观察溶液变化并测定其在波长为313 nm处的吸光值变化。
2 结果与分析2.1 胶原蛋白的表达优化2.1.1 胶原蛋白序列设计本研究设计思路如图 1所示,来源于Streptococcus pyogenes的胶原蛋白序列片段,以V-CL表示[22, 25],其中包括辅助三股螺旋正确折叠的V结构域和三股螺旋结构域CL;V-NZ表示在CL基因序列N端添加终止密码子TAG,并利用双质粒体系在蛋白翻译过程中引入非天然氨基酸O2beY;V-2C表示在CL序列两端插入半胱氨酸,以期O2beY与半胱氨酸交联形成硫醚键,从而促进胶原蛋白的组装。V-NZ和V-2C经酶切获得具有三股螺旋结构的NZ和2C,混合后可进行交联反应。
 |
图 1 重组胶原蛋白硫醚键交联的设计策略 Fig. 1 Design strategy of thioether bond cross-linking of recombinant collagen (   |
| 图选项 |
2.1.2 胶原蛋白在单质粒系统中的表达由于未转入带有氨酰tRNA合成酶/tRNA对基因的pEVOL质粒,E. coli BL2 (DE3)/pCold-NZ菌株无法识别终止密码子并引入O2beY,V-NZ胶原蛋白的翻译在TAG处终止,电泳图谱中显示约为10.0 kDa的特征条带(图 2),与理论分子量9.86 kDa相近。V-2C引入两个半胱氨酸突变,蛋白表达完整,电泳图谱中显示约为21.30 kDa的特征条带(图 2),由于胶原域序列中含大量脯氨酸,其特殊构象使得胶原蛋白在SDS-PAGE中会发生分子量迁移,条带大小约为理论分子量的1.4倍[10, 26-27]。
 |
| 图 2 单质粒系统表达产物的SDS-PAGE电泳分析 Fig. 2 SDS-PAGE analysis of the expression products in single plasmid system. M: premixed protein marker; T: whole cell protein after induction; S: soluble extract after induction; 1–2: purified protein. |
| 图选项 |
2.1.3 V-NZ在双质粒系统中的表达pEVOL质粒含有氨酰tRNA合成酶/tRNA对基因,将其转化至E. coli BL21(DE3)/pCold-NZ中构建双质粒系统,可识别终止密码子TAG并在蛋白质翻译后修饰过程中将培养基中游离的O2beY引入V-NZ序列使基因完整表达,理论分子量约为17.98 kDa。但由于氨酰tRNA合成酶的表达量不足,导致表达产物有两种,分别对应电泳图中10.0 kDa左右未引入O2beY的蛋白条带和21.2 kDa引入O2beY目的蛋白条带(图 3)。为了获得高纯度的目的蛋白,对阿拉伯糖浓度、诱导温度和时间以及IPTG浓度进行优化。
 |
| 图 3 双质粒系统表达产物的SDS-PAGE电泳分析 Fig. 3 The SDS-PAGE analysis of the expression products in two-plasmid system. M: premixed protein marker; T: whole cell protein after induction; S: soluble extract after induction; 1: purified protein. |
| 图选项 |
2.1.4 阿拉伯糖浓度的优化增强araBAD启动子的诱导能力可提高氨酰tRNA合成酶的表达量[21],因此探究了阿拉伯糖的浓度对目的蛋白表达的影响。随着阿拉伯糖浓度的增加,V-NZ基因所表达的完整V-NZ蛋白占该基因表达的比例如图 4所示,分别为70%、55%、80%、66%、63%以及65%。当阿拉伯糖浓度为0.06%时,完整蛋白占比最大,纯化后其产量约为14 mg/L。因此,在后续条件优化中阿拉伯糖浓度为0.06%。
 |
| 图 4 阿拉伯糖对胶原蛋白表达的影响 Fig. 4 The effect of arabinose on collagen expression. M: premixed protein marker; T: whole cell protein after induction; S: soluble extract after induction; 1–6: purified protein. |
| 图选项 |
2.1.5 诱导温度及时间的优化Peng等[28]对pCold-Ⅲ上启动子lacI的诱导时间进行研究,发现25 ℃诱导10 h后转入15 ℃诱导14 h的诱导方式有利于蛋白的表达,然而由于氨酰tRNA合成酶/tRNA对的表达量有限,通过优化诱导温度及时间使目的蛋白的表达与氨酰tRNA合成酶的表达及识别相匹配,更有利于获得高产量完整蛋白。如图 5所示,诱导温度为15 ℃时,蛋白产量最低,在此条件下改变诱导时间(12 h和24 h) 对完整蛋白表达量影响较小,两种条件下产量约为5–8 mg/L;诱导条件为25 ℃、12 h时完整蛋白所占比例为85%,其产量为10 mg/L;诱导条件为25 ℃、24 h时完整蛋白占比90%,其产量为17 mg/L。因此,选择25 ℃诱导24 h作为后续诱导温度和时间。
 |
| 图 5 诱导温度及时间对胶原蛋白表达的影响 Fig. 5 Effect of induction temperature and time on collagen expression. M: premixed protein marker; T: whole cell protein after induction; S: soluble extract after induction; 1–4: purified protein. |
| 图选项 |
2.1.6 IPTG浓度的优化为探究IPTG的诱导浓度对完整蛋白表达的影响,将其浓度分别设置为0.5 mmol/L和0.7 mmol/L。图 6中IPTG浓度为0.5 mmol/L时,V-NZ完整蛋白纯度接近100%,而IPTG浓度为0.7 mmol/L时,完整蛋白占比约为95%。因此优化后采用IPTG浓度为0.5 mmol/L。通过以上条件优化,V-NZ的表达量达20 mg/L,纯度接近100%。
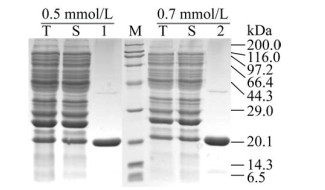 |
| 图 6 IPTG浓度对胶原蛋白表达的影响 Fig. 6 The effect of IPTG concentration on collagen expression. M: premixed protein marker; T: whole cell protein after induction; S: soluble extract after induction; 1–2: purified protein. |
| 图选项 |
2.2 突变胶原蛋白的表征2.2.1 胶原蛋白的分子量鉴定重组胶原蛋白V-NZ包括V结构域和三股螺旋结构域NZ,其中胰蛋白酶可以识别两个结构域间的酶切位点(LVPR↓GS),且可水解碱性氨基酸(赖氨酸、精氨酸) 的羧基与其他氨基酸的氨基之间的肽键。经胰蛋白酶处理后,V结构域被酶切成多条含2–20个氨基酸残基的肽段;而在V结构域的辅助下NZ在胞内形成刚性的三股螺旋结构,胰蛋白酶无法在短时间内切割。不同浓度胰蛋白酶酶切V-NZ的结果如图 7所示。当摩尔比例为25︰1时,6 h内完全切除V结构域,酶切时间最短,但胰蛋白酶的含量最高,高浓度的胰蛋白酶在溶液中长时间存在可能导致胶原蛋白三股螺旋被消化[29],且后续去除困难;当摩尔比例为2 500︰1时,V结构域在24 h内被完全切除,胰蛋白酶用量最低,但酶切时间太长;当摩尔比例为250︰1时,胰蛋白酶含量适中,9 h内V结构域被完全切除。因此,选择摩尔比例为250︰1的胰蛋白酶浓度酶切。
 |
| 图 7 胰蛋白酶浓度对切除V结构域的影响 Fig. 7 The effect of trypsin concentration on V-domain cleavage. 0–24: trypsin digestion time (h). |
| 图选项 |
对酶切后脱盐冻干的样品进行质谱鉴定(图 8),表 1分别列出野生型和突变体的实际分子量和理论分子量。结果表明,表达的胶原蛋白实际分子量和理论分子量误差低于5%,冻干后的样品为正确表达的胶原蛋白样品。
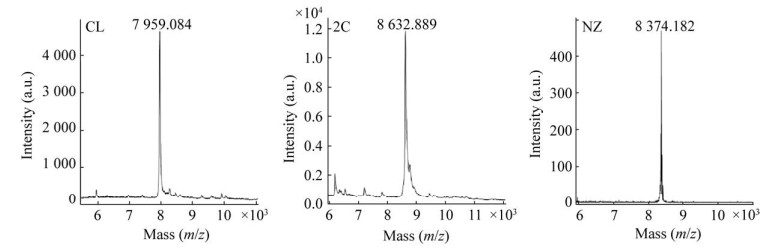 |
| 图 8 酶切后胶原蛋白的质谱鉴定 Fig. 8 Mass spectrometric of collagen after trypsin digestion. |
| 图选项 |
表 1 酶切后胶原蛋白的计算值与实验值Table 1 Calculated and observed values of collagen after digestion
| Collagen | Calculated value (g/mol) | Observed value (g/mol) |
| CL | 7 949.52 | 7 959.08 |
| NZ | 8 391.68 | 8 374.18 |
| 2C | 8 625.25 | 8 632.89 |
表选项
2.2.2 胶原蛋白的热稳定性检测将表达正确的胶原蛋白样品配制成1 mg/mL的溶液,对其进行圆二色谱鉴定。图 9A中胶原蛋白在225 nm处出现特征性正吸收峰,说明胶原蛋白三股螺旋的正确折叠。将图 9B热变图谱进行拟合,计算出野生型胶原蛋白(CL) 和突变体(2C和NZ) 的Tm值分别为26.97 ℃、29.89 ℃以及27.40 ℃,2C可能形成少量链间二硫键导致Tm提高约3 ℃,而NZ的突变对胶原蛋白的热稳定性影响不大。
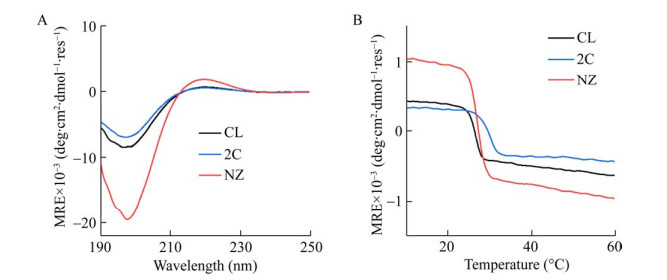 |
| 图 9 胶原蛋白圆二色谱图 Fig. 9 Circular dichroism of purified collagen. (A) CD spectra. (B) Melting curves. |
| 图选项 |
2.3 硫醚键形成的优化胶原蛋白的热变谱图(图 9B) 显示,20 ℃条件下突变体NZ开始解旋,为了在体外交联过程中保持胶原蛋白的三股螺旋结构,本研究选用15 ℃作为体外交联的反应温度。
Xuan等[30]发现非天然氨基酸与蛋白质进行体外交联时,缓冲液的pH会影响成键效率,因此本研究将NZ和2C在不同pH的缓冲液中进行反应。反应不同时间的SDS-PAGE如图 10所示。在不同pH的缓冲液条件下反应48 h后,对照组(CL、NZ、2C) 和混合溶液(MIX) 分子量无明显变化;反应96 h后,对照组分子量不变,混合溶液中出现分子量大小约为25.7 kDa的条带,接近NZ和2C的表观分子量之和,说明NZ和2C部分分子间形成硫醚键。其中,pH为7.4、8.5、9.0时,通过SDS-PAGE上条带浓度估算体外硫醚键的形成率分别约为5%、12%和30%。
 |
| 图 10 不同pH下胶原硫醚键的形成情况 Fig. 10 Collagen thioether bond formation at different pH. 1–4: CL, NZ, 2C, NZ+2C (MIX). |
| 图选项 |
根据图 11动态光散射结果,在不同pH的缓冲液条件下,0–96 h对照组分子粒径基本不变,而混合溶液的分子粒径随着pH的增长逐渐增加。当反应96 h后,pH 7.4混合溶液中分子的粒径为40.33 nm、187.1 nm和859.7 nm,其比例为43.4%、17.0%和39.6% (图 11B);pH 8.5混合溶液中分子的粒径为93.42 nm和552.3 nm,比例为53.8%和46.2% (图 11C);pH 9.0混合溶液中分子的粒径为139.6 nm和1 022 nm,比例为32.0%和68.0% (图 11D)。结果表明硫醚键易在碱性条件下形成,pH值越大硫醚键的形成率越高。
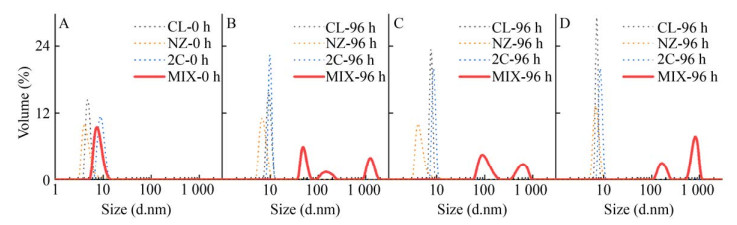 |
| 图 11 胶原蛋白溶液的分子粒径分布图 Fig. 11 Size distribution of collagen solution. (A) Reaction 0 h. (B) Reaction 96 h in pH 7.4 PBS buffer. (C) Reaction 96 h in pH 8.5 HEPES buffer. (D) reaction 96 h in pH 9.0 NH4HCO3 buffer. |
| 图选项 |
此外,Xiang等[31]将引入O2beY的ZSPA亲和蛋白突变体和引入半胱氨酸的Z蛋白突变体在pH 7.4的PBS缓冲液中进行分子间交联,37 ℃反应1 h后交联效率达43%,提高交联反应温度能大幅度缩短交联反应时间,然而为了维持胶原蛋白的三股螺旋结构,本实验交联反应在15 ℃进行,后续可对胶原蛋白进行序列改造提高胶原蛋白的热稳定性,从而在较高反应温度下提高交联效率。
2.4 胶原蛋白的浊度测定根据优化后的条件对NZ和2C进行交联,结果如图 12所示。反应0 h时,对照组保持透明,混合溶液呈淡黄色;反应96 h后,对照组溶液仍保持透明,而混合溶液更加浑浊、颜色加深并出现少量聚集体沉淀。而且从各个样品在313 nm处的吸光值变化看出[32],在0–96 h对照组CL、NZ、2C溶液的吸光值基本不变;而混合溶液的吸光值随着交联时间的增长逐渐增加,96 h吸光值为0.28,是0 h的2.12倍。结果表明,NZ和2C分子间交联,导致分子容易聚集沉淀,从而使得混合溶液浊度增加。
 |
| 图 12 胶原蛋白溶液的浊度测定 Fig. 12 Turbidity kinetics of collagen solution. A: CL; B: NZ; C: 2C; D: MIX. |
| 图选项 |
采用体外交联形成硫醚键的方式促进胶原蛋白自组装,与之前报道的在重组胶原蛋白序列中分别引入酪氨酸和半胱氨酸,通过添加氧化剂促进其交联的方法[9]相比,反应条件温和,无须添加其他试剂和提供特殊氧化还原环境。虽然根据胶原蛋白溶液的杨氏模量变化(数据未展示),混合溶液尚未形成水凝胶,但可通过增加序列长度以及在多位点插入非天然氨基酸等方式改造重组胶原蛋白,提高其稳定性、缩短交联时间,以及促进其多形貌自组装形成高阶结构,为仿生材料的设计和开发提供参考。此外,可通过在重组胶原蛋白序列中引入功能位点,如基质金属蛋白酶位点、整合素位点、纤维连接蛋白结合位点和肝素结合位点等来改造多功能重组胶原蛋白,为胶原蛋白材料提供新的设计方向。
3 结论本研究利用双质粒系统在重组胶原蛋白中引入非天然氨基酸O2beY,并对含非天然氨基酸的重组胶原蛋白进行表达优化,与优化前相比,产量提高42.9%,纯度接近100%。对含非天然氨基酸的重组胶原蛋白和含半胱氨酸的重组胶原蛋白进行体外交联反应优化,发现提高缓冲液pH对硫醚键的形成更有利,分子间硫醚键的形成可以增大胶原蛋白溶液中的分子粒径。在重组胶原蛋白中引入非天然氨基酸和半胱氨酸并进行体外交联,为典型纤维状蛋白—胶原蛋白在纳米尺度的组装设计提供了新思路。
参考文献
| [1] | Brodsky B, Persikov AV. Molecular structure of the collagen triple helix. Adv Prot Chem, 2005, 70: 301-339. |
| [2] | Sylvestre P, Couture-Tosi E, Mock M. A collagen-like surface glycoprotein is a structural component of the Bacillus anthracis exosporium. Mol Microbiol, 2010, 45(1): 169-178. |
| [3] | Ramachandran GN. Structure of collagen. Nature, 1956, 177(4511): 710-711. |
| [4] | Kadler KE, Holmes DF, Trotter JA, et al. Collagen fibril formation. Biochem J, 1996, 316(1): 1-11. DOI:10.1042/bj3160001 |
| [5] | 田思涵. 胶原蛋白的概况、性质与应用. 化工管理, 2018(5): 160. Tian SH. Introduction, properties and application of collagen. Chem Enterpr Manag, 2018(5): 160 (in Chinese). DOI:10.3969/j.issn.1008-4800.2018.05.126 |
| [6] | 陈秀金, 曹健, 汤克勇. 胶原蛋白和明胶在食品中的应用. 郑州工程学院学报, 2002, 23(1): 66-69, 93. Chen XJ, Cao J, Tang KY. Application of collagen and gelatin in food industry. J Zhengzhou Inst Eng, 2002, 23(1): 66-69, 93 (in Chinese). |
| [7] | Wang XY, Kim HJ, Wong C, et al. Fibrous proteins and tissue engineering. MaterialsToday, 2006, 9(12): 44-53. |
| [8] | Peng YY, Yoshizumi A, Danon SJ, et al. A Streptococcus pyogenes derived collagen-like protein as a non-cytotoxic and non-immunogenic cross-linkable biomaterial. Biomaterials, 2010, 31(10): 2755-2761. DOI:10.1016/j.biomaterials.2009.12.040 |
| [9] | Stoichevska V, An B, Peng YY, et al. Formation of multimers of bacterial collagens through introduction of specific sites for oxidative crosslinking. J Biomed Mater Res Part A, 2016, 104(9): 2369-2376. DOI:10.1002/jbm.a.35772 |
| [10] | Yoshizumi A, Yu ZX, Silva T, et al. Self-association of Streptococcus pyogenes collagen-like constructs into higher order structures. Protein Sci, 2009, 18(6): 1241-1251. DOI:10.1002/pro.134 |
| [11] | Yu ZX, Brodsky B, Inouye M. Dissecting a bacterial collagen domain from Streptococcus pyogenes: sequence and length-dependent variations in triple helix stability and folding. J Biol Chem, 2011, 286(21): 18960-18968. DOI:10.1074/jbc.M110.217422 |
| [12] | Xu Y, Keene DR, Bujnicki JM, et al. Streptococcal Scl1 and Scl2 proteins form collagen-like triple helices. J Biol Chem, 2002, 277(30): 27312-27318. DOI:10.1074/jbc.M201163200 |
| [13] | Rubin AL, Riggio RR, Nachman RL, et al. Collagen materials in dialysis and implantation. Trans Am Soc Artif Intern Organs, 1968, 14: 169-175. |
| [14] | Weadock KS, Miller EJ, Bellincampi LD, et al. Physical crosslinking of collagen fibers: comparison of ultraviolet irradiation and dehydrothermal treatment. J Biomed Mater Res, 1995, 29(11): 1373-1379. DOI:10.1002/jbm.820291108 |
| [15] | Wang HM, Yang ZM. Short-peptide-based molecular hydrogels: novel gelation strategies and applications for tissue engineering and drug delivery. Nanoscale, 2012, 4(17): 5259-5267. DOI:10.1039/c2nr31149f |
| [16] | Asai D, Xu DH, Liu WG, et al. Protein polymer hydrogels by in situ, rapid and reversible self-gelation. Biomaterials, 2012, 33(21): 5451-5458. DOI:10.1016/j.biomaterials.2012.03.083 |
| [17] | Zhou ML, Qian ZG, Chen L, et al. Rationally designed redox-sensitive protein hydrogels with tunable mechanical properties. Biomacromolecules, 2016, 17(11): 3508-3515. DOI:10.1021/acs.biomac.6b00973 |
| [18] | Wang TW, Liang C, Xu HJ, et al. Incorporation of nonstandard amino acids into proteins: principles and applications. World J Microbiol Biotechnol, 2020, 36(4): 60-74. DOI:10.1007/s11274-020-02837-y |
| [19] | Deiters A, Cropp TA, Mukherji M, et al. Adding amino acids with novel reactivity to the genetic code of Saccharomyces cerevisiae. J Am Chem Soc, 2003, 125(39): 11782-11783. DOI:10.1021/ja0370037 |
| [20] | Wang L, Brock A, Herberich B, et al. Expanding the genetic code of Escherichia coli. Science, 2001, 292(5516): 498-500. DOI:10.1126/science.1060077 |
| [21] | Young TS, Ahmad I, Yin JA, et al. An enhanced system for unnatural amino acid mutagenesis in E. coli. J Mol Biol, 2010, 395(2): 361-374. DOI:10.1016/j.jmb.2009.10.030 |
| [22] | Bionda N, Cryan AL, Fasan R. Bioinspired strategy for the ribosomal synthesis of thioether-bridged macrocyclic peptides in Bacteria. ACS Chem Biol, 2014, 9(9): 2008-2013. DOI:10.1021/cb500311k |
| [23] | Moore EJ, Zorine D, Hansen WA, et al. Enzyme stabilization via computationally guided protein stapling. Proc Natl Acad Sci USA, 2017, 114(47): 12472-12477. DOI:10.1073/pnas.1708907114 |
| [24] | Rasmussen M, Bj?rck L. Unique regulation of SclB — a novel collagen-like surface protein of Streptococcus pyogenes. Mol Microbiol, 2010, 40(6): 1427-1438. |
| [25] | Yu ZX, An B, Ramshaw JAM, et al. Bacterial collagen-like proteins that form triple-helical structures. J Struc Biol, 2014, 186(3): 451-461. DOI:10.1016/j.jsb.2014.01.003 |
| [26] | Wang L, An XX, Yang FM, et al. Isolation and characterisation of collagens from the skin, scale and bone of deep-sea redfish (Sebastes mentella). Food Chem, 2008, 108(2): 616-623. DOI:10.1016/j.foodchem.2007.11.017 |
| [27] | Li LB, Fan DD, Ma XX, et al. High-level secretory expression and purification of unhydroxylated human collagen α1(Ⅲ) chain in Pichia pastoris GS115. Biotechnol Appl Biochem, 2015, 62(4): 467-475. DOI:10.1002/bab.1297 |
| [28] | Peng YY, Howell L, Stoichevska V, et al. Towards scalable production of a collagen-like protein from Streptococcus pyogenes for biomedical applications. Microb Cell Fact, 2012, 11: 146-153. DOI:10.1186/1475-2859-11-146 |
| [29] | Yu ZX, Visse R, Inouye M, et al. Defining requirements for collagenase cleavage in collagen type Ⅲ using a bacterial collagen system. J Biol Chem, 2012, 287(27): 22988-22997. DOI:10.1074/jbc.M112.348979 |
| [30] | Xuan WM, Shao SD, Schultz PG. Protein crosslinking by genetically encoded noncanonical amino acids with reactive aryl carbamate Side Chains. Angew Chem Int Ed, 2017, 56(18): 5096-5100. DOI:10.1002/anie.201611841 |
| [31] | Xiang Z, Lacey VK, Ren HY, et al. Proximity-enabled protein crosslinking through genetically encoding haloalkane unnatural amino acids. Angew Chem Int Ed, 2014, 53(8): 2190-2193. DOI:10.1002/anie.201308794 |
| [32] | Xu F, Ji L, Vikas J, et al. Compositional control of higher order assembly using synthetic collagen peptides. J Am Chem Soc, 2011, 134(1): 47-50. |
