

海理工大学 医疗器械与食品学院,上海 200093
收稿日期:2020-05-16;修改日期:2020-06-16
基金项目:国家重点研发计划(Nos. 2018YFC1602900,2018YFC1602500) 资助
摘要:小鼠杂交瘤单克隆抗体来源稳定、后期易制备、产量高,是免疫学中使用最为普遍的抗体。传统的耗时费力的杂交瘤制备技术无法满足日益增长的市场需求。文中从抗原设计筛选、B细胞富集与筛选、骨髓瘤细胞的改造、融合技术的改进、阳性杂交瘤细胞筛选及单克隆抗体性能快速测定中所涉及的快速制备技术方面进行阐述,以期为系统化的小鼠杂交瘤单克隆抗体的快速制备方法提供参考。
关键词:小鼠杂交瘤单克隆抗体快速制备抗原特异性
Research progress in the rapid preparation of monoclonal antibodies of mouse hybridoma
Shuiqin Fang, Cheng Liu, Junfei Ma, Shuaishuai Yan, Dongpo Xu, Qing Liu


School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China
Received: May 16, 2020; Received in revised form June 16, 2020
Supported by: National Key Research and Development Program of China (Nos. 2018YFC1602900, 2018YFC1602500)
Corresponding author: Qing Liu. Tel/Fax: +86-21-65710368; E-mail: liuq@usst.edu.cn.
Abstract: Mouse hybridoma monoclonal antibody is the most commonly used antibody in immunology because of its stable source, easy preparation in later stage and high yield. The traditional time-consuming and laborious hybridoma preparation technology could not meet the growing market demand. In this paper, we describe the rapid preparation techniques involved in antigen design and screening, B cell enrichment and screening, transgenic myeloma cells, fusion technology improvement, positive hybridoma cell screening and rapid detection of monoclonal antibody performance, to provide a reference for rapid preparation of mouse hybridoma monoclonal antibody.
Keywords: mouse hybridomamonoclonal antibodyrapid preparationantigen-specific
1975年德国****Kohler和Milstein成功将骨髓瘤细胞和产生抗体的B淋巴细胞融合为杂交瘤细胞[1],这种杂交瘤细胞既具有可产生只针对某一特定抗原决定簇的单克隆抗体的B淋巴细胞特性,同时也具有瘤细胞无限增殖的特性。杂交瘤技术的创建,开创了抗体制备和使用的新纪元,结合纳米粒子[2-3]、电化学[4]、核酸传感器[5]和芯片[6]等新材料和新技术的改进,使得单克隆抗体已经广泛应用于食品安全有害物检测[7]、疾病早期筛查[8]和免疫治疗[9]等领域,而且在未来几年内,基于基本情况的销售预测、保守的销售预测和乐观的销售预测,单克隆抗体的市场规模都将保持一个高速增长的态势[10]。
小鼠杂交瘤单克隆抗体来源稳定、后期易制备、产量高[11],是免疫检测分析和疾病早期筛查使用最为普遍的抗体。制备良好的小鼠杂交瘤单克隆抗体涉及很多技术环节,包括抗原的设计筛选、动物免疫、细胞融合筛选技术、抗体的纯化方法等,每一个技术环节都缺一不可,本文主要对小鼠杂交瘤单克隆抗体制备过程及每个环节中所涉及的快速制备技术方面进行阐述。
1 小鼠杂交瘤融合技术1.1 常规小鼠杂交瘤融合技术小鼠杂交瘤是在抗原经鉴定后进行制备,免疫动物,测定血清效价,效价达到要求后,将脾细胞和骨髓瘤细胞融合,经过HAT和HT选择性培养基的筛选和间接酶联免疫吸附测定(Enzyme linked immunosorbent assay,ELISA) 的筛选确认,获得的杂交瘤既能无限增殖又能分泌针对抗原特异性的杂交瘤抗体[1],具体流程如图 1所示。Zhao等通过设计多肽的方法规避小鼠对DKK2 (Dickkopf-related protein 2) 的免疫耐受,根据DKK2序列设计并合成了6条多肽作为免疫原来刺激小鼠的免疫反应,结果发现有5条多肽产生的抗血清都能够识别重组DKK2蛋白,且分别获得了针对其中3条多肽的具有中和活性的鼠源单抗1-5F8、5-1A10和7-1A0。这些鼠源单抗被证明不仅能够在体外实验抑制DKK2信号通路,也能够在动物体内抑制肿瘤生长[12]。暴发于2019年底的新型冠状病毒肺炎(COVID-19) 疫情已成为全球性的公共卫生大事件,已有采用小鼠杂交瘤技术制备的中和抗体[13]。
 |
| 图 1 小鼠杂交瘤融合示意图 Fig. 1 Schematic diagram of mouse hybrid tumor fusion. |
| 图选项 |
1.2 转基因小鼠杂交瘤技术通过转基因技术将编码人源性的抗体基因转入到抗体基因缺失的小鼠中,根据转入的基因不同,可将转基因小鼠杂交瘤制备的抗体分为嵌合抗体[14]和全人源化抗体[15]。嵌合抗体是由将鼠源性抗体的可变区基因与人源性抗体的恒定区基因通过DNA重组拼接,与载体进行组装,转染至细胞中表达的抗体分子。因其减少了鼠源性成分,从而降低了鼠源性抗体引起的排斥反应,并有助于提高疗效[14]。Golsaz等构建的人鼠嵌合抗体4G4,竞争ELISA证明两种抗体,在乙型肝炎病毒表面抗原(Hepatitis B surface antigen,HBsAg) 中结合相同的表位。用ELISA和Western blotting进行抗原结合研究表明,4G4保留了亲本小鼠抗体的亲和力和特异性,并显示出对13种HBsAg逃逸突变体的反应类似的情形。即使在最低浓度下,细胞培养中的乙型肝炎病毒(Hepatitis B,HBV)中和能力也相当高[16]。人源化抗体就是构建的人鼠嵌合抗体,而全人源化抗体,是指通过基因重组技术,将人类编码抗体的基因全部转移到经过基因改造的抗体基因缺失的小鼠中,使得小鼠表达系统能够完全表达人类的抗体。
2 抗原设计筛选2.1 半抗原设计筛选半抗原(Hapten),又称不完全抗原(Incomplete antigen),是指某些分子量小、结构比较单一的物质单独免疫时不能诱导宿主免疫应答,即不具备免疫原性。常见的半抗原有小分子药物[17-18]、真菌毒素[19]、河豚毒素[20]、糖类、核酸和类脂[21]等,这些物质均不能引起机体的免疫应答,需要偶联牛血清白蛋白(BSA)、卵清蛋白(OVA) 或者模拟肽,才能产生免疫原性,才可用于制备单克隆抗体。
2.2 完全抗原设计筛选选择合适的靶蛋白片段作为抗原是研究人员在抗体开发或疫苗设计的第一步所面临的一个关键挑战,因为针对截短蛋白产生的抗体必须能够检测到原蛋白,而经过设计筛选的抗原[22],往往能够有效地引起宿主机体的免疫应答,能够快速地获得抗体,起到事半功倍的作用。因此,在抗原进行免疫时,有必要对抗原生物学信息进行查询、设计和筛选。
对于生物学信息比较清楚的抗原,可从Uniprot、AntigenDB、OMPdb等数据库中收集抗原蛋白组序列信息及蛋白三维空间结构信息,使用CD-HIT等工具对蛋白序列数据进行去冗余,得到非冗余蛋白组所构建的数据库。首先对数据库中抗原免疫原性进行分析,利用预测软件(BCpred、Bepitope) 对蛋白上B细胞线性表位进行预测和预测工具(SYFPEITH、CTL-Pred) 对T细胞表位进行预测[23]。基于预测表位肽段,对各肽段打分进行标准化,利用排序融合等机器学习算法构建免疫原性排序模型。其次,对数据库中抗原的结构进行分析,使用同源建模工具SWISS-MODEL,以PDB数据库中序列相似性高的结构为模板[24],构建蛋白三维空间结构模型。利用TMalign及Multiprot工具,对蛋白空间表位结构的三维结构相似性进行计算。最后利用原核或真核表达系统对计算筛选得到的候选靶标进行表达。Mahboubeh等利用预测表达的M2型丙酮酸激酶(M2 pyruvate kinase,PKM2) 蛋白制备的抗体不仅能够识别表达的PKM2蛋白,也能识别乳腺癌MCF-7细胞中的蛋白[22]。
3 B细胞富集与筛选小鼠的淋巴器官由多种类型的细胞组成,包括非B细胞系(40%–60%) 和表达IgM “幼稚” B细胞(40%–60%) 和其他淋巴细胞(< 5%),任何一种细胞均可用于融合,但是只有表达IgG的B细胞(主要为浆细胞) 与骨髓瘤融合后才有可能形成分泌单克隆抗体的杂交瘤细胞,且只有小部分细胞(0.2%–5%) 表达抗原特异性抗体[25]。传统的杂交瘤技术以聚乙二醇(Polyethylene glycol,PEG) 作为融合剂,将脾细胞与骨髓瘤细胞融合筛选杂交瘤,该方法融合效率低,只有5×10–6[26],因此,有必要对效应B细胞进行筛选和富集,提高融合率。
目前,对B细胞的分选主要依赖流式细胞仪[26-27]来完成。Dale等利用CD45R免疫磁珠对B细胞进行富集,然后利用流式细胞仪对荧光标记的CD19抗体和IgG+双荧光信号的单个B细胞进行分选[26]。Shiakolas等利用流式细胞仪对荧光标记的抗原和IgG+双荧光信号的单个B细胞进行分选,并利用液滴微流控进行封装和分选来完成针对抗原特异性单个B细胞进行测序[28]。利用流式细胞仪针对抗原特异性的单个B细胞进行分选,能够有效地获得针对抗原的抗体序列并对其进行表达,获得重组单克隆抗体。采用此方法筛选得到的B细胞活性较低,通常情况下,只能用于重组单克隆抗体的生产。
而采用联合抗小鼠IgM的抗体和小鼠Pan-B细胞分选试剂盒(Miltenyi) 去除IgM+细胞和非B细胞,实现了对效应B细胞的富集。该试剂盒包含多种针对细胞表面抗原的生物素化单抗,如表达在T细胞上的CD4和CD90.2抗原,表达在髓系细胞上的CD11c、CD49b和Gr-1抗原,以及表达在红细胞上的Ter-119抗原。利用抗生物素的磁珠分选去除生物素抗体连接的细胞,结合IgM抗体的分选去除的B细胞数量,细胞数量共减少约20倍,由于技术原因,PEG融合的结果不一致。而电融合的总克隆孔数、产生IgG的克隆孔数和产生靶特异性IgG的克隆孔数比PEG融合高约1.5–3.0倍。而采用此方法应用在大鼠上,结果表明T细胞和IgM+ B细胞的联合分选导致脾脏细胞数量减少约9倍,与未分选的细胞相比,分选后克隆孔减少了大约10倍,但分泌抗原特异性IgG的克隆孔在克隆孔总数中的百分比增加了约5倍[25]。
4 骨髓瘤细胞的改造在杂交瘤细胞培养初期,上清液中抗体的浓度通常很低,如果可以暂时限制细胞将抗体释放到培养基中,通过抗原抗体的结合可以快速地对杂交瘤细胞进行分选。在重组抗体的噬菌体展示技术中,单克隆抗体随着噬菌体的外壳蛋白表达而表达,目标抗原与外壳蛋白上的抗体进行结合,从而保证基因型(抗体编码基因) 和表型(产生的抗体) 之间的联系。而将这一基本原理赋予杂交瘤细胞技术,需要将分泌的抗体捕获到杂交瘤细胞表面。过去已经完成了用生物素对抗体产生细胞进行表面标记的方法,该方法可以通过链霉素结合的配体与抗体结合将细胞分离出来。但是,化学表面标记通常是无法预测的,并且可能会干扰正常功能和细胞活力。Listek等通过构建质粒转染了用于杂交瘤融合的骨髓瘤细胞,如图 2所示,通过该技术,融合后的杂交瘤分泌生物素受体肽在细胞膜表面,加入链霉亲和素标记的抗原,链霉亲和素与生物素受体肽相连接,当分泌的抗体具有所需的抗原特异性时,它们就会与相应的杂交瘤细胞相连,加入荧光标记的二抗会与抗体进行结合,再利用流式细胞仪对具有荧光信号的杂交瘤进行识别和分选。此外,这个系统还可以选择同种型抗体并且筛选潜在的交叉反应性[29]。
 |
| 图 2 修饰后的瘤细胞用于抗原特异性筛选、交叉反应性筛选、亚型特异性筛选示意图[29] Fig. 2 Schematic diagram of modified tumor cells for antigen-specific screening, cross-reactivity screening and isotype-specific screening[29]. |
| 图选项 |
5 融合技术的改进5.1 常规融合技术常规的杂交瘤融合技术,主要是将一定数量比例的小鼠脾细胞和骨髓瘤细胞在PEG作用下,小鼠脾细胞和骨髓瘤细胞融合为杂交瘤细胞[30]。
5.2 电融合技术电融合技术是指将脾细胞与小鼠骨髓瘤细胞在电脉冲场的作用下融合为杂交瘤细胞的技术,该方法避免了常规融合技术的化学试剂污染。但电融合法生产杂交瘤的效率仍然较低,其原因在于两种细胞在融合前的排序是随机结合,尤其是当两种细胞大小有较大差异时,排序电压更容易让大细胞与大细胞接触,而需要融合的两种细胞接触机会减少,导致融合效率降低。吴梦等在电融合前采用生物素、链霉亲和素分别标记脾细胞和骨髓瘤细胞,然后对两种细胞进行相互配对。结果表明,脾细胞和SP2/0细胞经过生物素、链霉亲和素处理后,增加了两种细胞的接触机会,减少了相同细胞融合的几率。因此,用改良电融合法制备杂交瘤的数量明显高于正常电融合法,大大提高了融合效率[31]。Kato等采用脾细胞于CpG寡聚脱氧核苷酸中共孵育,然后再电融合,融合率和产抗体的细胞数量都得到提高[32]。
6 阳性杂交瘤分选6.1 常规阳性杂交瘤分选方法常规筛选阳性杂交瘤方法是在杂交瘤融合后,经过选择性培养基和间接ELISA筛选,轻轻将阳性杂交瘤细胞吹起并计数,稀释至100个细胞/孔铺8个孔、稀释至10个细胞/孔铺8个孔、稀释至1个细胞/孔铺80个孔,每孔100 μL,并于第二天在倒置显微镜下查孔,查含有单个细胞的微孔或几个细胞紧挨着的小细胞团[33]。有限稀释法的次数取决于单个杂交瘤细胞的获得,且每次亚克隆培养时间需要7–10 d,并需要间接ELISA进行阳性确认。有限稀释法决定了亚克隆不能一次就获得单个杂交瘤细胞,需要反复再反复[34],直至克隆到单个细胞为止。细胞培养操作烦琐,工作量大,且会在多次克隆中丢失一些其他亚型的杂交瘤细胞。
6.2 半固体筛选方法为了克服有限稀释法的缺陷,1982年Davis等利用甲基纤维素构建了半固体培养基,使得杂交瘤能够在半固体培养基中有效地形成单细胞群落[35]。甲基纤维素半固体培养基克隆化培养杂交瘤细胞比有限稀释法要容易许多,主要是融合细胞彼此分离,呈集落生长,相互不产生干扰、不混杂,一步即可完成单克隆的分离工作。采用半固体筛选后的杂交瘤细胞,还需进一步扩大培养,通过间接ELISA方法确认单个杂交瘤细胞对抗原的特异性。由于未能对单细胞群落细胞所产生的抗体进行有效测定,需要将半固体培养基中所有的细胞挑选出来,挑选的工作难度依然很大。
6.3 细胞膜荧光免疫吸附测定法在甲基纤维素半固体细胞培养基中,杂交瘤细胞能够有效地形成单细胞群落,在基于半固体快速筛选方法中,如何快速筛选产抗原特异性抗体杂交瘤细胞成为了关键。Akiko和Yoshimoto等分别利用“油链”连接捕获抗体,“油链”锚定在细胞上,细胞分泌的抗体被“油链”的捕获抗体所捕获,加入的荧光标记的检测抗体与分泌的抗体结合,实现了对产抗体的杂交瘤细胞的识别[36-37]。李秀清等利用“油链”将抗原锚定在细胞膜上,通过CSFIA (Cell surface-fluorescence immunosor-bent assay) 方法快速筛选阳性杂交瘤细胞(图 3A),成功解决了针对抗原特异性的问题。其主要操作流程如图 3B所示,通过抗原与“油链”连接,与荧光标记的二抗一起加入到含有杂交瘤细胞的半固体培养基中,“油链”锚定在瘤细胞膜上,分泌的抗体与锚定在瘤细胞上的抗原结合,荧光标记的二抗与抗体结合,洗脱未结合的抗原和二抗,通过倒置荧光显微镜观察,最终在产抗原特异性的抗体的杂交瘤细胞周围形成绿色的荧光。利用该方法可以高效率地筛选出抗孔雀石绿(MG) 和猪流行性腹泻病毒(PEDV) 的阳性杂交瘤克隆。与基于ELISA的筛选方法相比,基于CSFIA的方法能够在不到25%的相应处理时间内分离出两倍以上的杂交瘤克隆[17]。
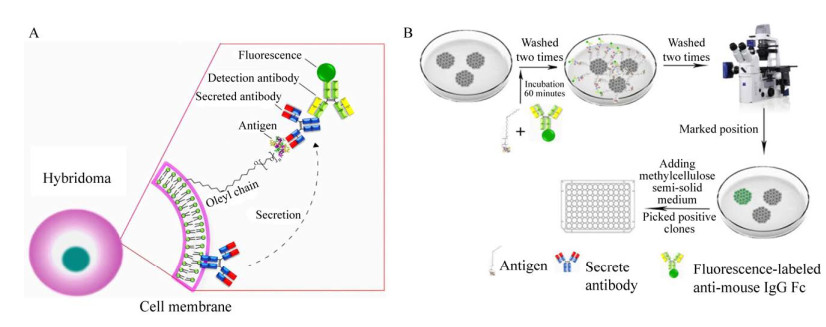 |
| 图 3 细胞膜荧光免疫吸附测定法原理图(A) 及操作过程示意图(B)[17] Fig. 3 Schematic diagram (A) and operation process (B) of surface-fluorescence immunosor-bent assay[17]. |
| 图选项 |
6.4 芯片筛选方法芯片用于杂交瘤的筛选,主要有几个方面的优势:一是针对抗原高灵敏度的测定方法,芯片微孔中,细胞的含量比较少,所产生的抗体的量也比较少;二是芯片体积小通量高,可以测试大量的克隆,避免了克隆丢失的情况出现;三是筛选时间,芯片中的杂交瘤占据的空间比较小,在较短的时间里,就需要进行测定和筛选[34, 38]。Love等利用PDMS (Poly(dimethylsiloxane)) 通过印章打印的方式铺在平板上,直径和长度都是50–100 μm,间隔50–100 μm。每个PDMS板用氧等离子体处理20–30 s,然后浸入到无菌的BSA溶液中来提高润湿性和减少细胞对微孔的粘附性。约25 mm×50 mm×5 mm PDMS板包含25 000个微孔(100 μm直径,间距100 μm),0.5 mL细胞悬液(细胞数量从1×105–5×105) 放置微孔上3–5 min,杂交瘤细胞随机地沉积在微孔的底部,产生约50%–75%的微孔里含有1–3个细胞。被贴在微孔底部并浸没在培养基中培养1周以上,将要检测时,倒置密封在盖玻片上培养2–4 h。微孔里的细胞产生的单抗被二抗捕获,加入不同荧光标记的抗原(图 4A),结果如图 4B所示,这种方法能够有效地区分不同杂交瘤的细胞,且所对应的芯片微孔里细胞生长良好(图 4C)。而与标记抗原方法相比(图 4A),采用标记检测抗体方法(图 4D–E) 可显示对每孔细胞数的变化以及对单个细胞产生的抗体量,具有更高的灵敏性[34]。Paul等在构建的微阵列的基础上使用Python进行半自动数据评估,筛选出产高亲和力抗体的杂交瘤[38]。Nobuo等利用细胞膜荧光免疫吸附测定法和芯片结合的技术构建了一种高通量自动化单细胞分选系统[36]。
 |
| 图 4 微雕刻后玻片上两种抗体测定方法(A:二抗捕获抗体,与标记的抗原结合;B:微阵列显微照片;C:在B中用白框标记的区域的扩展视图和相应微孔的相位对比图像;D:包被抗原捕获抗体,与标记的二抗结合;E:抗体阵列的荧光显微图及相应微孔的相衬图像[34]) Fig. 4 Two methods for detection of antibodies on the surface of a glass slide after microengraving. (A) Secondary antibody captures secreted antibody that can then bind labeled antigen. (B) Micrograph of a microarray prepared using microwells. (C) Expanded view of the region marked with a white box in B and a phase-contrast image of the corresponding microwells. (D) Antigen-coated slides capture secreted antibody that is detected with labeled secondary antibody. (E) Fluorescence micrograph of an array of antibodies and the phase contrast image of the corresponding microwells[34]. |
| 图选项 |
6.5 微流控芯片筛选方法微流控从运行方式分为管道微流控和液滴微流控,应用于细胞分选的微流控较多,而用在阳性杂交瘤筛选的主要是液滴微流控[33]。液滴微流控中单细胞在液滴中的分隔使细胞上的或分泌的蛋白分析成为可能,从而克服了传统的流式细胞仪和荧光激活分选细胞的一些主要限制。如图 5所示,在50 pL液滴中,一个荧光探针和一个包被有抗小鼠IgG抗体的单珠共同分割单个小鼠杂交瘤细胞,经过15 min的细胞培养,单珠子捕获分泌的抗体,当捕获的抗体与探针结合时荧光被定位在珠子上,产生清晰可分辨的荧光,经过检测器的识别,将分泌抗体的杂交瘤分选出来,对未分泌抗体的杂交瘤进行舍弃[39]。
 |
| 图 5 微流控芯片用于杂交瘤筛选方法示意图[39] Fig. 5 Schematic diagram of microfluidic chip for hybridoma screening[39]. |
| 图选项 |
6.6 仪器全自动筛选方法6.6.1 流式细胞仪筛选方法流式细胞仪(Flow cytometer) 基于对荧光标记抗原与抗体亚型结合免疫球蛋白作为筛选指标,能够全自动、快速、高效地对针对抗原特异性且活的杂交瘤细胞进行筛选[40-41]。Dippong等利用过氧化物酶标记的半抗原与荧光标记的抗过氧化物酶的抗体偶联物检测抗体的特异性,用荧光标记的抗小鼠IgG的抗体鉴定抗体的分泌(图 6-1),利用荧光激活细胞分选技术(FACS) 将融合混合物中半抗原特异性的单个杂交瘤细胞分选于多孔板中进行培养(图 6-2),通过直接竞争ELISA检测方法确认(图 6-3),最后得到了分别针对雌激素酮(E1) 和卡马西平(CBZ) 分泌特异性单克隆抗体杂交瘤的方法,避免了烦琐的重复筛选和克隆过程,为其他半抗原特异性抗体制备提供参考[40]。
 |
| 图 6 流式细胞仪用于抗原特异性杂交瘤示意图(1:半抗原和IgG对杂交瘤的识别;2:流式细胞仪对具有双荧光信号的杂交瘤的分选;3:间接ELISA对杂交瘤上清的阳性测试[40]) Fig. 6 Schematic diagram of flow cytometer for antigen-specific hybridoma screening. 1: Recognition of hybridoma by hapten and IgG; 2: Separation of hybridoma with double fluorescence signal by flow cytometry; 3: Indirect ELISA positive test of hybridoma supernatant[40]. |
| 图选项 |
6.6.2 ClonePix FL筛选方法ClonePix FL是赛默飞世尔一款全自动杂交瘤细胞筛选平台,其外表如图 7A所示。其原理是杂瘤细胞在半固体培养基上形成分散的克隆群落,杂交瘤分泌的抗体与培养基中的荧光标记检测试剂或者接种后加入的荧光检测试剂结合,在杂交瘤细胞周围形成荧光聚集的现象,ClonePix FL图像识别软件对荧光进行识别、定位(图 7B),并根据信号指令,自动地将阳性细胞挑选至96孔板中扩大培养(图 7C)。加入的荧光标记物不同,检测的细胞不同,ClonePix FL可以进行多重细胞的挑选。目前,ClonePix FL广泛用于重组蛋白抗体药物细胞的筛选[42-43],Bowen和Nakamura等采用ClonePix FL优化和筛选单克隆抗体高产CHO细胞系[42, 44]。
 |
| 图 7 ClonePix FL筛选杂交瘤流程图(A:ClonePix FL仪器外观;B:半固体中杂交瘤在可见光和紫外光下的图片;C:ClonePix FL循环筛选过程) Fig. 7 Schematic diagram of ClonePix FL for hybridoma screening. (A) Appearance picture of ClonePix FL. (B) Pictures of hybridoma in semisolid under visible and ultraviolet light. (C) Cycle screening process of ClonePix FL. |
| 图选项 |
7 单克隆抗体的特异性、效价及亚型快速测定7.1 间接ELISA法目前,对单克隆抗体的筛选、效价的测定及交叉反应测定均依赖间接ELISA方法[30],该方法主要是将抗原固定在固相载体上,封闭、洗脱,与目标的抗体孵育、洗脱,与酶标二抗孵育、洗脱,形成抗原-抗体-酶标二抗的三元复合物,催化底物形成有色物质,产物的量与抗体的量直接相关,每次测定时间5 h–1 d。因此,急需一种操作简便、周期短的快速检测方法,可大大提高单克隆抗体筛选和制备的效率。
7.2 可视化宏阵列“可视化细菌宏阵列技术”是将抗原致病菌和非抗原致病菌灭活后,点制在硝酸纤维素膜上构建蛋白宏阵列,具体过程如图 8所示,用辣根过氧化物酶标记的抗小鼠抗体作为检测抗体,用DAB作为显色液,构建可视化细菌宏阵列,同步筛选两个单克隆抗体核心指标(最佳反应能力、交叉反应) 的杂交瘤细胞株,可视化细菌宏阵列不仅大大提高了单克隆抗体筛选效率,而且检测结果肉眼可见[45-46]。
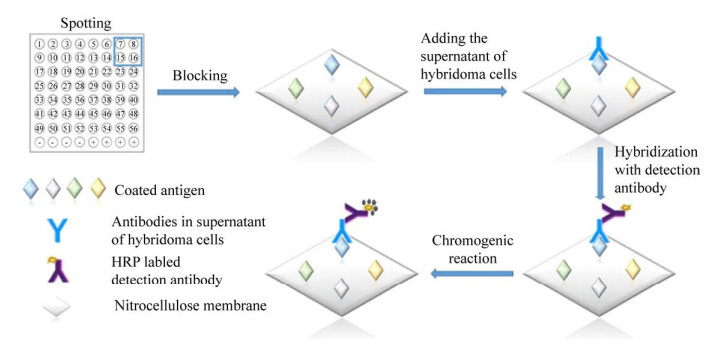 |
| 图 8 细菌宏阵列原理示意图[45] Fig. 8 Schematic diagram of the principle of bacterial macroarrays[45]. |
| 图选项 |
7.3 免疫层析法免疫层析法已经广泛应用于病原物的检测,其基本原理是利用双抗夹心或者竞争法来检测抗原,而采用抗原去检测抗体目前主要集中在血清中的抗体检测,例如新冠病毒IgM/IgG联检测试卡,其基本原理如图 9所示,将抗人IgM抗体、IgG抗体分别喷涂在T线上,结合垫分别喷涂金标标记的COVID-19表达的抗原和金标标记的兔IgG,当层析时,人血中的IgM抗体、IgG抗体分别与结合垫中纳米金标记的抗原结合,经过T线时,IgM抗体、IgG抗体又分别被T线中的抗IgM抗体、IgG抗体所结合,从而显色[47]。用此方法快速检测杂交瘤抗体、腹水抗体和纯化抗体的相关研究还未见报道。
 |
| 图 9 新冠病毒胶IgM-IgG联合抗体快速检测示意图[47] Fig. 9 Schematic illustration of rapid SARS-CoV-2 IgM-IgG combined antibody test[47]. |
| 图选项 |
7.4 电化学方法病毒感染的检测通常使用血清学检测技术,如ELISA法检测抗体反应。Wang等提出了一种新的无标记电容式免疫传感器快速检测超低病毒特异性抗体的浓度,这种分析也可用于确定感染基于同型患病率的阶段。如图 10A所示,玻璃载玻片上带有PDMS基底,并预留一个6 mm的微孔,工作电极和参比电极置于微孔上。工作电极上包被抗原,血清中的抗体与工作电极上抗原结合,会引起工作电极上电阻的变化(图 10B),从而引起信号的变化,对血清中的抗体实行快速检测。分别加入IgG1、IgG2a、IgG2b、IgG3、IgA和IgM抗体,还可以进行血清中抗体亚型的快速测定[48]。
 |
| 图 10 电容式免疫传感器设计原理图及工作原理[48] Fig. 10 Schematic of capacitive immunosensor design (A) and working principles (B)[48]. |
| 图选项 |
8 总结小鼠杂交瘤单克隆抗体的开发目前仍充满着挑战,针对单一特定结构的靶标时,低融合率对最终获得抗体的目的可能无影响,但是对含有多靶标的抗原时,例如致病菌,对筛选并获得特异性的抗体,低融合率可能会起着决定性的影响。对于这种多靶标的抗原,通常通过测序获得病原菌的序列,并通过生物信息能准确地预测致病菌的特异性膜蛋白,但仍然存在靶标为糖蛋白而糖蛋白的空间结构无法预测[49-50]、易出现对重组蛋白具有亲和力而不能对理论上含有此靶标的病原菌实现全覆盖的现象。目前,通过针对抗原特异性的B细胞受体高通量测序,并进行计算和评价打分,筛选出特异性强广谱性强的单克隆抗体序列[28],使得对测试抗原的预选成为一种可能。
不考虑其他人为因素的影响,融合率的提高和最后产抗体的细胞数量对高质量的抗体制备起着关键性的作用。采用化学方法分别标记脾细胞和骨髓瘤细胞增加了两种细胞结合机会,减少了两种细胞自融合的几率,提高了融合效率[31]。但化学标记方法对细胞仍然有一定毒性,造成细胞状态较差,最终导致融合效率提高不明显或者降低。而采用对瘤细胞的改造,使瘤细胞表达生物素受体肽[29],再利用抗原连接链霉亲和素,抗原再去与B细胞表面抗体结合,形成B细胞-抗原-链霉亲和素-生物素受体肽-骨髓瘤细胞复合物,这种通过生物学方法使脾细胞和骨髓瘤细胞特异性结合来提高融合率的方法值得期待。结合对效应B细胞的富集或者对非浆细胞的去除[25, 51],采用电融合方法以及其他一些物质的刺激诱导[32],对提高融合率的一套系统组合方法值得去探索、组合和构建。
阳性杂交瘤细胞的筛选方法的建立,包括细胞膜荧光免疫吸附测定法、芯片筛选方法、微流控芯片筛选方法和仪器筛选方法等,摆脱了对传统有限稀释法的依赖,避免了重复的筛选过程及不确定性,使阳性杂交瘤细胞筛选时间大大缩短。对于筛选的阳性杂交瘤还需进一步扩大培养并能够快速进行测试,效果不佳的杂交瘤应该在开发过程中尽早消除[38]。本文所阐述的免疫层析法和电化学方法主要是针对血清中的抗体进行测定和筛查病原,而对于杂交瘤细胞上清、腹水中抗体的快速测定还未涉及。
小鼠杂交瘤单克隆抗体快速制备技术涉及很多环节,包括抗原设计筛选、B细胞富集筛选、瘤细胞改造、融合技术改进、阳性杂交瘤细胞筛选及单克隆抗体性能快速测定,对每个环节进行优化并进行系统化组合改建,仍然值得进一步探究。
参考文献
| [1] | K?hler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature, 1975, 256(5517): 495-497. DOI:10.1038/256495a0 |
| [2] | Zhang Y, Tan C, Fei RH, et al. Sensitive chemiluminescence immunoassay for E. coli O157:H7 detection with signal dual-amplification using glucose oxidase and laccase. Anal Chem, 2014, 86(2): 1115-1122. DOI:10.1021/ac4028774 |
| [3] | Hu RR, Yin ZZ, Zeng YB, et al. A novel biosensor for Escherichia coli O157:H7 based on fluorescein-releasable biolabels. Biosens Bioelectron, 2016, 78: 31-36. DOI:10.1016/j.bios.2015.11.018 |
| [4] | Zhang F, He YP, Fu KN, et al. Dual- wavebands-resolved electrochemiluminescence multiplexing immunoassay with dichroic mirror assistant photomultiplier-tubes as detectors. Biosens Bioelectron, 2018, 115: 77-82. DOI:10.1016/j.bios.2018.05.006 |
| [5] | Cui HY, Song WQ, Cao ZJ, et al. Simultaneous and sensitive detection of dual DNA targets via quantum dot-assembled amplification labels. Luminescence, 31(1): 281-287. DOI:10.1002/bio.2959 |
| [6] | Yang Z, Liu Y, Lei C, et al. Ultrasensitive detection and quantification of E. coli O157:H7 using a giant magnetoimpedance sensor in an open-surface microfluidic cavity covered with an antibody-modified gold surface. Microchim Acta, 2016, 183(6): 1831-1837. DOI:10.1007/s00604-016-1818-3 |
| [7] | Zong J, Zhang YS, Zhu Y, et al. Rapid and highly selective detection of formaldehyde in food using quartz crystal microbalance sensors based on biomimetic poly-dopamine functionalized hollow mesoporous silica spheres. Sens Actuat B: Chem, 2018, 271: 311-320. DOI:10.1016/j.snb.2018.05.089 |
| [8] | Zhu Y, Zhang Q, Li X, et al. Detection of AFP with an ultra-sensitive giant magnetoimpedance biosensor. Sens Actuat B: Chem, 2019, 293: 53-58. DOI:10.1016/j.snb.2019.05.004 |
| [9] | Narumi Y, Yoshida B, Minami Y, et al. Neuromyelitis optica spectrum disorder secondary to treatment with anti-PD-1 antibody nivolumab: the first report. BMC Cancer, 2018, 18: 95. DOI:10.1186/s12885-018-3997-2 |
| [10] | Grilo AL, Mantalaris A. The increasingly human and profitable monoclonal antibody market. Trends Biotechnol, 2019, 37(1): 9-16. DOI:10.1016/j.tibtech.2018.05.014 |
| [11] | Kelso GF, Kazi SA, Harris SJ, et al. Impact on monoclonal antibody production in murine hybridoma cell cultures of adenosine receptor antagonists and phosphodiesterase inhibitors. Bioorg Med Chem Lett, 2016, 26(2): 540-544. DOI:10.1016/j.bmcl.2015.11.075 |
| [12] | Zhao R, Xiao Q, Li M, et al. Rational design of peptides for identification of linear epitopes and generation of neutralizing monoclonal antibodies against Dickkopf-related protein 2 (DKK2) for cancer therapy. Antibody Therapeutics, 2020, 3(2): 63-70. DOI:10.1093/abt/tbaa004 |
| [13] | Ku ZQ, Ye XH, Salazar GT, et al. Antibody therapies for the treatment of COVID-19. Antibody Therapeut, 2020, 3(2): 101-108. DOI:10.1093/abt/tbaa007 |
| [14] | Baykov IK, Matveev AL, Stronin OV, et al. A protective chimeric antibody to tick-borne encephalitis virus. Vaccine, 2014, 32(29): 3589-3594. DOI:10.1016/j.vaccine.2014.05.012 |
| [15] | Kellermann SA, Green LL. Antibody discovery: the use of transgenic mice to generate human monoclonal antibodies for therapeutics. Curr Opin Biotechnol, 2002, 13(6): 593-597. DOI:10.1016/S0958-1669(02)00354-3 |
| [16] | Golsaz-Shirazi F, Amiri MM, Farid S, et al. Construction of a hepatitis B virus neutralizing chimeric monoclonal antibody recognizing escape mutants of the viral surface antigen (HBsAg). Antivir Res, 2017, 144: 153-163. DOI:10.1016/j.antiviral.2017.06.013 |
| [17] | Li XQ, Bian HF, Yu SM, et al. A rapid method for antigen-specific hybridoma clone isolation. Anal Chem, 2018, 90(3): 2224-2229. DOI:10.1021/acs.analchem.7b04595 |
| [18] | Chen ZJ, Liu XX, Xiao ZL, et al. Production of a specific monoclonal antibody for 1-naphthol based on novel hapten strategy and development of an easy-to-use ELISA in urine samples. Ecotoxicol Environ Safe, 2020, 196: 110533. DOI:10.1016/j.ecoenv.2020.110533 |
| [19] | Xu SL, Zhang GG, Fang BL, et al. Lateral flow immunoassay based on polydopamine-coated gold nanoparticles for the sensitive detection of zearalenone in maize. ACS Appl Mater Inter, 2019, 11(34): 31283-31290. DOI:10.1021/acsami.9b08789 |
| [20] | Zhou Y, Li YS, Pan FG, et al. Identification of tetrodotoxin antigens and a monoclonal antibody. Food Chem, 2009, 112(3): 582-586. DOI:10.1016/j.foodchem.2008.06.022 |
| [21] | Logan SM, Chen W, Aubry A, et al. Production of a D-glycero-D-manno-heptosyltransferase mutant of Mannheimia haemolytica displaying a veterinary pathogen specific conserved LPS structure; development and functionality of antibodies to this LPS structure. Vet Microbiol, 2006, 116(1): 175-186. |
| [22] | Razzaqi M, Rasaee M, Paknejad M. A critical challenge in the development of antibody: selecting the appropriate fragment of the target protein as an antigen based on various epitopes or similar structure. Mol Immunol, 2019, 111: 128-135. |
| [23] | Panda SK, Mahapatra RK. In-silico screening, identification and validation of a novel vaccine candidate in the fight against Plasmodium falciparum. Parasitol Res, 2017, 116(4): 1293-1305. DOI:10.1007/s00436-017-5408-z |
| [24] | Rout S, Patra NP, Mahapatra RK. An in silico strategy for identification of novel drug targets against Plasmodium falciparum. Parasitol Res, 2017, 116(9): 2539-2559. DOI:10.1007/s00436-017-5563-2 |
| [25] | Jane S, H BE, Chung-Ming H, et al. Methods for increasing the efficiency of hybridoma generation: US, WO/2014/093786. 2014-07-17. |
| [26] | Starkie DO, Compson JE, Rapecki S, et al. Generation of recombinant monoclonal antibodies from immunised mice and rabbits via flow cytometry and sorting of antigen-specific IgG+ memory B cells. PLoS ONE, 2016, 11(3): e152282. |
| [27] | Hoven MY, De Leij L, Keij JFK, et al. Detection and isolation of antigen-specific B cells by the fluorescence activated cell sorter (FACS). J Immunol Methods, 1989, 117(2): 275-284. DOI:10.1016/0022-1759(89)90150-6 |
| [28] | Setliff I, Shiakolas AR, Pilewski KA, et al. High-throughput mapping of B Cell receptor sequences to antigen specificity. Cell, 2019, 179(7): 1636-1646.e15. DOI:10.1016/j.cell.2019.11.003 |
| [29] | Listek M, H?now A, Gossen M, et al. A novel selection strategy for antibody producing hybridoma cells based on a new transgenic fusion cell line. Sci Rep, 2020, 10: 1664. |
| [30] | 曾海娟, 王广彬, 郭慧琴, 等. 抗瓜类细菌性果斑病菌单克隆抗体的制备及特性鉴定. 食品科学, 2015, 36(23): 228-232. Zeng HJ, Wang GB, Guo HQ, et al. Preparation and characterization of monoclonal antibody against Acidovorax avenae subsp. citrulli in Melons. Food Sci, 2015, 36(23): 228-232 (in Chinese). DOI:10.7506/spkx1002-6630-201523042 |
| [31] | 吴梦, 刘作华, 罗林, 等. 利用改良电融合法制备杂交瘤细胞的试验探索. 四川畜牧兽医, 2016, 43(7): 26-28. Wu M, Liu ZH, Luo L, et al. The study of modified electrofusion method to prepare hybridoma cell. Sichuan Animal Vet Sci, 2016, 43(7): 26-28 (in Chinese). DOI:10.3969/j.issn.1001-8964.2016.07.010 |
| [32] | Kato M, Sasamori E, Chiba T, et al. Cell activation by CpG ODN leads to improved electrofusion in hybridoma production. J Immunol Methods, 2011, 373(1/2): 102-110. |
| [33] | Shen YG, Yalikun Y, Tanaka Y. Recent advances in microfluidic cell sorting systems. Sens Actuat B: Chem, 2019, 282: 268-281. DOI:10.1016/j.snb.2018.11.025 |
| [34] | Love JC, Ronan JL, Grotenbreg GM, et al. A microengraving method for rapid selection of single cells producing antigen-specific antibodies. Nat Biotechnol, 2006, 24(6): 703-707. DOI:10.1038/nbt1210 |
| [35] | Davis JM, Pennington JE, Kubler AM, et al. A simple, single-step technique for selecting and cloning hybridomas for the production of monoclonal antibodies. J Immunol Methods, 1982, 50(2): 161-171. DOI:10.1016/0022-1759(82)90222-8 |
| [36] | Yoshimoto N, Kida A, Jie X, et al. An automated system for high-throughput single cell-based breeding. Sci Rep, 2013, 3: 1191. DOI:10.1038/srep01191 |
| [37] | Kida A, Iijima M, Niimi T, et al. Cell surface-fluorescence immunosorbent assay for real-time detection of hybridomas with efficient antibody secretion at the single-cell level. Anal Chem, 2013, 85(3): 1753-1759. DOI:10.1021/ac303067k |
| [38] | Paul M, Weller MG. Antibody screening by microarray technology—direct identification of selective high-affinity clones. Antibodies, 2020, 9(1): 1. DOI:10.3390/antib9010001 |
| [39] | Mazutis L, Gilbert J, Ung WL, et al. Single-cell analysis and sorting using droplet-based microfluidics. Nat Protoc, 2013, 8(5): 870-891. DOI:10.1038/nprot.2013.046 |
| [40] | Dippong M, Carl P, Lenz C, et al. Hapten-specific single-cell selection of hybridoma clones by fluorescence-activated cell sorting for the generation of monoclonal antibodies. Anal Chem, 2017, 89(7): 4007-4012. DOI:10.1021/acs.analchem.6b04569 |
| [41] | Akagi S, Nakajima C, Tanaka Y, et al. Flow cytometry-based method for rapid and high-throughput screening of hybridoma cells secreting monoclonal antibody. J Biosci Bioeng, 2018, 125(4): 464-469. DOI:10.1016/j.jbiosc.2017.10.012 |
| [42] | Roy G, Miro-Quesada G, Zhuang L, et al. Sequential screening by ClonePix FL and intracellular staining facilitate isolation of high producer cell lines for monoclonal antibody manufacturing. J Immunol Methods, 2017, 451: 100-110. DOI:10.1016/j.jim.2017.08.012 |
| [43] | Hou JJC, Hughes BS, Smede M, et al. High-throughput ClonePix FL analysis of mAb-expressing clones using the UCOE expression system. New Biotechnol, 2014, 31(3): 214-220. DOI:10.1016/j.nbt.2014.02.002 |
| [44] | Nakamura T, Omasa T. Optimization of cell line development in the GS-CHO expression system using a high-throughput, single cell-based clone selection system. J Biosci Bioeng, 2015, 120(3): 323-329. DOI:10.1016/j.jbiosc.2015.01.002 |
| [45] | Li J, Zhai XZ, Ding CC, et al. Development of a bacterial macroarray for the rapid screening of targeted antibody-secreted hybridomas. SLAS DISCOVERY: Advancing the Science of Drug Discovery, 2018, 24(2): 190-198. |
| [46] | Olijnyk NV. An algorithmic historiography of the Ebola research specialty: mapping the science behind Ebola. Scientometrics, 2015, 105(1): 623-643. DOI:10.1007/s11192-015-1688-1 |
| [47] | Li ZT, Yi XY, Luo XM, et al. Development and clinical application of A rapid IgM-IgG combined antibody test for SARS-CoV-2 infection diagnosis. J Med Virol, 2020, 92(9): 1518-1524. DOI:10.1002/jmv.25727 |
| [48] | Wang L, Filer JE, Lorenz MM, et al. An ultra-sensitive capacitive microwire sensor for pathogen-specific serum antibody responses. Biosens Bioelectron, 2019, 131: 46-52. DOI:10.1016/j.bios.2019.01.040 |
| [49] | Carvalho AMRS, Mendes TADO, Coelho EAF, et al. New antigens for the serological diagnosis of human visceral leishmaniasis identified by immunogenomic screening. PLoS ONE, 2018, 13(12): e0209599. DOI:10.1371/journal.pone.0209599 |
| [50] | Wrapp D, Wang NS, Corbett KS, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science, 2020, 367(6483): 1260-1263. DOI:10.1126/science.abb2507 |
| [51] | Schmidt E, Leinfelder U, Ge?ner P, et al. CD19+ B lymphocytes are the major source of human antibody-secreting hybridomas generated by electrofusion. J Immunol Methods, 2001, 255(1/2): 93-102. |
