
 , 杨吉飞1, 高闪电1, 独军政1, 赵亚茹1, 刘志杰1, 关贵全1, 刘光远1, 罗建勋1, 殷宏1,2
, 杨吉飞1, 高闪电1, 独军政1, 赵亚茹1, 刘志杰1, 关贵全1, 刘光远1, 罗建勋1, 殷宏1,2

1. 中国农业科学院 兰州兽医研究所 家畜疫病病原生物学国家重点实验室 甘肃省动物寄生虫病重点实验室,甘肃 兰州 730046;
2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009
收稿日期:2020-06-18;接收日期:2020-11-02;网络出版时间:2020-11-19
基金项目:甘肃省重点研发计划(No. 18YF1WA131),中国农业科学院农业科技创新工程项目(No. CAAS-ASTIP-2016-LVRI),中国农业科学院基本科研业务费专项(No. Y2019YJ07-02)资助
摘要:为了筛选出酶联免疫吸附测定(Enzyme linked immunosorbent assay,ELISA)反应性最佳的非洲猪瘟病毒(African swine fever virus,ASFV)诊断抗原,通过建立ELISA方法,以杆状病毒昆虫细胞表达系统表达的ASFV p30蛋白诊断抗原为参照,首次探讨原核表达系统表达的ASFV p35蛋白作为诊断抗原的抗原性和潜力。免疫印迹和免疫荧光结果表明,获得了40 kDa的重组p35蛋白和30 kDa的p30蛋白,两种蛋白与ASFV阳性血清均具有较好的免疫反应原性。采用重组p30和p35蛋白作为诊断抗原分别建立ELISA方法,并验证其敏感性、稳定性以及与进口试剂盒的符合率。结果显示,尽管p35-ELISA方法的检测敏感性稍低于p30-ELISA方法,但其敏感性仍可达95.8%,且p35-ELISA方法和p30-ELISA方法的批内和批间变异系数均小于10%。p35-ELISA方法与进口试剂盒比较,符合率达97.2%。结果表明建立的p35-ELISA方法敏感性高且稳定性好,可应用于ASFV感染血清的检测。
关键词:非洲猪瘟病毒p35蛋白p30蛋白抗原性间接ELISA
Comparison of the antigenicity of African swine fever virus p35 protein as diagnostic antigen
Lei Shi1, Zhancheng Tian1

 , Jifei Yang1, Shandian Gao1, Junzheng Du1, Yaru Zhao1, Zhijie Liu1, Guiquan Guan1, Guangyuan Liu1, Jianxun Luo1, Hong Yin1,2
, Jifei Yang1, Shandian Gao1, Junzheng Du1, Yaru Zhao1, Zhijie Liu1, Guiquan Guan1, Guangyuan Liu1, Jianxun Luo1, Hong Yin1,2

1. State Key Laboratory of Veterinary Etiological Biology/Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730046, Gansu, China;
2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, Jiangsu, China
Received: June 18, 2020; Accepted: November 2, 2020; Published: November 19, 2020
Supported by: Key Research and Development Program of Gansu Province, China (No. 18YF1WA131), Agricultural Science and Technology Innovation Engineering Project of Chinese Academy of Agricultural Sciences (No. CAAS-ASTIP-2016-LVRI), Special Fund for Basic Scientific Research of Chinese Academy of Agricultural Sciences (No. Y2019YJ07-02)
Corresponding author: Zhancheng Tian. Tel: +86-931-8342681; E-mail: tianzhancheng@caas.cn;
Hong Yin. E-mail: yinhong@caas.cn.
Abstract: In order to screen African swine fever virus (ASFV) diagnostic antigen with the best enzyme linked immunosorbent assay (ELISA) reactivity. By establishing the ELISA method, the diagnostic antigen of ASFV p30 protein expressed by baculovirus-insect cell expression system as reference, we explored the antigenic properties and diagnostic potential of ASFV p35 protein expressed by prokaryotic expression system as a diagnostic antigen. The results of Western blotting and immunofluorescence show that the molecular weight of the recombinant p35 protein and p30 protein obtained was 40 kDa and 30 kDa, respectively, and these two proteins had good immuno-reactivity with ASFV positive serum. Recombinant p30 and p35 proteins were used as diagnostic antigens to establish ELISA, and the sensitivity and repeatability of these methods were tested. The results show that although the detection sensitivity of the p30-ELISA established in this study was higher than that of the p35-ELISA, the sensitivity of p35-ELISA was 95.8%, and variations in intra- and inter-assay repeatability of the two methods were less than 10%. The coincidence rate between the p35-ELISA and the imported kit was 97.2%. Results show that p35-ELISA was sensitive and stable, and could detect specific antibodies against ASFV.
Keywords: African swine fever virusp35p30antigenicityindirect ELISA
非洲猪瘟(African swine fever,ASF)是非洲猪瘟病毒(African swine fever virus,ASFV)引起的一种急性、高度接触性和高致死性动物传染病[1]。ASFV属于虫媒病毒,是非洲猪瘟相关病毒科(Asfarviridae)非洲猪瘟病毒属(Asfivirus)的唯一成员[2]。直径约为200 nm的病毒粒子呈二十面体形态,具有内膜和囊膜双层膜结构,病毒在胞浆内复制,病毒基因组为线性、共价封闭的双链DNA (dsDNA)分子[3-4]。非洲猪瘟被世界动物卫生组织(OIE)列为A类动物传染病。ASFV主要感染家猪、非洲和欧亚野猪、钝缘蜱等,其中被感染但不表现出临床症状的疣猪等非洲野猪和钝缘蜱为ASFV的宿主[5-7]。ASF的临床症状可表现为急性死亡、慢性和亚临床感染[2, 8-9]。自2018年8月我国辽宁省沈阳市发生首起ASF疫情以来[10],ASF给我国养猪业造成巨大损失,严重影响了我国居民的生活质量。
尽管针对ASF开发了一些实验室内保护效果较好的减毒疫苗,但出于对ASFV减毒疫苗的生物安全性考虑,到目前为止,还没有被批准的商品化ASF疫苗用于田间ASF的免疫预防,ASF的根除仍然需要依靠及时的实验室诊断和严格的扑杀措施来消除疫情和控制疾病[11]。尽管分子诊断技术对于ASF的早期诊断预防很有效[11-12],但对于一些低病毒血症和临床症状不明显的感染动物开展大规模流行病学筛查,血清学诊断方法仍然被认为是ASF诊断和控制的主要手段[13-14]。目前OIE认可的ASF常规诊断方法为血清学ELISA方法初筛后再通过免疫印迹的方法进一步确定[15-16]。OIE认可的检测方法中的病毒抗原来源于活病毒,涉及到生物安全三级实验室处理大量活病毒的生物安全性问题[9, 17]。因此,筛选出一些ELISA反应性最佳的ASFV诊断抗原,对于建立可靠的血清学诊断方法和避免不必要的生物安全问题至关重要[18-19]。
以前的研究结果表明,采用杆状病毒昆虫细胞表达系统制备的ASFV pp62重组蛋白作为诊断抗原建立的ELISA方法,对保存较差的田间血清样品检测的可靠性和敏感性优于以ASFV p30和p54重组蛋白为包被抗原建立的ELISA方法,产生的ELISA结果甚至可以不用OIE认可的免疫印迹方法(Immunoblotting,IB)再次确认。尽管如此,pp62蛋白具有诊断潜力的主要抗原表位的分布仍需作进一步分析[18]。pp62是一种由ORF CP530R编码的多聚蛋白前体,被ASFV蛋白酶S273R水解后形成两种结构蛋白p35和p15[20]。ASFV p35蛋白上是否分布有pp62蛋白的主要线性抗原表位及作为诊断抗原建立ELISA方法尚未见报道。本研究首次以原核表达系统获得的ASFV p35重组蛋白为包被抗原建立ELISA方法,与通过昆虫杆状病毒表达系统制备的p30抗原建立的ELISA方法和进口试剂盒进行比较[21],分析ASFV p35蛋白作为诊断抗原的抗原性和潜力。
1 材料与方法1.1 材料杆状病毒表达载体pFastBacTM、pET-30a载体、标准ASFV阳性血清和阴性血清均保存于国家非洲猪瘟区域(兰州)实验室。辣根过氧化酶标记山羊抗猪IgG购自北京中杉金桥生物技术有限公司;Complete His-Tag Purification Resin购自上海罗氏公司;INgezim PPA COMPAC 11.PPA.K.3 (5 plates kit,Lote/Batch:050819)购自西班牙英吉纳公司;Bradford蛋白浓度测定试剂盒购自Solarbio公司。Cellfectin?Ⅱ Reagent (昆虫细胞脂质体转染试剂)、PureLinkTM HiPure Plasmid Midiprep Kit;Alexa Fluor 488标记的山羊抗小鼠IgG购自Abcam公司。
1.2 方法1.2.1 引物设计参照于GenBank中ASFV (Pig/HLJ/18)参考序列,利用Primer Premier 5.0软件设计p35基因表达引物(p35F和p35R)、p30基因表达引物(p30F和引入His表达标签序列的p30R)和重组杆状病毒穿梭质粒鉴定引物(M13F和M13R)。引物及基因合成与测序均委托擎科生物科技有限公司完成。
1.2.2 ASFV p35重组蛋白和ASFV p30重组杆状病毒的制备为了制备原核表达的ASFV p35重组蛋白。以合成的p35基因为模板进行PCR扩增,反应条件为:95 ℃ 5 min;95 ℃ 1 min,58 ℃ 30 s,72 ℃ 1.5 min,34个循环;72 ℃ 10 min。PCR扩增的目的基因经EcoRⅠ和SalⅠ双酶切后插入到pET-30a载体中,PCR鉴定为阳性的菌液经擎科生物科技有限公司测序正确后,将其命名为pET-30a-p35。将阳性重组质粒转化至BL21感受态细胞,经16 ℃条件下诱导表达6 h后用SDS-PAGE检测蛋白表达量。大量诱导后沉淀菌体,用裂解液重悬菌体,超声破碎后离心,取上清按照Ni-NTA Superflow Cartridge手册在非变性条件下进行镍柱亲和层析纯化重组蛋白,纯化的重组蛋白经Bradford蛋白浓度测定试剂盒测定浓度。
为了获得ASFV p30重组杆状病毒。以合成的带有His表达标签的ASFV p30基因为模板进行PCR扩增,反应条件为:95 ℃ 5 min;95 ℃ 1 min,48 ℃ 30 s,72 ℃ 1.5 min,34个循环;72 ℃ 10 min。将目的DNA经EcoRⅠ和XbaⅠ双酶切后插入到pFastBacTM载体,得到pFastBac-p30重组质粒,委托擎科生物科技有限公司测序验证后,将pFastBac-p30重组质粒转化至DH10BacTM感受态细胞,得到重组杆状病毒穿梭质粒Bacmid-p30,进一步用鉴定引物M13F和M13R鉴定。将鉴定正确的重组杆粒DNA提纯后在Cellfectin? Ⅱ Reagent的介导下,转染生长状态最佳的Sf9细胞,设正常细胞作为对照。27 ℃培养72 h,待出现明显细胞病变后,收获上清用蚀斑试验测定重组杆状病毒的效价。再次进行病毒传代扩增,获得病毒滴度较高的P3代Bac-p30重组杆状病毒。
1.2.3 ASFV p35和p30重组蛋白的鉴定用收集的p3代重组杆状病毒Bac-p30感染的Sf9昆虫细胞裂解上清和原核表达纯化的重组p35蛋白作为抗原。ASFV阳性血清(1︰500)作为一抗,并将阴性血清(1︰500)设为阴性对照,山羊抗猪IgG (1︰20 000)作为二抗进行免疫印迹分析,加入底物显色液后避光显色3–10 min,拍照。
将MOI为0.1的p3代重组杆状病毒Bac-p30感染的Sf9细胞作为检测组,同时设杆状病毒感染的Sf9细胞作为空白对照组。用小鼠抗His标签抗体(1︰200)作为一抗,Alexa Flour 488标记的山羊抗小鼠IgG (1︰1 000)作为二抗进行间接免疫荧光分析,倒置荧光显微镜下观察特异性绿色荧光的产生情况。
1.3 p35-ELISA 方法和p30-ELISA方法的建立1.3.1 反应条件的优化按照常规间接ELISA的操作方法[22],通过方阵滴定法对最佳抗原包被量、最佳血清稀释倍数和最佳封闭液及作用时间进行摸索与优化。将纯化的重组p35蛋白以5、2.5、1.25、0.625 μg/mL进行100 μL/孔的抗原量包被;同时将适量重组杆状病毒Bac-p30感染昆虫Sf9细胞72 h后收集的细胞裂解上清测定总蛋白浓度为14.9 mg/mL,将获得的蛋白用PBS缓冲液以1︰10、1︰50、1︰100和1︰200稀释后按照100 μL/孔的抗原量包被,将标准ASFV阴性和阳性血清做1︰100、1︰200、1︰400、1︰800、1︰1 600、1︰3 200和1︰6 400稀释。分别加入到2%脱脂乳或1% BSA封闭的ELISA酶标板中,根据ASFV阴性和阳性血清的OD450值及P/N值最大时选择合适的抗原包被量和最佳血清稀释倍数和封闭液。将ASFV阳性和阴性血清按最佳稀释度在37 ℃分别孵育0.5、1.0、1.5 h,根据阴性和阳性血清的OD450值及P/N值选择合适的血清作用时间;将山羊抗猪IgG (1︰20 000)加入ELISA板后,37 ℃分别作用0.5、1.0、1.5 h,根据P/N值选择合适的酶标二抗作用浓度和作用时间。
1.3.2 临界值的确定在重组蛋白p30和p35为诊断抗原建立的最佳ELISA反应条件下,通过实验室保存的92份田间非洲猪瘟阴性血清(经西班牙英吉纳公司的ASFV抗体检测试剂盒和OIE建议的ASFV荧光PCR检测均为阴性),以公式:临界值=阴性样品的平均OD450值+3×标准偏差(s),确定临界值。当待检血清的OD450平均值≥x+3s,则判定为阳性,当OD450 < x+2s则判定为阴性,介于二者之间则判定为可疑样品。
1.4 敏感性检测使用p35-ELISA方法和p30-ELISA方法对用同一批次重组蛋白包被的酶标板对同一批次不同稀释倍数的血清样品进行检测,从1︰100起,2倍倍比稀释至1︰6 400,统计不同稀释倍数下二者的阳性率,进行p35-ELISA方法和p30-ELISA方法检测灵敏度的比较。此外,用p35-ELISA方法对48份ASFV感染血清进行检测,计算其敏感性。
1.5 稳定性检测按已建立的间接ELISA最佳反应体系和条件,用同一批次重组蛋白包被的酶标板对同一批次不同稀释倍数的标准ASFV阳性血清样品进行检测;用不同批次重组蛋白包被的酶标板对同一批次不同稀释倍数的标准ASFV阳性血清样品进行检测,计算批内和批间样本的变异系数CV,评价批内和批间重复性试验的稳定性。
1.6 符合率试验同时用本研究建立的p35-ELISA方法和西班牙英吉纳公司非洲猪瘟抗体检测试剂盒对48份ASFV感染血清和60份健康血清进行检测,计算二者符合率。
2 结果与分析2.1 重组p35蛋白的表达纯化和鉴定SDS-PAGE结果显示,部分重组p35蛋白以可溶性的形式表达,通过非变性条件下的镍柱亲和层析纯化获得了纯度较高的重组p35蛋白,分子量约为40 kDa (图 1A);与阴性血清对照组相比,ASFV阳性血清能够特异性识别纯化的重组p35蛋白(图 1B)。SDS-PAGE和Western blotting结果表明p35蛋白在原核表达系统中得以正确表达。
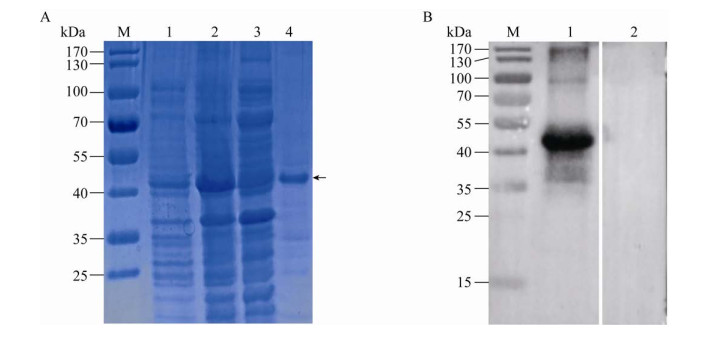 |
| 图 1 重组p35蛋白的表达鉴定 Fig. 1 Identification of the recombinant p35 protein. (A) SDS-PAGE of recombinant ASFV p35 protein. M: protein marker; 1: negative control; 2: induced lysates for 6 h; 3: ultrasonic supernatant of recombinant bacteria for 6 h; 4: the purified recombinant p35 protein. (B) The reactivity of anti-ASFV positive sera to the purified recombinant p35 protein, M: protein marker; 1, 2: the positive sera against ASFV antigen; 3: negative sera. |
| 图选项 |
2.2 重组p30蛋白的表达和鉴定与正常Sf9细胞相比,p3代重组杆状病毒Bac-p30感染Sf9细胞72 h后,显微镜下可观察到明显的细胞病变,主要表现为细胞生长缓慢,开始膨大变成囊泡状,裂解和脱落。间接免疫荧光结果表明:对照组杆状病毒感染的Sf9细胞无特异性荧光出现,但重组杆状病毒感染的Sf9细胞在倒置荧光显微镜下出现特异性的绿色荧光(图 2A)。免疫印迹结果显示,ASFV阳性血清能够特异性识别重组杆状病毒Bac-p30感染的Sf9细胞裂解上清中的p30抗原条带(图 2B)。
 |
| 图 2 重组p30蛋白的表达鉴定 Fig. 2 Identification of the recombinant p30 protein by Western blotting. (A) The cytopathic effect and indirect immunofluorescence assay of Sf9 cells infected with Bac-p30. (a) Normal Sf9 cells; (b) Sf9 cells infected with Bac-p30; (c) Sf9 cells infected with wild type baculovirus; (d) Sf9 cells infected with Bac-p30. (B) M: protein marker; 1: Sf9 cells infected with wild type baculovirus; 2: ultrasonic supernatant of Sf9 cells infected with Bac-p30. |
| 图选项 |
2.3 反应条件的优化根据得到的ASFV阳性血清和阴性血清OD450值及P/N值可以得出本研究所建立的p35-ELISA方法的最适抗原包被量为2.5 μg/mL,以1% BSA作为封闭液封闭,最适封闭时间为45 min,
血清稀释倍数为1︰100,酶标二抗的稀释倍数为1︰20 000,最适酶标二抗封闭时间为45 min效果最佳;将重组杆状病毒Bac-p30感染昆虫Sf9细胞获得的细胞裂解上清蛋白总浓度为14.9 mg/mL以1︰200稀释后100 μL/孔的抗原量包被,1% BSA作为封闭液封闭,最适封闭时间为1 h,血清稀释倍数为1︰100,酶标二抗的稀释倍数为1︰20 000,最适酶标二抗封闭时间为1 h,产生的P/N值最大,效果最佳。
2.4 临界值确定和敏感性检测以建立的p35-ELISA方法对92份ASFV阴性血清样品进行检测,平均OD450值为0.163 6,标准差为0.017 8,确定的临界值为0.217,当待检血清OD450值≥0.217判定为阳性,当OD450值< 0.199判定为阴性;p30-ELISA方法对同一批次ASFV阴性血清样品进行检测,平均OD450值为0.160 3,标准差为0.030 8,按照公式计算其临界值为0.253,当待检血清OD450值≥0.253判定为阳性,当OD450值< 0.222判定为阴性。
通过ASFV阳性血清倍比稀释的方法比较p30-ELISA方法和p35-ELISA方法的检测灵敏度。结果表明,p30-ELISA方法的检测敏感性稍高于p35-ELISA方法(数据未显示)。在被检的48份ASFV感染血清中,p35-ELISA方法有46份血清检测结果为阳性,该方法的敏感性为95.8%。
2.5 稳定性评价p35-ELISA方法的批内变异系数在1.42%–7.40%之间,批间变异系数在0.58%–1.71%之间(表 2)。p30-ELISA方法的批内变异系数在0.39%–3.39%之间,批间变异系数在0.87%–3.58%之间(表 3)。
表 1 引物序列Table 1 Primer sequence
| Primer name | Sequence (5′–3′) | Size (bp) |
| p35F | GCGAATTCATGGGGAATGACCCGCCGGT | 28 |
| p35R | CTGTCGACTTAATGGTGATGATCCCCCCTACCTTTTCCT | 39 |
| p30F | GCGAATTCATGGATTTTATTTTAAATA | 27 |
| p30R | TGTCTAGATTAATGGTGATGGTGATGATGTTTTTTTTTTAAAAGTTTAAT | 59 |
| M13F | TGTAAAACGACGGCCAGT | 18 |
| M13R | AGCGGATAACAATTTCACACAGG | 23 |
表选项
表 2 p35-ELISA的稳定性试验Table 2 Stability test of the p35 -ELISA
| Dilution ratio | p35 In-batch | p35 Batch-to-batch | ||||
| Average value | Standard deviation | CV (%) | Average value | Standard deviation | CV (%) | |
| 1︰100 | 1.725 6 | 0.024 5 | 1.42 | 1.725 6 | 0.024 5 | 1.42 |
| 1︰200 | 0.882 0 | 0.017 9 | 2.03 | 0.882 0 | 0.017 9 | 2.03 |
| 1︰400 | 0.634 0 | 0.022 3 | 3.52 | 0.634 0 | 0.022 3 | 3.52 |
| 1︰800 | 0.435 3 | 0.032 2 | 7.40 | 0.435 3 | 0.032 2 | 7.40 |
| 1︰1 600 | 0.267 0 | 0.005 0 | 1.87 | 0.267 0 | 0.005 0 | 1.87 |
表选项
表 3 p30-ELISA的稳定性试验Table 3 Stability test of the p30-ELISA
| Dilution ratio | p30 In-batch | p30 Batch-to-batch | ||||
| Average value | Standard deviation | CV (%) | Average value | Standard deviation | CV (%) | |
| 1︰100 | 1.320 6 | 0.031 8 | 2.41 | 1.288 8 | 0.011 7 | 0.91 |
| 1︰200 | 1.201 4 | 0.010 4 | 0.87 | 1.191 0 | 0.005 1 | 0.43 |
| 1︰400 | 1.070 6 | 0.038 3 | 3.58 | 1.032 3 | 0.035 0 | 3.39 |
| 1︰800 | 0.935 0 | 0.030 1 | 3.22 | 0.904 9 | 0.028 1 | 3.11 |
| 1︰1 600 | 0.827 1 | 0.009 7 | 1.17 | 0.817 4 | 0.003 2 | 0.39 |
表选项
表 4 p35-ELISA与进口试剂盒符合率试验Table 4 Coincidence rate test of p35-ELISA with imported kit
| p35-ELISA | ING | Total | |
| Positive | Negative | ||
| Positive | 45 | 1 | 46 |
| Negative | 2 | 60 | 62 |
| Total | 47 | 61 | 108 |
表选项
2.6 符合率试验对108份血清(48份ASFV感染猪血清和60份健康猪血清)进行检测,结果显示,本研究建立的p35-ELISA抗体检测方法和西班牙英吉纳公司非洲猪瘟抗体检测试剂盒(ING)共有105份血清检测结果一致,符合率为97.2%。
3 讨论非洲猪瘟给我国乃至全球养猪业带来了毁灭性的打击[10]。在国际上还没有研发出针对ASF有效的疫苗和治疗方法之前,分子诊断方法和血清学检测技术仍被认为是识别感染动物、根除潜在ASFV感染风险的主要手段[11, 23]。尽管分子诊断方法对于ASF的早期诊断预防至关重要,但血清学方法成本低廉和便捷的特点更适合于大规模的田间流行病学调查[13, 17, 23]。可靠的血清学诊断方法的建立与所选抗原的抗原性密切相关[19, 21]。以前的研究结果表明,在昆虫杆状病毒表达系统中制备的ASFV诊断抗原中,ASFV pp62蛋白作为诊断抗原建立的ELISA方法针对保存较差的田间血清样品的检测结果优于以p54和p30蛋白为抗原靶标建立的ELISA方法[19]。为了进一步确认pp62蛋白水解产物p35蛋白作为诊断抗原的抗原性和潜力,本研究采用原核表达系统表达了p35蛋白和昆虫杆状病毒表达系统表达p30蛋白,以上述方法制备的抗原建立的ELISA诊断方法进行检测灵敏度的比较,获得了与预期理论蛋白分子量大小一致的40 kDa重组p35蛋白和30 kDa重组p30蛋白。制备的诊断抗原能与ASFV阳性血清发生特异性反应,获得的p30蛋白和p35蛋白均具有较好的反应原性。在确定的最佳ELISA反应体系和条件下,确定了p30-ELISA和p35-ELISA方法的临界值、检测灵敏度和批内和批间重复性试验的稳定性评价。
原核表达系统制备诊断抗原的生产成本相对低廉,制备的蛋白易于纯化,稳定性较好,适合大规模生产[24]。本研究在原核表达系统中制备ASFV p35重组蛋白,通过与昆虫杆状病毒表达系统表达的p30重组蛋白在抗原性及其ELISA中的反应性进行对比分析。以原核表达纯化的p35抗原为基础建立的间接ELISA方法的检测灵敏度稍低于以昆虫杆状病毒表达系统制备的p30抗原为基础建立的间接ELISA方法。昆虫杆状病毒表达系统高效表达重组蛋白的同时能够正确折叠以维持表达蛋白的空间构象和蛋白活性,而原核表达系统表达的蛋白仅展示线性表位。因此,与原核表达的p35蛋白相比,昆虫杆状病毒表达系统表达的p30蛋白可展示较多的线性和构象性表位,这可能解释昆虫杆状病毒表达系统表达制备的p30重组蛋白作为诊断抗原时,p30-ELISA方法的灵敏度稍高于原核表达系统制备的重组p35蛋白为包被抗原建立的ELISA方法。因此,在后续的研究中可将ASFV p35蛋白在昆虫杆状病毒表达系统中表达,获得具有生物学活性的p35重组蛋白,以便于该重组蛋白展示更多抗原表位用于提高重组p35蛋白诊断抗原的抗原性和检测灵敏度。尽管如此,建立的p35-ELISA方法与进口试剂盒相比,其符合率达到97.9%,可见,所建立的p35-ELISA方法可用于田间ASFV抗体特异性检测。
总之,本研究中的原核表达系统制备的p35蛋白和昆虫杆状病毒表达系统制备的p30蛋白的反应原性较好,建立的p35-ELISA方法和p30-ELISA方法检测灵敏度高且稳定性好,两种方法均可用于田间ASF血清样本的流行病学调查。该研究为建立ASF血清学诊断方法制备优质诊断抗原提供了新的思路和物质基础。
参考文献
| [1] | Penrith ML, Thomson GR, Bastos ADS, et al. An investigation into natural resistance to African swine fever in domestic pigs from an endemic area in southern Africa. Rev Sci Technol, 2004, 23(3): 965-977. DOI:10.20506/rst.23.3.1533 |
| [2] | Dixon LK, Chapman DAG, Netherton CL, et al. African swine fever virus replication and genomics. Virus Res, 2013, 173(1): 3-14. DOI:10.1016/j.virusres.2012.10.020 |
| [3] | Zhang HL, Jin M, Zhao Y, et al. Research progress in the immunology and vaccine of the African swine fever virus. Chin J Virol, 2019, 35(3): 533-541 (in Chinese). 张洪亮, 金铭, 赵越, 等. 非洲猪瘟病毒免疫学及疫苗研究进展. 病毒学报, 2019, 35(3): 533-541. |
| [4] | Revilla Y, Pérez-Nú?ez D, Richt JA. African swine fever virus biology and vaccine approaches. Adv Virus Res, 2018, 100: 41-74. |
| [5] | Blome S, Gabriel C, Beer M. Pathogenesis of African swine fever in domestic pigs and European wild boar-. Virus Res, 2013, 173(1): 122-130. DOI:10.1016/j.virusres.2012.10.026 |
| [6] | Mebus CA. African swine fever. Adv Virus Res, 1988, 35: 251-269. |
| [7] | Wang SC, Zhang SF, Hu RL. Research progress of Ornithodoros ticks related to the epidemiology of African swine fever virus. Acta Parasitol Med Entomol Sin, 2019, 26(4): 269-276 (in Chinese). 王述超, 张守峰, 扈荣良. 非洲猪瘟流行病学与媒介钝蜱研究进展. 寄生虫与医学昆虫学报, 2019, 26(4): 269-276. |
| [8] | Sánchez-Vizcaíno JM, Mur L, Martínez-López B. African swine fever (ASF): Five years around Europe. Vet Microbiol, 2013, 165(1/2): 45-50. |
| [9] | Dixon LK, Sun H, Roberts H. African swine fever. Antiviral Res, 2019, 165: 34-41. DOI:10.1016/j.antiviral.2019.02.018 |
| [10] | Wang Y, Miao FM, Chen T, et al. Diagnosis of the first African swine fever in China. Chin J Virol, 2018, 34(6): 817-821 (in Chinese). 王颖, 缪发明, 陈腾, 等. 中国首例非洲猪瘟诊断研究. 病毒学报, 2018, 34(6): 817-821. |
| [11] | Arias M, Jurado C, Gallardo C, et al. Gaps in African swine fever: Analysis and priorities. Transbound Emerg Dis, 2018, 65(S1): 235-247. |
| [12] | Gallardo MC, Reoyo ADLT, Fernández-Pinero J, et al. African swine fever: a global view of the current challenge. Porcine Health Manag, 2015, 1: 21. DOI:10.1186/s40813-015-0013-y |
| [13] | Gallardo C, Fernández-Pinero J, Arias M. African swine fever (ASF) diagnosis, an essential tool in the epidemiological investigation. Virus Res, 2019, 271: 197676. DOI:10.1016/j.virusres.2019.197676 |
| [14] | Laddomada A, Rolesu S, Loi F, et al. Surveillance and control of African swine fever in free-ranging pigs in Sardinia. Transbound Emerg Dis, 2019, 66(3): 1114-1119. DOI:10.1111/tbed.13138 |
| [15] | Pastor MJ, Laviada MD, Sanchez-Vizcaino JM, et al. Detection of African swine fever virus antibodies by immunoblotting assay. Can J Vet Res, 1989, 53(1): 105-107. |
| [16] | Pastor MJ, Arias M, Escribano JM. Comparison of two antigens for use in an enzyme-linked immunosorbent assay to detect African swine fever antibody. Am J Vet Res, 1990, 51(10): 1540-1543. |
| [17] | Gallardo C, Nieto R, Soler A, et al. Assessment of African swine fever diagnostic techniques as a response to the epidemic outbreaks in eastern European union countries: how to improve surveillance and control programs. J Clin Microbiol, 2015, 53(8): 2555-2565. DOI:10.1128/JCM.00857-15 |
| [18] | Gallardo C, Blanco E, Rodriguez JM, et al. Antigenic properties and diagnostic potential of african swine fever virus protein pp62 expressed in insect cells. J Clin Microbiol, 2006, 44(3): 950-956. DOI:10.1128/JCM.44.3.950-956.2006 |
| [19] | Gallardo C, Reis AL, Kalema-Zikusoka G, et al. Recombinant antigen targets for serodiagnosis of African swine fever. Clin Vaccine Immunol, 2009, 16(7): 1012-1020. DOI:10.1128/CVI.00408-08 |
| [20] | Simón-Mateo C, Andrés G, Almazán F, et al. Proteolytic processing in African swine fever virus: Evidence for a new structural polyprotein, pp62. J Virol, 1997, 71(8): 5799-5804. DOI:10.1128/JVI.71.8.5799-5804.1997 |
| [21] | Pérez-Filgueira DM, González-Camacho F, Gallardo C, et al. Optimization and validation of recombinant serological tests for African swine fever diagnosis based on detection of the p30 protein produced in Trichoplusia ni larvae. J Clin Microbiol, 2006, 44(9): 3114-3121. DOI:10.1128/JCM.00406-06 |
| [22] | Zhang W, Hou LD, Song J, et al. Establishment of a high sensitive indirect ELISA for detecting specific antibodies against H9 subtype avian influenza virus. Chin J Biotech, 2017, 33(8): 1253-1264 (in Chinese). 仉薇, 侯力丹, 宋洁, 等. 一种更灵敏的特异性检测H9亚型禽流感抗体的间接ELISA方法的建立. 生物工程学报, 2017, 33(8): 1253-1264. |
| [23] | Zsak L, Borca MV, Risatti GR, et al. Preclinical diagnosis of African swine fever in contact-exposed swine by a real-time PCR assay. J Clin Microbiol, 2005, 43(1): 112-119. DOI:10.1128/JCM.43.1.112-119.2005 |
| [24] | Porowińska D, Wujak M, Roszek K, et al. Prokaryotic expression systems. Postepy Hig Med Dosw, 2013, 67: 119-129. DOI:10.5604/17322693.1038351 |
