

1. 齐鲁理工学院,山东 济南 250200;
2. 天津科技大学,天津 300457
收稿日期:2019-10-15;接收日期:2020-04-08;网络出版时间:2020-05-15
基金项目:国家重点研发计划(No. 2018YFA0901700)资助
摘要:细胞内生物大分子的相分离(Phase separation)现象是近几年受到极大关注的新兴研究领域。作为一种细胞生化反应的聚集分割机制, 其在自然界中广泛存在, 参与基因转录调控, 影响生物体对外界刺激的应答等重要生理过程。相分离失调可能导致一些重大疾病的发生, 诸多交叉领域的研究者正试图通过相分离这个全新角度来审视老年痴呆等相关疾病, 探索其发生的分子机制以及通过相分离进行干预和治疗的潜在可能性。文中拟介绍该领域最新研究进展, 从生物相分离现象的发现、生化基础及其与疾病发生的联系等方面, 综述目前的主要研究方向, 并对该领域拟解决的关键问题进行展望。
关键词:相分离生物相变细胞分子凝集相分离失调
Research progress of phase separation of intracellular biological macromolecules
Hui Li1, Qingxi Liu1, Xinjun Li1, Qiang Jiao1, Wenjian Ma1,2


1. Qilu Institute of Technology, Jinan 250200, Shandong, China;
2. Tianjin University of Science and Technology, Tianjin 300457, China
Received: October 15, 2019; Accepted: April 8, 2020; Published: May 15, 2020
Supported by: National Key Research and Development Program (No. 2018YFA0901700)
Corresponding author: Wenjian Ma. Tel/Fax: +86-22-60602831; E-mail: ma_wj@tust.edu.cn.
Abstract: The phenomenon of phase separation of intracellular biological macromolecules is an emerging research field that has received great attention in recent years.As an aggregation and compartment mechanism of cell biochemical reactions, it widely exists in nature and participates in important physiological processes such as gene transcription and regulation, as well as influences organism's response to external stimuli.Disequilibrium of phase separation may lead to the occurrence of some major diseases.Researchers in cross-cutting fields are trying to examine dementia and other related diseases from a new perspective of phase separation, exploring its molecular mechanism and the potential possibility of intervention and treatment. This review intends to introduce the latest research progress in this field, summarize the major research directions, biochemical basis, its relationship with disease occurrence, and giving a future perspective of key problems to focus on.
Keywords: phase separationbiological phase transitioncellular molecule aggregationdisequilibrium of phase separation
生物大分子的“相变”或称“相分离”是近年来生命科学领域新兴的发展方向。相分离本是一个物理化学常见现象,当二元系统打破其稳定而均匀的单相状态时,会发生相分离。如同把水和油置于同一容器时,会出现分层现象。近年来发现,细胞液里的不同生物大分子成分也会相互聚集分离,形成液滴状结构[1],这就是所谓的“相分离”。通俗地说,是细胞内蛋白等生物大分子作为固体颗粒,所表现出的液滴具有的性质(流动性、可融合和分散),相互之间可发生融合,聚集在一起形成发挥特定生物功能的液滴状结构,其虽然没有细胞膜状结构围绕,但通过聚集形成类似于细胞器的独立空间,是一种在化学结构基础上产生的物理现象。
2009年,Hyman和Brangwynne研究线虫性腺中RNA和P颗粒形成小球的过程中,首次观察到P颗粒并非通常所认为的固体化内核的蛋白,P颗粒之间可以像液滴一样相互碰撞、融合,表现出类似于液体的物理性质,也即存在“液-液相分离”现象[2],此后围绕“相分离”的生物研究逐步开展起来。2012年Michael Rosen和Steven McKnight发现,在体外试管中通过改变生物化学条件,可以重现体内的“相分离”现象[3-4],是相分离领域的突破性研究进展。然而伴随生物体内“相分离”研究的开展,一直面临很大争议,特别是这种现象是否在细胞内普遍发生是疑问的焦点。近年来随着技术的不断更新和推进,越来越多的证据证实了生物相变这一现象的存在,“相分离”成为目前热门的前沿生物研究领域,被Science杂志评为2018年十大科学突破。
“相分离”涉及到细胞活动的很多方面,细胞DNA的组装、DNA损伤修复、RNA转录以及细胞膜上的信号转导等生命活动都存在这一现象。“相分离”会随着细胞渗透压等情况的改变发生变化,以应对细胞所面临的不良条件。异常的“相分离”会导致多种疾病的发生,如神经性退行疾病、癌症等。关于其具体的表征和理化特性,Salman等提出了“生物分子缩合物”的概念,来归类“相分离”形成的分子聚集体。根据分子的聚集和独立两个特征,概括了包括细胞体、核体、无膜细胞器、颗粒、斑点、聚集体、组合物和膜斑点在内的各种无膜区室[5]。当然,鉴于这是近年来新兴的研究领域,更多的共性表征,特别是个性表征,目前尚没有很多非常明确的界定。这些“生物分子缩合物”在细胞核、细胞质、细胞膜上均有分布。
目前,“相分离”的研究内容还主要集中在发现新的可发生相分离的生物大分子,以及其发生相变的影响因素,包括物理、化学、生物等。进一步研究相分离分子的化学结构特点,并揭示其导致的生物功能变化,以及与衰老和神经退行性疾病之间的联系,是非常吸引人的研究课题。
1 生物分子相分离现象的生化基础及其影响因素在水溶剂中,生物大分子之间通过各种相互作用力使亲和力更强,从而形成相分离现象(见图 1所示模式图,参考自文献[5]并稍作修改),这些作用力包括:酸碱性束之间的静电相互作用(图 1A,P颗粒中的Laf-1),多肽β-链之间的多肽骨架相互作用(图 1B,Fus、hnRNPA1/2),芳香族和碱性残基之间阳离子-π相互作用(图 1C,DEAD-box解旋酶4,DDX4)[6],多嘧啶束结合蛋白与RNA中的UCUCU束(图 1D,PTB-RNA),结构域间的寡聚化(图 1E,EDC3-DCP2,NPM1-R-motifs,SynGAP-PSD-95)以及模块化的结构域之间的相互作用(图 1F,Nck and neural Wiskott-Aldrich syndrome protein,N-WASP)[7]。生物大分子一般通过一种或多种作用力实现生命活动中的相分离,而由不同机理引起的相分离现象其发生条件不同,有些相互作用是有条件的,需要在细胞内特定条件下完成,如通过结构域相互作用的蛋白,这些蛋白的结构域通常富含脯氨酸(Pro)、赖氨酸(Lys)、苯丙氨酸(Phe)、色氨酸(Trp)、酪氨酸(Tyr)等氨基酸,通过其特殊的R基团来实现分子间的相互作用;另一种无条件的可以在体外发生相分离的蛋白则含有大量无序区,被称为固有无序区(Intrinsically disordered regions,IDRs)或低复杂性序列(Low-complexity (LC) sequence),其特点是序列复杂性低并且由特定氨基酸类型组成,主要包括甘氨酸(Gly)、丝氨酸(Ser)、谷氨酰胺(Gln)、天冬酰胺(Asn)、苯丙氨酸(Phe)和酪氨酸(Tyr),有些还含有带电残基赖氨酸(Lys)、精氨酸(Arg)、谷氨酸(Glu)和天冬氨酸(Asp)等[8-9]。
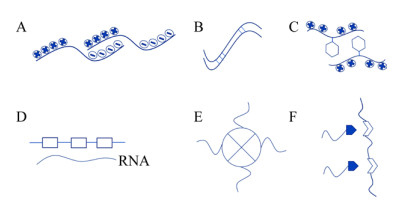 |
| 图 1 相分离分子作用力模式图[5] Fig. 1 Model of the molecular forces in phase-separation[5]. |
| 图选项 |
除了蛋白本身的化学结构决定了能否发生“相分离”外,其发生还与蛋白分子的浓度、溶液的酸碱度、盐浓度及温度有关,低盐浓度可以促进相分离[10-11]。在对Fus、hnRNPA2等通过IDR介导相分离的蛋白的体外相分离实验中,发现其不仅会发生液态的相分离,在低温条件下(4 ℃)还会发生过度聚集形成水凝胶,甚至在低pH条件下会形成无法逆转的沉淀。这些液态、水凝胶、沉淀的形成与解聚条件也与不同分子间氨基酸的组成及甲基化、磷酸化程度相关,如酵母Sup35蛋白形成的凝胶相较其他蛋白来说对SDS的耐受性更强[4],Fus蛋白中精氨酸低甲基化时强烈促进相分离和凝胶化[12-13],Hp1α蛋白去磷酸化后“相分离”能力减弱[14],同时,这些蛋白的原纤维化也会受到其他相关蛋白甚至DNA、RNA的调控,如Karyopherin-b2蛋白[15-16]、DNA依赖性蛋白激酶DNA-PK[17]、Laf-1蛋白结合的RNA等[18]。
因此,可以通过蛋白序列中氨基酸的组成特点来预测生物大分子是否可以发生相分离,或者通过改变氨基酸的组成和修饰来改造蛋白结构,进一步影响其相变特征,如在Fus中增加精氨酸数量则可以在高盐浓度下发生相分离,而将精氨酸和酪氨酸突变则不能发生相分离[16]。而改造蛋白结构是一种治疗因相分离异常所引发的疾病的一种潜在方案,对相关蛋白发生相变的生物化学基础的研究也对相关疾病药物的开发具有指导意义,如蛋白的磷酸化抑制剂等。
2 相分离的生物学意义近年来,陆续在多种生命活动中发现“相分离”现象,从DNA的组装,损伤修复,RNA的转录翻译,到细胞的增殖、衰老,细胞信号转导,细胞周期调控[19],应激保护等,甚至与神经细胞的突触有关[8]。
相分离现象的发生贯穿于细胞的整个生命进程中。细胞的增殖是从有丝分裂开始的,染色质疏散暴露出DNA以方便复制,此后再组装为结构更加紧密的染色体进行联会,将遗传物质分配到两个新的细胞。在这个过程中,染色体的浓缩可能与Hp1α蛋白的相分离有密切联系。Larson和Narlikar发现异染色质具有液滴状特性,Hp1α蛋白的“相分离”导致异染色质的基因沉默[14, 20],而BuGZ蛋白经历相变或凝聚以促进纺锤体及其相关组分的组装[21]。
相分离在蛋白表达过程中也扮演相当重要的角色,影响转录和翻译等过程。首先,相分离可能对转录进行调节,Denes等提出了一个基于相分离的模型,解释了超级增强子高效转录的作用原理[22]。核仁是细胞核内重要的RNA/蛋白质的复合体,主要功能为核糖体亚单位的组装,Brangwynne等的研究表明,大的球形核仁可以通过小的球形核仁的融合形成,表现得像液滴,低复杂性/无序蛋白质基序和重复结合结构域通过促进核质相分离驱动核RNA/蛋白质液滴的组装[23-24],Fus主要定位于细胞核,但也存在于细胞质核糖核蛋白(RNP)颗粒中,RNA结合蛋白在转录、RNA加工和DNA修复中起作用[25-26]。
细胞的稳态调节也有相分离密切参与,在极端状态时,如低pH的压力环境下,酵母细胞会启动保护机制,重要蛋白会聚集成液滴,如蛋白酶体储存颗粒(PSG),其主要由蛋白酶体和游离泛素组成,此外它还在细胞衰老过程中赋予适应性[27],酵母中类似的蛋白还有聚(A)结合蛋白(Pab1)[28]。酵母中的这种“相分离”状态的改变也与其休眠有关,当蛋白聚集形成细丝时,似乎允许细胞的代谢下调进入休眠状态,而ATP依赖的伴侣蛋白则可以使细胞从这种休眠状态恢复过来[29-30],类似的还有非洲爪蟾卵母细胞中的巴尔比尼体[31]和秀丽隐杆线虫的RNP颗粒[32-33]。由“相分离”驱动形成的无膜隔室对衰老相关疾病非常敏感,衰老及相关疾病的发生可能与细胞逐渐失去对细胞内稳态即“相分离”的控制有关[34]。
此外,相分离在DNA修复和信号传导等重要生命活动中也发挥着重要作用。在有53BP1蛋白参与的DNA损伤修复过程中,53BP1蛋白区存在液滴样的相分离现象,这种相分离作用可能有助于协调局部DNA损伤识别和全局基因激活[10, 35]。在Wnt信号传导中的细胞质Dv1簇[36-37]以及T细胞活化中的信号传导簇也是由相分离驱动的[38-39]。
在上述众多现象中,相分离以其调节相关分子聚集和分散、实现功能活动的分区化发挥重要作用,其过程可由专职的蛋白协调进行。
3 相分离与疾病发生的联系鉴于“相分离”参与到细胞的各种生命活动中,其异常的状态必然会导致多种疾病的发生。
如一些具有朊病毒样结构域的核RNA结合蛋白,其突变可加速纤维化并引起疾病,包括肌萎缩性侧索硬化(ALS)、额颞叶痴呆(FTD)和多系统蛋白病(MSP),其中Tdp-43、Fus、EWSER1蛋白从细胞核转移到细胞质中发生错误的定位和聚集,会引起ALS、FTD的发生[40-41]。在MSP中,也发现了hnRNPA1和hnRNPA2的错误定位[40, 42]。
相分离导致的蛋白沉积可能与多种神经性退行疾病密切相关。Liu和Fang研究发现,PARylation通过影响液-液相分离和淀粉样蛋白聚集,在多种神经退行性疾病中发挥重要作用[43]。作为老年痴呆的主要疾病,阿尔茨海默病的发生与存在“相分离”现象的Tau蛋白的病变存在很强的相关性。Tau是一种可溶的神经元特异性微管结合蛋白,具有内在无序性和不均匀的电荷分布,当AD中认知缺陷变得明显时,它们的清除可缓解这种症状[44-45]。
另一种破坏性的神经系统疾病——亨廷顿氏病,又称亨廷顿舞蹈病(Huntington’s disease,HD),也与相分离存在联系。HD的发病与亨廷顿蛋白(Huntingtin protein,Htt) N-末端区域内的聚谷氨酰胺(PolyQ)束的长度有关[46],即Htt-NTFs。Ramdzan等的研究表明,患者细胞内不溶性内含物可以影响细胞代谢和促进其他蛋白质与Htt-NTFs的共聚集和相分离[47]。Profilin与Htt-NTFs的富含脯氨酸的c38区域的结合通过多相连接降低了聚集和相分离的驱动力[48]。
与上述蛋白类似的还有帕金森病(Parkinson’s disease)中的a-突触核蛋白(a-synuclein)等[43]。除此之外,Fus和EWSR1还与癌症相关,EWSR1常被发现与致癌基因的转录相关,朊病毒样结构域的物理特性可以重新定位关键的染色质调节复合物,以建立和维持致癌基因表达程序[49-50]。
4 目前的主要研究方向及研究方法蛋白能否发生“相分离”可以通过生物信息学方法,根据“相分离”的生物化学特征进行预测,然后再通过实验手段证明其特性。网站预测和分析蛋白序列是一种预测蛋白是否能发生“相分离”常用的手段,常用的网站如表 1所示。
表 1 常用网站及其预测方向Table 1 Common websites and their forecasting directions
| Name | URL | Forecast direction |
| PONDR | http://www.pondr.com/ | Predict protein disorder, low complexity and charge prediction disorder |
| disEMBL | http://dis.embl.de/ | Predict protein disorder, low complexity and charge prediction disorder, Beta aggregation prediction |
| CAST | http://dis.embl.de/ | Predict protein low complexity |
| SEG | http://mendel.imp.ac.at/METHODS/seg.server.html | Predict protein low complexity |
| EMBOSS | http://www.bioinformatics.nl/cgi-bin/EMBOSS/Charge | Analysis of individual amino acids and the average charge distribution along the primary sequence |
| PLAAC | http://plaac.wi.mit.edu/ | Predict protein-like prion-like domains and disordered regions |
表选项
传统的研究相分离的实验方法,主要通过体外的液滴形成实验、凝胶形成实验、电镜拍摄原纤维、核磁共振、原纤维衍生、体外相转变测定、光漂白后的荧光修复(FRAP)等。由于IDR介导的蛋白相变在体外可以观察到明显的相分离现象,对这类型的蛋白研究更加深入,通过调整缓冲溶液的盐浓度、pH、溶质成分等可以容易地观察到相分离,甚至得到蛋白的水凝胶,从而通过染色和拍照等手段进行进一步研究。
尽管在体外实验中,“相分离”的研究成果已经非常丰富,但仍存在质疑,关键在于这种“相分离”现象是否在细胞中实际发生,因此迫切需要有效的检测平台,以研究细胞中时刻变化的蛋白的物理状态[1]。
活细胞成像显微镜是细胞内“相分离”研究的基础,这种显微镜可以满足对活细胞长时间的连续观察、摄像,捕捉蛋白所形成液滴的动态变化。在此基础上,需要对观察的蛋白对象进行良好的标记,以及对细胞状态的改变刺激。
光遗传是一种通过光照实时影响细胞内蛋白表达的新方法,已经应用在多个生物研究领域。Shin等通过光遗传平台,利用光来激活IDR介导的活细胞相变,构建“opto-Droplet”系统来研究RNP体蛋白的IDR驱动的凝聚相,实现了光控的可逆相分离[51]。Zhu利用Cry2olig光遗传学系统来调节核仁的粘弹性,发现Cry2olig蛋白质在高于阈值浓度时,核仁可以凝胶化成紧密连接的低迁移率网状结构[24]。“opto-Droplet”系统可以在活细胞内,通过光照改变蛋白表达情况,从而使我们对蛋白相变的实时观察研究不只停留在简单的物理、化学条件的改变,还深入到生物大分子对相变的影响[51]。
通过CRISPR技术对细胞内基因进行编辑,在原有蛋白上加入易被追踪观察的标志物,可以很好地帮助研究者在不影响该蛋白生理活动的同时,观察其相变情况。Kilic等通过CRISPR/Cas9工程化内源性的53BP1蛋白基因座并整合编码小单体红色荧光蛋白mScarlet的框内序列。在不影响该细胞周期、蛋白表达、应激反应的情况下,利用荧光显微镜观察到了活体细胞中53BP1的液滴状性质,及频繁的融合和裂变现象[10]。
随着新技术不断被应用到“相分离”研究领域中,我们也能更加深入地了解生物相变的驱动原理及致病原因。
5 总结与展望长久以来,我们对生命探索的关键在于分解式的研究,即把宏观的分解为微观的,把对个体的研究深入到组织、细胞、分子的层面研究其作用规律,而这种研究往往得到一个点的了解,作为一个复杂而协调的统一体,即便只上升到细胞层面来看,我们所了解的点也构成了一个庞大复杂的集合,各种蛋白如何协调工作,怎样各司其职而不相互干扰是一直以来困扰研究人员的一个难点。生物相变概念的引入,提供了一个不同蛋白分区工作的思路,或者说同工同时的蛋白与无关蛋白相互分离重组的可行的调度方案。这种新的概念给了我们一个新的研究问题的角度,不仅关注各分子之间的化学作用,并考虑其物理状态的变化。目前对于相分离的研究主要集中在其发生的生化基础及特性,相变的化学条件的调控,并向分子相互作用的调控方向发展。其中与疾病相关的可相分离的蛋白更是备受关注,对于相关疾病发生有了新的认识和理解。
随着相分离研究的深入,由相分离引起的众多疾病有望找到新的突破口。目前已有一家基于生物相变的生物医药公司Dewpoint在美国成立,而PARP抑制剂也有望在神经性退行疾病的治疗中发挥新的作用[43]。
生物相变不仅在基础研究领域给我们带来新的视角,由于其生物催化活性、可逆缩合和溶解、生长和分裂的特性,液-液相分离在动态细胞合成方面也被认为是一种可行的分区策略[52]。
除此之外,可“相分离”的蛋白在体外表现出的聚集、融合、相变等特性,使其在生物工程领域也具有一定的应用价值和开发前景。生物合成以其环保、可再生以及完成精细复杂产物的优势,是一种富有潜力的化学合成的替代方案[53]。基于其易于调控以及合成细胞毒性物质等优势,非细胞生物合成近年来引起重视。但其面临着酶生产成本高、催化效率低、酶和辅因子的回收等多种问题[54]。而相分离则可能为我们解决体外因酶浓度和聚集程度远低于细胞内而造成的催化效率低的问题打开了一个新的突破口,目前我们已将相分离应用到非细胞生物合成中,来解决体系稳定性及多酶协同优化等问题。
总而言之,生物大分子的相分离现象一经发现即备受关注,呈现飞速发展的态势,为细胞研究打开了新的局面,将物理性质与生物领域紧密结合,让人们以从未有过的物理视角看到了生命活动的神奇。
参考文献
| [1] | Dolgin E. What lava lamps and vinaigrette can teach us about cell biology. Nature, 2018, 555(7696): 300-302. DOI:10.1038/d41586-018-03070-2 |
| [2] | Brangwynne CP, Eckmann CR, Courson DS, et al. Germline P granules are liquid droplets that localize by controlled dissolution/condensation. Science, 2009, 324(5935): 1729-1732. DOI:10.1126/science.1172046 |
| [3] | Li PL, Banjade S, Cheng HC, et al. Phase transitions in the assembly of multivalent signalling proteins. Nature, 2012, 483(7389): 336-340. DOI:10.1038/nature10879 |
| [4] | Kato M, Han TW, Xie SH, et al. Cell-free formation of RNA granules: low complexity sequence domains form dynamic fibers within hydrogels. Cell, 2012, 149(4): 753-767. |
| [5] | Banani SF, Lee HO, Hyman AA, et al. Biomolecular condensates: organizers of cellular biochemistry. Nat Rev Mol Cell Biol, 2017, 18(5): 285-298. DOI:10.1038/nrm.2017.7 |
| [6] | Nott TJ, Petsalaki E, Farber P, et al. Phase Transition of a disordered nuage protein generates environmentally responsive membra-neless organelles. Mol Cell, 2015, 57(5): 936-947. DOI:10.1016/j.molcel.2015.01.013 |
| [7] | Zeng ML, Shang Y, Araki Y, et al. Phase transition in postsynaptic densities underlies formation of synaptic complexes and synaptic plasticity. Cell, 2016, 166(5): 1163-1175. DOI:10.1016/j.cell.2016.07.008 |
| [8] | Elbaum-Garfinkle S, Kim Y, Szczepaniak K, et al. The disordered P granule protein LAF-1 drives phase separation into droplets with tunable viscosity and dynamics. Proc Natl Acad Sci USA, 2015, 112(23): 7189-7194. DOI:10.1073/pnas.1504822112 |
| [9] | Holehouse AS, Pappu RV. FUS zigzags its way to cross beta. Cell, 2017, 171(3): 499-500. |
| [10] | Kilic S, Lezaja A, Gatti M, et al. Phase separation of 53BP1 determines liquid-like behavior of DNA repair compartments. EMBO J, 2019, 38(16): e101379. |
| [11] | Lin Y, Protter DS, Rosen MK, et al. Formation and maturation of phase-separated liquid droplets by RNA-binding proteins. Mol Cell, 2015, 60(2): 208-219. |
| [12] | Qamar S, Wang GZ, Randle SJ, et al. FUS phase separation is modulated by a molecular chaperone and methylation of arginine cation-π interactions. Cell, 2018, 173(3): 720-734. |
| [13] | Hofweber M, Hutten S, Bourgeois B, et al. Phase separation of FUS is suppressed by its nuclear import receptor and arginine methylation. Cell, 2018, 173(3): 706-719. DOI:10.1016/j.cell.2018.03.004 |
| [14] | Larson AG, Elnatan D, Keenen MM, et al. Liquid droplet formation by HP1α suggests a role for phase separation in heterochromatin. Nature, 2017, 547(7662): 236-240. DOI:10.1038/nature22822 |
| [15] | Guo L, Kim HJ, Wang HJ, et al. Nuclear-import receptors reverse aberrant phase transitions of rna-binding proteins with prion-like domains. Cell, 2018, 173(3): 677-692. |
| [16] | Yoshizawa T, Ali R, Jiou J, et al. Nuclear import receptor inhibits phase separation of FUS through binding to multiple sites. Cell, 2018, 173(3): 693-705. |
| [17] | Murray DT, Kato M, Lin Y, et al. Structure of FUS protein fibrils and its relevance to self-assembly and phase separation of low-complexity domains. Cell, 2017, 171(3): 615-627. DOI:10.1016/j.cell.2017.08.048 |
| [18] | Elbaum-Garfinkle S, Brangwynne CP. Liquids, Fibers, and Gels: The many phases of neurodegeneration. Dev Cell, 2015, 35(5): 531-532. DOI:10.1016/j.devcel.2015.11.014 |
| [19] | Boeynaems S, Tompa P, van den Bosch L. Phasing in on the cell cycle. Cell Div, 2018, 13: 1. |
| [20] | Larson AG, Narlikar GJ. The role of phase separation in heterochromatin formation, function, and regulation. Biochemistry, 2018, 57(17): 2540-2548. DOI:10.1021/acs.biochem.8b00401 |
| [21] | Jiang H, Wang SS, Huang YJ, et al. Phase transition of spindle-associated protein regulate spindle apparatus assembly. Cell, 2015, 163(1): 108-122. |
| [22] | Hnisz D, Shrinivas K, Young RA, et al. A phase separation model for transcriptional control. Cell, 2017, 169(1): 13-23. |
| [23] | Brangwynne CP, Mitchison TJ, Hyman AA. Active liquid-like behavior of nucleoli determines their size and shape in Xenopus laevis oocytes. Proc Natl Acad Sci USA, 2011, 108(11): 4334-4339. DOI:10.1073/pnas.1017150108 |
| [24] | Zhu L, Brangwynne CP. Nuclear bodies: the emerging biophysics of nucleoplasmic phases. Curr Opin Cell Biol, 2015, 34: 23-30. DOI:10.1016/j.ceb.2015.04.003 |
| [25] | Ryu HH, Jun MH, Min KJ, et al. Autophagy regulates amyotrophic lateral sclerosis-linked fused in sarcoma-positive stress granules in neurons. Neurobiol Aging, 2014, 35(12): 2822-2831. DOI:10.1016/j.neurobiolaging.2014.07.026 |
| [26] | Ederle H, Dormann D. TDP-43 and FUS en route from the nucleus to the cytoplasm. FEBS Lett, 2017, 591(11): 1489-1507. DOI:10.1002/1873-3468.12646 |
| [27] | Enenkel C. The paradox of proteasome granules. Curr Genet, 2018, 64(1): 137-140. |
| [28] | Riback JA, Katanski CD, Kear-Scott JL, et al. Stress-Triggered phase separation is an adaptive, evolutionarily tuned response. Cell, 2017, 168(6): 1028-1040. DOI:10.1016/j.cell.2017.02.027 |
| [29] | Petrovska I, Nüske E, Munder MC, et al. Filament formation by metabolic enzymes is a specific adaptation to an advanced state of cellular starvation. Elife, 2014, 3: e02409. |
| [30] | Munder MC, Midtvedt D, Franzmann T, et al. A pH-driven transition of the cytoplasm from a fluid- to a solid-like state promotes entry into dormancy. Elife, 2016, 5: e09347. DOI:10.7554/eLife.09347 |
| [31] | Boke E, Ruer M, Wühr M, et al. Amyloid-like self-assembly of a cellular compartment. Cell, 2016, 166(3): 637-650. DOI:10.1016/j.cell.2016.06.051 |
| [32] | Hubstenberger A, Noble SL, Cameron C, et al. Translation repressors, an RNA helicase, and developmental cues control RNP phase transitions during early development. Dev Cell, 2013, 27(2): 161-173. DOI:10.1016/j.devcel.2013.09.024 |
| [33] | Alberti S, Hyman AA. Are aberrant phase transitions a driver of cellular aging?. Bioessays, 2016, 38(10): 959-968. DOI:10.1002/bies.201600042 |
| [34] | Hubstenberger A, Cameron C, Noble SL, et al. Modifiers of solid RNP granules control normal RNP dynamics and mRNA activity in early development. J Cell Biol, 2015, 211(3): 703-716. DOI:10.1083/jcb.201504044 |
| [35] | Piccinno R, Minneker V, Roukos V. 53BP1-DNA repair enters a new liquid phase. EMBO J, 2019, 38(16): e102871. |
| [36] | Schwarz-Romond T, Merrifield C, Nichols BJ, et al. The Wnt signalling effector Dishevelled forms dynamic protein assemblies rather than stable associations with cytoplasmic vesicles. J Cell Sci, 2005, 118(22): 5269-5277. DOI:10.1242/jcs.02646 |
| [37] | Miller JR, Rowning BA, Larabell CA, et al. Establishment of the dorsal-ventral axis in Xenopus embryos coincides with the dorsal enrichment of dishevelled that is dependent on cortical rotation. J Cell Biol, 1999, 146(2): 427-438. DOI:10.1083/jcb.146.2.427 |
| [38] | Grakoui A, Bromley SK, Sumen C, et al. The immunological synapse: a molecular machine controlling T cell activation. Science, 1999, 285(5425): 221-227. DOI:10.1126/science.285.5425.221 |
| [39] | Phair RD, Misteli T. High mobility of proteins in the mammalian cell nucleus. Nature, 2000, 404(6778): 604-609. DOI:10.1038/35007077 |
| [40] | Harrison AF, Shorter J. RNA-binding proteins with prion-like domains in health and disease. Biochem J, 2017, 474(8): 1417-1438. DOI:10.1042/BCJ20160499 |
| [41] | Patel A, Lee HO, Jawerth L, et al. A liquid-to-solid phase transition of the ALS protein FUS accelerated by disease mutation. Cell, 2015, 162(5): 1066-1077. DOI:10.1016/j.cell.2015.07.047 |
| [42] | Molliex A, Temirov J, Lee J, et al. Phase separation by low complexity domains promotes stress granule assembly and drives pathological fibrillization. Cell, 2015, 163(1): 123-133. |
| [43] | Liu C, Fang YS. New insights of poly(ADP- ribosylation) in neurodegenerative diseases: a focus on protein phase separation and pathologic aggregation. Biochem Pharmacol, 2019, 167: 58-63. DOI:10.1016/j.bcp.2019.04.028 |
| [44] | Pedersen JT, Sigurdsson EM. Tau immunotherapy for Alzheimer's disease. Trends Mol Med, 2015, 21(6): 394-402. DOI:10.1016/j.molmed.2015.03.003 |
| [45] | Wegmann S, Eftekharzadeh B, Tepper K, et al. Tau protein liquid-liquid phase separation can initiate tau aggregation. EMBO J, 2018, 37(7): e98049. |
| [46] | Walker FO. Huntington's disease. Lancet, 2007, 369(9557): 218-228. DOI:10.1016/S0140-6736(07)60111-1 |
| [47] | Ramdzan YM, Trubetskov MM, Ormsby AR, et al. Huntingtin inclusions trigger cellular quiescence, deactivate apoptosis, and lead to delayed necrosis. Cell Rep, 2017, 19(5): 919-927. DOI:10.1016/j.celrep.2017.04.029 |
| [48] | Posey AE, Holehouse AS, Pappu RV. Phase separation of intrinsically disordered proteins. Methods Enzymol, 2018, 611: 1-30. DOI:10.1016/bs.mie.2018.09.035 |
| [49] | Boulay G, Sandoval GJ, Riggi N, et al. Cancer-specific retargeting of baf complexes by a prion-like domain. Cell, 2017, 171(1): 163-178. |
| [50] | Schwartz JC, Wang XY, Podell ER, et al. RNA seeds higher-order assembly of FUS protein. Cell Rep, 2013, 5(4): 918-925. |
| [51] | Shin Y, Berry J, Pannucci N, et al. Spatiotemporal control of intracellular phase transitions using light-activated optoDroplets. Cell, 2017, 168(1/2): 159-171. |
| [52] | Martin N. Dynamic synthetic cells based on liquid-liquid phase separation. Chembiochem, 2019, 20(20): 2553-2568. DOI:10.1002/cbic.201900183 |
| [53] | Wilding KM, Schinn SM, Long EA, et al. The emerging impact of cell-free chemical biosynthesis. Curr Opin Biotechnol, 2018, 53: 115-121. DOI:10.1016/j.copbio.2017.12.019 |
| [54] | Schmid-Dannert C, López-Gallego F. Advances and opportunities for the design of self-sufficient and spatially organized cell-free bio-catalytic systems. Curr Opin Chem Biol, 2019, 49: 97-104. DOI:10.1016/j.cbpa.2018.11.021 |
| [55] | Gao YF, Li PL. "Liquid-liquid" phase separation of biological macromolecules: current situation and prospects. Chin J Cell Biol, 2019, 41(2): 185-191 (in Chinese). 郜一飞, 李丕龙. 生物大分子"液-液"相分离:现状与展望. 中国细胞生物学学报, 2019, 41(2): 185-191. |
| [56] | Wu RB, Li PL. Liquid-liquid phase separation and biomolecular condensates. Chin Sci Bull, 2019(22): 2285-2291 (in Chinese). 吴荣波, 李丕龙. 液-液相分离与生物分子凝集体. 科学通报, 2019(22): 2285-2291. |
