
 , 燕炯
, 燕炯

山西医科大学 公共卫生学院,山西 太原 030001
收稿日期:2019-11-21;接收日期:2020-01-19
基金项目:国家自然科学基金(No. 31772551),山西省自然科学基金(No. 201901D111182)资助
摘要:应用CRISPR/Cas9技术敲除3T3-L1前脂肪细胞plin1,观察PLIN1缺失对脂肪细胞中脂肪水解的影响并探究可能机制。常规培养3T3-L1前脂肪细胞,电穿孔法转染plin1敲除载体,嘌呤霉素培养基挑选plin1敲除细胞,观察转染及筛选后的细胞存活率。“鸡尾酒”法诱导3T3-L1前脂肪细胞分化,酶法测定甘油和TG含量,油红O染色观察脂滴形态及数目的变化。Western blotting检测PLIN1、PPARγ、Fsp27和脂肪酶的蛋白表达;RT-PCR检测PLIN1和脂肪酶的mRNA表达。对照组细胞诱导分化后,微小脂滴数目较少,单房脂滴数目较多并围绕细胞核呈环型排列。相较于对照组,敲除组细胞诱导分化后微小脂滴数目增加,单房脂滴体积缩小,数目减少;细胞中PLIN1 mRNA及蛋白表达被显著抑制(P < 0.05);甘油水平显著上升(0.098 4±0.007 6),TG含量显著下降(0.031 0±0.005 3);HSL和ATGL两种脂肪酶的mRNA及蛋白表达均升高(P < 0.05);PPARγ和Fsp27的表达未有明显变化。上述结果表明plin1敲除后通过暴露脂滴中脂质以及上调脂肪酶等效应增强了3T3-L1脂肪细胞的脂解作用。
关键词:脂滴甘油三酯脂肪酶基因敲除
CRISPR/Cas9 knockout plin1 enhances lipolysis in 3T3-L1 adipocytes
Chenyi Feng, Xiang Xu, Weipeng Dong, Zhaoyang Chen

 , Jiong Yan
, Jiong Yan

School of Public Health, Shanxi Medical University, Taiyuan 030001, Shanxi, China
Received: November 21, 2019; Accepted: January 19, 2020
Supported by: National Natural Science Foundation of China (No. 31772551), Natural Science Foundation of Shanxi Province, China (No.201901D111182)
Corresponding author: Zhaoyang Chen. Tel: +86-351-4135647; E-mail: ccytycn@126.com;
Jiong Yan. Tel: +86-351-3985168; E-mail: yanjiong@126.com.
Abstract: We used CRISPR/Cas9 to delete plin1 of 3T3-L1 preadipocyte, to observe its effect on lipolysis in adipocytes and to explore regulatory pathways. We cultured 3T3-L1 preadipocytes, and the plin1 knockout vectors were transfected by electroporation. Puromycin culture was used to screen successfully transfected adipocytes, and survival rates were observed after transfection. The optimized "cocktail" method was used to differentiate 3T3-L1 preadipocytes. The glycerol and triglyceride contents were determined by enzymatic methods. The changes in lipid droplet form and size were observed by Oil red O staining. The protein expression of PLIN1, PPARγ, Fsp27, and lipases was measured by Western blotting. RT-PCR was used to measure the expression of PLIN1 and lipases mRNA. After the adipocytes in the control group were induced to differentiate, the quantity of tiny lipid droplets was decreased, and the quantity of unilocular lipid droplets was increased and arranged in a circle around the nucleus. Compared with the control group, the volume of unilocular lipid droplets decreased, and the quantity of tiny lipid droplets increased after induction of adipocytes in the knockout group. The expression of PLIN1 mRNA and protein in the adipocytes was significantly inhibited (P < 0.05); glycerol levels increased significantly (0.098 4± 0.007 6), TG levels decreased significantly (0.031 0±0.005 3); mRNA and protein expression of HSL and ATGL increased (P < 0.05); PPARγ and Fsp27 expression unchanged in adipocytes. The above results indicate that the knockout of plin1 enhances the lipolysis of 3T3-L1 adipocytes by exposing lipids in lipid droplets and up-regulating lipases effects.
Keywords: lipid dropletstriglyceridelipaseene knockout
心血管疾病、肥胖、2型糖尿病等代谢综合征的发生发展与脂质代谢异常关系密切[1-2]。过量的能量摄入引起的脂质代谢异常导致三酰甘油(Triglyceride,TG)在脂肪细胞中的累积,造成脂肪细胞肥大或增生,而脂滴作为储存脂质的主要场所,是脂肪细胞中最大的细胞器[3]。脂滴来源于内质网,由中心的TG等中性脂质及外周覆盖镶嵌蛋白的单层磷脂膜构成。脂滴通过微小脂滴的相互融合或结合TG而增大,通过脂解作用而缩小[4-5]。周脂素(Perilipin1,PLIN1)属于脂滴表面蛋白perilipins家族,在白色脂肪组织中高度表达并双向调控脂解作用[6-7],但其具体作用机制尚不明确。
第3代基因编辑技术CRISPR/Cas9具有高效稳定、经济可行、易于操作等特点,已广泛应用于多个学科领域[8]。本研究拟通过CRISPR/Cas9技术敲除3T3-L1前脂肪细胞中的plin1,观察细胞中脂滴形态大小及脂肪水解的变化,检测脂滴表面相关蛋白和脂代谢调控因子的表达,为进一步了解plin1的生物学功能,探究PLIN1对脂肪细胞中脂滴形成及脂肪水解作用并为后续实验提供重要的基础和依据。
1 材料与方法1.1 主要试剂和细胞3T3-L1前脂肪细胞系(小鼠胚胎成纤维细胞)、山羊抗鼠IgG (1︰5 000)、山羊抗兔IgG (1︰5 000)抗体购自武汉博士德生物工程有限公司,HSL (兔单克隆,1︰1 000)、ATGL (鼠单克隆,1︰1 000)、Fsp27 (鼠单克隆,1︰500)、Perilipin1 (兔多克隆,1︰1 000)抗体购自Abcam公司,细胞总RNA提取试剂盒购自北京聚合美生物科技有限公司,TG检测试剂盒、甘油含量检测试剂盒购自南京建成生物工程研究所,CRISPR/Cas9载体PX459购自美国Addgene公司,PLIN1基因敲除载体(PLIN1- PX459-0,1,2,3)由本课题组前期构建,sgRNA1、2、3序列及靶标基因序列如图 1所示。
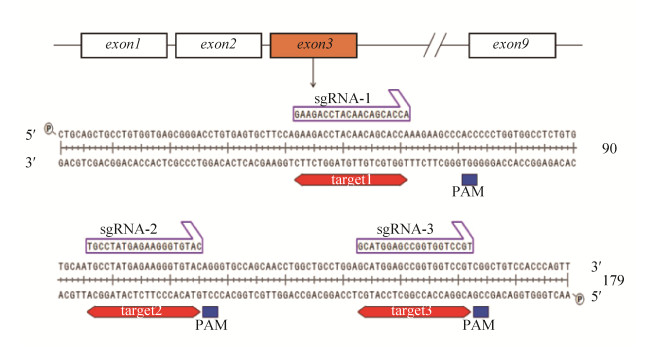 |
| 图 1 sgRNA序列及靶标序列 Fig. 1 sgRNA sequence and target sequence |
| 图选项 |
1.2 3T3-L1前脂肪细胞培养含有10%胎牛血清的高葡萄糖型DEME完全培养基混入1%青链霉素,在37 ℃、5% CO2的无菌环境下培养前脂肪细胞,培养基颜色发黄时或每2 d更换一次。当细胞在培养瓶底聚合至80%–90%时进行传代。
1.3 细胞电穿孔转染、嘌呤霉素筛选以及诱导分化实验共分为5组:空白对照组(Control group,CG)、阴性对照组/PLIN1-PX459-0 (Negative control group,NG)及PLIN1-PX459-1组、PLIN1-PX459-2组、和PLIN1-PX459-3组基因敲除组。将敲除效果最好载体组作为plin1敲除组(plin1 knock out group,KO)。电穿孔转染:细胞观察计数后加入100 μL含有质粒的细胞悬液至0.2 mm电转杯中,按预定条件置入Bio-Rad Gene Pulser Xcell系统中完成转染。嘌呤霉素筛选:6×104/孔的细胞密度铺板,分别加入稀释为5个浓度梯度的嘌呤霉素培养基,37 ℃培养细胞并间隔2 d换液一次,记录细胞日存活率,挑选出嘌呤霉素4 d内使细胞致死的最佳浓度并用该浓度在转染24 h后筛选转染成功的细胞。细胞诱导分化:收集成功转染敲除载体的细胞并采用优化后的“鸡尾酒”法诱导分化[9]。
1.4 细胞内TG与甘油含量测定收集各组细胞至EP管中,加入200 μL PBS后冰水浴条件下破碎细胞制备匀浆。依据甘油检测试剂盒说明书要求配制相应的工作液并96孔板中进行点样20 μL,每孔中加入180 μL工作液后,37 ℃充分进行反应5 min,通过酶标仪在550 nm测定各孔OD值。绘制的标准曲线并进行BCA蛋白定量,在标准曲线的线性范围内计算甘油含量并通过匀浆液中每mg总蛋白浓度校正,TG含量测定同上。
1.5 脂滴油红O染色收集各组细胞铺板于6孔板中,加入1 mL 4%预先配制的多聚甲醛固定细胞1 h后洗净,再加入油红O染液1 mL室温染色1 h后洗净染液,XDS-1型光学显微镜下观察并拍照。Image pro plus 6.1图像分析软件测量脂滴直径,定义直径小于1 μm的为微小脂滴,1–2 μm的为中等脂滴,大于2 μm的为单房脂滴。
1.6 Western blotting检测脂肪细胞中PLIN1、PPARγ、Fsp27和脂肪酶的蛋白表达各组细胞诱导分化8 d后,RIPA裂解液提取细胞总蛋白并定量蛋白浓度,100 ℃金属浴变性后制备SDS-PAGE凝胶。80 V,15 min;100 V,60 min电泳后;120 min,220mA恒流转膜。5%的脱脂奶粉封闭后用稀释的一抗进行反应,4 ℃过夜。室温二抗孵育120 min。NC膜漂洗数次后滴加现配的ECL,于ChemiDoc MP成像系统下曝光。Image J软件检测各蛋白条带灰度值,以GAPDH或β-actin条带进行校正。
1.7 Real Time-Polymerase Chain Reaction检测PLIN1和脂肪酶的mRNA表达当细胞汇合至80%左右时,利用M5 TRIgent试剂提取细胞总RNA,按照试剂盒说明书去除gDNA后加入反转录体系,95℃加热3 min获得cDNA。按照天根Super Real彩色荧光定量预混试剂要求以及Real-Time PCR仪使用说明操作配置反应体系,PCR反应程序:95 ℃ 10 s,60 ℃ 32 s,65 ℃ 5 s,共40个循环。上下游引物序列见表 1。
表 1 RT-PCR引物序列Table 1 RT-PCR primer sequences
| Primer name | Primer sequences (5'–3') | Size (bp) |
| Plin1-F | GAGAGGAGACAGACGACGAGGAG | 23 |
| Plin1-R | GGTCACTGCGGAGATGGTGTTC | 22 |
| Hsl-F | CTCACAGTTACCATCTCACCTC | 22 |
| Hsl-R | GATTTTGCCAGGCTGTTGAGTA | 22 |
| Atgl-F | CAGAGATGGACTTCGATTCCTT | 22 |
| Atgl-R | CAGGTGCTCTAGAATTCGATCT | 22 |
表选项
1.8 数据分析采用SPSS 18.0软件进行数据分析,定量资料采用均数±标准差(x±s)描述。两组间样本均数比较采用t检验,多组间样本均数比较采用one-way ANOVA分析,P < 0.05为有统计学意义。
2 结果与分析2.1 前脂肪细胞转染效率与诱导分化转染敲除载体后,各组细胞12 h存活率基本一致,均在80%以上;筛选出细胞的转染效率约为30%;如图 2所示,嘌呤霉素培养基使细胞致死效果最佳的浓度为4 μg/mL;诱导分化0、6、12 d后油红O染色观察;对照组细胞中出现大量单房脂滴且围绕细胞核呈环型分布;敲除组细胞中微小脂滴数目增多,单房脂滴体积明显缩小,数目减少(图 3)。
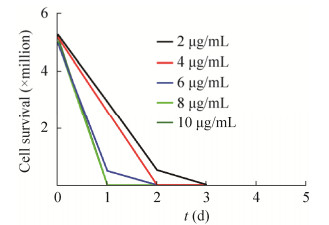 |
| 图 2 嘌呤霉素浓度筛选 Fig. 2 Screening of puromycin concentration |
| 图选项 |
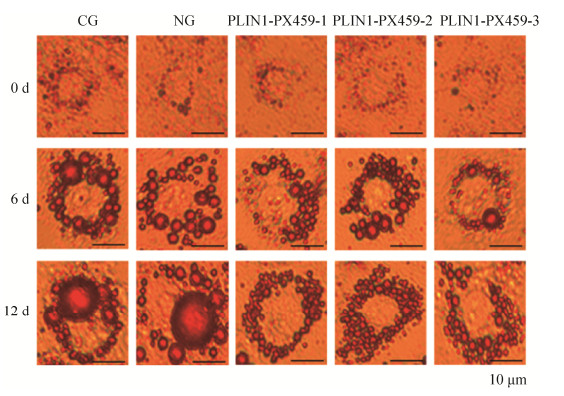 |
| 图 3 3T3-L1前脂肪细胞诱导分化 Fig. 3 Differentiation of 3T3-L1 preadipocytes |
| 图选项 |
2.2 plin1敲除后对3T3-L1脂肪细胞中PLIN1蛋白及mRNA表达的影响各组细胞诱导分化的6 d后检测PLIN1蛋白及mRNA表达(图 3)。相比于对照组,敲除组细胞中PLIN1蛋白(图 4A)及mRNA表达均降低(P < 0.05) (图 4B)。其中以PLIN1-PX459-2组敲除效果最好,作为plin1敲除组。
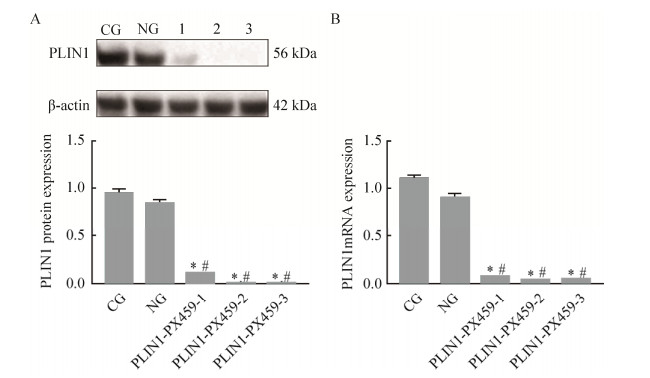 |
| 图 4 脂肪细胞中plin1敲除效果 Fig. 4 Effect of plin1 knockout in adipocytes. (A) Expression of PLIN1 protein in adipocytes after knockout. (B) Relative expression of PLIN1 mRNA in adipocytes after knockout. *: compared with the CG, P < 0.05; #: compared with the NG, P < 0.05 |
| 图选项 |
2.3 plin1敲除后对脂肪细胞中脂滴大小的影响各组细胞诱导分化8 d测量脂滴直径。结果表明,相比于对照组,敲除组细胞中的微小脂滴数目增加;中等及单房脂滴数目减少(P < 0.05) (图 5)。
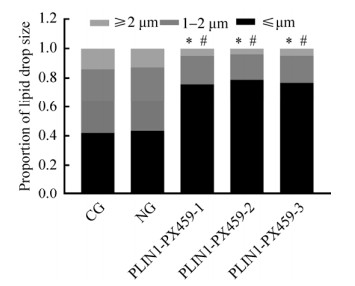 |
| 图 5 电转染后脂肪细胞内脂滴比例 Fig. 5 Proportion of lipid droplets in adipocytes after electroporation. *: compared with the CG, P < 0.05; #: compared with the NG, P < 0.05 |
| 图选项 |
2.4 plin1敲除后对脂肪细胞中的甘油和TG的影响各组细胞诱导分化12 d后检测细胞中甘油和TG水平,结果表明,相比于对照组,敲除组细胞中甘油水平显著上升,TG水平显著下降(P < 0.05) (表 2)。
表 2 各组脂肪细胞中甘油与TG水平Table 2 Glycerol and triglyceride in each group of adipocytes
| Group | Glycerol (mmol/g protein) | TG (mmol/g protein) |
| CG | 0.048 5±0.013 1 | 0.107 8±0.003 9 |
| NG | 0.037 6±0.012 4 | 0.125 6±0.007 6 |
| KO | 0.098 4±0.007 6*# | 0.031 0±0.005 3*# |
| *: compared with the CG, P < 0.05; #: compared with the NG, P < 0.05. | ||
表选项
2.5 plin1敲除对脂肪细胞中HSL和ATGL的影响各组细胞诱导分化12 d后检测两种脂肪酶HSL和ATGL的mRNA及蛋白表达。结果显示,相比于对照组,敲除组细胞中HSL和ATGL mRNA及蛋白表达均显著升高(P < 0.05) (图 6)。
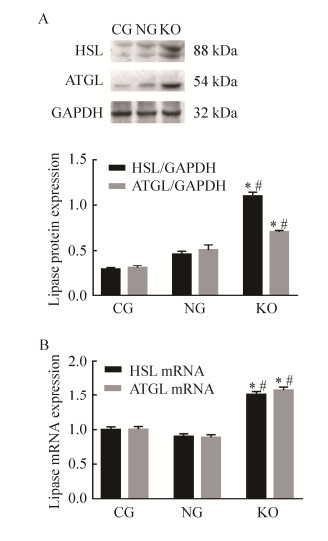 |
| 图 6 plin1敲除后脂肪细胞中脂肪酶蛋白及mRNA表达 Fig. 6 Expression of lipase protein and mRNA in adipocytes after plin1 knockout. *: compared with the CG, P < 0.05; #: compared with the NG, P < 0.05 |
| 图选项 |
2.6 plin1敲除对脂肪细胞中Fsp27和PPARγ蛋白表达的影响各组细胞诱导分化12 d后检测Fsp27和PPARγ的蛋白表达,如图 7所示,相比于对照组,敲除组细胞中Fsp27和PPARγ的蛋白表达未有明显变化(P > 0.05)。
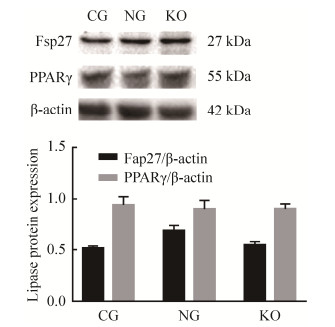 |
| 图 7 plin1敲除后脂肪细胞中相关蛋白表达 Fig. 7 Expression of related proteins in adipocytes after plin1 knockout |
| 图选项 |
3 讨论肥大的脂肪细胞主要是脂滴之间的融合以及TG的累积,最终形成巨大的单房脂滴所导致的[10]。当脂解作用发生时,TG被包括ATGL和HSL在内的多种脂肪酶催化水解为游离脂肪酸和甘油,导致脂滴体积缩小[12-13]。而通过检测细胞中甘油和TG含量即可说明脂肪细胞中脂解作用的强弱[11]。
本次研究电转染plin1敲除载体后,细胞中PLIN1蛋白及mRNA的表达水平证明3T3-L1脂肪细胞中的plin1被成功敲除;在前脂肪细胞诱导分化的过程中,敲除组细胞存活率与对照组相比未有明显差异,细胞分化比例基本一致;敲除组细胞中仍会出现脂滴并且增大。在诱导分化12 d后,酶法测定脂肪细胞中甘油和TG水平发现敲除组细胞中甘油水平显著上升,TG水平显著下降;油红O染色以及脂滴直径测量发现敲除组细胞中脂滴体积明显减小,单房脂滴难以形成,数量减少,而微小脂滴的数目显著增多。表明plin1敲除后可能会增强3T3-L1脂肪细胞中的脂解作用并引起细胞中脂滴形态及数目的改变。这可能是由于PLIN1缺失后,脂解酶更易于接触脂滴并水解其储存的TG所导致的。此外,敲除组细胞在诱导分化过程中,脂肪甘油三酯脂肪酶(Adipose triglyceride lipase,ATGL)与激素敏感脂肪酶(Hormone-sensitive lipase,HSL)的基因表达明显升高。而在肾上腺素、瘦素激素等刺激脂解过程中,ATGL与HSL的磷酸化和转移虽然被改变,但基因表达却未受到影响[14-15]。表明脂肪酶基因的上调可能是plin1敲除增强脂肪细胞脂解的另一个因素。ATGL是脂肪细胞中主要的TG脂肪酶,受到比较识别基因-58 (Comparative gene identification-58,CGI-58)与G0/G1转换基因-2 (G0/G1 switch gene-2,G0S2)的调控[16]。PLIN1磷酸化后会与CGI-58解离,激活ATGL的表达与活性[17]。因此,在plin1敲除后脂肪细胞中ATGL表达增加可能是由于PLIN1缺失引起的CGI-58大量解离所引起的,但是否与G0S2有关尚未探究。而HSL表达升高的原因可能是与plin1敲除后抑制了甾醇调节元件结合蛋白-1c (Sterol regulator element-binding protein-1c,SREBP-1c)表达的激活有关[18]。但HSL需要通过磷酸化后,在磷酸化的PLIN1介导下转移至脂滴表面才能发挥作用[15],plin1敲除后其表达量升高是否会影响细胞的脂解作用也有待进一步研究。相比于课题组前期研究中沉默或下调plin1[19-20],CRISPR/ Cas9近乎完全抑制了PLIN1的表达,完成了plin1敲除,更加显著提高了细胞中脂解酶的表达以及基础脂解。
细胞死亡诱导DNA断裂因子α样效应器(Cell death-inducing DNA fragmentation factor alpha-like effector,CIDE)家族蛋白也是一类调控脂质代谢的脂滴表面结合蛋白,其中Fsp27 (CIDEc)与CIDEa蛋白在脂肪组织中特异表达[21]。Fsp27蛋白的N端结构域可以与PLIN1特异性结合从而被激活,Fsp27激活后与CIDEa蛋白在脂滴间的结合点聚集,并介导微小脂滴间的相互融合,从而促进单房脂滴的形成。Fsp27与PLIN1共同表达及协同作用可能是脂肪细胞中的单房脂滴或大脂滴形成的必要条件[22-23]。我们发现在plin1敲除的脂肪细胞中,Fsp27的表达并未受到影响,这是由于PLIN1与Fsp27的协同作用是通过蛋白-蛋白互作产生的[22],PLIN1可能并未影响Fsp27的转录及转录后调控。PLIN1缺失后Fsp27仍存在于脂滴表面,但不能独立发挥促进单房脂滴形成的作用。PPARγ是核受体过氧化物酶体增殖物激活受体(Peroxisome proliferators- activated receptors,PPARs)家族成员之一,调节3T3-L1前脂肪细胞生长分化与脂质生成[24-26]。PPARγ被抑制时会导致前脂肪细胞分化障碍及脂质合成减弱,引起脂滴形态的变化。另外,PPARγ也是plin1的上游转录因子[26]。在本次研究中发现敲除组细胞中PPARγ的表达并未有明显改变,表明细胞中脂质生成作用并未减弱。这从侧面支持了脂滴形态及数目变化是由于PLIN1缺失所导致的推论。但脂肪生成作用并不只受PPARγ调控,其表达量未变是否能说明脂肪生成作用的稳定仍需进一步研究。
4 结论本研究通过CRISPR/Ca9技术证实plin1敲除后会通过暴露脂滴中脂质以及上调脂肪酶等效应增强3T3-L1脂肪细胞的脂解作用。进一步阐述了plin1的生物学功能,为后续实验以及代谢综合征的防治提供了理论基础。
参考文献
| [1] | DeBose-Boyd RA. Significance and regulation of lipid metabolism. Semin Cell Dev Biol, 2018, 81: 97. |
| [2] | Smith U, Kahn BB. Adipose tissue regulates insulin sensitivity: role of adipogenesis, de novo lipogenesis and novel lipids. J Intern Med, 2016, 280(5): 465-475. |
| [3] | Walther TC, Chung J, Farese RV. Lipid droplet biogenesis. Annu Rev Cell Dev Biol, 2017, 33: 491-510. |
| [4] | Krahmer N, Guo Y, Farese RV, et al. SnapShot: lipid droplets. Cell, 2009, 139(5): 1024-1024. |
| [5] | Martin S, Parton RG. Lipid droplets: a unified view of a dynamic organelle. Nat Rev Mol Cell Biol, 2006, 7(5): 373-378. |
| [6] | Sztalryd C, Brasaemle DL. The perilipin family of lipid droplet proteins: Gatekeepers of intracellular lipolysis. Biochim Biophys Acta Mol Cell Biol Lipids, 2017, 1862(10): 1221-1232. |
| [7] | Brasaemle DL, Rubin B, Harten IA, et al. Perilipin A increases triacylglycerol storage by decreasing the rate of triacylglycerol hydrolysis. J Biol Chem, 2000, 275(49): 38486-38493. |
| [8] | Zhan CS, Xia XY. Research progress of CRISPR-Cas9 system for gene therapy. Chin J Biotechnol, 2016, 32(7): 861-869 (in Chinese). 詹长生, 夏小雨. 基于CRISPR-Cas9技术的基因治疗研究进展. 生物工程学报, 2016, 32(7): 861-869. |
| [9] | Guo XL, Xu MG, Zhang XL, et al. Establishment of culture and differentiation of mouse 3T3-L1 preadipocytes. Zhongguo Yaowu Yu Linchuang, 2013, 13(12): 1542-1544, 1662 (in Chinese). 郭秀玲, 徐民岗, 张秀丽, 等. 小鼠3T3-L1前脂肪细胞培养与诱导分化方法的建立. 中国药物与临床, 2013, 13(12): 1542-1544+1662. |
| [10] | Suzuki M. Regulation of lipid metabolism via a connection between the endoplasmic reticulum and lipid droplets. Anat Sci Int, 2017, 92(1): 50-54. |
| [11] | Langin D. Control of fatty acid and glycerol release in adipose tissue lipolysis. C R Biol, 2006, 329(8): 598-607. |
| [12] | Fruhbeck G, Mendez-Gimenez L, Fernandez-Formoso JA, et al. Regulation of adipocyte lipolysis. Nutr Res Rev, 2014, 27(1): 63-93. |
| [13] | Lampidonis AD, Rogdakis E, Voutsinas GE, et al. The resurgence of Hormone-Sensitive Lipase (HSL) in mammalian lipolysis. Gene, 2011, 477(1/2): 1-11. |
| [14] | Koltes DA, Spurlock ME, Spurlock DM. Adipose triglyceride lipase protein abundance and translocation to the lipid droplet increase during leptin-induced lipolysis in bovine adipocytes. Domest Anim Endocrinol, 2017, 61: 62-76. |
| [15] | Granneman JG, Moore HP, Granneman RL, Greenberg AS, et al. Analysis of lipolytic protein trafficking and interactions in adipocytes. J Biol Chem, 2007, 282(8): 5726-5735. |
| [16] | Turnbull PC, Ramos SV, MacPherson RE, et al. Characterization of lipolytic inhibitor G(0)/G(1) switch gene-2 protein (G0S2) expression in male Sprague-Dawley rat skeletal muscle compared to relative content of adipose triglyceride lipase (ATGL) and comparitive gene identification-58 (CGI-58). PLoS ONE, 2015, 10(3): e0120136. |
| [17] | MacPherson RE, Ramos SV, Vandenboom R, et al. Skeletal muscle PLIN proteins, ATGL and CGI-58, interactions at rest and following stimulated contraction. Am J Physiol, 2013, 304(8): R644-650. |
| [18] | Zhang S, Liu G, Xu C, et al. Perilipin 1 Mediates lipid metabolism homeostasis and inhibits inflammatory cytokine synthesis in bovine adipocytes. Front Immunol, 2018, 9: 467. |
| [19] | Zhang SH, Zhang ZW, Wang JS, et al. Combined effect of PLIN1 gene silencing and isoproterenol on lipolysis of 3T3-L1 adipocytes. Xiandai Yufang Yixue, 2018, 45(1): 2023-2027, 2038 (in Chinese). 张少华, 赵志武, 王君实, 等. 沉默PLIN1基因与异丙肾上腺素对3T3-L1脂肪细胞脂解的机制探究. 现代预防医学, 2018, 45(1): 2023-2027, 2038. |
| [20] | Zhao ZW, Wang JS, Ma M, et al. Effect of down-regulated Perilipin 1 gene expression on lipolysis of 3T3-L1 adipocytes. Zhongguo Shengwu Gongcheng Zazhi, 2016, 36(3): 17-22 (in Chinese). 赵志武, 王君实, 马敏, 等. 下调Perilipin 1基因表达对3T3-L1细胞脂解的影响. 中国生物工程杂志, 2016, 36(3): 17-22. |
| [21] | Slayton M, Gupta A, Balakrishnan B, et al. CIDE proteins in human health and disease. Cells, 2019, 8(3). |
| [22] | Grahn TH, Zhang Y, Lee MJ, Sommer AG, Mostoslavsky G, Fried SK, et al. FSP27 and PLIN1 interaction promotes the formation of large lipid droplets in human adipocytes. Biochem Biophys Res Commun, 2013, 432(2): 296-301. |
| [23] | Gong J, Sun Z, Wu L, et al. Fsp27 promotes lipid droplet growth by lipid exchange and transfer at lipid droplet contact sites. J Cell Biol, 2011, 195(6): 953-963. |
| [24] | Xu X, Dong WP, Zhang SH, et al. Construction of Fsp27 gene silencing vector and its effect on cell lipolysis. Biotechnol Bull, 2020, 36(3): 65-70 (in Chinese). 许祥, 董维鹏, 张少华, 等. Fsp27基因沉默载体的构建及其对细胞脂解的影响研究. 生物技术通报, 2020, 36(3): 65-70. |
| [25] | Shao X, Wang M, Wei X, et al. Peroxisome proliferator-activated receptor-gamma: master regulator of adipogenesis and obesity. Curr Stem Cell Res Ther, 2016, 11(3): 282-289. |
| [26] | Zhu YX, Zhang ML, Zhong Y, et al. Modulation effect of peroxisome proliferator-activated receptor agonists on lipid droplet proteins in liver. J Diabetes Res, 2016, 2016: 8315454. |
