
 , 余波
, 余波

南昌师范学院 生物系,江西 南昌 330000
收稿日期:2019-11-12;接收日期:2020-01-09
基金项目:江西省教育厅科学技术研究重点项目(No. GJJ181070), 江西省科技计划项目重点研发计划(No. 20192BBFL60008), 南昌师范学院科技创新团队项目(No. NSTD20143005)资助
摘要:HSP21是植物响应高温胁迫的关键基因,在防止蛋白变性、保护细胞结构和维持植物正常生长发育等方面发挥重要作用,克隆HSP21基因是揭示木薯抵抗高温胁迫分子机制的基础。为得到木薯HSP21同源基因及分析其表达蛋白的性质,文中采用电子克隆技术对新基因进行组装和衍生,并使用生物信息学分析方法,对预测蛋白的一级至高级结构、亲水性/疏水性、信号肽、蛋白同源性和系统进化等进行全面解析。结果表明,HSP21基因含有969个碱基对,其开放阅读框有705个碱基,预测蛋白含234个氨基酸。预测蛋白是非跨膜蛋白,具有碱性和亲水性,主要定位于叶绿体内。通过多重序列比对和系统进化分析发现,木薯与巴西橡胶树、蓖麻和麻疯树等植物的HSP21蛋白同源性较高。结果可为该基因的克隆和转化提供参考依据。
关键词:木薯HSP21基因电子克隆生物信息学
In silico cloning and bioinformatics analysis of HSP21 in Manihot esculenta
Shangguang Du

 , Bo Yu
, Bo Yu

Department of Biology, Nanchang Normal University, Nanchang 330000, Jiangxi, China
Received: November 12, 2019; Accepted: January 9, 2020
Supported by: Key Project of Science and Technology Research of Jiangxi Provincial Department of Education (No. GJJ181070), Key Research and Development Program of Science and Technology Plan of Jiangxi Province (No. 20192BBFL60008), Science and Technology Innovation Team Project of Nanchang Normal University (No. NSTD20143005)
Corresponding author: Shangguang Du. Tel: +86-791-83817248; E-mail: duguangss@foxmail.com;
Bo Yu. Tel: +86-791-83817248; E-mail: yubojxie@163.com.
Abstract: HSP21 gene is a key gene to respond high temperature stress in plant and plays an important role in preventing protein denaturation, protecting cell structure and maintaining normal growth and development. Therefore, cloning HSP21 gene is the basis for revealing the molecular mechanism of resistance to high temperature stress in cassava. To obtain cassava HSP21 homologous gene and analyze the properties of predicted protein, electronic cloning technology was used to assemble and derivate new gene in this study, and bioinformatics analysis method was used to analyze the primary to highest structure, hydrophilicity/hydrophobicity, signal peptide, protein homology and phylogenetic evolution of expressed protein. HSP21 gene was 969 bp, its open reading frame was 705 bp, and the predicted protein contains 234 amino acids. The predicted protein is a non-transmembrane protein that is alkaline and hydrophilic, and is mainly localized in the chloroplast. Through multiple sequence alignment and phylogenetic analysis, it was found that the cassava HSP21 protein has high homology with other plants such as Hevea brasiliensis, Ricinus communis, and Jatropha curcas. The results could provide reference for the study of cloning and transformation of this gene.
Keywords: CassavaHSP21in silico cloningbioinformatics
木薯(Manihot esculenta Crantz),又称树薯,与甘薯、马铃薯并称为全球三大薯类,它是国内外广泛种植的大戟科木薯属粮食作物,也是一种价值很高的工业材料和养殖饲料,被誉为“淀粉之王”、“地下粮仓”[1]。木薯具有耐贫瘠[2]、耐干旱[3]、喜高温[4]的特点,单位面积产量较高,是一种适应性很强的作物。目前木薯研究主要集中在种质抗寒、农艺性状等方面,对抗高温分子机制的研究较少[5]。
小热休克蛋白(Small heat shock proteins,sHSPs)基因广泛存在于植物中,它是热激蛋白基因家族中一类重要的热应激基因,高温胁迫会激发该基因的表达[6-7]。sHSPs能有效抑制蛋白质变性、保持细胞膜、细胞骨架稳定及诱导抵抗高温胁迫相关基因的表达,所以它在维持植物正常生命活动中发挥重要作用[8-11]。高温环境下,sHSPs能够有效调节植物细胞膜的流动性,并与构象改变的蛋白质结合,等温度恢复正常时,蛋白质与之分离并恢复正常的构象;并且sHSPs能防止细胞发生非正常凋亡,有效减少高温对植物的伤害[12-14]。
HSP21热激蛋白是一类重要的sHSP蛋白,是一种进化上比较保守的蛋白质,它广泛分布于植物的各个部位[15]。对拟南芥、水稻和烟草等模式植物研究发现,HSP21热激蛋白不仅在高温中抵抗热胁迫,也在其他胁迫时保护细胞,并在植物生长发育中发挥重要作用[16-17]。近年来,sHSP基因的功能在模式植物中得到广泛的研究,而木薯sHSP基因的功能还存在许多盲区,甚至HSP21基因尚未被克隆[16-17]。木薯是广泛种植于热带和亚热带的耐热性作物,克隆HSP21基因可为其表达载体构建、遗传转化以及热胁迫下光合保护机制的研究奠定基础。传统的基因克隆技术主要包含简并序列克隆技术、定位克隆技术和转座子标签克隆技术等,这些方法虽能较好地完成基因克隆的目的,但实验步骤繁琐、试剂用量大且时间太长,并耗费大量人力和物力[18-19]。基因电子克隆技术是利用现有数据库对目标基因的表达序列标签(EST序列)进行采集、组装和衍生,得到所需要的cDNA序列,该技术不仅能准确、快速地得到新基因,而且节省大量的人力物力。
本研究使用电子克隆技术,利用拟南芥HSP21基因的核苷酸序列,得到木薯相应的EST序列,利用序列组装软件进行拼结、衍生,得到木薯HSP21基因的cDNA序列,并利用生物信息学方法预测其表达蛋白的性质。这为该基因的克隆、表达载体构建、遗传转化以及热胁迫分子机制的研究提供参考。
1 材料与方法1.1 木薯HSP21基因的电子克隆以拟南芥HSP21的基因序列(Gene ID:828881)为探针,在木薯的EST库中通过blastn搜寻同源的EST序列,选择能够覆盖探针核苷酸序列的EST序列,利用CAP3在线软件(http://doua.prabi.fr/software/cap3)对序列进行组装和衍生,得到的cDNA继续对比,直至无新的EST序列可组装。
1.2 木薯HSP21基因的序列分析分别利用DNAMAN、ORFfinder完成氨基酸序列的翻译和开放阅读框的寻找;分别利用在线软件(https://web.expasy.org/protparam/和https://web.expasy.org/protscale/)分析表达蛋白的基本理化指数、亲水性/疏水性[1-3];分别利用在线软件ProtComp v9.0和TMHMM工具分析该蛋白亚细胞定位和跨膜区域;利用NetPhos 3.0和SignalP 4.1在线软件分析磷酸化位点与信号肽;使用SOPMA和SWISS-MODEL在线软件分析二级及高级结构。
1.3 系统进化树构建利用ClustalX 2.0对木薯、巴西橡胶树、蓖麻、麻疯树等12种不同物种的HSP21氨基酸序列进行多重比对[1-3],参数默认,保存aln文件;然后在MEGA X软件中打开该aln文件,建立HSP21同源蛋白的系统进化树,以Kimura双参数模型计算遗传距离,设置检验方法(Bootstrap method),循环次数为1 000。
2 结果与分析2.1 木薯HSP21基因cDNA克隆利用拟南芥HSP21核苷酸序列,在NCBI数据库中进行木薯EST序列的blastn,得到4条相关的EST序列,并具有重叠群特点,使用CAP3在线软件拼装和衍生,获得一段总长为969个碱基的cDNA序列(图 1)。使用ORFfinder软件分析可知,此cDNA的ORF框为112–816碱基(图 2),起始和终止密码子分别是ATG和TGA,表达蛋白含有234个氨基酸。Blastx分析表明,该序列与巴西橡胶树、蓖麻的HSP21蛋白具有较高的亲缘关系[19-21],序列一致性分别为83%和73%,且能比对到同源蛋白的首尾两端,即该cDNA序列是完整的,命名基因为MeHSP21,表达蛋白为MeHSP21。
 |
| 图 1 木薯HSP21基因的cDNA拼接图 Fig. 1 Assembled cDNA drawing of cassava HSP21 gene. |
| 图选项 |
 |
| 图 2 木薯HSP21基因的cDNA及预测蛋白序列分析 Fig. 2 The sequence analysis of cDNA and predicted protein of HSP21 gene in cassava. |
| 图选项 |
2.2 MeHSP21基因表达蛋白理化性质分析使用ProtParam tool分析cDNA表达蛋白的理化参数,该蛋白质分子式、分子量和理论等电点分别为C1134H1847N327O359S10、26.10 kDa和7.71,是碱性蛋白质;脂肪系数、负电荷残基(天冬氨酸+谷氨酸)和正电荷残基(精氨酸+赖氨酸)分别是74.91、35.00和36.00;不稳定系数和平均总亲水性分别是36.01和–0.584,属于稳定亲水蛋白(表 1)。预测蛋白含有20种氨基酸,含量最多的是丝氨酸(Ser),最少的是组氨酸(His)和酪氨酸(Tyr)。
表 1 表达蛋白理化性质预测Table 1 Physicochemical properties prediction of expressed protein
| Items | Results |
| Molecular formula | C1134H1847N327O359S10 |
| Molecular weight | 26.10 kDa |
| Theoretical pI | 7.71 |
| Total number of negatively charged residues (Asp+Glu) | 35.00 |
| Total number of positively charged residues (Arg+Lys) | 36.00 |
| Instability index | 36.01 |
| Aliphatic index | 74.91 |
| Grand average of hydropathicity | –0.584 |
表选项
2.3 MeHSP21基因表达蛋白疏水性/亲水性分析对木薯MeHSP21蛋白的一级结构进行ProtScale分析,该多肽链的第216位Phe和第174位的Lys分别具有最高分值(1.500)和最低分(–2.867),即前者疏水性最强,后者亲水性最强(图 3)。利用ProtParam分析可知,氨基酸序列平均疏水指数为–0.584,即该蛋白为亲水性蛋白。
 |
| 图 3 木薯HSP21蛋白疏水性/亲水性预测 Fig. 3 Predicted hydrophilicity/hydrophobicity of HSP21 protein in cassava. |
| 图选项 |
2.4 亚细胞定位和跨膜区分析使用ProtComp v.9.0在线软件分析目标蛋白亚细胞定位(表 2),在叶绿体中此蛋白质具有最大分数(9.27);即表达蛋白可能是主要定位于叶绿体内的功能蛋白。利用TMHMM v.2.0在线分析(图 4),此蛋白质没有明显的跨膜区,为非生物膜上的功能蛋白。
表 2 木薯HSP21蛋白亚细胞定位分析Table 2 Analysis of subcellular localization of HSP21 protein in cassava
| Location | LocDB | PotLocDB | Neural nets | Pentamers | Integral |
| Nuclear | - | - | - | - | - |
| Plasma membrane | - | - | 0.96 | - | 0.10 |
| Extracellular | - | - | 0.99 | 0.28 | 0.52 |
| Cytoplasmic | - | - | - | - | - |
| Mitochondrial | - | - | - | 1.05 | 0.05 |
| Endoplasmic reticulum | - | - | - | 0.02 | - |
| Peroxisomal | - | - | 0.96 | - | 0.05 |
| Golgi apparatus | - | - | 0.11 | 0.20 | 0.01 |
| Chloroplast | 10.00 | 3.00 | - | 3.96 | 9.27 |
| Vacuolar | - | - | - | 0.08 | - |
| Note: “-” represents a value of “0.00”. | |||||
表选项
 |
| 图 4 木薯HSP21蛋白跨膜区域预测 Fig. 4 Predicted transmembrane region of HSP21 protein in cassava. |
| 图选项 |
2.5 磷酸化位点与信号肽分析蛋白质磷酸化是成熟后修饰的重要方式,磷酸化修饰和表达蛋白的功能成正相关[22-24]。利用NetPhos 3.0服务在线分析(图 5),此蛋白含有的丝氨酸、苏氨酸和酪氨酸磷酸化位点数目分别是19、8、0。利用SignalP 4.1信号肽分析,第17位的赖氨酸残基拥有最高原始剪切位点分值(C-score)和最高综合剪切位点分值(Y-score),分别为0.132和0.147,且多肽链首位蛋氨酸残基的最高信号肽分值(S-score)为0.181 (图 6)。所有分值均低于平均分0.5,即该蛋白是无信号肽结构的非分泌蛋白。
 |
| 图 5 木薯HSP21蛋白磷酸化位点分析 Fig. 5 Analysis of phosphorylation sites of HSP21 protein in cassava. |
| 图选项 |
 |
| 图 6 木薯HSP21蛋白信号肽分析 Fig. 6 Analysis of signal peptide of HSP21 protein in cassava. |
| 图选项 |
2.6 高级结构的预测使用SOPMA分析MeHSP21蛋白的二级结构可知,多肽链中含有3种氨基酸序列,分别是16.24%的α螺旋、17.52%的延伸链和66.24%的无规则卷曲序列(图 7)。选取“5nms.pdb”模板,利用SWISS-MODEL预测该蛋白三级结构,序列一致性和覆盖度分别是77.86%、60%,空间结构主要由α螺旋、β折叠和无规则卷曲构成;利用VMD 1.9.3软件绘制其三维结构,见图 8。
 |
| 图 7 木薯HSP21蛋白的二级结构分析 Fig. 7 Analysis of the secondary structure of HSP21 protein in cassava. |
| 图选项 |
 |
| 图 8 木薯HSP21蛋白的三级结构分析 Fig. 8 Tertiary structure analysis of HSP21 protein in cassava. |
| 图选项 |
2.7 氨基酸同源性分析及进化树构建利用NCBI数据库对木薯MeHSP21的氨基酸序列比对发现,木薯与巴西橡胶树Hevea brasiliensis (XP_021679758.1)、哥伦比亚锦葵Herrania umbratica (XP_021290181.1)、蓖麻Ricinus communis (XP_002532054.1)、可可Theobroma cacao (EOY23687.1)、长蒴黄Corchorus olitorius (OMO97779.1)、麻疯树Jatropha curcas (XP_012071995.1)、圆果黄麻Corchorus capsularis (OMO95089.1)等植物的HSP21同源蛋白序列一致性分别为83%、74%、73%、74%、73%、74%、72%。利用DNAMAN对HSP21的氨基酸序列多重比对(图 9),以上8种植物的HSP21蛋白具有一定的相似性,观察发现,HSP21的72–234氨基酸序列具有很高的相似性,其中136–234氨基酸序列(ACD结构域,α-crystallin domain)高度相似。
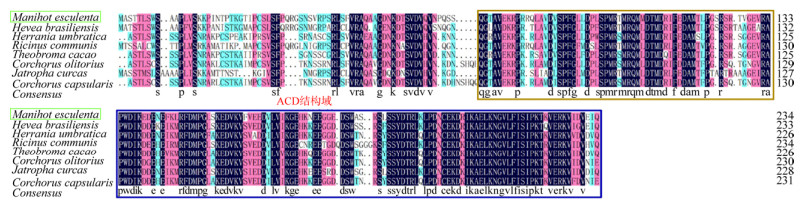 |
| 图 9 木薯与其他植物的HSP21氨基酸序列多重比对 Fig. 9 Multiple alignment of HSP21 amino acid sequences of cassava and other plants. |
| 图选项 |
利用ClustalX 2.0和MEGA X对HSP21蛋白的氨基酸序列进行系统发育分析(图 10)[1-3],木薯与巴西橡胶树H. brasiliensis、蓖麻R. communis、麻疯树J. curcas处于同一分支,这4种植物同属于大戟科,具有很高的同源性;而樱桃李、草莓等蔷薇科植物的HSP21同源蛋白亦聚在另一分支,这与它们在植物进化系统所在位置完全吻合[25-27]。
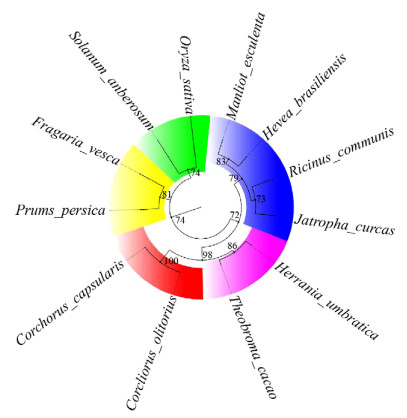 |
| 图 10 不同植物中HSP21同源蛋白的系统进化树 Fig. 10 Phylogenetic tree of HSP21 in different plants. |
| 图选项 |
3 讨论木薯是我国南方地区广泛种植的薯类作物,以其地下块茎含有丰富的淀粉而成为一种世界性的粮食作物[28],并且,它又是重要的工业原料和动物饲料[29],因此具有重要的经济价值[30]。利用基因克隆技术改良木薯品种是开发其种质资源的基础,随着万种植物基因组计划的开展和深度测序水平的不断提高,越来越多的植物基因组被测序。电子克隆技术因具有快速、准确和成本低的优点在基因功能研究中发挥重要的作用。
科学家现已完成了木薯野生祖先种和栽培种的全基因组测序,并克隆出K+通道蛋白AKT1、钙调蛋白转录因子CAMTA、金属硫蛋白MT和乙烯信号转导蛋白EIL等蛋白质的相关基因,阐释了木薯离子吸收、生长发育调控、活性氧耐受及免疫应答等机理,但对热胁迫抵抗的分子机制知之甚少[31-32]。在30 ℃的高温下,植物叶绿体结构受损严重、类囊体膜功能异常、光系统Ⅰ和Ⅱ活力大幅降低,光合作用遭受严重抑制[33-34],HSP21蛋白是定位于木薯叶绿体内的功能蛋白,在热胁迫中起到防止蛋白变性、稳定叶绿体结构和维持细胞光合作用正常进行的作用[7, 12]。因此,克隆该基因对揭示热胁迫下光合功能保护的分子机制具有十分积极的意义。
研究表明,HSP21亲水蛋白存在于叶绿体内,是叶绿体发育必需的功能蛋白[12],本研究结果与之吻合(图 3、4、6)。在不同植物中,HSP21氨基酸序列虽有一定的变异性,但有些结构特征是保守的[35-36]。对拟南芥、水稻和烟草等研究发现,HSP21蛋白的N端是由长度可变的氨基酸序列组成(平均长度55个氨基酸),C端的ACD结构域由6–8个反向平行的β折叠构成(约90个氨基酸)[37-39]。本研究发现,木薯C端ACD结构域含有98个氨基酸,由6个β折叠构成(图 8–9),这和以往报道吻合[37-39]。和其他植物相比,木薯HSP21蛋白N端的序列一致性较小(含有50个氨基酸),N端区域能够调节HSP21与变性蛋白的结合[39],可能在木薯抵抗高温胁迫中发挥重要作用。
本文利用拟南芥HSP21基因序列,得到木薯的相应EST序列,利用软件进行拼结、衍生,得到木薯MeHSP21基因的cDNA序列,并利用生物信息学方法预测表达蛋白的性质。该蛋白是含有234个氨基酸、具有碱性和亲水性的非跨膜蛋白,主要在叶绿体内发挥作用。通过氨基酸序列比对发现,木薯MeHSP21蛋白与巴西橡胶树、蓖麻和麻疯树等植物的HSP21蛋白同源性较高。本研究为该基因的克隆、表达载体的构建和遗传转化提供参考。
参考文献
| [1] | Wang YQ, Zhang F, Li RM, et al. Cloning and expression of MeAnn1 gene from cassava (Manihot esculenta Crantz). Mol Plant Breed, 2019, 13(11): 2477-2483 (in Chinese). 王雨晴, 张帆, 李瑞梅, 等. 木薯MeAnn1基因的克隆及表达分析. 分子植物育种, 2019, 13(11): 2477-2483. |
| [2] | Ma WH, Li XY, Shen JS, et al. Transcriptomic analysis reveals Apis mellifera adaptations to high temperature and high humidity. Ecotoxicol Environ Saf, 2019, 184: 109599. DOI:10.1016/j.ecoenv.2019.109599 |
| [3] | Li JH, Sun HY, Ruan MB, et al. Cloning and sequence analysis of low temperature inducible gene MeLTI6A promoter from Manihot esculenta. Chin J Trop Crops, 2013, 34(11): 2164-2171 (in Chinese). 黎娟华, 孙海彦, 阮孟斌, 等. 木薯低温诱导基因MeLTI6A的启动子的克隆与序列分析. 热带作物学报, 2013, 34(11): 2164-2171. DOI:10.3969/j.issn.1000-2561.2013.11.016 |
| [4] | Liao WB, Peng M. Gene cloning of DELLA protein from cassava and its expression patterns under drought stress. J Trop Organ, 2012, 3(4): 298-304 (in Chinese). 廖文彬, 彭明. 木薯赤霉素途径DELLA蛋白基因克隆及其对干旱胁迫的响应. 热带生物学报, 2012, 3(4): 298-304. DOI:10.3969/j.issn.1674-7054.2012.04.002 |
| [5] | Xiang XH, Wu XR, Chao JT, et al. Genome-wide identification and expression analysis of the WRKY gene family in common tobacco (Nicotiana tabacum L.). Hereditas (Beijing), 2016, 38(9): 840-857 (in Chinese). 向小华, 吴新儒, 晁江涛, 等. 普通烟草WRKY基因家族的鉴定及表达分析. 遗传, 2016, 38(9): 840-857. |
| [6] | Frezzato F, Raggi F, Martini V, et al. HSP70/HSF1 axis, regulated via a PI3K/AKT pathway, is a druggable target in chronic lymphocytic leukemia. Int J Cancer, 2019, 145(11): 3089-3100. DOI:10.1002/ijc.32383 |
| [7] | Pareek A, Rathi D, Mishra D, et al. Physiological plasticity to high temperature stress in chickpea: adaptive responses and variable tolerance. Plant Sci, 2019, 289: 110258. DOI:10.1016/j.plantsci.2019.110258 |
| [8] | Ren HY, Luo MX, Chen JZ, et al. Identification of TPD52 and DNAJB1 as two novel bile biomarkers for cholangiocarcinoma by iTRAQ-based quantitative proteomics analysis. Oncol Rep, 2019, 42(6): 2622-2634. |
| [9] | Sayed S, Faruq O, Hossain M, et al. Thermal cycling effect on osteogenic differentiation of MC3T3-E1 cells loaded on 3D-porous Biphasic Calcium Phosphate (BCP) scaffolds for early osteogenesis. Mater Sci Eng C, 2019, 105: 110027. DOI:10.1016/j.msec.2019.110027 |
| [10] | Shanmugasundaram R, Wick M, Lilburn MS. Effect of a post-hatch lipopolysaccharide challenge in Turkey poults and ducklings after a primary embryonic heat stress. Dev Comparat Immunol, 2019, 101: 103436. DOI:10.1016/j.dci.2019.103436 |
| [11] | Trivedi J, Parveen A, Rozy F, et al. Discovery of 2-isoxazol-3-yl-acetamide analogues as heat shock protein 90 (HSP90) inhibitors with significant anti-HIV activity. Eur J Med Chem, 2019, 183(11): 111699. |
| [12] | Wang QY, Buchanan RL, Tikekar RV. Evaluation of adaptive response in E. coli O157:H7 to UV light and gallic acid based antimicrobial treatments. Food Control, 2019, 106: 106723. DOI:10.1016/j.foodcont.2019.106723 |
| [13] | Yeh CH, Sun LW, Lai CM, et al. Effect of ethanol extracts of Hericium erinaceus mycelium on morphine-induced microglial migration. Mol Med Rep, 2019, 20(6): 5279-5285. |
| [14] | Yuan JL, Guo JL, Wang HY, et al. Acute toxicity of cypermethrin on the juvenile of red claw crayfish Cherax quadricarinatus. Chemosphere, 2019, 237: 124468. DOI:10.1016/j.chemosphere.2019.124468 |
| [15] | Kasim WA, Nessem AA, Gaber A. Effect of seed priming with aqueous extracts of carrot roots, garlic cloves or ascorbic acid on the yield of Vicia faba grown under drought stress. Pak J Bot, 2019, 51(6): 1979-1985. DOI:10.30848/PJB2019-6(41) |
| [16] | Sun X, Yin YH, Kong LC, et al. The effect of propofol on hypoxia-modulated expression of heat shock proteins: potential mechanism in modulating blood-brain barrier permeability. Mol Cell Biochem, 2019, 462(2): 85-96. |
| [17] | Habashy WS, Milfort MC, Rekaya R, et al. Cellular antioxidant enzyme activity and biomarkers for oxidative stress are affected by heat stress. Int J Biometeorol, 2019, 63(12): 1569-1584. DOI:10.1007/s00484-019-01769-z |
| [18] | Pignataro L. Alcohol protects the CNS by activating HSF1 and inducing the heat shock proteins. Neurosci Lett, 2019, 713: 134507. DOI:10.1016/j.neulet.2019.134507 |
| [19] | Dos Reis SP, De Souza Concei??o Tavares L, De Nazaré Monteiro Costa C, et al. Molecular cloning and characterization of a novel RING zinc-finger protein gene up-regulated under in vitro salt stress in cassava. Mol Biol Rep, 2012, 39(6): 6513-6519. DOI:10.1007/s11033-012-1479-1 |
| [20] | Duraisamy R, Natesan S, Muthurajan R, et al. Molecular studies on the transmission of indian cassava mosaic virus (ICMV) and sri lankan cassava mosaic virus (SLCMV) in cassava by Bemisia tabaci and cloning of ICMV and SLCMV replicase gene from cassava. Mol Biotechnol, 53(2): 150-158. DOI:10.1007/s12033-012-9503-1 |
| [21] | Guo DH, Tian HM, Xu YS, et al. Cloning and expression of β-glucosidase from cassava in Pichia pastoris GS115. Advances in Applied Biotechnology. Berlin, Heidelberg: Springer, 2015: 11-20. |
| [22] | Abdalla NA, Ragab ME, El-Miniawy SEDM, et al. Callus induction, regeneration and molecular characterization of cassava (Manihot esculenta Crantz). J Appl Sci Res, 2013, 9(6): 3781-3790. |
| [23] | Duff-Farrier CRA, Mbanzibwa DR, Nanyiti S, et al. Strategies for the construction of cassava brown streak disease viral infectious clones. Mol Biotechnol, 2019, 61(2): 93-101. |
| [24] | Mohammed IU, Abarshi MM, Muli B, et al. The symptom and genetic diversity of cassava brown streak viruses infecting cassava in east africa. Adv Virol, 2012, 795697. |
| [25] | Mbewe W, Kumar PL, Changadeya W, et al. Diversity, distribution and effects on cassava cultivars of cassava brown streak viruses in malawi. J Phytopathol, 2015, 163(6): 433-443. DOI:10.1111/jph.12339 |
| [26] | Lengbamroung P, Vichukit V, Visser RGF, et al. Cloning and molecular characterization of α-and β-amylase genes from cassava (Manihot esculenta Crantz). Kaset J Nat Sci, 2005, 39(3): 446-454. |
| [27] | Nassar NMA, Dos Santos E, David SRO. The transference of apomixis genes from manihot neusana nassar to cassava, M. esculenta crantz. Hereditas, 2004, 132(2): 167-170. DOI:10.1111/j.1601-5223.2000.00167.x |
| [28] | Wei MM, Li WG, Gao XS, et al. The research progress and prospect of cold resistant breeding of tropical crops in China. Chin J Trop Crops, 2015, 36(4): 821-828 (in Chinese). 位明明, 李维国, 高新生, 等. 中国热带作物抗寒育种研究进展与展望. 热带作物学报, 2015, 36(4): 821-828. DOI:10.3969/j.issn.1000-2561.2015.04.030 |
| [29] | Wang HJ, Wang WQ, Li WB, et al. Research progress of cold resistance and cultivation practice for cassava moving northward. Chin J Trop Crops, 2016, 37(7): 1437-1443 (in Chinese). 王惠君, 王文泉, 李文彬, 等. 木薯的抗寒性及北移栽培技术研究进展综述. 热带作物学报, 2016, 37(7): 1437-1443. DOI:10.3969/j.issn.1000-2561.2016.07.031 |
| [30] | Zhong YH, Lu BY, Li KM. Research advances on the safety, nutrition and processing of cassava. J Chin Inst Food Sci Technol, 2019, 19(6): 284-292 (in Chinese). 钟永恒, 陆柏益, 李开绵. 木薯质量安全、营养品质与加工利用新进展. 中国食品学报, 2019, 19(6): 284-292. |
| [31] | Elias AA, Rabbi I, Kulakow P, et al. Improving genomic prediction in cassava field experiments by accounting for interplot competition. G3, 2018, 8(3): 933-944. DOI:10.1534/g3.117.300354 |
| [32] | Ding ZH, Fu LL, Tie WW, et al. Clone and expression characteristics of MeTPS9 gene in cassava. Biotechnol Bull, 2017, 33(11): 84-91 (in Chinese). 丁泽红, 付莉莉, 铁韦韦, 等. 木薯MeTPS9基因克隆及表达特性分析. 生物技术通报, 2017, 33(11): 84-91. |
| [33] | Ali AH, Abdelrahman M, Radwan U, et al. Effect of Thermomyces fungal endophyte isolated from extreme hot desert-adapted plant on heat stress tolerance of cucumber. Appl Soil Ecol, 2018, 124: 155-162. DOI:10.1016/j.apsoil.2017.11.004 |
| [34] | Chidambaranathan P, Kumar PT, Satheesh V, et al. Genome-wide analysis identifies chickpea (Cicer arietinum) heat stress transcription factors (Hsfs) responsive to heat stress at the pod development stage. J Plant Res, 2018, 131(3): 525-542. DOI:10.1007/s10265-017-0948-y |
| [35] | Poulain P, Gelly JC, Flatters D. Detection and architecture of small heat shock protein monomers. Plos One, 2010, 5(4): e9990. DOI:10.1371/journal.pone.0009990 |
| [36] | Kriehuber T, Rattei T, Weinmaier T, et al. Independent evolution of the core domain and its flanking sequences in small heat shock proteins. FASEB J, 2010, 24(10): 3633-3642. DOI:10.1096/fj.10-156992 |
| [37] | Mahmood T, Safdar W, Abbasi BH, et al. An overview on the small heat shock proteins. Afr J Biotechnol, 2010, 9(7): 927-949. DOI:10.5897/AJB09.006 |
| [38] | Mcdonald ET, Bortolus M, Koteiche HA, et al. Sequence, structure, and dynamic determinants of Hsp27 (HspB1) equilibrium dissociation are encoded by the N-terminal domain. Biochemistry, 2012, 51(6): 1257-1268. DOI:10.1021/bi2017624 |
| [39] | Jaya N, Garcia V, Vierling E. Substrate binding site flexibility of the small heat shock protein molecular chaperones. Proc Natl Acad Sci USA, 2009, 106(37): 15604-15609. DOI:10.1073/pnas.0902177106 |
