

浙江农林大学 亚热带森林培育国家重点实验室,浙江 杭州 311300
收稿日期:2019-07-08;接收日期:2019-09-29;网络出版时间:2019-10-25
基金项目:浙江省科技厅林木新品种选育重大科技专项(No. 2016C02056-9);国家自然科学基金(No. 31270657)资助
摘要:转录因子在调控植物生长、发育及环境适应性等方面发挥重要作用。具有B-box结构域的一类锌指结构转录因子称为BBX,它们通过调控基因转录,与同类或其他转录因子的互作参与植物光形态建成、花发育、避荫效应、植物信号转导以及非生物和生物逆境响应等。文中从BBX蛋白结构、分类以及其功能方面对该类转录因子在植物中的作用进行了综述。
关键词:B-box光形态建成成花避荫效应逆境
BBX transcriptional factors family in plants–a review
Yang Ning, Qing Cong, Longjun Cheng


State Key Laboratory of Subtropical Silviculture, Zhejiang Agriculture and Forestry University, Hangzhou 311300, Zhejiang, China
Received: July 8, 2019; Accepted: September 29, 2019; Published: October 25, 2019
Supported by: Zhejiang Province Key Project for Science and Technology Grant (No. 2016C02056-9); National Natural Science Foundation of China (No. 31270657)
Corresponding author: Longjun Cheng. Tel: +86-571-63743855; E-mail: ljcheng@zju.edu.cn.
Abstract: Transcriptional factors play important roles in plant growth, development and responses to stresses. BBX transcriptional factors are characterized with one or two B-box domains in the protein sequence. They are comprehensively involved in photomorphogenesis, flowering, shade avoidance, signal transduction of phytohormones, biotic and abiotic stress responses in plants by regulating gene transcription and interacting with other transcription factors. The classification, structure and functions of BBX of plants are reviewed in this paper.
Keywords: B-boxphotomorphogenesisfloweringshade avoidancestress
转录因子是生物中重要的调控因子,广泛参与生物生长、发育、代谢及环境响应的调控过程。锌指蛋白(Zinc finger protein, ZFP)类转录因子是生物中的一大类转录因子,其含有由组氨酸(His)、半胱氨酸(Cys)和锌离子构成的锌指结构域,能够与DNA、RNA及蛋白质互作,发挥对转录、RNA包装、细胞凋亡、蛋白折叠组装等的调控作用。根据锌指结构转录因子蛋白结构的不同,该蛋白家族又分为若干亚家族[1-2]。
BBX (B-box)是锌指结构蛋白家族的一个亚家族,其氨基酸序列中包含1个或2个参与蛋白质-蛋白质之间互作的B-box基序。含B-box结构域的蛋白广泛存在于真核生物中,在动物中B-box结构域经常与RING结构域和卷曲螺旋结构域形成三价体结构蛋白TRIM (Tripartite motif)/RBCC (RING-B-box-coiled-coil)。在细胞中泛肽化过程、蛋白运输以及转录调控等方面发挥作用[3-4]。在植物中,拟南芥Arabidopsis thaliana有32个BBX蛋白,其中21个含2个B-box基序,另外11个仅含一个B-box基序[5]。水稻(Oryza sativa) 30个BBX蛋白中则有17个在N末端含有2个B-box基序[6]。B-box结构域往往单独存在于N末端,或者和存在于C末端的CCT (Conserved carboxy- terminal)结构域一起出现,含B-box结构域的蛋白与其他具有卷曲螺旋结构域的蛋白互作能产生等同于TRIM/RBCC的功能[5-6]。拟南芥中发现的第一个BBX蛋白CONSTANS (CO/AtBBX1)就能够与含有卷曲螺旋结构域的蛋白SPA1 (Suppressor of phyA-105 1)互作,参与光周期影响的成花控制过程[7]。
与动物中BBX蛋白研究相比[3, 8],植物中BBX蛋白功能的研究比较晚。但近年来研究发现,植物B-box结构域在介导蛋白互作和基因表达调控方面发挥着极为重要的作用。在植物中,B-box结构域能够在BBX蛋白家族内部或和其他蛋白形成异源二聚体的形式,在基因转录调控中发挥重要作用。拟南芥中AtBBX24和AtBBX25通过形成一个非活性异源二聚体的形式,干扰HY5 (ELONGATED HYPOCOTYL 5)功能的发挥,进而影响AtBBX22/LZF1 (LIGHT-REGULATED ZINC FINGER PROTEIN 1)表达,抑制幼苗的光形态建成过程[9]。而AtBBX24还可以通过和HY5形成异源二聚体的作用,影响HY5与花青素合成酶基因启动子的结合抑制它们的表达[10]。甚至不同植物之间的BBX蛋白也可以产生互作效应。拟南芥中的AtBBX32蛋白就能够和大豆Glycine max中的GmBBX62互作[11]。另一方面,作为转录因子,BBX蛋白本身也调控着很多基因的表达,参与植物的生长、发育、光形态建成、激素信号转导和逆境响应等生命过程。随着研究的深入,BBX基因在植物中发挥的重要功能和分子调控机制不断被揭示出来,在植物分子遗传学领域其被重视的程度越来越高。
1 BBX蛋白的结构、分类及进化B-box结构域包含1个或2个长约40个氨基酸残基的B-box基序。根据B-box基序氨基酸序列的一致性差异以及锌离子结合氨基酸残基的特异性,分为B-box1 (B1)和B-box2 (B2)两种类型。但组成B-box结构域的氨基酸残基序列仍具有相当的保守性。CCT结构域所含氨基酸残基为42–43个,其序列也具有高度保守性,参与BBX蛋白转录调控和核蛋白转运等功能的发挥[12-14]。
根据B-box结构域的数目和含有CCT结构域的情况,BBX蛋白可以分为5种结构类型。类型Ⅰ和类型Ⅱ都含有2个B-box和1个CCT结构域(B1+B2+CCT),但类型Ⅰ、Ⅱ的B-box2在氨基酸序列上有差异;类型Ⅲ仅有B-box1和1个CCT结构域(B1+CCT);类型Ⅳ只含有2个B-box结构域(B1+B2);类型Ⅴ只有1个B-box结构域B1 (图 1)。除了B-box和CCT结构域外,Ⅰ–Ⅳ类中的不同BBX蛋白在C末端还含有CO、CO-like、TOC (Translocons the outer membrane of the Choroplast)以及M1–M7这7个功能尚不明确的结构域;有些BBX蛋白在C末端还存在1个由6个氨基酸组成的缬氨酸-脯氨酸(VP)基序,其一致性序列为:G-I/V-V-P-S/T-F。VP基序离CCT结构域一般约16–20个氨基酸残基,该基序在BBX蛋白与卷曲螺旋蛋白互作中发挥重要作用[12, 15-16]。COP1 (CONSTITUTIVE PHOTOMORPHOGENIC 1)作为泛肽连接酶组分参与HY5的降解,抑制植物光形态建成[17]。研究发现,具有差异的VP基序可以使不同的BBX以不同的亲和力结合COP1的WD40 (Trp-Asp-40)结构域,进而调控光形态建成[18]。
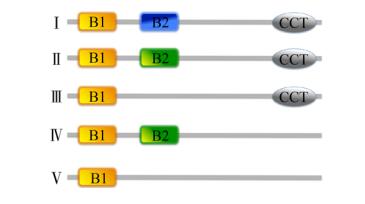 |
| 图 1 BBX蛋白的结构类型 Fig. 1 Structure class of BBX protein. |
| 图选项 |
在BBX蛋白进化中,2个B-box结构域的氨基酸序列属于严谨性保守序列,而VP基序、核定位序列(Nuclear localization sequence, NLS)则具有辐射性变异特征[19]。例如BBX蛋白类型Ⅰ、Ⅱ和Ⅲ的核定位序列均为双组分型核定位序列,位于CCT结构域内,而没有CCT结构域的类型Ⅳ和Ⅴ也存在双组分或单组分核定位信号序列[12]。从BBX蛋白进化角度上看,动物中B-box1和B-box2结构域氨基酸序列的一致性具有较大差异。而植物中B-box1和B-box2结构域氨基酸序列尽管也有一定的差异,但它们的拓扑结构是相同的。另外,大多数绿藻的BBX蛋白只有1个B-box结构域,但较为原始的莱茵衣藻Chlamydomonas reinhrdtti BBX蛋白CrBBX1有2个B-box结构域,这说明最初的BBX蛋白只有1个B-box结构域,只是在后来的进化中B-box结构域所在的基因组序列发生了复制事件,而该事件很可能发生在绿色植物登陆之前,然后才是CCT结构域的形成。而2个B-box和CCT结构域在随后进化过程中的删除,以及B-box结构域的进一步复制事件,帮助BBX蛋白完成了其不同结构类型的演化[12]。
2 BBX蛋白的功能BBX基因家族编码的蛋白作为重要的转录因子,一方面直接作用于相关基因的启动子区域,调控基因的表达;另外还以蛋白互作的形式调控其他蛋白的功能,参与植物的光形态建成、成花生理、避荫效应、激素信号转导及对逆境胁迫的响应等重要生长、发育过程。
2.1 BBX蛋白与光形态建成BBX蛋白在光形态建成中发挥重要作用。拟南芥bbx4突变体幼苗在红光下表现为胚轴伸长;bbx20在红光和蓝光下胚轴伸长;bbx21和bbx2无论在红光、远红光还是蓝光中都表现为胚轴伸长[14, 16, 20-21]。抑制光形态建成的BBX蛋白则与光受体类型关系不大,bbx24、bbx25和bbx32突变体在红光、远红光和蓝光下,胚轴都受到明显抑制[9, 22-23]。这说明促进光形态建成的BBX蛋白往往在不同光敏色素和细胞色素途径的下游起作用。
不同的BBX蛋白在光形态建成中发挥的作用也不同,既有协同作用,又有拮抗作用。尤其是类型Ⅳ,该类型拟南芥中的8个BBX蛋白有6个(BBX20–BBX25)参与HY5依赖性的光形态建成过程,HY5是对光形态建成过程起促进作用的核心调控因子[24]。其中,AtBBX20–23是光形态建成的正调控因子;而AtBBX24和AtBBX25则是光形态建成负调控因子。AtBBX21和AtBBX22互作又可以直接作用于HY5基因表达的启动子区域,增强其表达活性[16, 25],AtBBX24和AtBBX25则通过形成异源二聚体的形式抑制HY5的转录活性[9]。不同的BBX蛋白对COP1也有不同的调控。AtBBX20、AtBBX21和AtBBX22抑制COP1的功能发挥;AtBBX24和AtBBX25则能提高COP1的活性,而COP1在有光的条件下又能够结合到BBX24和BBX25上减弱它们的功能[9, 14, 16, 21, 26]。在发挥作用的方式方面,BBX20、BBX24和BBX25能直接与COP1进行互作,而BBX21和BBX22则需要被COP1招募进入核散斑才能发挥作用。另外,紫外受体UVR8 (UV-B resistance 8)在紫外辐射下,能够在核内积累并激活COP1,进而调控紫外响应基因,抑制拟南芥幼苗胚轴的生长,但BBX24能延缓由COP1活化引起的HY5积累造成的光形态建成效应[27]。有意思的是,BBX24还可以调节另外一个紫外信号响应调节蛋白RCD1 (Radical-induced cell death 1),抑制BBX24的表达,表明BBX24在紫外辐射引起的光形态建成效应中,可以通过负反馈调节途径精准地调控这种效应[28]。对于结构相似的BBX蛋白为何产生完全不同的功能,近来的研究认为这可能与BBX蛋白C末端序列的多样性有密切的关系,该区域松散的保守型导致了不同BBX蛋白功能的多样性,例如BBX21和BBX24都可以在转录后调控HY5的活性,但方式是相反的,这种相反的调控方式就是由它们C末端序列的不同导致的[10, 29]。
其他BBX蛋白也参与光形态建成过程,如AtBBX4可以在COP1下游作为光形态建成的正调控因子而发挥作用[14];AtBBX32能够与AtBBX21结合后,进而与HY5互作并降低其转录活性[23];低剂量紫外辐射条件下,COP1还可以促进BBX5和BBX18的表达而抑制BBX7和BBX8的表达[30]。BBX30和BBX31在正常光下都抑制植物光形态建成,但在紫外光下BBX31却作为光形态建成的正调控因子而存在[31-32]。
另外,光诱导的花色素苷合成作为光形态建成的一部分,也受到BBX蛋白调控。其中,AtBBX21、AtBBX22和AtBBX23是花色素苷合成的正调控因子[16, 25, 33-34],AtBBX24、AtBBX25和AtBBX32则抑制花色素苷的生物合成和积累[9-10, 23]。梨Pyrus pyrifolia中PpBBX16也是果实中花青素苷的正调控因子[35]。BBX蛋白往往通过直接或者与其他蛋白互作间接调控花青素苷生物合成的相关基因,AtBBX21可以通过直接结合在HY5启动子区域,激活其表达,影响花青素苷的合成;番茄Solanum lycopersicum中SlBBX20也可以直接结合在类胡萝卜素合成关键酶基因PHYTOENE SYNTHASE1启动子上,诱导其表达,参与类胡卜素的合成[36]。而AtBBX24则可能通过与HY5形成异源二聚体的方式干扰HY5与花青素苷合成基因启动子的结合[10]。
由此可见,BBX蛋白参与光形态建成既有表达层面上的基因调控起作用,也有蛋白层面的互作效应的参与,甚至结构相似的蛋白也会发挥完全不同的功能,它们之间的互作机制更是极其复杂。
2.2 BBX蛋白在植物成花过程中的作用植物成花过程受多种条件控制。其中,光周期对植物成花的影响与BBX蛋白关系密切。长日照下,拟南芥的CO/AtBBX1能够直接结合在FT (FLOWERING LOCUS T)基因启动子上,激活FT基因的表达促进植物的开花[13, 37]。同时,针对CO的抑制因子COP1,光诱导的FKF1能够阻止COP1二聚体的形成,使COP1发挥作用的四聚体形式[(COP1)2(SPA1)2]不能正常形成,从而使CO能顺利地作用于成花途径,短日照条件下,FKF1 (FLAVIN-BINDING, KELCH REPEAT,F-BOX 1)主要在夜间表达,不能被光激活,因此也就不能发挥抑制CO的抑制子COP1的作用[38-40]。另外,HOS1 (HIGH EXPRESSION OF OSMOTICALLY RESPONSIVE GENE 1)也能与CO互作,介导长日照条件下CO蛋白的降解,通过调控CO的表达量精确植物的成花时间[41-42]。
除了CO外,其他BBX蛋白也参与植物成花的调控过程。拟南芥bbx4/col3突变体长日照、短日照条件下都能提前开花[14]。进一步研究表明,AtBBX4 (COL3)可能是通过与AtBBX32互作进一步调控FT的表达实现对植物成花调控的[43]。AtBBX32还能够与EMF1 (EMBRYONIC FLOWER1)互作调控拟南芥中成花时间[44]。短日照条件下,AtBBX6也能通过促进FT、SOC基因的表达导致植株提前开花,co突变体中超表达AtBBX6也能一定程度上抑制晚花效应。但有意思的是,BBX6缺失的突变体中,成花时间并不发生改变。暗示其在调控植物成花方面的功能上可能具有冗余性[45]。bbx7/col8突变体开花早于野生型,而BBX7超表达株系长日照下则延长拟南芥成花时间,说明BBX7可能通过抑制CO和FT基因表达影响植物的成花[46]。AtBBX19、AtBBX13也都影响成花。超表达AtBBX19抑制拟南芥转基因株系的成花,它能够通过与CO竞争性结合FT的启动子,抑制FT及其下游基因的表达,从而抑制成花[47];COL12 (AtBBX13)则通过与CO的互作,改变CO的活性,影响植物的成花发育[48-49]。
在成花途径的影响方面,BBX蛋白在不同植物之间具有很强的保守性。水稻中CO同源基因Hd1在短日照条件下促进开花而长日照条件下抑制开花,其功能发挥不依赖于其转录水平的高低,而与其蛋白功能的调控密切相关[50]。Hd1 (Heading date 1)可能通过与OsHAL3 (Halotolerance protein 3)或者GHD7 (Grain number, plant height, and heading date 7)形成蛋白复合物的形式,抑制长日照下水稻的成花,另外OsPPR37 (Pentatricopeptide repeat- containing protein 37)可能也存在与Hd1的互作效应[51-53]。水稻中另外两个BBX蛋白也参与了光周期途径,OsBBX5、OsBBX27和OsCOL15短日照条件下均抑制成花,OsBBX5在光敏色素-B受体的下游发挥作用;OsBBX27通过负调控Hd3a和FTL (FLOWERING LOCUS T-like)基因的表达而发挥作用[54-55];OsCOL15则可以上调GHD7或者下调成花激活基因RID1 (Rice Indeterminate 1)的作用来实现其功能[56]。大麦Hordeum vulgare L.中的HvCO1基因也是BBX基因家族的同源基因,它能够通过上调HvFT基因的表达而促进植株的成花[57]。中国大白菜Brassica rapa中的BrBBX32也能通过其B-box结构域与BrAGL24 (AGAMOUS-LIKE 24)互作促进植株的开花过程[58]。菊花Chrysanthemum morifolium中的CmBBX24则对开花有抑制作用[59]。
但影响植物花发育的BBX蛋白的保守性特点也有一定的局限。甜菜Beta vulgaris中的BvCOL1与拟南芥中的CO亲缘关系最近,但它并不调控植株的成花效应。而BvBBX19则可能与BTC1 (Bolting time control 1)互相作用调控BvFT1和BvFT2参与花发育,这条途径很可能与拟南芥中CO介导的成花发育途径有所不同[60]。
2.3 BBX蛋白在避荫响应中的作用植物生长密度过高时,其生长环境的红光/远红光(R/FR: red/far red)比值会下降,这种下降成为植物产生避荫响应的一种重要信号,从而导致植物的竞争性生长,如胚轴和茎的伸长、分枝减少、叶片相对与水平方向的生长角度加大和加速开花等[61-62]。BBX蛋白能够介导遮荫环境中的细胞伸长。cop1突变体严重抑制避荫响应,而在突变体中双突变bbx1和bbx2则可以恢复cop1的避荫响应,这说明BBX21/LHUS和BBX22作用在COP1的下游,在遮荫环境条件下通过负反馈机制调节植株的避荫响应[63]。bbx24突变体遮荫条件下胚轴缩短,bbx24和bbx25双突变体中,胚轴缩短的表型被加强。研究表明BBX24和BBX25蛋白对遮荫的响应也是依赖于COP1蛋白的[9]。另外,PIF4转录因子在遮荫环境中能结合在细胞伸长相关基因的启动子上,促进细胞伸长,而这种效应需要BBX24与DELLA蛋白的结合,以阻止DELLA介导的PIF4活性抑制[64]。BBX16/COL7能够通过上调PIL1的表达在高R/FR比值下促进拟南芥的分枝,在低R/FR比值下增强植株的避荫效应[65]。
研究表明,不同的BBX蛋白在避荫响应中发挥的作用是不同的,甚至是相反的,如AtBBX19、AtBBX21、AtBBX22能抑制避荫响应,而AtBBX18、AtBBX24对避荫响应则有促进作用,参与避荫响应的植物激素相关基因的表达也受到BBX蛋白的调控[63]。不同BBX基因在避荫响应发挥的具体功能和作用机制都需要进一步的研究进行揭示。
2.4 生物和非生物逆境响应中的BBX蛋白逆境因子一直是影响植物生长发育的重要因素。大部分转录因子家族的基因都参与逆境响应调控。BBX蛋白在植物生长的生物逆境和非生物逆境响应方面都发挥一定的作用。
在光形态建成发挥负调控作用的AtBBX18还参与了拟南芥耐热响应。AtBBX18基因表达被热胁迫诱导。AtBBX18 RNA干涉转基因株系其耐热性得到提高,而超表达AtBBX18的转基因株系则热耐受性下降。AtBBX18对热胁迫响应基因DGD1 (Digalactosyldiacyglycerol synthase 1)、HsfA2 (Heat stress transcription factor A2)和Hsp101 (Heat shock protein 101)都有下调作用,暗示该基因在热胁迫响应中发挥负调控作用[66]。AtBBX24则参与盐逆境信号的传递作用。在酵母Saccharomyces cerevisiae中,AtBBX24 cDNA转化细胞能够提高其耐盐能力,拟南芥中超表达AtBBX24的株系耐盐能力也得到提高,但BBX24基因表达并不受盐的诱导。另外,AtBBX24蛋白能结合到一个H-蛋白基因HPPBF-1的启动子区域,促进其表达,该基因同样受盐胁迫诱导,说明AtBBX24间接参与了植物耐盐性提高相关的分子途径[67]。苹果Malus domestica中相当一部分BBX基因在渗透压、高盐、低温和脱落酸(Abscisic acid, ABA)处理下表达上调[68]。其中,MdBBX10在大肠杆菌Escherichia coli中表达增强了细胞对盐和渗透胁迫的耐受性,研究表明拟南芥中超表达该基因也能增强转基因植株对干旱、盐等非生物逆境的抗性,这种抗性的增加与超表达MdBBX10导致的活性氧清除能力增强密切相关[69-70]。水稻中BBX基因Ghd2超表达后,植株对干旱变得敏感,进一步研究发现,超表达Ghd2转基因株系衰老相关基因表达上调,表明Ghd2在加速干旱诱导的水稻叶片衰老中起重要作用[71]。菊花的CmBBX24、CmBBX22也都参与了植株对低温、干旱等的响应过程[59, 72-73]。另外,高盐和PEG处理能够诱导马铃薯Solanum sogarandinum中SsBBX24基因的表达和蛋白积累,且日照时间长短还能调控SsBBX24对盐胁迫的响应[74]。由此可见,BBX在广泛参与了植物的干旱、低温、高盐和氧化胁迫等非生物逆境响应。对它们进行具体分子调控机制的研究,将有利于提高作物的非生物逆境抗性。
机械损伤响应和生物侵害的保卫反应中也有BBX蛋白的参与。茉莉酸(Jasmonic acid, JA)是机械损伤响应中的重要信号分子,用JA的前体12-氧-植物二烯酸(12-oxo-phytodienoic acid, OPDA)处理拟南芥时,AtBBX32表达被强烈上调。几丁质也可以上调AtBBX32的表达,响应几丁质的转录因子是参与植物保卫反应的关键因子[75]。油菜Brassica napus在遭受跳甲危害时,BBX基因的表达也发生改变[76]。水稻中敲除OsCOL9会增加转基因株系对稻瘟病的易感性,而超表达该基因,则可以增强植株对稻瘟病的抗性[77]。这表明BBX在机械损伤和生物胁迫中也发挥了一定作用。
2.5 BBX与激素信号转导除了直接在转录和蛋白水平上的调控外,BBX蛋白已经被证实在生长素(Indole-3-acetic acid, IAA)、赤霉素(Gibberellic acid, GA)、脱落酸和油菜素内酯(Brassinosteroid, BR)等激素信号转导中发挥了重要的作用[78]。
AtBBX21能够分别与HY5和ABI5 (ABA insensitive 5)形成异源二聚体,调控光介导的ABA信号转导作用,影响光形态建成[79];AtBBX18则可以通过促进赤霉素的活性促进胚轴的生长,这种促进作用是通过调控GA代谢基因的活性来实现的[80]。AtBBX20可以通过抑制参与信号途径的基因BZR1 (BRASSINAZOLE-RESISTANT 1),来抑制胚轴的伸长[81]。水稻中的OsBBX8、OsBBX27和OsBBX30对光信号和IAA、GA等激素信号都有响应,表明这些基因可能在光形态建成和激素信号的交叉互作中发挥了重要的作用[6]。
在避荫响应中,AtBBX21作为负调控因子能够下调生长素、乙烯和油菜素内酯相关的基因,影响长期遮荫条件下的植物生长[63]。AtBBX16能够上调生长素合成抑制因子SUR2 (Superroot 2)的表达,调控植物的分枝特性以应对遮荫条件[65, 82]。与BBX24结合调控PIF4 (Phytochrome interacting factors 4)的DELLA因子,是GA信号转导途径的重要负调控因子,说明GA信号也参与了避荫响应的调控过程[64]。
干旱环境下,ABA可以通过调控CO转录后的功能或者活性,进而促进FT基因的表达而实现“干旱逃逸” (干旱条件下加速开花的现象)[83]。菊花中Cm-BBX24 RNA干涉株系开花提前,但很多GA生物合成途径的相关基因被上调,外施GA4/7也会影响Cm-BBX24表达,暗示GA可能参与了Cm-BBX24对菊花成花的调控过程[59]。拟南芥中CO还可以通过与介导水杨酸(Salicylic acid, SA)信号转导的TGA4 (TGACG MOTIF-BINDING FACTOR 4)蛋白互作调控植物的成花发育[84]。这说明在植物成花发育过程中,植物激素同样在BBX扮演的角色中发挥了一定作用。
激素信号同样参与了BBX在植物逆境响应中作用。OsCOL9能够与OsRACK1 (Receptor for activated C-Kinase 1)互作,通过水杨酸和乙烯(Ethylene, ET)信号通路增强水稻对稻瘟病的抗性[77]。用ABA处理拟南芥植株时,叶片中BBX11、BBX13、BBX22的表达在大幅上调,而BBX2、BBX3、BBX16、BBX18、BBX19则能被ABA以及参与ABA早期信号转导的环腺苷二磷酸核糖cADPR (Cyclic adenosine diphosphate ribose)下调[85]。拟南芥中超表达CmBBX22,转基因植株对ABA敏感程度下降,且对干旱耐受能力增强。暗示ABA可能介导了CmBBX22响应干旱的能力。中国白梨Pyrus bretschneideri和苹果中BBX基因在非生物逆境和激素处理下表达变化,也说明了BBX在非生物逆境响应下功能的发挥需要植物激素协助[72, 86]。
3 总结与展望BBX基因家族作为锌指结构转录因子中一类重要成员,广泛参与了植物生长和发育以及对环境的响应过程。在发挥作用的方式上,不仅存在转录活性的调控,BBX还往往通过复杂的蛋白互作效应实现其功能。同一个基因家族不同成员在调控同一个生理过程时,正效应和负效应共存,这对植物生长、发育的精准调控非常有利。研究这类基因的功能,有利于了解植物对复杂生理过程和环境响应的分子机制。目前,尽管对BBX基因家族成员功能开始有了一定了解,但囿于其功能的复杂性,这种认知仍非常有限。特别是在木本植物中,相应BBX基因功能的研究更少,而BBX参与的成花效应、避荫响应和逆境胁迫响应等对林木植物的生产和育种也具有非常重要的意义。很有必要对重要林木植物的BBX基因功能进行深入的研究。
笔者所在的研究团队从巨桉Eucalyptus grandis全基因组范围内鉴定得到了21个BBX基因,21个EgrBBX蛋白序列的B1、B2和CCT结构域均非常保守,并且和拟南芥B1、B2和CCT结构域保守氨基酸序列的相似性非常强。说明BBX的结构域在进化过程中具有很强的保守性。在这些启动子序列上,分布着大量的:光响应元件:ACE、Sp1、G-box等;激素响应元件:脱落酸响应元件ABRE (ABA-responsive element)、茉莉酸响应元件CGTCA-motif、水杨酸响应元件TCA;以及非生物逆境响应元件:干旱诱导的MYB结合序列(MYB binding sequence,MBS)、低温响应元件(Low temperature response,LTR)和热激响应元件(Heat shock elements,HSE)等。暗示这些基因在光信号、激素和逆境响应中都可能发挥了重要功能。进一步的表达分析也表明,EgrBBX基因对光照强度和光周期有明显的响应;低温(4 ℃)和高盐(200 mmol/L NaCl)处理对大部分EgrBBX基因能产生瞬时性的诱导表达。尤其在高盐条件下,除了EgrBBX7、EgrBBX9和EgrBBX13外,其他EgrBBX基因均在24 h内有一个明显的诱导表达峰出现,茉莉酸甲酯处理的植株中EgrBBX基因的表达也有类似的特点。这些结果表明,桉树中的BBX蛋白可能也是整合光形态建成、激素信号转导和逆境响应等的关键因子,进一步研究这些基因的功能具有重要意义。
BBX功能的复杂性主要在于不同BBX蛋白之间的功能差异,及由它们之间的不同互作引起的不同生物学效应方面。因此,下一步研究中,一方面可以根据基因在不同环境和处理下的表达情况筛选相应生物学相关的重要基因,通过遗传转化手段,进一步明确这些基因的功能。同时结合蛋白互作技术平台,分析不同BBX之间的互作对它们功能发挥的影响。而转录组等组学分析手段的利用,将为解析BBX参与的重要分子调控网络提供有力的支持。
参考文献
| [1] | Riechmann JL, Heard J, Martin G, et al. Arabidopsis transcription factors: genome-wide comparative analysis among eukaryotes. Science, 2000, 290(5499): 2105-2110. DOI:10.1126/science.290.5499.2105 |
| [2] | Laity JH, Lee BM, Wright PE. Zinc finger proteins: new insights into structural and functional diversity. Curr Opin Struct Biol, 2001, 11(1): 39-46. DOI:10.1016/S0959-440X(00)00167-6 |
| [3] | Meroni G, Diez-Roux G. TRIM/RBCC, a novel class of 'single protein RING finger' E3 ubiquitin ligases. Bioessays, 2005, 27(11): 1147-1157. DOI:10.1002/bies.20304 |
| [4] | Gangappa SN, Botto JF. The BBX family of plant transcription factors. Trend Plant Sci, 2014, 19(7): 460-470. DOI:10.1016/j.tplants.2014.01.010 |
| [5] | Khanna R, Kronmiller B, Maszle DR, et al. The Arabidopsis B-box zinc finger family. Plant Cell, 2009, 21(11): 3416-3420. DOI:10.1105/tpc.109.069088 |
| [6] | Huang JY, Zhao XB, Weng XY, et al. The rice B-box zinc finger gene family: genomic identification, characterization, expression profiling and diurnal analysis. PLoS One, 2012, 7(10): e48242. DOI:10.1371/journal.pone.0048242 |
| [7] | Laubinger S, Marchal V, Gentilhomme J, et al. Arabidopsis SPA proteins regulate photoperiodic flowering and interact with the floral inducer CONSTANS to regulate its stability. Development, 2006, 133(16): 3213-3222. DOI:10.1242/dev.02481 |
| [8] | Borden KLB. RING fingers and B-boxes: zinc-binding protein-protein interaction domains. Biochem Cell Biol, 1998, 76(2/3): 351-358. |
| [9] | Gangappa SN, Crocco CD, Johansson H, et al. The Arabidopsis B-BOX protein BBX25 interacts with HY5, negatively regulating BBX22 expression to suppress seedling photomorphogenesis. Plant Cell, 2013, 25(4): 1243-1257. DOI:10.1105/tpc.113.109751 |
| [10] | Job N, Yadukrishnan P, Bursch K, et al. Two B-box proteins regulate photomorphogenesis by oppositely modulating HY5 through their diverse C-terminal domains. Plant Physiol, 2018, 176(4): 2963-2976. DOI:10.1104/pp.17.00856 |
| [11] | Qi QG, Gibson A, Fu XR, et al. Involvement of the N-terminal B-box domain of Arabidopsis BBX32 protein in interaction with soybean BBX62 protein. J Biol Chem, 2012, 287(37): 31482-31493. DOI:10.1074/jbc.M112.346940 |
| [12] | Crocco CD, Botto JF. BBX proteins in green plants: insights into their evolution, structure, feature and functional diversification. Gene, 2013, 531(1): 44-52. |
| [13] | Tiwari SB, Shen Y, Chang HC, et al. The flowering time regulator CONSTANS is recruited to the FLOWERING LOCUS T promoter via a unique cis-element. New Phytol, 2010, 187(1): 57-66. DOI:10.1111/j.1469-8137.2010.03251.x |
| [14] | Datta S, Hettiarachchi GHCM, Deng XW, et al. Arabidopsis CONSTANS-LIKE3 is a positive regulator of red light signaling and root growth. Plant Cell, 2006, 18(1): 70-84. DOI:10.1105/tpc.105.038182 |
| [15] | Holm M, Hardtke CS, Gaudet R, et al. Identification of a structural motif that confers specific interaction with the WD40 repeat domain of Arabidopsis COP1. EMBO J, 2001, 20(1/2): 118-127. |
| [16] | Datta S, Hettiarachchi C, Johansson H, et al. SALT TOLERANCE HOMOLOG2, a B-box protein in Arabidopsis that activates transcription and positively regulates light-mediated development. Plant Cell, 2007, 19(10): 3242-3255. DOI:10.1105/tpc.107.054791 |
| [17] | Wang HY, Ma LG, Li JM, et al. Direct interaction of Arabidopsis cryptochromes with COP1 in light control development. Science, 2001, 294(5540): 154-158. DOI:10.1126/science.1063630 |
| [18] | Lau K, Podolec R, Chappuis R, et al. Plant photoreceptors and their signaling components compete for binding to the ubiquitin ligase COP1 using their VP-peptide motifs. EMBO J, 2019, 38(18): e102140. |
| [19] | Kim SK, Park HY, Jang YH, et al. The sequence variation responsible for the functional difference between the CONSTANS protein, and the CONSTANS-like (COL) 1 and COL2 proteins, resides mostly in the region encoded by their first exons. Plant Sci, 2013, 199-200: 71-78. DOI:10.1016/j.plantsci.2012.09.019 |
| [20] | Datta S, Johansson H, Hettiarachchi C, et al. LZF1/SALT TOLERANCE HOMOLOG3, an Arabidopsis B-box protein involved in light-dependent development and gene expression, undergoes COP1-mediated ubiquitination. Plant Cell, 2008, 20(9): 2324-2338. DOI:10.1105/tpc.108.061747 |
| [21] | Fan XY, Sun Y, Cao DM, et al. BZS1, a B-box protein, promotes photomorphogenesis downstream of both brassinosteroid and light signaling pathways. Mol Plant, 2012, 5(3): 591-600. DOI:10.1093/mp/sss041 |
| [22] | Kumagai T, Ito S, Nakamichi N, et al. The common function of a novel subfamily of B-Box zinc finger proteins with reference to circadian-associated events in Arabidopsis thaliana. Biosci Biotechnol Biochem, 2008, 72(6): 1539-1549. DOI:10.1271/bbb.80041 |
| [23] | Holtan HE, Bandong S, Marion CM, et al. BBX32, an Arabidopsis B-Box protein, functions in light signaling by suppressing HY5-regulated gene expression and interacting with STH2/BBX21. Plant Physiol, 2011, 156(4): 2109-2123. |
| [24] | Gangappa SN, Botto JF. The multifaceted roles of HY5 in plant growth and development. Mol Plant, 2016, 9(10): 1353-1365. DOI:10.1016/j.molp.2016.07.002 |
| [25] | Chang CSJ, Li YH, Chen LT, et al. LZF1, a HY5-regulated transcriptional factor, functions in Arabidopsis de-etiolation. Plant J, 2008, 54(2): 205-219. DOI:10.1111/j.1365-313X.2008.03401.x |
| [26] | Bowler C, Botto J, Deng XW. Photomorphogenesis, B-Box transcription factors, and the legacy of Magnus Holm. Plant Cell, 2013, 25(4): 1192-1195. DOI:10.1105/tpc.113.250412 |
| [27] | Jiang L, Wang Y, Li QF, et al. Arabidopsis STO/BBX24 negatively regulates UV-B signaling by interacting with COP1 and repressing HY5 transcriptional activity. Cell Res, 2012, 22(6): 1046-1057. DOI:10.1038/cr.2012.34 |
| [28] | Jiang L, Wang Y, Bj?rn LO, et al. Arabidopsis radical-induced cell death1 is involved in UV-B signaling. Photochem Photobiol Sci, 2009, 8(6): 838-846. DOI:10.1039/b901187k |
| [29] | Yadukrishnan P, Job N, Johansson H, et al. Opposite roles of group IV BBX proteins: Exploring missing links between structural and functional diversity. Plant Signal Behav, 2018, 13(8): e1562641. |
| [30] | Oravecz A, Baumann A, Máté Z, et al. CONSTITUTIVELY PHOTOMORPHOGENIC1 is required for the UV-B response in Arabidopsis. Plant Cell, 2006, 18(8): 1975-1990. DOI:10.1105/tpc.105.040097 |
| [31] | Yadav A, Bakshi S, Yadukrishnan P, et al. The B-box-containing microprotein miP1a/BBX31 regulates photomorphogenesis and UV-B protection. Plant Physiol, 2019, 179(4): 1876-1892. DOI:10.1104/pp.18.01258 |
| [32] | Heng YQ, Lin F, Jiang Y, et al. B-box containing proteins BBX30 and BBX31, acting downstream of HY5, negatively regulate photomorphogenesis in Arabidopsis. Plant Physiol, 2019, 180(1): 497-508. DOI:10.1104/pp.18.01244 |
| [33] | Xu DQ, Jiang Y, Li JG, et al. BBX21, an Arabidopsis B-box protein, directly activates HY5 and is targeted by COP1 for 26S proteasome-mediated degradation. Proc Natl Acad Sci USA, 2016, 113(27): 7655-7660. DOI:10.1073/pnas.1607687113 |
| [34] | Zhang XY, Huai JL, Shang FF, et al. A PIF1/PIF3-HY5-BBX23 transcription factor cascade affects photomorphogenesis. Plant Physiol, 2017, 174(4): 2487-2500. DOI:10.1104/pp.17.00418 |
| [35] | Bai SL, Tao RY, Tang YX, et al. BBX 16, a B-box protein, positively regulates light-induced anthocyanin accumulation by activating MYB10 in red pear. Plant Biotechnol J, 2019, 17(10): 1985-1997. DOI:10.1111/pbi.13114 |
| [36] | Xiong C, Luo D, Lin AH, et al. A tomato B-box protein Sl BBX 20 modulates carotenoid biosynthesis by directly activating PHYTOENE SYNTHASE 1, and is targeted for 26S proteasome-mediated degradation. New Phytol, 2019, 221(1): 279-294. DOI:10.1111/nph.15373 |
| [37] | Cao S, Kumimoto RW, Gnesutta N, et al. A distal CCAAT/NUCLEAR FACTOR Y complex promotes chromatin looping at the FLOWERING LOCUS T promoter and regulates the timing of flowering in Arabidopsis. Plant Cell, 2014, 26(3): 1009-1017. DOI:10.1105/tpc.113.120352 |
| [38] | Lee BD, Kim MR, Kang MY, et al. The F-box protein FKF1 inhibits dimerization of COP1 in the control of photoperiodic flowering. Nat Commun, 2017, 8(1): 2259. |
| [39] | Subramanian C, Kim BH, Lyssenko NN, et al. The Arabidopsis repressor of light signaling, COP1, is regulated by nuclear exclusion: mutational analysis by bioluminescence resonance energy transfer. Proc Natl Acad Sci USA, 2004, 101(17): 6798-6802. DOI:10.1073/pnas.0307964101 |
| [40] | Zhu DM, Maier A, Lee JH, et al. Biochemical characterization of Arabidopsis complexes containing CONSTITUTIVELY PHOTOMORPHOGENIC1 and SUPPRESSOR OF PHYA proteins in light control of plant development. Plant Cell, 2008, 20(9): 2307-2323. DOI:10.1105/tpc.107.056580 |
| [41] | Lee JH, Kim JJ, Kim SH, et al. The E3 ubiquitin ligase HOS1 regulates low ambient temperature-responsive flowering in Arabidopsis thaliana. Plant Cell Physiol, 2012, 53(10): 1802-1814. DOI:10.1093/pcp/pcs123 |
| [42] | Lazaro A, Valverde F, Pi?eiro M, et al. The Arabidopsis E3 ubiquitin ligase HOS1 negatively regulates CONSTANS abundance in the photoperiodic control of flowering. Plant Cell, 2012, 24(3): 982-999. DOI:10.1105/tpc.110.081885 |
| [43] | Tripathi P, Carvallo M, Hamilton EE, et al. Arabidopsis B-BOX32 interacts with CONSTANS-LIKE3 to regulate flowering. Proc Natl Acad Sci USA, 2017, 114(1): 172-177. DOI:10.1073/pnas.1616459114 |
| [44] | Park HY, Lee SY, Seok HY, et al. EMF1 interacts with EIP1, EIP6 or EIP9 involved in the regulation of flowering time in Arabidopsis. Plant Cell Physiol, 2011, 52(8): 1376-1388. DOI:10.1093/pcp/pcr084 |
| [45] | Hassidim M, Harir Y, Yakir E, et al. Over-expression of CONSTANS-LIKE 5 can induce flowering in short-day grown Arabidopsis. Planta, 2009, 230(3): 481-491. DOI:10.1007/s00425-009-0958-7 |
| [46] | Cheng XF, Wang ZY. Overexpression of COL9, a CONSTANS-LIKE gene, delays flowering by reducing expression of CO and FT in Arabidopsis thaliana. Plant J, 2005, 43(5): 758-768. DOI:10.1111/j.1365-313X.2005.02491.x |
| [47] | Wang CQ, Dehesh K. From retrograde signaling to flowering time. Plant Signal Behav, 2015, 10(6): e1022012. DOI:10.1080/15592324.2015.1022012 |
| [48] | Ordo?ez-Herrera N, Trimborn L, Menje M, et al. The transcription factor COL12 is a substrate of the COP1/SPA E3 ligase and regulates flowering time and plant architecture. Plant Physiol, 2018, 176(2): 1327-1340. |
| [49] | Wang CQ, Guthrie C, Sarmast MK, et al. BBX19 interacts with CONSTANS to repress FLOWERING LOCUS T transcription, defining a flowering time checkpoint in Arabidopsis. Plant Cell, 2014, 26(9): 3589-3602. DOI:10.1105/tpc.114.130252 |
| [50] | Yano M, Katayose Y, Ashikari M, et al. Hd1, a major photoperiod sensitivity quantitative trait locus in rice, is closely related to the Arabidopsis flowering time gene CONSTANS. Plant Cell, 2000, 12(12): 2473-2484. DOI:10.1105/tpc.12.12.2473 |
| [51] | Su L, Shan JX, Gao JP, et al. OsHAL3, a blue light-responsive protein, interacts with the floral regulator Hd1 to activate flowering in rice. Mol Plant, 2016, 9(2): 233-244. DOI:10.1016/j.molp.2015.10.009 |
| [52] | Nemoto Y, Nonoue Y, Yano M, et al. Hd1, a CONSTANS ortholog in rice, functions as an Ehd1 repressor through interaction with monocot-specific CCT-domain protein Ghd7. Plant J, 2016, 86(3): 221-233. DOI:10.1111/tpj.13168 |
| [53] | Fujino K, Yamanouchi U, Nonoue Y, et al. Switching genetic effects of the flowering time gene Hd1 in LD conditions by Ghd7 and OsPRR37 in rice. Breed Sci, 2019, 69(1): 127-132. DOI:10.1270/jsbbs.18060 |
| [54] | Lee YS, Jeong DH, Lee DY, et al. OsCOL4 is a constitutive flowering repressor upstream of Ehd1 and downstream of OsphyB. Plant J, 2010, 63(1): 18-30. |
| [55] | Mi SK, Song MC, Kang EY, et al. Galactinol is a signaling component of the induced systemic resistance caused by Pseudomonas chlororaphis O6 root colonization. Mol Plant-Microbe Interact, 2008, 21(12): 1643-1653. DOI:10.1094/MPMI-21-12-1643 |
| [56] | Wu W, Zhang Y, Zhang M, et al. The rice CONSTANS-like protein OsCOL15 suppresses flowering by promoting Ghd7 and repressing RID1. Biochem Biophys Res Commun, 2018, 495(1): 1349-1355. DOI:10.1016/j.bbrc.2017.11.095 |
| [57] | Campoli C, Drosse B, Searle I, et al. Functional characterisation of HvCO1, the barley (Hordeum vulgare) flowering time ortholog of CONSTANS. Plant J, 2012, 69(5): 868-880. DOI:10.1111/j.1365-313X.2011.04839.x |
| [58] | Ma GP, Zhao DQ, Wang TW, et al. BBX32 interacts with AGL24 involved in flowering time control in Chinese cabbage (Brassica rapa L.ssp.pekinensis). Notul Botan Horti Agrobotan Cluj-Napoca, 2019, 47(1): 34-45. |
| [59] | Yang YJ, Ma C, Xu YJ, et al. A zinc finger protein regulates flowering time and abiotic stress tolerance in chrysanthemum by modulating gibberellin biosynthesis. Plant Cell, 2014, 26(5): 2038-2054. |
| [60] | Dally N, Xiao K, Holtgr?we D, et al. The B2 flowering time locus of beet encodes a zinc finger transcription factor. Proc Natl Acad Sci USA, 2014, 111(28): 10365-10370. DOI:10.1073/pnas.1404829111 |
| [61] | Casal JJ. Photoreceptor signaling networks in plant responses to shade. Annu Rev Plant Biol, 2013, 64: 403-427. DOI:10.1146/annurev-arplant-050312-120221 |
| [62] | Pierik R, De Wit M. Shade avoidance: phytochrome signalling and other aboveground neighbour detection cues. J Experim Bot, 2013, 65(11): 2815-2824. |
| [63] | Crocco CD, Holm M, Yanovsky MJ, et al. Function of B-BOX under shade. Plant Signal Behav, 2011, 6(1): 101-104. |
| [64] | Crocco CD, Locascio A, Escudero CM, et al. The transcriptional regulator BBX24 impairs DELLA activity to promote shade avoidance in Arabidopsis thaliana. Nat Commun, 2015, 6: 6202. DOI:10.1038/ncomms7202 |
| [65] | Sun ZB, Qi XY, Wang ZL, et al. Overexpression of TsGOLS2, a galactinol synthase, in Arabidopsis thaliana enhances tolerance to high salinity and osmotic stresses. Plant Physiol Biochem, 2013, 69: 82-89. DOI:10.1016/j.plaphy.2013.04.009 |
| [66] | Wang QM, Tu XJ, Zhang JH, et al. Heat stress-induced BBX18 negatively regulates the thermotolerance in Arabidopsis. Mol Biol Rep, 2013, 40(3): 2679-2688. DOI:10.1007/s11033-012-2354-9 |
| [67] | Nagaoka S, Takano T. Salt tolerance-related protein STO binds to a Myb transcription factor homologue and confers salt tolerance in Arabidopsis. J Exp Bot, 2003, 54(391): 2231-2237. DOI:10.1093/jxb/erg241 |
| [68] | Liu X, Li R, Dai YQ, et al. Genome-wide identification and expression analysis of the B-box gene family in the Apple (Malus domestica Borkh.). genome.Mol Genet Genom, 2018, 293(2): 303-315. DOI:10.1007/s00438-017-1386-1 |
| [69] | Liu X, Dai YQ, Li R, et al. Members of B-box protein family from Malus domestica enhanced abiotic stresses tolerance in Escherichia coli. Mol Biotechnol, 2019, 61(6): 421-426. DOI:10.1007/s12033-019-00172-8 |
| [70] | Liu X, Li R, Dai YQ, et al. A B-box zinc finger protein, MdBBX10, enhanced salt and drought stresses tolerance in Arabidopsis. Plant Mol Biol, 2019, 99(4/5): 437-447. |
| [71] | Liu JH, Shen JQ, Xu Y, et al. Ghd2, a CONSTANS-like gene, confers drought sensitivity through regulation of senescence in rice. J Experim Bot, 2016, 67(19): 5785-5798. DOI:10.1093/jxb/erw344 |
| [72] | Liu YA, Chen H, Ping Q, et al. The heterologous expression of CmBBX22 delays leaf senescence and improves drought tolerance in Arabidopsis. Plant Cell Rep, 2019, 38(1): 15-24. DOI:10.1007/s00299-018-2345-y |
| [73] | Imtiaz M, Yang YJ, Liu RX, et al. Identification and functional characterization of the BBX24 promoter and gene from chrysanthemum in Arabidopsis. Plant Mol Biol, 2015, 89(1/2): 1-19. |
| [74] | Kielbowicz-Matuk A, Rey P, Rorat T. Interplay between circadian rhythm, time of the day and osmotic stress constraints in the regulation of the expression of a Solanum Double B-box gene. Ann Bot, 2014, 113(5): 831-842. DOI:10.1093/aob/mct303 |
| [75] | Libault M, Wan JR, Czechowski T, et al. Identification of 118 Arabidopsis transcription factor and 30 ubiquitin-ligase genes responding to chitin, a plant-defense elicitor. Mol Plant Microbe Interact, 2007, 20(8): 900-911. |
| [76] | Gruber M, Wu LM, Links M, et al. Analysis of expressed sequence tags in Brassica napus cotyledons damaged by crucifer flea beetle feeding. Genome, 2012, 55(2): 118-133. DOI:10.1139/g11-083 |
| [77] | Liu H, Dong SY, Sun DY, et al. CONSTANS-Like 9 (OsCOL9) interacts with receptor for activated C-Kinase 1 (OsRACK1) to regulate blast resistance through salicylic acid and ethylene signaling pathways. PLoS ONE, 2016, 11(11): e166249. |
| [78] | Vaishak K, Yadukrishnan P, Bakshi S, et al. The B-box bridge between light and hormones in plants. J Photochem Photobiol B: Biol, 2019, 191: 164-174. DOI:10.1016/j.jphotobiol.2018.12.021 |
| [79] | Xu DQ, Li JG, Gangappa SN, et al. Convergence of light and ABA signaling on the ABI5 promoter. PLoS Genet, 2014, 10(2): e1004197. DOI:10.1371/journal.pgen.1004197 |
| [80] | Wang QM, Zeng JX, Deng KQ, et al. DBB1a, involved in gibberellin homeostasis, functions as a negative regulator of blue light-mediated hypocotyl elongation in Arabidopsis. Planta, 2011, 233(1): 13-23. DOI:10.1007/s00425-010-1274-y |
| [81] | Sun Y, Fan XY, Cao DM, et al. Integration of brassinosteroid signal transduction with the transcription network for plant growth regulation in Arabidopsis. Dev Cell, 2010, 19(5): 765-777. |
| [82] | Zhang ZL, Ji RH, Li HY, et al. CONSTANS-LIKE 7 (COL7) is involved in phytochrome B (phyB)-mediated light-quality regulation of auxin homeostasis. Mol Plant, 2014, 7(9): 1429-1440. |
| [83] | Riboni M, Test AR, Galbiati M, et al. ABA-dependent control of GIGANTEA signalling enables drought escape via up-regulation of FLOWERING LOCUS T in Arabidopsis thaliana. J Exp Bot, 2016, 67(22): 6309-6322. DOI:10.1093/jxb/erw384 |
| [84] | Song YH, Song NY, Shin SY, et al. Isolation of CONSTANS as a TGA4/OBF4 interacting protein. Mol Cells, 2008, 25(4): 559-565. |
| [85] | Sánchez JP, Duque P, Chua NH. ABA activates ADPR cyclase and cADPR induces a subset of ABA-responsive genes in Arabidopsis. Plant J, 2004, 38(3): 381-395. DOI:10.1111/j.1365-313X.2004.02055.x |
| [86] | Zou ZY, Wang RH, Wang R, et al. Genome-wide identification, phylogenetic analysis, and expression profiling of the BBX family genes in pear. J Hortic Sci Biotechnol, 2018, 93(1): 37-50. |
