

1. 湖南科技大学 生命科学学院 重金属污染土壤生态修复与安全利用湖南省高校重点实验室,湖南 湘潭 411201;
2. 中国科学院分子植物科学卓越创新中心/植物生理生态研究所 植物分子遗传国家重点实验室,上海 200032
收稿日期:2019-04-25;接收日期:2019-06-06;网络出版时间:2019-07-01
基金项目:国家自然科学基金(No. 31700212),中国博士后基金(No. 2016m590387)资助
作者简介:龚继明 ??研究员、博士生导师,现任中国科学院植物生理生态研究所副所长、学术委员会主任;植物分子遗传国家重点实验室主任。主要从事植物营养调控及植物修复的分子机理研究,镉、氮等矿质元素吸收分配的分子机理研究,在Nat Biotechnol、Nat Commun、Plant Cell、Proc Natl Acad Sci USA等期刊发表成果多项。主持过973计划、863计划、中国科学院战略性先导科技专项(B)以及国家自然科学基金等国家重点科研计划。2013年获得”国家****科学基金”,2015年获得科技部“中青年科技创新领军人才”,2016年获得中组部“****”领军人才称号.
摘要:超积累植物由于其对重金属具有地上部超积累以及超耐受等特性,不仅是研究植物离子转运及毒性耐受的理想模式,而且在植物修复的发展和应用中具有不可替代的作用。伴矿景天是近年在我国境内发现的一种景天科镉(Cd)/锌(Zn)超积累植物。为鉴定其富集和耐受Cd的关键基因,笔者构建了其酵母表达cDNA文库,利用酵母的遗传互补系统筛选到一个极大提高了酵母抗Cd能力的基因SpMT2。SpMT2属于富含半胱氨酸(Cys)的金属硫蛋白(Metallothionein)家族。亚细胞定位表明SpMT2表达于酵母细胞质中,并特异地提高酵母对Cd的抗性。进一步研究发现SpMT2的表达显著降低了酵母液泡中Cd含量,但酵母吸收的总Cd含量无显著变化。推测抗性增加是由于SpMT2在酵母细胞质中通过螯合Cd从而降低Cd对酵母的毒害。qRT-PCR分析表明SpMT2在伴矿景天的根和地上部都高丰度表达,且不受Cd诱导变化。鉴于SpMT2也定位于植物细胞质中,结合上述结果,推测SpMT2可能在伴矿景天细胞质中螯合Cd,在降低Cd毒害的同时可能还保持Cd在细胞质中的流动性,从而在Cd长途转运过程中也发挥重要作用。
关键词:重金属镉植物修复超积累植物金属硫蛋白
Isolation and characterization of cadmium tolerant gene SpMT2 in the hyperaccumulator Sedum plumbizincicola
Jiashi Peng1,2, Hongying Yi2, Jiming Gong2


1. Key Laboratory of Ecological Remediation and Safe Utilization of Heavy Metal-Polluted Soils, College of Life Sciences, Hunan University of Science and Technology, Xiangtan 411201, Hunan, China;
2. National Key Laboratory of Plant Molecular Genetics, CAS Center for Excellence in Molecular Plant Sciences, Institute of Plant Physiology and Ecology, Chinese Academy of Sciences, Shanghai 200032, China
Received: April 25, 2019; Accepted: June 6, 2019; Published: July 1, 2019
Supported by: National Natural Science Foundation of China (No. 31700212), China Postdoctoral Science Foundation (No. 2016m590387)
Corresponding author: Jiming Gong. Tel: +86-21-54924036; E-mail: jmgong@sibs.ac.cn.
Abstract: Hyperaccumulators can hyper-accumulate and -tolerate heavy metals, thus are not only an ideal model to explore the mechanisms of ion transport and toxicity tolerance, but also play an irreplaceable role in the development and application of phytoremediation. Sedum plumbizincicola is a recently identified cadmium (Cd)/zinc (Zn) hyperaccumulator in the Crassulaceae family in China. Here we report the construction and screening of its yeast-expressing cDNA library. We identified a metallothionein protein encoding gene SpMT2. SpMT2 is localized in yeast cytoplasm and expression of it in yeast specifically enhanced resistance to Cd. Further analysis showed that SpMT2 did not affect Cd absorption in yeast, but greatly inhibited Cd transport into vacuoles, indicating that SpMT2 may reduce Cd toxicity via chelation in cytoplasm. qRT-PCR analyses indicated that SpMT2 was highly expressed both in roots and shoots, and did not respond to Cd treatment. Taking together the results that SpMT2 was also cytoplasm-localized in plants, we proposed that SpMT2 may chelate/detoxify Cd and retain the complex in cytosol, which renders higher mobility of Cd thus promoting long-distance Cd transport in S. plumbizincicola.
Keywords: heavy metalcadmiumphytoremediationhyperaccumulatorsmetallothionein
重金属超积累植物由于其高积累与高耐受重金属的特性,不仅可以直接用于环境污染的植物修复,还可以在深入解析其高富集和高耐受重金属机理的基础上为植物修复技术提供基因资源和研究思路。对十字花科“模式超积累植物”叶芽鼠耳芥Arabidopsis halleri和天蓝遏蓝菜Thlaspi caerulescens的研究表明,除了关键的转运蛋白如ZIP (ZRT and IRT-like protein)家族蛋白、HMA4 (Heavy metal ATPases 4)和MTP (Metal Transport Protein)等的组成型高表达外,一些金属螯合物如组氨酸(Histidine)和NA (Nicotinamine)等在超积累植物耐受和富集重金属的过程中也发挥着重要的作用[1]。然而,人们对另一类广泛存在于植物体内的金属螯合蛋白——金属硫蛋白(Metallothioneins,MTs)在超积累植物耐受和富集重金属的过程中所发挥的作用却知之甚少。
金属硫蛋白是一类富含半胱氨酸(Cys)并能够结合多种重金属如锌(Zn)、镉(Cd)以及铜(Cu)等的小分子蛋白。已有的证据表明,MTs在植物体内金属离子胁迫的解毒过程中发挥着重要作用[2]。植物金属硫蛋白家族在序列和功能上虽具多样性,但大多数被子植物MTs在序列的两端富含Cys,并且一般具有4种相对保守的Cys排列顺序,从而将植物MTs分为4种类型[2-3]。而对于重金属超积累植物,大量的研究证实一些MTs家族成员的表达水平远高于其近亲非超积累植物,这暗示它们可能参与了其超富集和超耐受重金属的过程[4-7]。这些MTs在酵母、拟南芥或烟草中表达后能提高对重金属的抗性[6-11]。然而,遗传学的证据表明MTs的高表达并没有与超积累植物对重金属的超耐受性连锁[7, 11-12]。这也就使MTs在超积累植物富集和耐受Cd的过程中的作用至今仍未被人们所解析。
伴矿景天Sedum plumbizincicola是近期在中国发现的景天科超积累植物新种[13-14]。地上部重金属超量积累以及较大的生物量和实验室种植方便等特性使伴矿景天成为较为理想的模式超积累植物。为了鉴定其富集和耐受重金属Cd的关键基因,我们通过筛选伴矿景天的cDNA文库得到一个富含Cys的金属硫蛋白家族基因SpMT2。通过酵母异源表达系统解析了其介导Cd耐受性的机制,并结合其在植物中的亚细胞定位和表达模式,推测SpMT2可能通过在伴矿景天细胞质内螯合Cd以增强对Cd的耐受性,同时这种螯合减少了Cd向液泡中的区隔化从而保持了Cd在植物体内的流动性,促进了Cd的高效长途转运。
1 材料与方法1.1 植物材料及培养条件伴矿景天采集自浙江省衢州市一处废弃的锌/铅矿(N29°14′29″,E118°50′32″)。实验室条件下,选择生长良好、茎部粗细基本一致的植物材料,截取含顶芽的3-5 cm长带叶枝条,扦插进行土壤培养,或进行营养液培养。伴矿景天营养液培养配方:1 L营养液中含2 000 μmol Ca(NO3)2、100 μmol KH2PO4、500 μmol MgSO4、100 μmol KCl、700 μmol K2SO4、10 μmol H3BO3、0.50 μmol MnSO4、1 μmol ZnSO4、0.20 μmol CuSO4、0.01 μmol (NH4)6Mo7O24、100 μmol Fe-EDTA,pH 5.5-5.8。生长环境为相对湿度60%-70%,恒温22-24 ℃,光照周期为16 h光照/8 h黑暗[15]。
1.2 cDNA文库构建及抗Cd基因筛选用不同浓度梯度以及时间梯度处理的伴矿景天分根和地上部取材后利用CTAB法(2% CTAB,25 mmol/L EDTA-Na2,0.1 mol/L Tris,pH 8.0,1.4 mol/L NaCl)提取伴矿景天总RNA[15]。按照试剂盒说明书(Invitrogen公司)步骤构建酵母表达全长cDNA文库,酵母表达载体为半乳糖诱导表达载体pYES-DEST52。将文库转化大肠杆菌进行扩增,提取质粒后,按照Gietz & Schiestl的方法[16]转化对Cd敏感的酵母ycf1突变体,涂布200个平板(碳源为葡萄糖),每块大平板(150 mm×15 mm)涂布约5 000个酵母转化子。收集平板上的转化子,混合后涂布到含有相应浓度Cd的培养基平板上(碳源为半乳糖),每块平板涂布约10万个细胞,涂布约200块平板。30 ℃培养7 d左右,对阳性转化子进行筛选鉴定。
1.3 酵母表型鉴定将目的基因连入酵母表达载体pYES2,并转化酵母[17]。挑取单克隆培养至OD600为1.0左右。用2 mL新鲜的液体培养基将适量菌液稀释至OD600为0.2左右,培养至OD600为0.6。取1 mL菌液,12 000×g离心收集菌体,用无菌水重悬菌体。将菌液依次稀释至OD600=1、0.1、0.01。分别取10 μL菌体悬液滴至含有不同浓度重金属的培养基平板上,28-30 ℃培养4-7 d。并拍照。
1.4 酵母液泡提取酵母液泡提取参考Li等的方法[18],并略有改动。简要步骤如下:从平板上刮取适量的酵母接种到20 mL液体培养基中,培养至OD600为1-1.5左右。将培养液倒入400 mL新鲜培养基中,培养至OD600为1时加入相应浓度的重金属处理,并继续培养6 h。1 800×g离心5 min,收集细胞。用30 mL含有100 mmol/L Tris-SO4 (pH 9.3)和10 mmol/L DTT的溶液重悬细胞至OD600为10,30 ℃静置10 min。离心,弃上清,菌体沉淀用缓冲液(1.2 mol/L山梨醇,20 mmol/L磷酸钾,pH 7.4)洗一次。加入20 mg/mL酵母细胞壁裂解酶(Sigma公司),30 ℃静置30 min以上。1 000×g、4 ℃离心5 min,用3.5 mL预冷的15%菲可缓冲液(15%菲可,0.2 mol/L山梨醇,10 mmol/L PIPES-KOH, pH 6.8)将无壁细胞悬起(至OD600=70)。加入二乙胺乙基葡聚糖至50 mg/mL,冰上3 min,30 ℃ 5 min,加入MgCl2至终浓度为1.5 mmol/L。裂解液转至离心管中,上面依次覆盖3 mL 8%菲可、4 mL 4%菲可和1 mL 0%菲可缓冲液(10 mmol/L PIPES-KOH,pH 6.8,1.5 mmol/L MgCl2,0.2 mol/L山梨醇),110 000×g、4 ℃离心90 min,收集0%和4%菲可的液相界面间的液泡。提取得到的液泡分为两份,一份用BSA法测定其总蛋白含量,另一份测定重金属含量。
1.5 荧光蛋白融合构建及亚细胞定位以eGFP-L和eGFP-R为引物扩增eGFP (表 1),并利用KpnⅠ和SacⅠ酶点连入酵母表达载体pYES2得到pYES2-eGFP载体。以SpMT2-L1和SpMT2-R2为引物扩增SpMT2 (表 1),通过Hind Ⅲ和KpnⅠ连入酵母表达载体pYES2-eGFP得到酵母亚细胞定位载体pYES2-SpMT2-eGFP,并转化酵母,用共聚焦显微镜(Olympus-FV1000)观察亚细胞定位,激发光波长488 nm,接受光波长500-550 nm。
表 1 本研究中所用到的引物Table 1 Primers used in this study
| Primer use | Primer name | Primer sequences (5′-3′) |
| SpMT2 coloning | SpMT2-L1 | AAGCTTAGATCTATGTCTTGCTGTGGCGGAA |
| SpMT2-R1 | TCTAGATCATTTGCAATTGCAGGGGT | |
| SpMT2-R2 | GTCGACGGTACCTTTGCAATTGCAGGGGTCA | |
| eGFP coloning | eGFP -L | GGTACCATGGTGAGCAAGGGCGAG |
| eGFP-R | GAGCTCTTACTTGTACAGCTCGTCC | |
| qRT-PCR | SpMT2-RT-L1 | ATGTCTTGCTGTGGCGGAA |
| SpMT2-RT-R1 | TCATTTGCAATTGCAGGGGT | |
| Restriction endonucleases sites were underlined. | ||
表选项
以SpMT2-L1和SpMT2-R2扩增SpMT2 (表 1),通过XhoⅠ和SalⅠ连入植物瞬时表达载体PA7-YFP得到用于拟南芥叶片细胞原生质体瞬时表达的载体PA7-SpMT2-YFP。参考He等[19]的方法转化拟南芥原生质体细胞,用共聚焦显微镜(Olympus-FV1000)观察亚细胞定位,激发光波长514 nm,接受光波长530-600 nm。
1.6 镉含量测定待测酵母细胞依次用超纯水、5 mmol/L的EDTA、超纯水各洗2次,每次5 min。清洗好后烘干,称干重,用70%浓硝酸硝解,稀释,用电感耦合等离子质谱(ICP-MS)测定镉离子含量[13]。
1.7 qRT-PCR检测基因表达提取RNA后,去除总RNA中的基因组DNA。精确量取1 μg总RNA进行反转录。将合适浓度梯度的SpMT2/pGEM T-easy质粒和伴矿景天cDNA在同一批次进行实时定量PCR。将SpMT2/pGEM T-easy的反应循环数和模板拷贝数制作标准曲线,计算伴矿景天转录组中SpMT2的表达丰度[13]。引物见表 1。
1.8 序列信息SpMT2的cDNA序列已经提交至GenBank,序列号(Accession Number)为MK893990。
2 结果与分析2.1 伴矿景天cDNA文库筛选及SpMT2的鉴定酵母具有真核生物基因的优良表达系统、高效的转化方法和可供筛选的丰富突变体、因此是筛选目的外源基因的高效系统。植物中很多抗Cd基因都是利用酵母互补系统对其cDNA文库进行筛选而被鉴定,如拟南芥的AtPCS1和AtPCR1、小麦Triticum aestivum的TaPCS1、TaTM20和TaHsfA4a、印度芥菜Brassica juncea的BjOXS3等[19-25]。伴矿景天由于遗传背景不明,基因序列信息缺失,因此利用酵母的遗传互补系统对其cDNA文库进行筛选以得到抗Cd的关键基因是研究伴矿景天富集和耐受Cd机理的有效方法。
利用均长为1 200 bp的酵母表达cDNA文库转化酿酒酵母Ycf1突变体DTY168,得到大于400 000个酵母单克隆。收集这些单克隆并混匀,取部分涂布于含有400 μmol/L Cd的平板上,最终筛选得到约6 000个抗Cd克隆。随机挑取200个克隆分析了其插入片段,发现只有两个基因,命名为KG7和KG8。KG8已经发表[13],在此选取KG7作为研究对象。由于KG7符合植物金属硫蛋白特征,因此命名为SpMT2。
SpMT2的CDS全长240 bp,编码79个氨基酸,其中Cys残基14个。根据Zimeri等[3]通过相邻Cys位置的间距对植物4种类型MTs的表征(表 2),SpMT2 (Cys排列顺序:1424243…24232)属于植物MT2亚家族。
表 2 植物金属硫蛋白的半胱氨酸数目及分布类型Table 2 Total numbers and spacing patterns of cysteine residues in different types of plant MTs
| Cysteine spacing pattern | Total cysteine number | |
| MT1 | 24242…324242 | 13 |
| MT2 | 1424243…24232 | 14 |
| MT3 | 326…24232 | 10 |
| MT4 | 42462…24232…2423 | 17 |
| SpMT2 | 1424243…24232 | 14 |
表选项
为了进一步验证SpMT2在酵母中的功能,将其在酵母Cd敏感突变体Δyap1及其野生型Y252中表达,发现能极大地提高突变体以及野生型酵母对Cd的抗性(图 1A)。值得一提的是,SpMT2的表达并没有增强酵母对Zn的耐受性(图 1B)。
 |
| 图 1 SpMT2的表达增强了酵母对Cd的抗性 Fig. 1 Expression of SpMT2 enhanced Cd tolerance in yeast. The cadmium-sensitive yeast mutant Δyap1 and its wild type Y252 (A), zinc-sensitive yeast mutant Δzrc1 and its wild type CM100 (B) were transformed with EV (pYES2 empty vector), SpMT2, and grown on SD plates with indicated concentrations of metals for 7 days. |
| 图选项 |
2.2 SpMT2定位于酵母细胞的细胞质中由于SpMT2的分子量远小于绿色荧光蛋白eGFP,为了利用eGFP的融合来观察SpMT2的亚细胞定位,我们先将SpMT2-eGFP的融合载体在酵母中表达,发现其抗Cd功能并未受到eGFP融合的影响(图 2A)。在此基础之上,我们检测了其亚细胞定位,SpMT2主要定位在酵母细胞质中(图 2B),暗示其可能主要在细胞质中发挥作用从而降低了Cd的毒害。
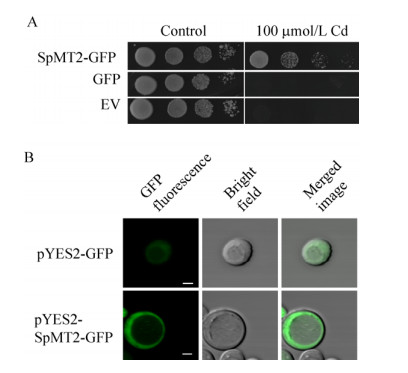 |
| 图 2 SpMT2定位于酵母的细胞质中 Fig. 2 SpMTL localized to the cytosol of yeast. (A) The SpMT2-eGFP fusion protein is functional. Y252 transformed with empty vector pYES2 (EV), pYES2-GFP or pYES2-SpMT2-eGFP were grown on SD plates with 100 μmol/L CdCl2 for 7 days. (B) Subcellular location of SpMT2 in yeast. Left: eGFP fluorescence; middle: bright field; right: merged images. Bars=2 μm. |
| 图选项 |
2.3 SpMT2减少了酵母中Cd向液泡中的转运由于酵母Δyap1突变体的液泡Cd区隔化功能受到影响[26],并且SpMT2的表达能提高野生型酵母Y252对Cd的抗性(图 1A),因此用50 μmol/L Cd处理Y252转化子酵母并提取了液泡,通过测定液泡中Cd含量发现,SpMT2的表达极大地减少了液泡中Cd的含量(图 3A),然而并没有改变酵母中总Cd的含量(图 3B)。
 |
| 图 3 SpMT2的表达减少了酵母中Cd向液泡的转运 Fig. 3 Expression of SpMT2 reduced Cd transport into vacuole. Total Cd accumulation (A) and vacuolar Cd accumulation (B) in yeast containing EV (pYES2 empty vector) or SpMT2. Yeast was treated with 50 μmol/L CdCl2 for 5 hours. Data are x±s, n=3. Statistical significance was indicated by lowercase letters above the bars (ANOVA test, P < 0.05). |
| 图选项 |
2.4 SpMT2定位于植物细胞的细胞质为了探究SpMT2在植物中是否也具有类似的功能,我们检测了其在植物中的亚细胞定位。将SpMT2-YFP的融合构建在拟南芥的原生质体细胞表达后,发现其与对照YFP的定位一致,主要位于细胞质中(图 4)。
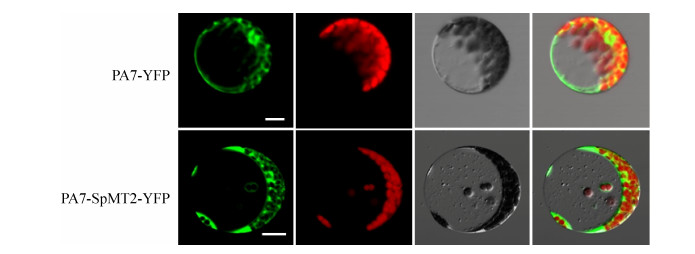 |
| 图 4 SpMT2定位于植物细胞质 Fig. 4 SpMT2 localized to the cytosol in plants. Subcellular location of SpMT2 in Arabidopsis mesophyll protoplasts. Bars=10 μm. |
| 图选项 |
2.5 SpMT2在伴矿景天中的表达模式基因的表达模式能够为基因功能的推测提供线索。我们通过分析单位总RNA中SpMT2的mRNA丰度来检测其表达模式。结果表明,SpMT2在伴矿景天根部和地上部都高丰度表达,且表达丰度无显著差异,1 μg总RNA中含有的SpMT2 mRNA的分子数超过108个(图 5)。需要指出的是,SpMT2的表达并不受Cd处理的诱导变化(图 5)。
 |
| 图 5 SpMT2在伴矿景天中的表达模式 Fig. 5 Expression levels of SpMT2 in S. plumbizincicola. Plants were grown in hydroponics for 6 weeks, and were transferred to solution supplemented with 10 μmol/L CdCl2 and allowed growth for another 3 d. Data are x±s, n=3. |
| 图选项 |
3 讨论本研究中我们通过高通量的cDNA文库筛选,克隆鉴定了金属硫蛋白家族成员SpMT2。并利用酵母系统证实SpMT2主要在细胞质发挥作用从而降低了Cd的毒害,同时减少了Cd向液泡中的区隔化。由于伴矿景天是新鉴定的物种,其相关遗传操作方法尚未成熟,但是我们根据SpMT2在植物细胞质定位以及在伴矿景天根部和地上部高丰度表达的结果,推测其可能在伴矿景天富集和耐受Cd过程中发挥了重要的作用。
植物体内存在多种类型的金属元素的螯合物,越来越多的研究表明,这些螯合物通过与金属元素形成稳定的复合物,在调节金属元素的液泡区隔容量(Vacuolar sequestration capacity,VSC)从而调节它们在体内转运的过程中发挥重要的作用[27]。特别是在超积累植物中,这些螯合物在细胞质中与重金属离子的螯合不仅降低了游离重金属离子造成的毒害,而且减少了根部重金属离子向液泡中的区隔化,保证了重金属离子流动性从而促进其在体内的长途转运。如NA在超积累植物叶芽鼠耳芥中的含量远高于其近亲非超积累植物,在NA含量减少的AhNAS2-RNAi株系中,地上部Zn和Cd的积累量也随之减少[28]。因此,我们推测SpMT2可能通过在伴矿景天细胞质中螯合Cd以增强对Cd的耐受性。同时,减少了Cd向液泡中的区隔化从而促进了Cd在体内的高效长途转运。
我们前期的研究已经证实,伴矿景天根部细胞中Cd的VSC显著小于其近亲非超积累植物[13],而地上部积累的Cd并不是主要储存于液泡中而更多地储存在细胞壁中[29]。因此,伴矿景天可能存在特殊的调节机制减少了Cd的VSC,SpMT2在根部和地上部都高丰度表达,可能在此过程中发挥作用。SpMT2在根部细胞的细胞质中通过螯合Cd促进了Cd向地上部的转运,而在地上部细胞质中与Cd的螯合可能在Cd向胞外细胞壁部位再分配过程中发挥作用。这一推测需要在未来通过构建和分析伴矿景天的SpMT2突变体或过表达材料等方式来进一步验证。
参考文献
| [1] | Kr?mer U. Metal hyperaccumulation in plants. Annu Rev Plant Biol, 2010, 61: 517-534. DOI:10.1146/annurev-arplant-042809-112156 |
| [2] | Cobbett C, Goldsbrough P. Phytochelatins and metallothioneins: roles in heavy metal detoxification and homeostasis. Annu Rev Plant Biol, 2002, 53: 159-182. DOI:10.1146/annurev.arplant.53.100301.135154 |
| [3] | Zimeri AM, Dhankher OP, McCaig B, et al. The plant MT1 metallothioneins are stabilized by binding cadmiums and are required for cadmium tolerance and accumulation. Plant Mol Biol, 2005, 58(6): 839-855. DOI:10.1007/s11103-005-8268-3 |
| [4] | Hammond JP, Bowen HC, White PJ, et al. A comparison of the Thlaspi caerulescens and Thlaspi arvense shoot transcriptomes. New Phytol, 2006, 170(2): 239-260. DOI:10.1111/j.1469-8137.2006.01662.x |
| [5] | van de Mortel JE, Villanueva LA, Schat H, et al. Large expression differences in genes for iron and zinc homeostasis, stress response, and lignin biosynthesis distinguish roots of Arabidopsis thaliana and the related metal hyperaccumulator Thlaspi caerulescens. Plant Physiol, 2006, 142(3): 1127-1147. DOI:10.1104/pp.106.082073 |
| [6] | Roosens NH, Leplae R, Bernard C, et al. Variations in plant metallothioneins: the heavy metal hyperaccumulator Thlaspi caerulescens as a study case. Planta, 2005, 222(4): 716-729. DOI:10.1007/s00425-005-0006-1 |
| [7] | van Hoof NALM, Hassinen VH, Hakvoort HWJ, et al. Enhanced copper tolerance in Silene vulgaris (Moench) Garcke populations from copper mines is associated with increased transcript levels of a 2b-type metallothionein gene. Plant Physiol, 2001, 126(4): 1519-1526. DOI:10.1104/pp.126.4.1519 |
| [8] | Roosens NH, Bernard C, Leplae R, et al. Evidence for copper homeostasis function of metallothionein (MT3) in the hyperaccumulator Thlaspi caerulescens. FEBS Lett, 2004, 577(1/2): 9-16. |
| [9] | Hassinen VH, Tervahauta AI, Halimaa P, et al. Isolation of Zn-responsive genes from two accessions of the hyperaccumulator plant Thlaspi caerulescens. Planta, 2007, 225(4): 977-989. DOI:10.1007/s00425-006-0403-0 |
| [10] | Hassinen VH, Tuomainen M, Per?niemi S, et al. Metallothioneins 2 and 3 contribute to the metal-adapted phenotype but are not directly linked to Zn accumulation in the metal hyperaccumulator, Thlaspi caerulescens. J Exp Bot, 2009, 60(1): 187-196. |
| [11] | Zhang J, Zhang M, Tian SK, et al. Metallothionein 2 (SaMT2) from Sedum alfredii Hance confers increased Cd tolerance and accumulation in yeast and tobacco. PLoS ONE, 2014, 9(7): e102750. DOI:10.1371/journal.pone.0102750 |
| [12] | Jack E, Hakvoort HWJ, Reumer A, et al. Real-time PCR analysis of metallothionein-2b expression in metallicolous and non-metallicolous populations of Silene vulgaris (Moench) Garcke. Environ Exp Bot, 2007, 59(1): 84-91. DOI:10.1016/j.envexpbot.2005.10.005 |
| [13] | Peng JS, Ding G, Meng S, et al. Enhanced metal tolerance correlates with heterotypic variation in SpMTL, a metallothionein-like protein from the hyperaccumulator Sedum plumbizincicola. Plant Cell Environ, 2017, 40(8): 1368-1378. DOI:10.1111/pce.12929 |
| [14] | Wu LH, Liu SB, Zhou SB, et al. Sedum plumbizincicola X.H. Guo et S.B. Zhou ex L.H. Wu (Crassulaceae): a new species from Zhejiang province, China. Plant Syst Evol, 2013, 299(3): 487-498. DOI:10.1007/s00606-012-0738-x |
| [15] | Peng JS, Ding G, Yi HY, et al. Cloning and functional analysis of phytochelatin synthase gene from Sedum plumbizincicola. Plant Physiol J, 2014, 50(5): 625-633 (in Chinese). 彭佳师, 丁戈, 易红英, 等. 伴矿景天植物螯合肽合酶基因的克隆及功能分析. 植物生理学报, 2014, 50(5): 625-633. |
| [16] | Gietz RD, Schiestl RH. Large-scale high-efficiency yeast transformation using the LiAc/SS carrier DNA/PEG method. Nat Protoc, 2007, 2(1): 38-41. DOI:10.1038/nprot.2007.15 |
| [17] | Elble RC. A simple and ef?cient procedure for transformation of yeasts. Biotechniques, 1992, 13(1): 18-20. |
| [18] | Li LT, Chen OS, McVey DW, et al. CCC1 is a transporter that mediates vacuolar iron storage in yeast. J Biol Chem, 2001, 276(31): 29515-29519. DOI:10.1074/jbc.M103944200 |
| [19] | Vatamaniuk OK, Mari S, Lu YP, et al. AtPCS1, a phytochelatin synthase from Arabidopsis: isolation and in vitro reconstitution. Proc Natl Acad Sci USA, 1999, 96(12): 7110-7115. DOI:10.1073/pnas.96.12.7110 |
| [20] | Song WY, Martinoia E, Lee J, et al. A novel family of Cys-rich membrane proteins mediates cadmium resistance in Arabidopsis. Plant Physiol, 2004, 135(2): 1027-1039. DOI:10.1104/pp.103.037739 |
| [21] | Clemens S, Kim EJ, Neumann D, et al. Tolerance to toxic metals by a gene family of phytochelatin synthases from plants and yeast. EMBO J, 1999, 18(12): 3325-3333. DOI:10.1093/emboj/18.12.3325 |
| [22] | Kim YY, Kim DY, Shim D, et al. Expression of the novel wheat gene TM20 confers enhanced cadmium tolerance to bakers' yeast. J Biol Chem, 2008, 283(23): 15893-15902. DOI:10.1074/jbc.M708947200 |
| [23] | Shim D, Hwang JU, Lee J, et al. Orthologs of the class A4 heat shock transcription factor HsfA4a confer cadmium tolerance in wheat and rice. Plant Cell, 2009, 21(12): 4031-4043. DOI:10.1105/tpc.109.066902 |
| [24] | Papoyan A, Kochian LV. Identification of Thlaspi caerulescens genes that may be involved in heavy metal hyperaccumulation and tolerance. Characterization of a novel heavy metal transporting ATPase. Plant Physiol, 2004, 136(3): 3814-3823. DOI:10.1104/pp.104.044503 |
| [25] | Blanvillain R, Kim JH, Wu SM, et al. OXIDATIVE STRESS 3 is a chromatin-associated factor involved in tolerance to heavy metals and oxidative stress. Plant J, 2009, 57(4): 654-665. DOI:10.1111/j.1365-313X.2008.03717.x |
| [26] | Wemmie JA, Szczypka MS, Thiele DJ, et al. Cadmium tolerance mediated by the yeast AP-1 protein requires the presence of an ATP-binding cassette transporter-encoding gene, YCF1. J Biol Chem, 1994, 269(51): 32592-32597. |
| [27] | Peng JS, Gong JM. Vacuolar sequestration capacity and long-distance metal transport in plants. Front Plant Sci, 2014, 5: 19. |
| [28] | Deinlein U, Weber M, Schmidt H, et al. Elevated nicotianamine levels in Arabidopsis halleri roots play a key role in zinc hyperaccumulation. Plant Cell, 2012, 24(2): 708-723. DOI:10.1105/tpc.111.095000 |
| [29] | Peng JS, Wang YJ, Ding G, et al. A pivotal role of cell wall in Cadmium accumulation in the Crassulaceae hyperaccumulator Sedum plumbizincicola. Mol Plant, 2017, 10(5): 771-774. DOI:10.1016/j.molp.2016.12.007 |
