
 , 栗军杰2, 曹荣月1
, 栗军杰2, 曹荣月1

1. 中国药科大学 生命科学与技术学院,江苏 南京 211100;
2. 上海药明生物技术有限公司 细胞培养工艺开发部,上海 200131
收稿日期:2019-09-22;接收日期:2019-12-12;网络出版时间:2020-01-06
摘要:近年来生物药市场需求量激增,高产量、高质量、低成本的哺乳动物细胞灌流培养工艺顺势成为工业界和学术界普遍关注的热点。文中围绕灌流培养工艺特有的操作环节及工艺优化应着重关注的细节展开论述,综述了近年来在灌流培养工艺开发和优化上取得的进步和提出的策略,以期为哺乳动物细胞灌流培养技术的开发提供参考。
关键词:灌流培养单细胞灌流速率中空纤维柱滤膜堵塞
Development and optimization of perfusion process for mammalian cell culture
Qiongqiong Zhang1, Mingyue Fang2

 , Junjie Li2, Rongyue Cao1
, Junjie Li2, Rongyue Cao1

1. Life Science and Technology College, China Pharmaceutical University, Nanjing 211100, Jiangsu, China;
2. Cell Culture Process Development Department, Wuxi Biologics, Shanghai 200131, China
Received: September 22, 2019; Accepted: December 12, 2019; Published: January 6, 2020
Corresponding author: Mingyue Fang. E-mail: Fang_mingyue@wuxiapptec.com;
Rongyue Cao. Tel: +86-25-83271242; E-mail: caorongyuenanjing@126.com.
Abstract: In recent years, the demand of biologics has increased rapidly. Cell culture process with perfusion mode has become more and more popular due to its high productivity, good quality and high efficiency. In this paper, the unique operation and the details of process optimization for perfusion culture mode are discussed by comparing with traditional batch culture process. Meanwhile, the progress and strategies in the development and optimization of perfusion culture process in recent years are summarized to provide reference for the future development of mammalian cell perfusion culture technology.
Keywords: perfusion culturecell specific perfusion ratehollow fiber filterfilter clogging
生物药靶向性高、疗效好、毒副作用小,自20世纪80年代一经提出,便备受医患人员的青睐。近年来生物药占据的市场份额发展更为迅猛,仅单克隆抗体便占去2017年年度十大畅销药中的8个名额,且年度销售额高达1 230亿美元[1]。
与微生物及昆虫细胞相比,哺乳动物细胞具有翻译后修饰功能,在蛋白类药物表达方面展现出了独特的优势,因此哺乳动物细胞表达系统通常是生物药物生产的首选平台。随着近年来市场上对生物药物需求量的持续增长,生物药物收益大幅度提升,更是在全球范围内掀起了哺乳动物细胞培养的热潮[2]。目前用于工业化生产的哺乳动物细胞株主要有中国仓鼠卵巢细胞(Chinese hamster ovary, CHO)、仓鼠胚肾细胞(Baby hamster kidney, BHK)、小鼠骨髓瘤细胞(NS0和SP2/0),还有一些人类细胞株,包括HEK293和HT-2080。其中对CHO细胞株的研究最为充分,应用最为广泛[3]。多种哺乳动物细胞培养工艺的开发及优化也主要针对CHO细胞株展开论述。
哺乳动物细胞体外培养较之传统的微生物细胞培养难度较大[4],主要是由于哺乳动物细胞倍增时间长、代谢途径复杂、对外界环境敏感性强、对营养要求苛刻,且培养过程中细胞状态容易改变。目前常用的哺乳动物细胞培养工艺有:批次培养、补料批次培养和灌流培养(图 1)。
 |
| 图 1 目前常用哺乳动物细胞培养工艺示意图 Fig. 1 Schematic diagram of mammalian cell culture process commonly used at present. (A) Batch. (B) Fed-Batch. (C) Perfusion |
| 图选项 |
目前常用哺乳动物细胞培养工艺特点见表 1。
表 1 常用哺乳动物细胞培养工艺特点[5-10]Table 1 Characteristics of mammalian cell culture process[5-10]
| Culture modes | Diagrams | Characteristics | Advantages | Disadvantages |
| Batch | A | No feeding, harvest only at the end of culture | Simple operation, little contamination risk | Lower peak viable cell density, short culture duration, low productivity |
| Fed-Batch | B | Multiple feeding, harvest only at the end of culture | Simple operation, long culture duration, high productivity | Low peak viable cell density, low productivity |
| Perfusion | C | Constant working volume, continuous feeding, continuous harvest | Long culture duration, low cost, high productivity with high quality | Complicated operation, requiring specific equipment |
表选项
基于哺乳动物细胞灌流培养技术在产物产量、质量及成本等方面表现出来的显著优势,越来越多获批上市的生物药物使用灌流培养工艺进行生产[11],对灌流培养工艺的开发和优化进而成为当前哺乳动物细胞培养工艺研究的热点[12]。结合图 1和表 1可以看出较之传统的批次培养,灌流培养工艺存在的特有之处及工艺优化应着重关注的地方有:①灌流新鲜培养基,灌流速率的大小调节;②放流多余细胞,放流速率的大小调节;③灌流工艺培养周期较长,细胞活率的维持和产量的提高;④细胞截留装置,细胞的高效截留和产物的高效滤过。本文主要从以上几个方面展开综述,以期为工业悬浮哺乳动物细胞灌流培养技术的开发提供参考。
1 细胞比灌流速率(Cell specific perfusion rate,CSPR)CSPR指单位细胞单位时间内灌流到的新鲜培养基体积,其相应的计算公式为:
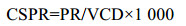 | (1) |
CSPR代表了培养过程中每天给到每个细胞的新鲜培养基体积,反映了灌流提供给细胞的营养水平,并不代表细胞自身的代谢状态。CSPR作为连接PR和VCD的桥梁,在灌流培养工艺的开发和优化过程中具有较高的指导价值,对其优化的方向是尽可能降低CSPR值的大小。这主要出于两方面的考虑[13]:①减少新鲜培养基的供应,降低生产成本(包括培养基自身及存储设备的成本);②降低收获液总体积,同时提高收获液中目的产物浓度,减轻下游纯化压力[14]。基于这两点考虑,Konstantinov等[15]建议应将CSPR尽可能控至低于50 pL/(cell·d)。
结合CSPR的定义,对其优化的方法主要有两大类:①降低PR;②提高目标VCD。但在实际操作过程中,各参数并不是可以无限调节的,应综合考虑其对培养过程的影响。PR过低则:a)不足以供给细胞生长最低的营养需求和及时带走代谢废物,导致细胞生长受限、活率下降;b)目的产物在反应罐中滞留时间较长,有降解风险(尤其是不稳定的产物,如FVIII[16])。PR过高则:a)细胞对培养基养分利用不充分,造成原料的浪费,提高生产成本;b)收获液目的产物浓度较低,下游纯化压力较大。VCD过低则:该培养体系的时空产率较低(Space-time yield,STY,g/(L·d)),生产成本高;VCD过高则:培养液粘度过高,细胞截留装置及供氧等设备不足以维持工艺正常运行[17]。
降低CSPR的相关方法在文献中有诸多报道。其中Konstantinov等[15]提出了“push-to-low”策略,该策略指在灌流培养的稳定阶段通过调节PR或VCD来逐步降低CSPR,直到寻找到CSPR的最小值,具体表现为更低的CSPR将导致细胞比生长速率(μ)、存活率(Viability)及比生产速率(Qp)等的下降。Lin等[18]在对培养基进行浓缩优化的基础上结合“push-to-low”的策略,为其所培养的CHO细胞株锁定到了最小的CSPR为75 pL/(cell·d),并将其成功放大至100 L的生产规模。Hiller等[14]在CHO细胞生长阶段将灌流泵关联于pH控制上,细胞在缺乏碳源情况下消耗乳酸使pH升高从而触发灌流的运行,提出了细胞按营养需求自主调控PR的灌流策略,整个灌流过程将CSPR成功控制于20–40 pL/(cell·d)之间。Gagnon等[19]则提出在前期CHO细胞生长阶段使用相对较高的CSPR,促使细胞快速生长至目标VCD,随之切换为浓缩的培养基以较低的CSPR继续灌流培养,这一策略减少了培养基的总用量并且方便了下游对目的产物的连续收获及纯化。
2 放流速率(Bleeding rate)调节灌流培养工艺较传统的批次培养工艺,最显著的特点是为细胞提供一个稳定且有利的生长环境,这主要得益于在培养过程中维持各个培养参数的稳定,这些参数主要包括各营养物质的浓度及细胞密度。其中恒定细胞密度的维持需要结合细胞的生长速率适当放流掉一定数量的细胞,在灌流培养的稳定阶段放流速率(数值上等于稀释速率,Dilution rate,D)应等于细胞的比生长速率。细胞生长越快,则需要放流的培养液量也越多,随之带来的问题是目的产物随着放流液的流失,导致产物收率降低[5]。因此,在灌流培养工艺的稳定阶段,一方面需要维持细胞密度足够高以确保较高的目的产物时空产率,另一方面也应当朝着降低放流速率的方向优化,进一步提高产物收率,比较理想的放流速率应控制为占总灌流速率的5%–10%[20]。
降低放流速率的基本原则是通过营养限制或环境限制为细胞提供次优的生长条件,以降低细胞的生长速率[5]。通常将细胞分裂滞留于G0/G1期,该阶段为细胞分裂的准备时间,细胞代谢旺盛,包括目的产物的合成[21]。Park等[22]从一系列化学物质中筛选出戊酸在抑制CHO细胞生长、提高细胞比生产速率上最具有优势。Wolf等[20]则对比了戊酸与降低培养温度对CHO细胞表现的影响,并发现在加入1 mmol/L戊酸的实验条件下,CHO细胞先是较对照组(36.5 ℃,不添加戊酸)表现出了更低的生长速率,但在培养第8天以后,细胞生长速率又逐渐回升。而较低培养温度(33.0 ℃)的实验组在整个培养过程中细胞生长速率都维持在较低水平,显著降低了细胞的放流速率,较对照组提升了目的蛋白收率高达15%。在实际生产过程中,适当降低培养温度确实是抑制细胞生长、提高细胞比生产速率的常用方法,但针对不同的克隆,其最适的降温后培养温度并不完全一样,因此在实际生产中还需结合实际情况寻找较为合适的培养温度。
随着灌流培养工艺的开发,近年来也发展起浓缩补料批次培养(Concentrated fed-batch,CFB)[23]的新型培养方式,其在连续培养过程中不控制稳态环境,无需放流,通过提高工艺过程中的峰值VCD (Peak VCD)和IVCD (Integrated viable cell density),进而在短时间内获得了极高的目的产物产量。较传统的灌流培养工艺,该类新型工艺培养周期较短,但时空产率得到了显著提升,在成本节约上具有显著优势,有望在生物药物生产中推广使用。
3 细胞比生产速率(Cell specific production rate,Qp)的提高提高培养体系的时空产率、降低药物生产成本,是细胞培养研究人员一以贯之的目标。决定高的时空产率的主要因素有[24]:高的细胞密度;高的Qp;长的可培养周期(往往取决于高细胞密度情况下高细胞活率的维持)。相应的,从细胞株自身出发,可以通过细胞构建和克隆筛选获得生长优异、代谢优良、产量可观的细胞株作为生产用细胞株。从细胞培养工艺出发,则可以针对不同的克隆筛选出最适宜的培养基,同时在培养过程中做好参数控制和调节,如温度、溶氧、pH等。
传统的批次培养过程中,常在细胞生长对数晚期适当降低培养温度以促进细胞产能的提升,Wolf等[20]采用CHO细胞株,在灌流工艺中同样尝试在目标细胞密度下为细胞提供较低的培养温度(33.0 ℃),发现较培养温度为36.5 ℃的条件,细胞Qp得到显著提升。Qin等[25]在CHO细胞灌流培养的稳定阶段使用氯化钠提高培养体系的渗透压,成功提高了培养体系时空产率,并且降低了产物的多聚体和酸性电荷异质体。Kuiper等[13]对现有用于补料批次培养的基础培养基和一定比例的补料培养基进行搭配混合,使用批次培养的摇管模型进行初步筛选,并在1 L生物反应器的规模下,使用灌流工艺培养CHO细胞,对筛选结果进行验证,发现合适比例的混合培养基能够在灌流培养中获得高的细胞密度及高的目的产物产量。
4 细胞截留装置4.1 细胞截留装置简介为了保证灌流过程中目的产物及时收获的同时不造成所培养悬浮细胞的损失,细胞截留装置自然成为了必不可少的基本要素之一。随着哺乳动物细胞灌流培养技术的发展,细胞截留设备也同样经历着不断的变革与创新,这其中不变的宗旨是在对细胞损伤较小的情况下,有效地实现细胞的截留和目的产物的滤过,这也是灌流工艺开发的重点所在。
目前常用的细胞截留技术及各自优缺点列于表 2。
表 2 目前常用细胞截留技术及优缺点[26-29]Table 2 Comparison of commonly used cell retention devices[26-29]
| Device names | Principles | Strengths | Weaknesses |
| Gravity settlers | Density difference between cells and media | The simplest device, less damage to cells, no product retention | Time consuming, not applicable in high cell density cultivation (> 40×106 cells/mL) |
| Centrifuges | Increasing settling velocities of cells by centrifugal force | High cell settling efficiency | High shear force, requiring aseptic batch centrifugation, complex operation |
| Acoustic settlers | Cell aggregation by acoustic frequency | Low shear force | Cell loss, not applicable in high cell density cultivation (> 40×106 cells/mL) |
| Hollow fiber filters | Large size cells retained by filter | No cell loss even at high VCD (> 100×106 cells/mL), easy to scale-up | Moderate shear force, fouling and clogging of the filter membrane leading to product retention |
表选项
相比之下,基于中空纤维柱过滤原理而设计的截留装置,因其对细胞截留率高、支持培养细胞密度高且设备简单、操作方便及易于放大等优点,在目前动物细胞灌流培养中使用最为广泛。目前常用的基于中空纤维柱过滤原理而开发的细胞截留装置主要有切向流过滤(Tangential flow filtration,TFF)模式和交替式切向流(Alternating tangential flow,ATF)模式。相比于TFF,ATF用隔膜泵代替蠕动泵,减少了系统对细胞的剪切力,同时由于隔膜泵周期性的凹凸运动,使得培养液在中空纤维柱中交替往复流动,由此产生的反向冲刷作用一定程度上减慢了柱子堵塞的速度[30-32],因此在灌流培养工艺中ATF更受青睐。
4.2 中空纤维柱滤膜堵塞问题研究进展由于灌流工艺较高的细胞密度和较长的培养周期,收获过程中往往会观测到中空纤维柱滤膜堵塞(Retention,R)的现象,具体表现为目的产物在罐内累积而收获液中目的产物浓度降低。相应的,中空纤维柱在t时刻堵塞程度可以表示为:
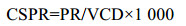 | (2) |
在培养过程中,滤膜堵塞为不可逆的过程,随着培养周期的延长,柱子对目的产物的截留渐趋严重,并最终因过低的目的产物收率及难以维持的收获液流速而不得不更换柱子或终止培养[33-34]。滤膜堵塞相应带来的问题有:①目的产物收率降低,增加生产成本[35];②目的产物截留于罐内时间过久,影响产物质量;③更换柱子增加操作的复杂性及染菌风险。基于这些考虑,分析培养过程中引起滤膜堵塞的因素,并进一步寻找可以减缓滤膜堵塞速率的措施是研究相关问题的主要方向。
4.2.1 中空纤维柱滤膜堵塞机理目前业界普遍接受的滤膜使用过程中堵塞模型主要有4种[31, 33],分别为:(A)滤孔口完全堵塞;(B)滤孔口部分堵塞;(C)滤孔内部黏附微粒;(D)滤膜表面形成滤饼(图 2)。
 |
| 图 2 滤膜使用过程中堵塞模型图 Fig. 2 Diagram of filter membrane fouling. (A) Complete pore blockage. (B) Partial pore blockage. (C) Pore constriction. (D) Cake formation |
| 图选项 |
图 2中最右侧部分代表中空纤维柱滤膜的纵切面,其中A、B两种模型代表直径大于滤膜孔径的微粒的堵塞作用,主要有细胞及消泡剂聚集而形成的微球,降低了滤膜的有效过滤面积;C类模型代表直径小于滤膜孔径的微粒的堵塞作用,主要有细胞碎片、脂质分子和细胞裂解释放的核酸及胞内蛋白等微粒黏附于滤膜孔径内壁,减小了滤孔有效过滤直径,使得过滤阻力增加;D类模型则代表各种微粒在滤孔堵塞后而于滤膜表面堆积,形成一层饼状黏附物,增大了过滤阻力,减小过滤流量。在实际培养过程中,4种基本的滤膜堵塞模型常常相伴存在。Hadpe等[31]针对这4种堵塞模型分别建立了相应的数学计算模型,该数学模型认为不同堵塞模型贡献的过滤阻力大小依次为A > C > B > D,并进一步指出滤孔的彻底堵塞是决定中空纤维柱在一轮实验中使用寿命的首要因素。Kelly等[33]也指出滤液及其中的微粒物质优先选择通过阻力最小的滤孔,而不是堆积在已经黏附于滤膜表面的颗粒上层形成滤饼。
4.2.2 影响中空纤维柱滤膜堵塞因素影响滤膜堵塞的因素可以概括分为两大类:①生物方面,主要指培养过程产生的可以引起滤膜堵塞的微粒物质,如细胞密度、细胞活率、消泡剂添加量、目的产物浓度及培养基组成等。灌流培养工艺常为高细胞密度发酵,往往需要开启微泡提高氧传质效率,由此也给细胞带来较高的剪切力,Xu等[36]认为在CHO细胞灌流培养中,2 g/L的PF68已不足以保护细胞免受高剪切力的损伤,并通过对比5 g/L PF68对细胞生长的影响,发现高浓度PF68可以更好地维持CHO细胞活率并由此降低了滤膜堵塞速率。Kelly等[33]通过采用CHO细胞株展开实验,对比了相同细胞活率、不同细胞密度的培养液,发现在相同收获液过滤速度的情况下,高细胞密度培养液倾向于形成更高的跨膜压力和滤膜堵塞速率。且通过电镜扫描滤膜切面,发现黏附于滤膜内表面的主要为细胞碎片及消泡剂微球。Liew等[37]也指出由于消泡剂强的表面活性,使其很容易黏附于滤膜表面,而其高度不稳定性也导致消泡剂碎片会黏附于滤孔内壁,进一步支持了消泡剂堵塞滤膜的观点。Wang等[32]在CHO细胞培养过程中通过测量乳酸脱氢酶(Lactate dehydrogenase,LDH)表征死细胞数量,指出较低的细胞活率导致较快的滤膜堵塞速率,并认为主要的原因是由于细胞死亡后裂解释放大量直径介于10–100 nm的微粒,此类微粒很快会引起滤膜堵塞。②物理方面,主要包括培养过程中影响滤膜堵塞速率的参数设置,如收获液过滤速率(单位膜面积单位时间内收获的液体量,L/(m2·h))及隔膜泵充气和抽真空速率(Pressure and exhaust,P/E flow,L/min)。Walther等[38]指出滤膜堵塞速率与收获液过滤速率成二次函数关系,且推荐操作过程中保持收获液过滤速率要小于2.5 L/(m2·h)。针对P/E flow对滤膜堵塞速率的影响,目前存在两种主流说法。一方面认为较高的P/E flow在抽真空阶段会存在较强的液体反向冲刷作用,有利于冲刷掉黏附于滤膜表面的微粒物质,避免柱子的堵塞[34, 39];一方面则指出较高的P/E flow对细胞存在较高的剪切力,而损伤的细胞会释放更多引起滤膜堵塞的微粒,加速滤膜堵塞,缩短中空纤维柱在一轮实验中的使用寿命[38]。双方观点各有一定的实验依据,因此增大P/E flow对滤膜堵塞速度的影响尚未定论,仍需进一步的研究来提供支持。
4.2.3 减缓或避免目的产物截留的措施寻求减缓甚至避免产物截留的措施,进而提高工艺的稳健性并提高目的产物收率、降低生物药物的生产成本一直是业界努力的目标。
Mercille等[40]从减少堵塞滤膜微粒总含量出发,指出可以通过在SP2/0细胞培养过程中,将培养基中加入DNase Ⅰ以降低滤膜堵塞速率。但作者并未进一步考察DNase Ⅰ的加入对目的产物质量的影响及对下游目的产物纯化工艺的影响,此外,在培养体系中所引入生物试剂的残留检测也会是药物质量把关中不得不面对的新问题。Wang等[41]从中空纤维柱自身特性出发,以CHO细胞株展开实验,提出可以使用较大孔径(如5 μm)的中空纤维柱以降低滤膜堵塞速率。但近年来将反应器灌流培养与下游纯化工艺相结合的连续操作正逐渐兴起[42],更推荐使用0.20 μm孔径的中空纤维柱,可以省去下游深层过滤操作,提高工作效率,节约生产成本。Kim等[43]通过在收获系统中引入一个单向阀和一个由控制器和计时器关联开关的夹管阀,避免了蠕动泵的使用,将重组人凝血因子Ⅷ收率成功提高1.46倍,且较之常规收获系统不影响CHO细胞生长情况。该收获系统搭建较为复杂,计时器控制夹管阀的开关要求较高的逻辑性,技术难度较大,尚未推广使用。Kwon等[44]提出一种新型的微流体细胞截留装置(Microfluidic cell retention device),该装置宏观结构类似粒子加速器,利用惯性分离细胞与蛋白产物,获得了高达99%的产物回收率,并且培养过程细胞活率维持较高。但作者采用CHO细胞株验证此截留装置时所采用工作体积仅有350 mL,并且目的细胞密度仅控制在20×106 cells/mL,该密度针对灌流发酵仍然处于偏低水平,因此该装置是否易于放大及是否能支持更高密度发酵时细胞不流失,仍需进一步考察。
5 总结与展望基于哺乳动物细胞灌流培养工艺单位工作体积高产量、高质量、低成本的显著优势,近年来随着生物药物市场的逐步扩大,工业界和学术界普遍关注灌流工艺的开发和优化,FDA也极大地鼓励生物药物生产工艺由传统的批次培养转型到灌流培养[12, 45]。本文通过综述近年来在灌流培养工艺开发和优化上取得的进步和提出的策略,为悬浮哺乳动物细胞灌流培养技术的开发提供了参考。
除上文讨论的优化关键点,灌流培养工艺的开发仍面临其他挑战:①成熟的小体积模型(Scale-down model)的开发。优良的小体积模型的开发,可以在优化工艺时降低生产成本,提高筛选效率。现提出灌流培养的小体积模型有深孔板和摇管等,此类模型不能完全模拟实际生产过程中连续换液和连续收获的操作,不能很好地反馈目的产物收获时对中空纤维柱滤膜的堵塞作用,此类模型也没有pH和溶解氧(Dissolved oxygen,DO)的实时控制,并不能完全模拟灌流培养中细胞的生长和代谢状态,作用较局限。②目的产物关键质量属性调控方法的开发。糖型和电荷等的变化均会影响蛋白类药物的有效性及在体内的免疫原性,尤其是在生物类似药的研发和申报时,对质量的调控显得更为重要。然而目前关于调节产物质量的文献报道多是基于传统的批次培养工艺,针对培养模式和细胞代谢状态有别的灌流培养工艺,开发出特有的更有效的调节质量策略仍需投入时间和精力。③ “亚批次”收获产物之间质量一致性的保证。灌流培养工艺周期较长(一般 > 30 d),培养期间目的产物连续收获。尽管认为灌流培养细胞生活环境处于稳定状态,但随着细胞倍增次数的增高,细胞代谢状态可能发生改变,进而影响到目的产物质量的一致性,而该问题是药物临床研究申请不得不面对的关键问题。因此,实现传统批次培养到连续灌流培养的完全转型,仍有较长的路要走。
参考文献
| [1] | Walsh G. Biopharmaceutical benchmarks 2018. Nat Biotechnol, 2018, 36(12): 1136-1145. DOI:10.1038/nbt.4305 |
| [2] | Bandaranayake AD, Almo SC. Recent advances in mammalian protein production. FEBS Lett, 2014, 588(2): 253-260. DOI:10.1016/j.febslet.2013.11.035 |
| [3] | Zhang MX, Zhu JW, Lu HL. Advances in antibody drug expression techniques. Chin J Biotech, 2019, 35(2): 171-182 (in Chinese). 张梦筱, 朱建伟, 路慧丽. 抗体药物表达技术最新进展. 生物工程学报, 2019, 35(2): 171-182. |
| [4] | Ayyar BV, Arora S, Ravi SS. Optimizing antibody expression: The nuts and bolts. Methods, 2017, 116: 51-62. DOI:10.1016/j.ymeth.2017.01.009 |
| [5] | Bielser JM, Wolf M, Souquet J, et al. Perfusion mammalian cell culture for recombinant protein manufacturing-A critical review. Biotechnol Adv, 2018, 36(4): 1328-1340. DOI:10.1016/j.biotechadv.2018.04.011 |
| [6] | Hong J, Demirji J, Blackstock D, et al. Development of an alternating tangential flow (ATF) perfusion-based transient gene expression (TGE) bioprocess for universal influenza vaccine. Biotechnol Prog, 2019, 35(5): e2831. |
| [7] | Karst DJ, Steinebach F, Soos M, et al. Process performance and product quality in an integrated continuous antibody production process. Biotechnol Bioeng, 2017, 114(2): 298-307. DOI:10.1002/bit.26069 |
| [8] | Pollock J, Ho SV, Farid SS. Fed-batch and perfusion culture processes: economic, environmental, and operational feasibility under uncertainty. Biotechnol Bioeng, 2013, 110(1): 206-219. |
| [9] | Xu S, Gavin J, Jiang RB, et al. Bioreactor productivity and media cost comparison for different intensified cell culture processes. Biotechnol Prog, 2017, 33(4): 867-878. |
| [10] | Bielser JM, Chappuis L, Xiao YS, et al. Perfusion cell culture for the production of conjugated recombinant fusion proteins reduces clipping and quality heterogeneity compared to batch-mode processes. J Biotechnol, 2019, 302: 26-31. DOI:10.1016/j.jbiotec.2019.06.006 |
| [11] | Li Y, Zhou H, Li JC, et al. Development and application of perfusion mammalian cell culture. Chin Med Biotechnol, 2015, 10(3): 267-270 (in Chinese). 李尤, 周航, 李锦才, 等. 哺乳动物细胞灌流培养技术的开发与应用. 中国医药生物技术, 2015, 10(3): 267-270. |
| [12] | Karst DJ, Steinebach F, Morbidelli M. Continuous integrated manufacturing of therapeutic proteins. Curr Opin Biotechnol, 2018, 53: 76-84. DOI:10.1016/j.copbio.2017.12.015 |
| [13] | Kuiper M, Spencer C, Faldt E, et al. Repurposing fed-batch media and feeds for highly productive CHO perfusion processes. Biotechnol Prog, 2019, 35(4): e2821. |
| [14] | Hiller GW, Ovalle AM, Gagnon MP, et al. Cell-controlled hybrid perfusion fed-batch CHO cell process provides significant productivity improvement over conventional fed-batch cultures. Biotechnol Bioeng, 2017, 114(7): 1438-1447. DOI:10.1002/bit.26259 |
| [15] | Konstantinov K, Goudar C, Ng M, et al. The "Push-to-Low" approach for optimization of high-density perfusion cultures of animal cells//Hu WS, Ed. Cell Culture Engineering. Berlin, Heidelberg: Springer, 2006: 75-98. |
| [16] | Kim SC, An S, Kim HK, et al. Effect of transmembrane pressure on factor Ⅷ yield in ATF perfusion culture for the production of recombinant human Factor Ⅷ co-expressed with von Willebrand factor. Cytotechnology, 2016, 68(5): 1687-1696. DOI:10.1007/s10616-015-9918-1 |
| [17] | Clincke MF, M?lleryd C, Zhang Y, et al. Very high density of CHO cells in perfusion by ATF or TFF in WAVE bioreactorTM. Part Ⅰ. Effect of the cell density on the process. Biotechnol Prog, 2013, 29(3): 754-767. |
| [18] | Lin H, Leighty RW, Godfrey S, et al. Principles and approach to developing mammalian cell culture media for high cell density perfusion process leveraging established fed-batch media. Biotechnol Prog, 2017, 33(4): 891-901. DOI:10.1002/btpr.2472 |
| [19] | Gagnon M, Nagre S, Wang WG, et al. Shift to high-intensity, low-volume perfusion cell culture enabling a continuous, integrated bioprocess. Biotechnol Prog, 2018, 34(6): 1472-1481. DOI:10.1002/btpr.2723 |
| [20] | Wolf MKF, Closet A, Bzowska M, et al. Improved performance in mammalian cell perfusion cultures by growth inhibition. Biotechnol J, 2019, 14(2): 1700722. |
| [21] | Du ZM, Treiber D, McCarter JD, et al. Use of a small molecule cell cycle inhibitor to control cell growth and improve specific productivity and product quality of recombinant proteins in CHO cell cultures. Biotechnol Bioeng, 2015, 112(1): 141-155. DOI:10.1002/bit.25332 |
| [22] | Park JH, Noh SM, Woo JR, et al. Valeric acid induces cell cycle arrest at G1 phase in CHO cell cultures and improves recombinant antibody productivity. Biotechnol J, 2016, 11(4): 487-496. |
| [23] | Yang WC, Minkler DF, Kshirsagar R, et al. Concentrated fed-batch cell culture increases manufacturing capacity without additional volumetric capacity. J Biotechnol, 2016, 217: 1-11. DOI:10.1016/j.jbiotec.2015.10.009 |
| [24] | Kunert R, Reinhart D. Advances in recombinant antibody manufacturing. Appl Microbiol Biotechnol, 2016, 100(8): 3451-3461. DOI:10.1007/s00253-016-7388-9 |
| [25] | Qin JY, Wu X, Xia ZG, et al. The effect of hyperosmolality application time on production, quality, and biopotency of monoclonal antibodies produced in CHO cell fed-batch and perfusion cultures. Appl Microbiol Biotechnol, 2019, 103(3): 1217-1229. |
| [26] | Choo CY, Tian Y, Kim WS, et al. High-level production of a monoclonal antibody in murine myeloma cells by perfusion culture using a gravity settler. Biotechnol Prog, 2007, 23(1): 225-231. DOI:10.1021/bp060231v |
| [27] | Shirgaonkar IZ, Lanthier S, Kamen A. Acoustic cell filter: a proven cell retention technology for perfusion of animal cell cultures. Biotechnol Adv, 2004, 22(6): 433-444. DOI:10.1016/j.biotechadv.2004.03.003 |
| [28] | Kim BJ, Oh DJ, Chang HN. Limited use of centritech Lab Ⅱ centrifuge in perfusion culture of rCHO Cells for the production of recombinant antibody. Biotechnol Prog, 2008, 24(1): 166-174. |
| [29] | Bosco B, Paillet C, Amadeo I, et al. Alternating flow filtration as an alternative to internal spin filter based perfusion process: Impact on productivity and product quality. Biotechnol Progr, 2017, 33(4): 1010-1014. |
| [30] | Karst DJ, Serra E, Villiger TK, et al. Characterization and comparison of ATF and TFF in stirred bioreactors for continuous mammalian cell culture processes. Biochem Eng J, 2016, 110: 17-26. DOI:10.1016/j.bej.2016.02.003 |
| [31] | Hadpe SR, Sharma AK, Mohite VV, et al. ATF for cell culture harvest clarification: mechanistic modelling and comparison with TFF. J Chem Technol Biotechnol, 2017, 92(4): 732-740. DOI:10.1002/jctb.5165 |
| [32] | Wang S, Godfrey S, Ravikrishnan J, et al. Shear contributions to cell culture performance and product recovery in ATF and TFF perfusion systems. J Biotechnol, 2017, 246: 52-60. DOI:10.1016/j.jbiotec.2017.01.020 |
| [33] | Kelly W, Scully J, Zhang D, et al. Understanding and modeling alternating tangential flow filtration for perfusion cell culture. Biotechnol Prog, 2014, 30(6): 1291-1300. DOI:10.1002/btpr.1953 |
| [34] | Radoniqi F, Zhang H, Bardliving CL, et al. Computational fluid dynamic modeling of alternating tangential flow filtration for perfusion cell culture. Biotechnol Bioeng, 2018, 115(11): 2751-2759. DOI:10.1002/bit.26813 |
| [35] | Bolton GR, Apostolidis AJ. Mechanistic modeling of the loss of protein sieving due to internal and external fouling of microfilters. Biotechnol Prog, 2017, 33(5): 1323-1333. DOI:10.1002/btpr.2514 |
| [36] | Xu S, Jiang RB, Chen YT, et al. Impact of Pluronic? F68 on hollow fiber filter-based perfusion culture performance. Bioprocess Biosyst Eng, 2017, 40(9): 1317-1326. DOI:10.1007/s00449-017-1790-2 |
| [37] | Liew MKH, Fane AG, Rogers PL. Fouling of Microfiltration Membranes by Broth-Free Antifoam Agents. Biotechnol Bioeng, 1997, 56(1): 89-98. |
| [38] | Walther J, McLarty J, Johnson T. The effects of alternating tangential flow (ATF) residence time, hydrodynamic stress, and filtration flux on high-density perfusion cell culture. Biotechnol Bioeng, 2019, 116(2): 320-332. DOI:10.1002/bit.26811 |
| [39] | Zydney AL. Continuous downstream processing for high value biological products: a review. Biotechnol Bioeng, 2016, 113(3): 465-475. DOI:10.1002/bit.25695 |
| [40] | Mercille S, Johnson M, Lemieux R, et al. Filtration-based perfusion of Hybridoma cultures in protein-free medium: reduction of membrane fouling by medium supplementation with DNase I. Biotechnol Bioeng, 1994, 43(9): 833-846. DOI:10.1002/bit.260430902 |
| [41] | Wang SB, Godfrey S, Radoniqi F, et al. Larger pore size hollow fiber membranes as a solution to the product retention issue in filtration-based perfusion bioreactors. Biotechnol J, 2019, 14(2): 1800137. DOI:10.1002/biot.201800137 |
| [42] | Su S, Jing YJ, Huang RJ, et al. The research progress of perfusion mammalian cell culture. China Biotechnol, 2019, 39(3): 105-110 (in Chinese). 苏爽, 金永杰, 黄瑞晶, 等. 哺乳动物细胞灌流培养工艺研究进展. 中国生物工程杂志, 2019, 39(3): 105-110. |
| [43] | Kim SC, An S, Kim HK, et al. Modified harvest system for enhancing Factor Ⅷ yield in alternating tangential flow perfusion culture. J Biosci Bioeng, 2016, 121(5): 561-565. DOI:10.1016/j.jbiosc.2015.10.001 |
| [44] | Kwon T, Prentice H, Oliveira J, et al. Microfluidic cell retention device for perfusion of mammalian suspension culture. Sci Rep, 2017, 7(1): 6703. DOI:10.1038/s41598-017-06949-8 |
| [45] | Nasr MM, Krumme M, Matsuda Y, et al. Regulatory perspectives on continuous pharmaceutical manufacturing: moving from theory to practice: September 26-27, 2016, international symposium on the continuous manufacturing of pharmaceuticals. J Pharm Sci, 2017, 106(11): 3199-3206. DOI:10.1016/j.xphs.2017.06.015 |
