
 , 王媛2
, 王媛2

1. 湖北大学 生命科学学院, 省部共建生物催化与酶工程国家重点实验室,湖北 武汉 430062;
2. 湖北文理学院 医学院,湖北 襄阳 441053;
3. 湖北师范大学 生命科学学院 食用野生植物保育与利用湖北省重点实验室,湖北 黄石 435002;
4. 武汉生物工程学院 生命科学与技术学院,湖北 武汉 430415
收稿日期:2019-08-24;接收日期:2019-12-20
基金项目:襄阳市科技研究与开发项目(襄科计) (No. 2017-32),湖北省自然科学基金(Nos. 2017CFB241, 2015CFB605),湖北文理学院教师培育基金(No. 2017kypy008),中国博士后面上项目(No. 2019M650176)资助
摘要:人细小病毒B19 (Human parvovirus B19,简称B19病毒),是目前为止已知能够感染并引起人类疾病的两种细小病毒科成员之一。B19病毒作为一种重要病原,能够引起如儿童传染性红斑、急性再障危象、胎儿水肿甚至死胎等疾病。文中从B19病毒基因型、病毒受体、基因组结构特点与复制、病毒转录与转录后调控、病毒非结构和结构蛋白特点与功能以及病毒诊断及抗病毒药物研究策略6个方面来综述B19病毒的最新研究进展,以期为B19病毒致病机制的深入研究与治疗诊断策略的制定提供参考。
关键词:B19病毒基因型基因组特点转录与转录后调控病毒蛋白特点与功能病毒诊断和抗病毒药物
Advances in molecular biology research on human parvovirus B19
Yanming Dong1, Jingjing Li3, Peng Xu4, Yi Li4, Lixin Ma1

 , Yuan Wang2
, Yuan Wang2

1. State Key Laboratory of Biocatalysis and Enzyme Engineering, School of Life Sciences, Hubei University, Wuhan 430062, Hubei, China;
2. College of Medical, Hubei University of Arts and Science, Xiangyang 441053, Hubei, China;
3. Hubei Key Laboratory of Edible Wild Plants Conservation and Utilization, Hubei Normal University, Huangshi 435002, Hubei, China;
4. School of Life Sciences and Technology, Wuhan University of Bioengineering, Wuhan 430415, Hubei, China
Received: August 24, 2019; Accepted: December 20, 2019
Supported by: Xiangyang Science and Technology Research and Development Project (No. 2017-32), Natural Science Foundation of Hubei Province (Nos. 2017CFB241, 2015CFB605), Teacher Research and Cultivation Fund of Hubei University of Arts and Science (No. 2017kypy008), China Postdoctoral Science Foundation (No. 2019M650176)
Corresponding author: Lixin Ma. Tel: +86-27-88661237-6349; E-mail: malixing@hubu.edu.cn;
Yuan Wang. Tel: +86-710-3591126; E-mail: wy7859@126.com.
Abstract: Human parvovirus B19 (B19 virus) is one of the two parvoviruses that cause human diseases. As an important pathogen to humans, it causes infectious erythema in children, acute aplastic anemia, fetal edema and death. In this review, we focus on the recent advances in the molecular virology of B19V, such as viral genotypes, viral receptor, genomic features and viral replication, viral transcription and post-transcription regulation, viral nonstructural and structural protein features and functions, viral diagnosis and antiviral agents, to provide reference for further study of B19 pathogenesis mechanisms, treatment and diagnostic strategies.
Keywords: parvovirus B19genotypesgenomic featurestranscriptional and post-transcriptional regulationviral protein features and functionviral diagnosis and antiviral agents
人细小病毒B19 (Human parvovirus B19),简称B19病毒,属于红细胞病毒属(Erythroparvovirus),细小病毒科(Parvoviridae)的重要成员[1]。该病毒于1974年由Cossart等在筛检献血者乙型肝炎病毒表面抗原时发现,并于1985年被正式命名为B19病毒[2]。目前,B19病毒和人博卡病毒(Human bocavirus)是已知能够感染并引起人类疾病的两种细小病毒科成员[3]。B19病毒作为一种重要病原,能够引起多种疾病,如儿童传染性红斑、急性再障危象、胎儿水肿甚至死胎等[1]。目前,虽然仍难以在细胞中获得大量具有感染性的B19病毒,但是基于感染性克隆和新的红系祖细胞(CD36+ human erythroid progenitor cells,CD36+ EPCs)的感染模型,仍极大推进了B19病毒分子生物学方面的研究[1]。文中从B19病毒基因型、基因组结构特点与复制、转录与转录后调控、病毒非结构和结构蛋白特点与功能、病毒诊断与抗病毒药物研究策略6个方面来综述该病毒的最新研究进展,以期为B19病毒致病机制的研究与诊断策略的制定提供参考。
1 B19病毒基因型一直以来,B19病毒分离株的遗传变异程度很低,仅存在一个亚型。2002年随着大量病毒株的发现,基于病毒基因组NS1-VP1u区域约858 bp的序列进化树分析,B19病毒被分为3个基因型1、2、3[1, 4]。其中基因1型,包含绝大部分发现的B19病毒株,如Au、J35;基因2型主要代表病毒株为LaLi、A6等;基因3型主要代表病毒株为D91.1和V9。后来进一步的系统进化树分析又将1型分为1a和1b型;3型分为3a(V9)和3b (D91.1)。研究表明,1型的分布呈全球性;2型已经几乎消失,只在欧洲、巴西和美国有极低的检出率;3型通常只流行于西非的加纳,但也已在巴西、法国、印度和美国被发现[5]。虽然不同基因型在核苷酸序列上存在明显的差别,但是大部分的差别都在第3个核苷酸位置,其突变并不影响氨基酸的正常编码;不同基因型病毒蛋白同源性在96%–97%之间[4]。三种基因型具有相似的生物学、病原学和抗原学特性。每种基因型的患病率随地理来源、人口和样本类型的不同而不同;报道显示,基因2型在病人的皮肤和心脏组织中具有较高的检出率,相反,基因1型在正常人的皮肤组织中的检出率较高。然而,也有报道显示,1型是唯一能在正常人和病人的皮肤组织中存在的基因型[4-5]。总之,B19病毒基因型与其致病性是否存在必然联系还有待进一步研究。
2 B19病毒受体红细胞糖苷脂(Globotetraosylceramide,Gb4),又称P抗原(P antigen),被认为是B19病毒感染所必需的主要受体[1]。主要体现在:可溶性的Gb4及其单克隆抗体均能阻止B19病毒的感染[6];含VP1/2的B19病毒VLPs可以在体外结合Gb4[7]。然而,证据表明,尽管Gb4是B19病毒感染所必需的,却并不足以维持感染。例如,尽管成熟的人红细胞(Human red blood cells,hRBCs)仍表达Gb4,却对B19病毒的侵染不敏感[8],并且Gb4缺失的人可以抵抗B19病毒的侵染[9],这表明可能存在其他的辅助受体在病毒内化过程中起作用。虽然早期研究认为整合蛋白α5β1和Ku80蛋白是潜在的辅助受体,但后续研究表明Ku80在CD36+ EPCs细胞表面的表达与B19病毒的感染性无关[10]。鉴于VP1u在B19病毒粒子结合和内化过程中起重要作用,理论上B19病毒受体存在于未发现的VP1u的互作蛋白中[11]。最新研究发现,Gb4在病毒侵染过程中并无病毒受体的功能,却是侵染后能否完成病毒复制所必需的[12],该结果解释了前期发现的Gb4是病毒感染所必需却不足以维持感染的现象。
3 B19病毒基因组结构特点与复制B19病毒粒子为T=1的正二十面体结构,无包膜,直径约为25 nm。具有感染性病毒粒子的分子质量约为5.6×106 Da,完整病毒粒子在氯化铯密度梯度中的浮力密度约为1.419 g/cm3[1]。B19病毒基因组简单,为单链的DNA,全长5 596 nt (图 1),两端各具有完全相同的末端重复序列(Inverted terminal repeats,ITRs);ITR全长401 nt,其不完整回文序列折叠形成发夹结构(Hairpin- like structure),且存在两种相同的构型flip和flop,二者互为反向互补链[1]。ITRs具有基因组复制中形成的双链DNA (复制形式DNA)的复制起始位点(Ori)[1]。B19病毒最小Ori位于5 214–5 280 nt,包含4个NS1结合元件(NS1-binding elements,NSBEs) (5′-CCGGCGGC-3′)。其中NSBE1和NSBE2均为8 bp长,中间被2 bp分隔开,且具有相同的基序;NSBE3和NSBE4具有简并序列。NSBE1和NSBE3是病毒复制所必需的,NSBE4则能增强病毒复制[13]。B19病毒DNA左端含有单一启动子P6,启动子内的180–490区域含有大量增强子元件序列,可以结合转录因子CREBP、C-Ets、GATA、YY1以及Oct-1,进而增强启动子活性[14-15]。另外,ITR内部(337–354 nt),也含有增强P6启动子活性的NSBEs[16-17]。除两端的ITR结构外,B19病毒基因组中间为4 568 bp长的编码区,主要存在3个几乎覆盖全长基因组的阅读框(ORF),其中第1个ORF编码较小的非结构蛋白7.5 kDa和两个结构蛋白VP1和VP2,第2个ORF主要编码非结构蛋白11 kDa,第3个ORF主要编码非结构蛋白NS1[18]。
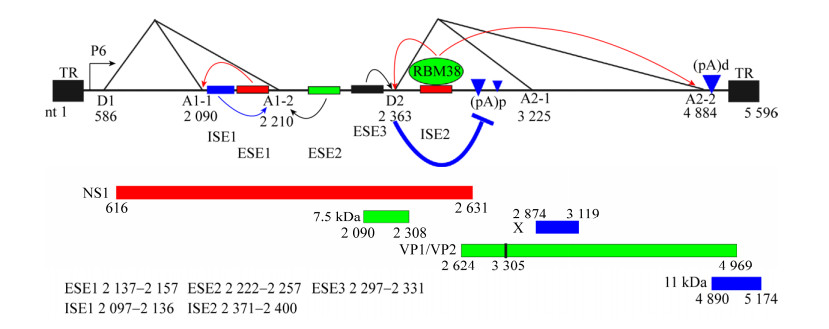 |
| 图 1 B19病毒转录及转录后调控示意图 Fig. 1 Diagram of B19 virus transcriptional and post-transcriptional regulation. |
| 图选项 |
B19病毒基因组的复制形式为滚环复制[17, 19],其基因组DNA复制过程为:病毒基因组负义单链DNA在细胞DNA聚合酶作用下,以左端ITR为引物,生成互补正义链DNA;然后NS1蛋白结合到NSBE位点并切割(Nick)其中的一条单链,完成ITR的退火延伸,并形成开放末端的双链DNA中间体;该复制中间体在NS1 ATP解旋酶功能的作用下,完成末端ITR结构的变性和退火,并形成双链ITR中间体,该中间体可以作为新的引物起始新一轮的病毒基因组DNA的复制。除NS1是B19病毒基因组复制所必需外,11 kDa蛋白可通过参与细胞内生长因子受体结合蛋白2 (Growth factor receptor-bound protein 2,Grb2)信号通路增强病毒基因组DNA的复制[20]。如同其他细小病毒科成员一样,由于细胞内DNA聚合酶δ (Pol δ)是完成B19病毒基因组复制所必需,因此,B19病毒复制也依赖于细胞周期处于S期[21-22]。进一步研究发现,其他S期细胞因子,如增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA)、复制因子复合物1 (Repication factor C,RFC1)、周期蛋白A (CyclinA)和微小染色体维持蛋白2 (Minichromosome maintenance protein 2,MCM2)均能与B19V复制中心共定位,这再次表明B19V的复制依赖于细胞周期处于S期。另外,研究显示由促红细胞生成素(Erythropoietin,Epo)激活引起的细胞内信号传导及转录激活蛋白5A (Signal transducer and activator of transcription 5A,STAT5A)的磷酸化水平也是B19病毒基因组复制所必需[10, 23];同时,低氧环境也通过调节Epo/EpoR信号通路中STAT5A的磷酸化调节病毒基因组的复制[10, 23]。
4 B19病毒转录及转录后调控如图 1所示,B19病毒的唯一前体mRNA由单一的P6启动子转录,并通过选择性剪切和选择性多腺苷酸化形成12个病毒mRNA转录物,其中NS1是由未经剪接的mRNA转录子翻译而来,其余11个经过剪接的mRNA转录子编码两个结构蛋白VP1和VP2,非结构蛋白11 kDa以及两个功能未知的蛋白7.5 kDa和X[1]。B19病毒基因组含有2个主要的多聚腺苷酸化位点(pA)p和(pA)d;其中(pA)p含有(pA)p1和(pA)p2,二者mRNA比例约为9:1;并且(pA)p位于B19病毒前体RNA (pre-mRNA)的第2个小内含子内[24]。研究表明,在非敏感细胞中,B19病毒的前体RNA均在(pA)p处发生多聚腺苷酸化,致使衣壳蛋白mRNA的产生受限;但在敏感及半敏感细胞系中,B19病毒的前体RNA可通过(pA)p生成编码衣壳蛋白和11 kDa蛋白的mRNAs[1]。因此,B19病毒全长转录物在(pA)p处的早期受阻被认为是其细胞趋性的机制。同时,在敏感细胞中,B19病毒转录物在(pA)p的受阻可以被其病毒基因组的复制所克服[17],但具体机制还有待进一步的研究。此外,RNA选择性剪切也是影响B19病毒转录后调控的重要因素[25]。B19病毒前体mRNA含有2个剪切供体位点(Donor sites,D1/D2)和4个剪切受体位点(Acceptor sites,A1-1/A1-2,A2-1/A2-2) (图 1)。A1-1和A1-2之间存在外显子剪切增强元件1 (Exon-splicing enhancer 1,ESE1),可促进A1-1的剪切;外显子2 (Exon2) 5′末端具有剪切增强元件2 (ESE2),能增强A1-2的剪切;外显子2 (Exon2) 3′末端的增强元件2 (ESE3)主要在识别D2供体位点的过程中起识别作用;邻近D2位点的富含G/GU区域的内含子剪切增强元件(Intron-splicing enhancer 2,ISE2),可被RNA结合蛋白RBM38结合,并促进D2/A2-2的剪切,进而影响11 kDa蛋白的产生,最终影响B19V的复制[26]。此外,内含子D1-A1的充分剪切可以促进病毒前体RNA在(pA)p的多聚腺苷酸化;而内含子D2-A2的剪切则竞争病毒前体RNA在(pA)p的多聚腺苷酸化,其具体机制在于U1核内小RNA (U1snRNA)通过结合D2,抑制在(pA)p的多聚腺苷酸化,进而促进编码衣壳蛋白VP2和11 kDa蛋白的mRNA生成[25, 27]。
5 B19病毒非结构和结构蛋白特点与功能5.1 非结构蛋白NS1非结构蛋白NS1 (78 kDa),其170–180位氨基酸具有核定位信号序列NLS,因此主要定位于细胞核[28-29]。NS1的N端具有起始DNA结合和内切酶结构域,为病毒复制所必需[13];NS1与细小病毒起始因子(Parvovirus initiation factor,PIF)及其他细胞因子共同结合于复制起始位点Ori,并激活NS1的切割活性,特异性切割B19病毒DNA trs位点,进而连接到切割DNA的5′末端,为引物结合提供一个3′ OH[13],并且基于此的NS1蛋白体外切割(nicking)实验方法也已获得成功[30],这将为靶向B19病毒复制过程的相关抗病毒药物的开发提供强有力的工具[31]。如图 2所示,NS1具有ATPase和NTP结合基序,使其具有ATP酶和DNA解旋酶的活性[29];其中,前者在dsRF DNA解旋中起作用,后者在NS1导致细胞毒性过程中起关键作用。在Sp1/Sp3的辅助下,NS1通过C端的转录激活结构域调控P6启动子以及细胞因子TNF-α、IL6的表达[16, 32-34]。此外,研究表明NS1也是B19病毒引起细胞凋亡的关键蛋白。如NS1可诱使B19病毒半敏感细胞K562和人原巨核细胞型白血病细胞(UT7/Epo)以及非敏感细胞HepG2的caspase-3/9依赖的线粒体凋亡途径,并且NTP结合位点被证明是其关键区域[35-36];另外,NS1也是B19病毒引起细胞周期阻滞和DNA损伤反应的关键蛋白[37]。如NS1通过与E2F4或者E2F5互作引起细胞G2期阻滞,其机制在于NS1通过其C端转录激活结构域2 (Transactivation domain 2,TAD2)激活细胞内ATR-CDC25C-CDK1信号通路并诱发细胞凋亡[29-30]。此外,NS1可引起UT7/Epo-S1的G1期阻滞,但对CD36+ EPCs细胞无影响,这表明NS1引起细胞G1期阻滞具有细胞特异性[38]。最新研究发现,基于B19病毒NS1的重组腺病毒载体可通过细胞凋亡途径杀死人巨核白血病细胞,该溶瘤病毒治疗策略将为人白血病的治疗提供新的方法和希望[39]。
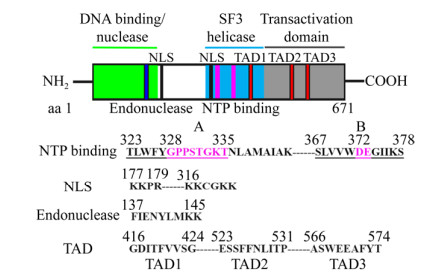 |
| 图 2 非结构蛋白NS1功能结构域及基序示意图[31] Fig. 2 Diagram of functional domain and motif on NS1 protein[31]. DNA binding domain: aa 2–176 (green); SF3 Helicase domain: aa 302–457 (light blue); Transactivation domain, TAD: aa 458–671(gray); Critical Transactivation domain (TAD): TAD1 (aa 416–424), TAD2 (aa 523–531), TAD3 (aa 566–574) (Red); Endonuclease motif: aa 137–145 (dark blue); Nuclear location signal, NLS: aa 177–179, aa 316–321 (Black). |
| 图选项 |
5.2 结构蛋白VP1和VP2B19病毒基因组右侧的大ORF主要编码结构蛋白VP1 (84 kDa)和VP2 (58 kDa)。如图 3所示,vp1和vp2属于重叠基因,其C端完全一样,其N-末端具有227个氨基酸组成的保守motif,称为VP1独特区(VP1-unique,VP1u)[1]。其中1–100位氨基酸主要参与病毒粒子的结合和内化[40];130–195位氨基酸具有磷脂酶A2 (Phospholipase A2,PLA2)活性,存在维持酶活性的关键区域,如钙离子结合保守区域以及酶活网络中心保守区域[41];VP1u很可能在B19病毒内化过程从细胞晚期内体中释放并进入细胞核以及与病毒侵染细胞和病毒粒子在细胞内释放有关[42]。另外,研究显示VP1u N端1–96位氨基酸尤其是第12个氨基酸前的区域以及第22–67氨基酸之间的区域;C端203–220位氨基酸尤其是C端的207位氨基酸的点突变可以使其丧失磷脂酶活性[43-44]。这表明,除了130–195位氨基酸是磷脂酶A2活性的关键区域外,VP1u的N端及C端对于维持其磷脂酶活性也异常重要。VP1和VP2分别占整个衣壳蛋白的4%和96%[11]。VP1编码mRNA起始翻译位点前具有多重AUG,致使VP1翻译效率较低[45]。VP1和VP2以大约1:20的比例组成T?1的正二十面体病毒衣壳(包括60个VP1/VP2蛋白,且每三个蛋白形成衣壳的一个面)[46]。虽然VP1少于VP2,但相对于VP2,VP1大部分氨基酸残基暴露在病毒衣壳外部,更容易结合抗体,因此是主要的抗原表位集中区[47];研究发现,VP1-VP2的连接区和VP1u区是B19病毒主要的中和性抗体表位的集中区[48]。例如,来自人外周血单核细胞(hPBMC)的两个中和抗体的抗原表位为线性且主要位于N端的80个氨基酸[49-50];本实验室利用纯化的MBP-VP1u融合蛋白制备的VP1u多克隆抗体可以显著抑制VP1u的磷脂酶A2活性,具有较高的特异性,为大量制备特异性的基于VP1u的中和抗体奠定了基础[43-44]。另外,B19病毒特异性记忆B细胞已经被确立,其主要靶向VP2的构象表位和VP1的线性表位,但并无VP2的线性表位[51]。两种蛋白均能在哺乳类、细菌、昆虫细胞中表达。在哺乳类、昆虫细胞中表达的VP2在无DNA或者NSP蛋白的情况下能够自组装形成病毒样颗粒(VLPs);VLPs在抗原性和免疫原性方面与B19病毒颗粒相似,已经成功应用于B19病毒抗体水平的检测。同时,含His标签的VP2在昆虫细胞中能成功组装成VLPs,为大规模制备VLP奠定了基础[52]。另外,VP2的C端含有非经典NLS基序(KLGPRKATGRW),可促使翻译的VP1和VP2进入细胞核完成衣壳的包装[40]。而红细胞糖苷脂结合区域(Globoside binding motif)则是病毒侵染细胞过程中与细胞膜受体P抗原(P antigen)结合的主要病毒衣壳位点[1]。
 |
| 图 3 VP1/VP2蛋白功能域及VP1u磷脂酶A2活性关键区域示意图 Fig. 3 Schematic diagram of critical region for VP1u sPLA2 activity and functional domain on VP1/VP2. VP1u N terminal: aa 1?96 (Black); VP1u C terminal and the key amino acid sites: aa 203?220 (Gray); aa 207 (Yellow); Critical region for sPLA2 activity: aa 130?195 (Red); Globoside binding motif: aa 577?677 (Blue); Nuclear localization signal (NLS): aa 720?730 (Purple). |
| 图选项 |
5.3 11 kDa蛋白和7.5 kDa蛋白11 kDa和7.5 kDa蛋白是B19病毒的两个小非结构蛋白[1]。研究表明,11 kDa蛋白在B19病毒感染敏感细胞CD36+ EPCs中可大量表达,其表达水平约为NS1蛋白的100倍[53]。同时,11 kDa蛋白主要呈细胞质内定位以及少量细胞核定位[20, 54]。如图 4所示,11 kDa蛋白含有94个富含脯氨酸(14个)的氨基酸,这14个脯氨酸形成3个富含脯氨酸的基序(SH3 motif);该SH3基序通过与含SH3配体序列的细胞内信号分子形成多蛋白复合物介导细胞内RTK信号通路的关闭并引起特异的生物学反应[55]。研究证实,11 kDa蛋白通过其SH3与Grb2互作,降低细胞内ERK活性,进而促进B19病毒的复制[20]。我们前期工作发现,11 kDa蛋白可激活细胞内NF-κB信号途径,进而激活相关启动子的活性[56]。而NF-κB通路又是调节众多与自身免疫性疾病相关的炎性因子和趋化因子如IL6、IL8、CXCL1表达的关键通路[57],因此,我们推测11 kDa蛋白可能通过激活NF-κB信号途径在B19病毒引起机体自主性免疫疾病方面起作用[56]。同时,细胞内RNA结合蛋白RBM38通过影响11 kDa mRNA的剪切调控依赖于11 kDa蛋白的病毒基因组DNA的复制[26]。然而,值得注意的是,目前关于11 kDa蛋白对B19病毒复制的影响主要在病毒感染敏感细胞CD36+ EPCs中被发现,在半敏感细胞系UT7/Epo-S1中转染B19病毒感染性克隆并未观察到该现象[20, 58]。另外,11 kDa蛋白除了影响病毒的复制及细胞内信号通路外,还影响病毒粒子的出核。研究显示,11 kDa蛋白的无义突变体病毒相对于野生型病毒,其感染性有明显的下降,并且病毒的衣壳蛋白主要集聚于细胞核内[58]。此外,11 kDa蛋白在B19病毒诱导依赖于caspase10途径的细胞凋亡途径中比NS1更重要[53]。对于7.5 kDa蛋白,该基因的缺失并不影响B19病毒的复制、病毒衣壳蛋白的出核以及病毒pre-mRNA的剪切及多聚腺苷酸化;至于该蛋白是否在病毒复制和感染过程中发挥作用,目前还不清楚[58]。另外,在VP区域还存在一个潜在的X蛋白(9 kDa);其类似蛋白仅在猪细小病毒(Porcine parvovirus,PPV)中被证实,在B19病毒感染中并不确定是否表达[1],并且在B19病毒感染性克隆中缺失该基因并不能影响病毒基因组DNA的复制[58]。有意思的是,我们通过荧光素酶报告系统研究发现,虽然X蛋白过量表达条件下主要存在于细胞质,但是却能上调B19病毒P6启动子活性;推测其可能通过影响相应的转录因子的表达水平间接调控病毒启动子的水平[56]。
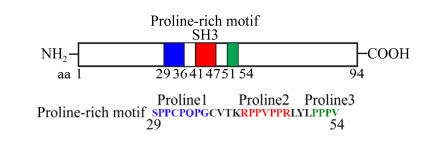 |
| 图 4 11 kDa蛋白主要功能性基序示意图 Fig. 4 Diagram of key functional motif on 11 kDa protein. |
| 图选项 |
6 B19病毒诊断及抗病毒药物研究6.1 B19病毒诊断试剂目前,B19病毒的诊断检测主要包括血清学检测和病毒核酸检测两种。其中前者是B19病毒诊断的基础,而病毒核酸检测则能提供进一步的协助诊断[1]。例如在免疫缺陷患者中,由于抗体产生不足,通常需要检测B19病毒DNA协助诊断;对于孕妇来说,通常将血清学抗体检测和病毒DNA水平联合应用;对于急性感染的诊断,通常以是否存在IgM以及IgG数量的4倍增加或IgG的血清学转换来表征[1]。对于血清学检测来说,从B19病毒粒子到体外纯化的重组衣壳蛋白VP1/VP2以及病毒样颗粒VLPs皆可作为抗体检测的抗原,其中VP1和VP2是最常用的抗原[59]。此外,尽管仍存在争议,但NS1特异性IgG仍被认为是检测严重关节炎患者和慢性病毒感染者时的重要血清学标志[60]。B19病毒核酸检测主要包括斑点杂交法(Dot blot hybridization)、聚合酶链反应法(Polymerase chain reaction,PCR)、原位杂交法(In situ hybridization)以及电化学传感器检测法(CRISPR-Cas12a based electrochemical biosensor,E-CRIPSR)。其中斑点杂交法作为最初的B19病毒核酸检测方法[61],逐渐被灵敏的PCR法替代[62];PCR法包括普通PCR法以及更灵敏的巢式PCR法(Nested PCR)和荧光定量PCR法(qPCR),其中后两者是目前最常用的B19病毒核酸检测方法[1, 62],常应用于病毒分型检测以及血液中B19病毒的大规模筛查;如最新研究发现基于NS1-VP1u区域的优化巢式PCR法在病毒核酸检测和分型检测中具有很高的敏感性与特异性[63];在血浆制品的B19病毒检测中,将核酸酶处理和长的目标序列结合的qPCR法既能保证检测的灵敏性,又可克服纳米滤膜过滤后片段化B19病毒DNA的残留对血浆中B19病毒DNA清除检测效果的影响[64]。原位杂交法则常被用来检测细胞内和组织内的B19病毒DNA[1]。E-CRIPSR法是基于CRISPR-Cas12a特异性切割DNA的性质在体外对B19病毒核酸DNA进行检测,其灵敏度可以达到pmol级别[65]。
6.2 抗B19病毒药物目前,B19病毒的抗病毒药物筛选与其他病毒相比仍存在巨大差距[66]。注射免疫球蛋白(IVIG)被认为是唯一有效的治疗途径,但对于免疫系统受损的患者来说,该治疗手段的效果十分有限[1]。
得益于B19病毒感染模型的建立和病毒复制机理的进一步研究,抗病毒化学药物的筛选在近几年取得了很大进步[66]。总体上B19病毒抗病毒药物的筛选主要分为4种策略[66]:(1)基于药物再定位的药物筛选方法,发现细胞增殖抑制剂羟基脲(Hu)具有抑制B19病毒在UT7/Epo-S1和CD36+ EPCs复制的活性[67]。(2)通过筛查已有抗病毒化合物是否对B19病毒复制感染有抑制活性,发现开环核苷西多福韦(Cidofovir,CDV)可以抑制B19病毒在UT7/Epo-S1和CD36+ EPCs细胞中的复制[68];尽管效果不理想,但其脂质结合物布罗福韦酯(Brincidofovir,BCV)表现出较强的抗病毒活性[69];最新研究发现,用于乙型肝炎治疗的合成胸腺嘧啶核苷类似物替比夫定(Telbivudine)可通过介入B19病毒感染骨髓衍生循环血管原细胞(Circulating angiogenic cells,CACs)后诱发的细胞凋亡途径,缓解导致内源性血管修复功能失调[70]。(3)通过抗病毒化合物文库筛选的方法,筛选到一些具有较好抗病毒活性香豆素衍生物[71]。(4)基于特定靶向药物的直接筛选,尤其是基于B19病毒复制中所必需的NS1蛋白的切割(nicking)活性进行抗病毒药物筛选,我们从96个小分子化合物文库中筛选到8个抑制NS1蛋白切割(nicking)活性超过80%的小分子化合物,并且,其中3个小分子化合物还能抑制在B19病毒感染性克隆转染UT7/EPO-S1细胞和B19病毒感染CD36+ EPCs细胞过程中病毒DNA的复制[31]。
除上述抗病毒化学药物外,相关的生物技术药物还处于发展阶段。如用于预防性的抗B19病毒疫苗在技术上是可行的,但仍处于研制过程中[72];另外,针对VP1u的人单克隆抗体能显著地中和B19V体外感染[50],表明抗VP1u的中和抗体将是治疗人骨髓的B19V感染的理想候选抗体治疗药物。
7 总结与展望B19病毒自发现以来,流行病学研究一直是研究的热点[1]。B19病毒DNA在癌症患者中的检出率约为50.69%,显著高于普通健康人群4.5%的检出率[1]。虽然B19病毒DNA的检出率在40%–60%之间,但由于人体免疫系统尤其是VP1u激活的中和抗体的作用,使得B19病毒载量绝大多数处于可控水平之内[1, 50]。不过当人体免疫抑制降低时,B19病毒载量会随之升高,并引起相应的红细胞祖母细胞的死亡及各种炎性疾病[1]。因此,基于B19病毒VP1u及相应衣壳蛋白新的抗原表位尤其是中和抗体抗原表位的发现和优化对于B19病毒的防控显得十分必要;目前,除了必要的血清学检测,巢式PCR与qPCR法检测仍然是B19病毒核酸的主流。而新兴起的E-CRIPSR法,由于其高特异性和灵敏性,将在开发便携、准确且低成本的B19病毒核酸诊断系统方面具有重要的应用前景。同时,鉴于NS1特异性IgG作为自主性免疫疾病尤其是类风湿性关节炎的重要血清学检测标志仍存在一定的争议,因此,进一步明晰B19病毒感染过程中NS1引起细胞凋亡及激活细胞炎性因子与相关疾病的关系的研究显得十分必要。另外,基于NS1蛋白体外切割(nicking)方法的B19病毒抗病毒药物的筛选的成功,为特异性靶向B19病毒复制过程的相关抗病毒药物的开发提供强有力的工具,因此,加强B19病毒在复制感染过程中的分子生物学研究将为特定靶向药物的直接筛选提供其他的理想靶标[30-31]。虽然经过体外分化培养的CD36+ EPCs对B19病毒感染高度敏感,并且也已成功用于抗病毒药物筛选,但由于费用昂贵、操作复杂以及极低的转染效率,限制了该病毒感染系统在相关研究中的应用[1]。因此,如何优化病毒感染复制模型,降低体外分化培养费用,并提高二者的瞬时转染效率,将为B19病毒诊断和抗病毒药物研究奠定基础。
参考文献
| [1] | Qiu JM, S?derlund-Venermo M, Young NS. Human parvoviruses. Clin Microbiol Rev, 2017, 30(1): 43-113. DOI:10.1128/CMR.00040-16 |
| [2] | Cossart YE, Cant B, Field AM, et al. Parvovirus-like particles in human sera. Lancet, 1975, 305(7898): 72-73. DOI:10.1016/S0140-6736(75)91074-0 |
| [3] | Allander T, Tammi MT, Eriksson M, et al. Cloning of a human parvovirus by molecular screening of respiratory tract samples. Proc Natl Acad Sci USA, 2005, 102(36): 12891-12896. DOI:10.1073/pnas.0504666102 |
| [4] | Servant-Delmas A, Lefrère JJ, Morinet F, et al. Advances in human B19 erythrovirus biology. J Virol, 2010, 84(19): 9658-9665. DOI:10.1128/JVI.00684-10 |
| [5] | Jain A, Kant R. Genotypes of erythrovirus B19, their geographical distribution & circulation in cases with various clinical manifestations. Indian J Med Res, 2018, 147(3): 239-247. DOI:10.4103/ijmr.IJMR_1816_16 |
| [6] | Brown KE, Anderson SM, Young NS. Erythrocyte P antigen: cellular receptor for B19 parvovirus. Science, 1993, 262(5130): 114-117. DOI:10.1126/science.8211117 |
| [7] | Nasir W, Nilsson J, Olofsson S, et al. Parvovirus B19 VLP recognizes globoside in supported lipid bilayers. Virology, 2014, 456-457: 364-369. DOI:10.1016/j.virol.2014.04.004 |
| [8] | B?nsch C, Kempf C, Ros C. Interaction of parvovirus B19 with human erythrocytes alters virus structure and cell membrane integrity. J Virol, 2008, 82(23): 11784-11791. DOI:10.1128/JVI.01399-08 |
| [9] | Brown KE, Hibbs JR, Gallinella G, et al. Resistance to parvovirus B19 infection due to lack of virus receptor (erythrocyte P antigen). N Engl J Med, 1994, 330(17): 1192-1196. DOI:10.1056/NEJM199404283301704 |
| [10] | Chen AY, Guan WX, Lou S, et al. Role of erythropoietin receptor signaling in parvovirus B19 replication in human erythroid progenitor cells. J Virol, 2010, 84(24): 12385-12396. |
| [11] | Leisi R, Von Nordheim M, Kempf C, et al. Specific targeting of proerythroblasts and erythroleukemic cells by the VP1u region of parvovirus B19. Bioconjugate Chem, 2015, 26(9): 1923-1930. DOI:10.1021/acs.bioconjchem.5b00321 |
| [12] | Bieri J, Ros C. Globoside is dispensable for Parvovirus B19 entry but essential at a postentry step for productive infection. J Virol, 2019, 93(20): e00972-19. |
| [13] | Tewary SK, Zhao HY, Deng XF, et al. The human parvovirus B19 non-structural protein 1 N-terminal domain specifically binds to the origin of replication in the viral DNA. Virology, 2014, 449: 297-303. DOI:10.1016/j.virol.2013.11.031 |
| [14] | Blundell MC, Beard C, Astell CR. In vitro identification of a B19 parvovirus promoter. Virology, 1987, 157(2): 534-538. DOI:10.1016/0042-6822(87)90296-0 |
| [15] | Blundell MC, Astell CR. A GC-box motif upstream of the B19 parvovirus unique promoter is important for in vitro transcription. J Virol, 1989, 63(11): 4814-4823. DOI:10.1128/JVI.63.11.4814-4823.1989 |
| [16] | Raab U, Beckenlehner K, Lowin T, et al. NS1 protein of parvovirus B19 interacts directly with DNA sequences of the p6 promoter and with the cellular transcription factors Sp1/Sp3. Virology, 2002, 293(1): 86-93. |
| [17] | Guan WX, Wong SS, Zhi N, et al. The genome of human parvovirus b19 can replicate in nonpermissive cells with the help of adenovirus genes and produces infectious virus. J Virol, 2009, 83(18): 9541-9553. DOI:10.1128/JVI.00702-09 |
| [18] | Ozawa K, Ayub J, Hao YS, et al. Novel transcription map for the B19 (human) pathogenic parvovirus. J Virol, 1987, 61(8): 2395-2406. DOI:10.1128/JVI.61.8.2395-2406.1987 |
| [19] | Burnett E, Cotmore SF, Tattersall P. Segregation of a single outboard left-end origin is essential for the viability of parvovirus minute virus of mice. J Virol, 2006, 80(21): 10879-10883. DOI:10.1128/JVI.01501-06 |
| [20] | Xu P, Chen AY, Ganaie SS, et al. The 11-kilodalton nonstructural protein of human parvovirus B19 facilitates viral DNA replication by interacting with Grb2 through its proline-rich motifs. J Virol, 2019, 93(1): e01464-18. |
| [21] | Zou W, Wang ZK, Xiong M, et al. Human parvovirus B19 utilizes cellular DNA replication machinery for viral DNA replication. J Virol, 2018, 92(5): e01881-17. |
| [22] | Luo Y, Lou S, Deng XF, et al. Parvovirus B19 infection of human primary erythroid progenitor cells triggers ATR-Chk1 signaling, which promotes B19 virus replication. J Virol, 2011, 85(16): 8046-8055. DOI:10.1128/JVI.00831-11 |
| [23] | Ganaie SS, Zou W, Xu P, et al. Phosphorylated STAT5 directly facilitates parvovirus B19 DNA replication in human erythroid progenitors through interaction with the MCM complex. PLoS Pathog, 2017, 13(5): e1006370. DOI:10.1371/journal.ppat.1006370 |
| [24] | Yoto Y, Qiu JM, Pintel DJ. Identification and characterization of two internal cleavage and polyadenylation sites of parvovirus B19 RNA. J Virol, 2006, 80(3): 1604-1609. DOI:10.1128/JVI.80.3.1604-1609.2006 |
| [25] | Guan WX, Cheng F, Huang QF, et al. Inclusion of the central exon of parvovirus B19 precursor mRNA is determined by multiple splicing enhancers in both the exon and the downstream intron. J Virol, 2011, 85(5): 2463-2468. DOI:10.1128/JVI.01708-10 |
| [26] | Ganaie SS, Chen AY, Huang C, et al. RNA binding protein RBM38 regulates expression of the 11-kilodalton protein of parvovirus B19, which facilitates viral DNA replication. J Virol, 2018, 92(8): e02050-17. |
| [27] | Guan WX, Huang QF, Cheng F, et al. Internal polyadenylation of the parvovirus B19 precursor mRNA is regulated by alternative splicing. J Biol Chem, 2011, 286(28): 24793-24805. DOI:10.1074/jbc.M111.227439 |
| [28] | Cotmore SF, McKie VC, Anderson LJ, et al. Identification of the major structural and nonstructural proteins encoded by human parvovirus B19 and mapping of their genes by prokaryotic expression of isolated genomic fragments. J Virol, 1986, 60(2): 548-557. DOI:10.1128/JVI.60.2.548-557.1986 |
| [29] | Wan ZH, Zhi N, Wong SS, et al. Human parvovirus B19 causes cell cycle arrest of human erythroid progenitors via deregulation of the E2F family of transcription factors. J Clin Invest, 2010, 120(10): 3530-3544. DOI:10.1172/JCI41805 |
| [30] | Sanchez JL, Romero Z, Quinones A, et al. DNA binding and cleavage by the human parvovirus B19 NS1 nuclease domain. Biochemistry, 2016, 55(47): 6577-6593. DOI:10.1021/acs.biochem.6b00534 |
| [31] | Xu P, Ganaie SS, Wang XM, et al. Endonuclease activity inhibition of the NS1 protein of parvovirus B19 as a novel target for antiviral drug development. Antimicrob Agents Chemother, 2019, 63(3): e01879-18. |
| [32] | Xu P, Zhou Z, Xiong M, et al. Parvovirus B19 NS1 protein induces cell cycle arrest at G2-phase by activating the ATR-CDC25C-CDK1 pathway. PLoS Pathog, 2017, 13(3): e1006266. DOI:10.1371/journal.ppat.1006266 |
| [33] | Fu Y, Ishii KK, Munakata Y, et al. Regulation of tumor necrosis factor alpha promoter by human parvovirus B19 NS1 through activation of AP-1 and AP-2. J Virol, 2002, 76(11): 5395-5403. DOI:10.1128/JVI.76.11.5395-5403.2002 |
| [34] | Moffatt S, Tanaka N, Tada K, et al. A cytotoxic nonstructural protein, NS1, of human parvovirus B19 induces activation of interleukin-6 gene expression. J Virol, 1996, 70(12): 8485-8491. DOI:10.1128/JVI.70.12.8485-8491.1996 |
| [35] | Moffatt S, Yaegashi N, Tada K, et al. Human parvovirus B19 nonstructural (NS1) protein induces apoptosis in erythroid lineage cells. J Virol, 1998, 72(4): 3018-3028. DOI:10.1128/JVI.72.4.3018-3028.1998 |
| [36] | Poole BD, Zhou J, Grote A, et al. Apoptosis of liver-derived cells induced by parvovirus B19 nonstructural protein. J Virol, 2006, 80(8): 4114-4121. DOI:10.1128/JVI.80.8.4114-4121.2006 |
| [37] | Lou S, Luo Y, Cheng F, et al. Human parvovirus B19 DNA replication induces a DNA damage response that is dispensable for cell cycle arrest at phase G2/M. J Virol, 2012, 86(19): 10748-10758. DOI:10.1128/JVI.01007-12 |
| [38] | Morita E, Nakashima A, Asao H, et al. Human parvovirus B19 nonstructural protein (NS1) induces cell cycle arrest at G1 phase. J Virol, 2003, 77(5): 2915-2921. DOI:10.1128/JVI.77.5.2915-2921.2003 |
| [39] | Xu P, Wang XM, Li Y, et al. Establishment of a parvovirus B19 ns1-expressing recombinant adenoviral vector for killing megakaryocytic leukemia cells. Viruses, 2019, 11(9): 820. DOI:10.3390/v11090820 |
| [40] | Leisi R, Ruprecht N, Kempf C, et al. Parvovirus B19 uptake is a highly selective process controlled by VP1u, a novel determinant of viral tropism. J Virol, 2013, 87(24): 13161-13167. DOI:10.1128/JVI.02548-13 |
| [41] | Zádori Z, Szelei J, Lacoste MC, et al. A viral phospholipase A2 is required for parvovirus infectivity. Dev Cell, 2001, 1(2): 291-302. DOI:10.1016/S1534-5807(01)00031-4 |
| [42] | Bleker S, Sonntag F, Kleinschmidt JA. Mutational analysis of narrow pores at the fivefold symmetry axes of adeno-associated virus type 2 capsids reveals a dual role in genome packaging and activation of phospholipase A2 activity. J Virol, 2005, 79(4): 2528-2540. DOI:10.1128/JVI.79.4.2528-2540.2005 |
| [43] | Deng XF, Dong YM, Yi QH, et al. The determinants for the enzyme activity of human parvovirus B19 phospholipase A2 (PLA2) and its influence on cultured cells. PLoS ONE, 2013, 8(4): e61440. DOI:10.1371/journal.pone.0061440 |
| [44] | Wang Y, Dong YM, Yi QH, et al. Preparation of polyclonal antibody against human parvovirus B19 VP1u and effect of N-terminal amino acids outside its conserved domain on the sPLA2 activity. Microbiol China, 2014, 41(2): 319-326 (in Chinese). 王媛, 董衍明, 易千慧, 等. 人细小病毒B19 VP1u多克隆抗体的制备及其保守区外N端氨基酸对sPLA2活性影响的初步研究. 微生物学通报, 2014, 41(2): 319-326. |
| [45] | Ozawa K, Ayub J, Young N. Translational regulation of B19 parvovirus capsid protein production by multiple upstream AUG triplets. J Biol Chem, 1988, 263(22): 10922-10926. |
| [46] | Kaufmann B, Chipman PR, Kostyuchenko VA, et al. Visualization of the externalized VP2 N termini of infectious human parvovirus B19. J Virol, 2008, 82(15): 7306-7312. DOI:10.1128/JVI.00512-08 |
| [47] | Kawase M, Momoeda M, Young NS, et al. Most of the VP1 unique region of B19 parvovirus is on the capsid surface. Virology, 1995, 211(2): 359-366. DOI:10.1006/viro.1995.1418 |
| [48] | Saikawa T, Anderson S, Momoeda M, et al. Neutralizing linear epitopes of B19 parvovirus cluster in the VP1 unique and VP1-VP2 junction regions. J Virol, 1993, 67(6): 3004-3009. DOI:10.1128/JVI.67.6.3004-3009.1993 |
| [49] | Anderson S, Momoeda M, Kawase M, et al. Peptides derived from the unique region of B19 parvovirus minor capsid protein elicitneutralizing antibodies in rabbits. Virology, 1995, 206(1): 626-632. DOI:10.1016/S0042-6822(95)80079-4 |
| [50] | Gigler A, Dorsch S, Hemauer A, et al. Generation of neutralizing human monoclonal antibodies against parvovirus B19 proteins. J Virol, 1999, 73(3): 1974-1979. DOI:10.1128/JVI.73.3.1974-1979.1999 |
| [51] | Corcoran A, Mahon BP, Doyle S. B cell memory is directed toward conformational epitopes of parvovirus B19 capsid proteins and the unique region of VP1. J Infect Dis, 2004, 189(10): 1873-1880. DOI:10.1086/382963 |
| [52] | Michel PO, M?kel? AR, Korhonen E, et al. Purification and analysis of polyhistidine-tagged human parvovirus B19 VP1 and VP2 expressed in insect cells. J Virol Methods, 2008, 152(1/2): 1-5. |
| [53] | Chen AY, Zhang EY, Guan WX, et al. The small 11 kDa nonstructural protein of human parvovirus B19 plays a key role in inducing apoptosis during B19 virus infection of primary erythroid progenitor cells. Blood, 2010, 115(5): 1070-1080. DOI:10.1182/blood-2009-04-215756 |
| [54] | Dong YM, Huang Y, Peng JX, et al. Regulatory effect of 11 kDa protein of parvovirus B19 on NF-κB pathway in Hela cells. Chin J Biotech, 2013, 29(7): 965-973 (in Chinese). 董衍明, 黄玉, 彭建新, 等. B19病毒11 kDa蛋白对Hela细胞内NF-κB信号通路的影响. 生物工程学报, 2013, 29(7): 965-973. |
| [55] | Fan MMY, Tamburic L, Shippam-Brett C, et al. The small 11-kDa protein from B19 parvovirus binds growth factor receptor-binding protein 2 in vitro in a Src homology 3 domain/ligand-dependent manner. Virology, 2001, 291(2): 285-291. |
| [56] | Dong YM, Huang Y, Wang Y, et al. The effects of the 11 kDa protein and the putative X protein on the p6 promoter activity of Parvovirus B19 in Hela cells. Virus Genes, 2013, 46(1): 167-169. DOI:10.1007/s11262-012-0839-1 |
| [57] | Sen RJ, Baltimore D. Inducibility of κ immunoglobulin enhancer-binding protein NF-κB by a posttranslational mechanism. Cell, 1986, 47(6): 921-928. DOI:10.1016/0092-8674(86)90807-X |
| [58] | Zhi N, Mills IP, Lu J, et al. Molecular and functional analyses of a human parvovirus B19 infectious clone demonstrates essential roles for NS1, VP1, and the 11 kDa protein in virus replication and infectivity. J Virol, 2006, 80(12): 5941-5950. DOI:10.1128/JVI.02430-05 |
| [59] | S?derlund M, Brown CS, Spaan WJM, et al. Epitope type-specific IgG responses to capsid proteins VP1 and VP2 of human parvovirus B19. J Infect Dis, 1995, 172(6): 1431-1436. DOI:10.1093/infdis/172.6.1431 |
| [60] | Jones LP, Erdman DD, Anderson LJ. Prevalence of antibodies to human parvovirus B19 nonstructural protein in persons with various clinical outcomes following B19 infection. J Infect Dis, 1999, 180(2): 500-504. DOI:10.1086/314894 |
| [61] | Bonvicini F, Manaresi E, Bua G, et al. Keeping pace with parvovirus B19 genetic variability: a multiplex genotype-specific quantitative PCR assay. J Clin Microbiol, 2013, 51(11): 3753-3759. DOI:10.1128/JCM.01970-13 |
| [62] | Naciute M, Mieliauskaite D, Rugiene R, et al. Frequency and significance of parvovirus B19 infection in patients with rheumatoid arthritis. J General Virol, 2016, 97(12): 3302-3312. DOI:10.1099/jgv.0.000621 |
| [63] | Pichon M, Labois C, Tardy-Guidollet V, et al. Optimized nested PCR enhances biological diagnosis and phylogenetic analysis of human parvovirus B19 infections. Arch Virol, 2019, 164(11): 2775-2781. DOI:10.1007/s00705-019-04368-w |
| [64] | Ideno S, Takahashi K, Yusa K, et al. Quantitative PCR evaluation of parvovirus B19 removal via nanofiltration. J Virol Methods, 2020, 275: 113755. DOI:10.1016/j.jviromet.2019.113755 |
| [65] | Dai YF, Somoza RA, Wang L, et al. Exploring the trans-cleavage activity of CRISPR-Cas12a (cpf1) for the development of a universal electrochemical biosensor. Angewand Chem, 2019, 58(48): 17399-17405. DOI:10.1002/anie.201910772 |
| [66] | Manaresi E, Gallinella G. Advances in the development of antiviral strategies against parvovirus B19. Viruses, 2019, 11(7): 659. DOI:10.3390/v11070659 |
| [67] | Bonvicini F, Bua G, Conti I, et al. Hydroxyurea inhibits parvovirus B19 replication in erythroid progenitor cells. Biochem Pharmacol, 2017, 136: 32-39. |
| [68] | Bonvicini F, Bua G, Manaresi E, et al. Antiviral effect of cidofovir on parvovirus B19 replication. Antivir Res, 2015, 113: 11-18. DOI:10.1016/j.antiviral.2014.11.004 |
| [69] | Bua G, Conti I, Manaresi E, et al. Antiviral activity of brincidofovir on parvovirus B19. Antiviral Research, 2019, 162: 22-29. DOI:10.1016/j.antiviral.2018.12.003 |
| [70] | Zobel T, Bock CT, Kühl U, et al. Telbivudine reduces parvovirus B19-induced apoptosis in circulating angiogenic cells. Viruses, 2019, 11(3): 227. DOI:10.3390/v11030227 |
| [71] | Conti I, Morigi R, Locatelli A, et al. Synthesis of 3-(Imidazo[2, 1-b]thiazol-6-yl)-2H-chromen-2-one derivatives and study of their antiviral activity against parvovirus B19. Molecules, 2019, 24(6): 1037. DOI:10.3390/molecules24061037 |
| [72] | Penkert RR, Young NS, Surman SL, et al. Saccharomyces cerevisiae-derived virus-like particle parvovirus B19 vaccine elicits binding and neutralizing antibodies in a mouse model for sickle cell disease. Vaccine, 2017, 35(29): 3615-3620. DOI:10.1016/j.vaccine.2017.05.022 |
