
 , 谢晶, 钱韻芳
, 谢晶, 钱韻芳 上海海洋大学 食品学院 上海水产品加工及贮藏工程技术研究中心,上海 201306
收稿日期:2019-09-20;接收日期:2020-01-09
基金项目:国家“十三五”重点研发计划(No. 2016YFD0400106)资助
摘要:β-防御素是斑点叉尾鮰Ietalurus punetaus抵御病原微生物侵染的首要蛋白质免疫因子,其一级结构包含氨基端24个氨基酸组成的信号肽和羧基端43个氨基酸组成的成熟肽,该成熟肽赋予β-防御素的生物学活性。文中首次构建了产斑点叉尾鮰β-防御素的毕赤酵母Pichia pastoris 重组菌株,实现了基于真核表达的斑点叉尾鮰β-防御素的生物合成。首先通过RT-PCR从斑点叉尾鮰皮肤中分离β-防御素成熟肽基因“IPBD”,将其与表达载体pPICZαA连接并转入毕赤酵母X-33后,获得重组毕赤酵母菌株;经含1 000 μg/mL博来霉素的培养基筛选,获得高拷贝重组菌株。以BMM培养基(无氨基氮源培养基)替代BMMY培养基(含氨基氮源培养基),对重组菌株的发酵培养条件进行优化,确定其产斑点叉尾鮰β-防御素的最适条件为:28 ℃、250 r/min、1.0%甲醇诱导表达96 h。重组菌株产物经镍离子亲和层析获得分子量为5.98 kDa的纯化蛋白,基于MALDI-TOF-TOF的质谱分析证明该纯化蛋白为重组IPBD。抑菌活性测定结果表明重组IPBD对革兰氏阳性的金黄色葡萄球菌Staphylococcus aureus、单增李斯特菌Listeria monocytogenes以及革兰氏阴性的铜绿假单胞菌Pseudomonas aeruginosa的抑菌率分别为69.6%、71.6%和65.8%。本研究为鱼类来源天然小分子抗菌肽的开发提供了可参考的重组DNA技术。
关键词:毕赤酵母重组表达斑点叉尾鮰β-防御素抑菌活性
Expression of Ietalurus punetaus β-defensin based on recombinant Pichia pastoris
Shasha Wang, Xingxing Lü, Zhen Zhao, Yan Tao

 , Jing Xie, Yunfang Qian
, Jing Xie, Yunfang Qian Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China
Received: September 20, 2019; Accepted: January 9, 2020
Supported by: National "13th Five-Year" Key Research and Development Program for Science and Technology Support (No. 2016YFD0400106)
Corresponding author: Yan Tao. Tel: +86-21-61900384; E-mail: ytao@shou.edu.cn.
Abstract: β-defensin is a primary protein immune factor in channel catfish's (Ietalurus punetaus) resistance to pathogenic microorganisms. Its primary structure contains a signal peptide composed of 24 amino acid residues at the N-terminal and a mature peptide composed of 43 amino acid residues at the C-terminal. The mature peptide region is responsible for the biological activity of β-defensin. In the present study, a recombinant strain of Pichia pastoris that produces channel catfish β-defensin, was constructed to realize the biosynthesis of channel catfish β-defensin based on eukaryotic expression. First, the β-defensin gene "IPBD" was isolated from the skin of channel catfish by RT-PCR. After linking it with the expression vector pPICZαA, pPICZαA-IPBD was transferred into competent P. pastoris X-33 cells to obtain recombinant P. pastoris strains. The yeast transformants with multi-copy gene inserts were obtained by using the culture medium containing 1 000 μg/mL zeocin. Using BMM culture medium (without amino nitrogen culture medium) instead of BMMY culture medium (with amino nitrogen culture medium), the fermentation and culture conditions of the recombinant strain were optimized, and the optimal conditions for producing channel catfish β-defensin were determined as follows: the expression was induced for 96 h with 1.0% methanol at 28 ℃, 250 r/min. Purified protein with molecular weight of 5.98 kDa was obtained by nickel affinity chromatography, and MALDI-TOF/TOF mass spectrometry proved that it was the expected recombinant IPBD. The antibacterial test results showed that the inhibitory rates of recombinant IPBD on Gram-positive Staphylococcus aureus and Listeria monocytogenes and Gram-negative Pseudomonas aeruginosa were 69.6%, 71.6% and 65.8%, respectively. This study provides a recombinant DNA technique for the development of small molecule natural antibacterial peptide from fish.
Keywords: Pichia pastorisrecombinant expressionchannel catfishβ-defensinantibacterial activity
防御素(Defensin)是生物机体在长期进化过程中保留下来的自身防御机制中的重要成分,是抗菌肽家族的重要成员;除去N端的信号肽,其成熟肽一般由29–54个氨基酸残基组成,内含6–8个保守的半胱氨酸残基,根据它们在分子内的位置和二硫键的连接方式分为α-防御素和β-防御素[1]。β-防御素在空间上通过C1-C5、C2-C4和C3-C6的连接方式形成3对二硫键,就此导致3股反相平行的β片层结构以稳定分子结构和防止被蛋白酶水解,这也是β-防御素与其他抗微生物肽的主要区别[2-3]。
虽然β-防御素在机体的免疫系统中发挥重要作用,但它在生物细胞中的表达量甚微,牛中性粒细胞中以2.2 mg/1010细胞存在[4],人体血浆中仅以纳摩尔的水平存在[5]。基于化学合成的途径制备成本高且难以有活性,而通过重组DNA技术构建β-防御素的生物合成体系,则可实现对其规模化的制备。鉴于此,有****在大肠杆菌表达系统中对牛中性粒细胞中的β-防御素基因进行重组DNA表达[6],鸡β-防御素在重组毕赤酵母Pichia pastoris菌株中的生物合成亦有报道[7];上述研究获得的重组β-防御素都显示了良好的抑菌活性。较之温血动物,鱼类栖息于更易遭受病原微生物污染的水域环境,而β-防御素则是其特异性免疫系统中的关键蛋白质免疫因子。关于鱼类β-防御素的研究起步较晚,迄今已有****从斜带石斑鱼Epinephelus coioides垂体中分离到β-防御素基因,并通过构建重组毕赤酵母实现了β-防御素的生物合成[8];还有****将从团头鲂Megalobrama amblycephala肝脏中分离到的β-防御素基因在大肠杆菌原核表达系统中进行重组DNA表达[9]。斑点叉尾鮰Ietalurus punetaus属底栖类鱼,其栖息环境复杂,尤其是近年来的高密度养殖导致它们更易遭受病原微生物的侵染。近来,有****称对斑点叉尾鮰进行体外细菌刺激试验后其皮肤中β-防御素的表达量增加最明显,由此推断β-防御素是其抵抗细菌感染的第一道防线,也因此被认为是开发天然抗菌剂的良好候选者;据此,Zhu等委托相关生技公司通过化学合成途径获得β-防御素成熟肽,发现其水溶液对多种细菌具有抑制作用[10]。然而,如上所述,化学合成方法无疑存在局限性。
迄今为止对于斑点叉尾鮰β-防御素的重组DNA表达研究尚属于空白。基于大肠杆菌原核表达系统的外源蛋白质表达有其局限性,例如对新生肽链无翻译后加工能力、以致表达产物缺乏应有的生物学活性,故不适合作为真核基因表达的宿主[11]。相比之下,作为真核表达宿主的毕赤酵母则克服了上述缺陷,且对发酵培养的营养要求低、易于高密度培养,可实现目的蛋白的分泌表达以方便后续处理[12]。据此,本研究拟通过构建重组毕赤酵母菌株和优化发酵培养条件,获得具有生物学活性的重组斑点叉尾鮰β-防御素,以期为鱼类来源小分子天然抗菌肽的开发提供重组DNA技术。
1 材料与方法1.1 材料1.1.1 实验动物、菌株和载体鲜活斑点叉尾鮰来源于上海市古棕路农贸市场;pMD19-T simple克隆载体购于TaKaRa公司;大肠杆菌DH5α购于天根生物科技有限公司;毕赤酵母X-33和表达载体pPICZαA购于Invitrogen公司;抑菌活性测定的菌株为金黄色葡萄球菌Staphylococcus aureus(ATCC 6538)、铜绿假单胞菌Pseudomonas aeruginosa (ATCC 27853)和单增李斯特菌Listeria monocytogenes (ATCC 19115)。
1.1.2 主要试剂和设备RNAiso plus试剂、Taq DNA聚合酶、T4 DNA连接酶和限制性内切酶(SacⅠ、XhoⅠ和XbaⅠ)均购于TaKaRa公司;Fast Quant cDNA第一链合成试剂盒、DNA分子量标准、蛋白质分子量标准、DNA回收试剂盒、质粒纯化试剂盒和酵母基因组提取试剂盒均购于天根生物科技有限公司;蛋白质分子量标准购于中科瑞泰生物科技有限;Western blotting试剂盒购于康为世纪生物科技有限公司。Gene Pulser XcellTM电穿孔系统和ProfiniaTM蛋白质纯化仪均购于BIO-RAD公司。引物合成、DNA测序委托生工生物工程(上海)股份有限公司完成;MALDI-TOF-TOF质谱测定委托上海中科新生命生物科技有限公司完成。大肠杆菌培养基LB、毕赤酵母培养基YPD、选择培养基MM和MD、诱导表达培养基BMG和BMM见Invitrogen公司毕赤酵母操作手册。
1.2 方法1.2.1 目的基因的cDNA克隆鲜活斑点叉尾鮰运至实验室后,使用RNAiso plus试剂提取其皮肤总RNA;cDNA第一链合成按照“Fast Quant cDNA第一链合成试剂盒”说明书操作。参考斑点叉尾鮰β-防御素基因(GenBank登录号:KX211992.1)设计的引物序列如表 1所示;第一次PCR以cDNA第一链为模板、IPB-F1和IPB-R1为引物,扩增β-防御素的全长cDNA:10×Taq缓冲液2 μL、dNTPs (10 mmol/L) 1.6 μL、IPB-F1和IPB-R1 (10 μmol/L)各0.8 μL、cDNA第一链0.2 μL、Taq DNA聚合酶(5 U/μL) 0.1 μL,无菌水调至20 μL;PCR反应条件为:94 ℃预变性3 min;94 ℃变性40 s,55.8 ℃退火30 s,72 ℃延伸1 min,30个循环;最后72 ℃延伸5 min。将该片段连接至pMD19-T simple载体后转化大肠杆菌DH5α感受态细胞,37 ℃培养12 h,阳性克隆送生工生物工程(上海)股份有限公司测序。第2次PCR以上述cDNA片段为模板、IPB-F2和IPB-R2为引物,扩增5′端含Kex2信号肽酶识别位点和XhoⅠ酶切位点、3′端含6×His标签的片段,反应体系和条件同上,仅退火温度改为57.7 ℃。第3次PCR以上述片段为模板、IPB-F2和IPB-R3为引物,扩增3′端含XbaⅠ酶切位点的目的基因“IPBD”,退火温度改为57.4 ℃。
表 1 引物序列Table 1 Sequences of primers
| Primer name | Primer sequence (5′–3′) | Size (bp) |
| IPB-FI | ACTACTTCTGGTCCTGCTGGT | 21 |
| IPB-R1 | GATGAGCAGCACTTCAGGTAC | 21 |
| IPB-F2 | CTCGAGAAAAGAGTGTCATTACCTTGGAGC | 30 |
| IPB-R2 | GTGGTGGTGGTGGTGGTGAAGGAAATATG | 29 |
| IPB-R3 | TCTAGATTATCAGTGGTGGTGGTGGTGGTGAAGGA | 35 |
| 3′AOX1 | GCAAATGGCATTCTGACATCC | 21 |
| 5′AOX1 | GACTGGTTCCAATTGACAAGC | 21 |
| Underlines indicate Kex2 signal cleavage site, italics indicate XhoⅠ and XbaⅠ restriction sites, bold letters indicate 6×His. | ||
表选项
1.2.2 X-33/pPICZαA-IPBD毕赤酵母重组菌株的构建用XhoⅠ和XbaⅠ双酶切切下pMD19-T- IPBD上的目的基因,将其与经同样酶处理的表达载体pPICZαA按3︰7 (V/V)混合,在T4 DNA连接酶作用下16 ℃孵育1 h,转入大肠杆菌DH5α感受态细胞后经PCR和双酶切鉴定重组表达载体pPICZαA-IPBD。经SacⅠ处理后的pPICZαA- IPBD与毕赤酵母X-33感受态细胞混合(V/V,1︰8),置于电转杯中冰浴数分钟后电击(1.5 kV、25 μF、200 Ω) 5 ms,立即加入1 mL预冷的1 mol/L山梨醇,30 ℃保温1.5 h后加入1 mL YPD培养基,28 ℃摇床培养1.5 h;菌体涂布于含100 μg/mL博来霉素的YPD平板上,28 ℃孵育至单菌落长出。挑取长势良好的菌落接种于含1 000 μg/mL博来霉素的YPD、MD和MM平板上以筛选高拷贝的甲醇利用快速型酵母转化子。提取转化子的基因组DNA,使用5′AOX1和3′AOX1 (表 1)为引物进行PCR鉴定。同时,将转入pPICZαA空载体的转化子作为阴性对照。
1.2.3 重组菌株的诱导表达将转化子接种于5 mL的YPD培养基中,28 ℃、250 r/min培养24 h;从中取500 μL转接至50 mL BMG培养基中,同上条件培养24 h;离心后将菌体重悬于250 mL BMM培养基中,同上条件再培养72 h。经Tricine-SDS-PAGE检验培养液上清,凝胶成分:0.1 mol/L Tricine、0.1% SDS,浓缩胶、夹层胶和分离胶的浓度分别为4%、10%和16.5%。
在上述预表达的基础上进行发酵培养条件的优化。将甲醇浓度设置为0%、0.5%、1%、1.5%和2%,将培养时间设置为0 h、24 h、48 h、72 h、96 h、120 h和144 h,同上条件进行诱导表达;通过Tricine-SDS-PAGE确定最适甲醇浓度和最适表达时间。
1.2.4 重组菌株产物的纯化和鉴定在最适表达条件下扩大培养液至1 L,经超滤膜包(赛多利斯VIVAFLOW 200)浓缩后,使用ProfiniaTM蛋白质纯化仪对培养液上清进行镍离子亲和层析,纯化产物通过Tricine-SDS-PAGE进行验证;电泳后的凝胶电转至PVDF膜上用于Western blotting分析:膜与封闭液反应1 h,洗膜后与抗His的鼠单克隆抗体(一抗)室温下孵育2 h,洗膜后再与辣根过氧化物酶标记的山羊抗小鼠IgG (二抗)室温下孵育1 h,洗膜后使用HRP-DAB试剂盒显色。另一方面,将纯化的蛋白质条带用于MALDI-TOF-TOF质谱分析。使用BCA试剂盒测定蛋白质浓度。
1.2.5 重组菌株产物的活性验证平板涂布法:将铜绿假单胞菌、金黄色葡萄球菌和单增李斯特菌分别接种于LB培养基中,37 ℃、150 r/min培养至OD600为0.5;各自以1︰100 (V/V)与X-33/pPICZαA-IPBD重组菌株的培养液上清混合,37 ℃孵育2 h;取30 μL涂于LB平板,37 ℃培养12 h后观察菌落生长情况;同时,将X-33/pPICZαA重组菌株的培养液上清与上述细菌作用作为阴性对照。比浊度法[13]:将3种细菌于37 ℃、150 r/min条件下培养至OD600为0.2–0.4,分别吸取50 μL至96孔板中,加入50 μL的X-33/pPICZαA-IPBD重组菌株的培养液上清(阴性对照加入的是X-33/pPICZαA重组菌株的培养液上清),37 ℃孵育24 h和48 h后分别测定各处理组和阴性对照组的OD600吸光值。
 |
每组试验设3个平行组,数据统计使用软件SPSS20中的单因素方差分析。
2 结果与分析2.1 目的基因的PCR扩增及重组表达载体的构建琼脂糖凝胶电泳显示(图 1):3次PCR分别扩增到236、159、171 bp的片段,最后一次扩增的片段经DNA测序显示:其5′端添加了Kex2信号肽酶识别位点和XhoⅠ酶切位点,3′端添加了6×His、两个终止密码子和XbaⅠ酶切位点(图 2A),该片段即目的基因“IPBD”;除了上述位点,目的基因编码了由43个氨基酸残基组成的斑点叉尾鮰β-防御素成熟肽,其中保守的6个半胱氨酸残基可形成3对二硫键以稳定其空间结构并赋予生物学活性。经预测,IPBD的理论分子量为5.98 kDa,pI为8.34。
 |
| 图 1 目的基因的PCR扩增电泳图 Fig. 1 Agarose gel electrophoresis of PCR amplified target gene. M: DNA ladder; 1: the first PCR amplification fragment; 2: the second PCR amplification fragment; 3: the third PCR amplification fragment. |
| 图选项 |
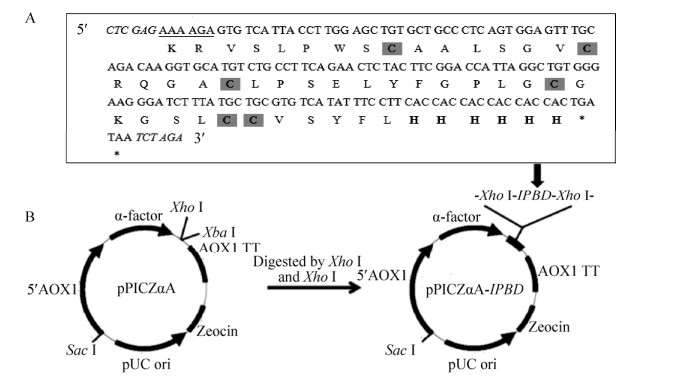 |
| 图 2 目的基因的核苷酸和推断的氨基酸序列(A)及重组表达载体pPICZαA-IPBD的构建(B) Fig. 2 Nucleotide and deduced amino acid sequences of the target gene (A) as well as schematic representation of the recombinant expression vector pPICZαA-IPBD (B). Underlines indicate Kex2 signal cleavage site, italics indicate XhoⅠ and XbaⅠ restriction sites, bold letters indicate 6×His, cysteine residues are shaded, star indicates stop code. |
| 图选项 |
如图 2B所示,将目的基因IPBD与表达载体pPICZαA连接得到重组表达载体pPICZαA-IPBD,转入大肠杆菌后使用载体上的通用引物5′AOX1和3′AOX1进行菌落PCR验证,结果显示(图 3A):4个菌落均在近700 bp处有明显条带,与预期分子量672 bp相符;进一步使用XhoⅠ和XbaⅠ对pPICZαA-IPBD进行双酶切,琼脂糖凝胶电泳显示在100–200 bp处有1个微弱的条带(图 3B),与171 bp的预期分子量相符。
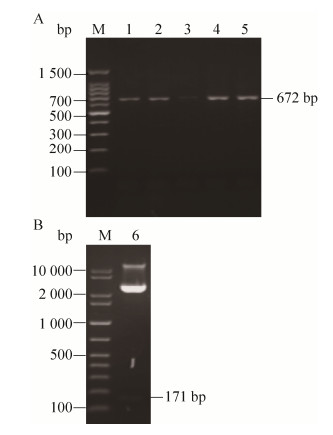 |
| 图 3 pPICZαA-IPBD的PCR (A)和双酶切鉴定(B) Fig. 3 Identification of pPICZαA-IPBD by colony PCR (A) and digestion of two endonucleases (B). M: DNA ladder; 1–5: colony PCR products; 6: pPICZαA-IPBD products digested by two endonucleases. |
| 图选项 |
2.2 重组毕赤酵母菌株的筛选及目的蛋白的诱导表达经含高浓度博来霉素的YPD平板和MM平板筛选到3株酵母转化子;以它们的基因组DNA为模板,使用引物5′AOX1和3′AOX1进行PCR验证,结果如图 4所示。含pPICZαA-IPBD的3株重组酵母菌均在近700 bp处有明显条带,与预期分子量672 bp相符;而含pPICZαA的阴性对照菌株则显示了1个约600 bp的条带,符合589 bp的预期分子量。
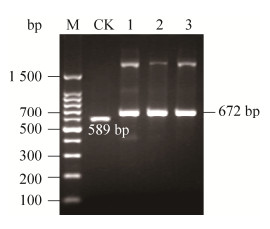 |
| 图 4 X-33/pPICZαA-IPBD的PCR鉴定 Fig. 4 PCR identification of X-33/pPICZαA-IPBD. M: DNA ladder; 1–3: PCR product of X-33/pPICZαA-IPBD; CK: PCR product of X-33/pPICZαA. |
| 图选项 |
选择图 4的2号菌株用于预表达,条件为:28 ℃、250 r/min、1.0 %甲醇,表达72 h。培养液上清经Tricine-SDS-PAGE显示了1个近5.8 kDa的蛋白质条带,与重组IPBD的理论分子量5.98 kDa相近,而阴性对照的培养液上清在该分子量位置则无明显条带(数据未显示)。在上述预表达的基础上,进一步考察不同甲醇浓度对该重组菌株表达的影响,由图 5A可见,各种甲醇浓度下,在5.8 kDa处虽然均显示有蛋白质条带,但1.0%甲醇诱导表达的条带最深,故在之后分时段表达时采用1.0 %的甲醇浓度。由图 5B可见,不同的诱导表达时间下蛋白质条带显示了明显的差异,96 h时最明显,超过96 h后条带明显变浅,故确定96 h为最适表达时间。
 |
| 图 5 各种甲醇浓度(A)和表达时间(B)下重组菌株产物的Tricine-SDS-PAGE分析 Fig. 5 Tricine-SDS-PAGE analysis of recombinant strain products at various methanol concentrations (A) and expression times (B). M: protein marker. |
| 图选项 |
2.3 目的蛋白的Western blotting和MALDI-TOF-TOF质谱鉴定在上述最适表达条件下扩大培养至1 L,培养液上清经镍离子亲和层析获得分子量位置在近5.8 kDa处的纯化产物(图 6A),其蛋白质浓度为0.5 mg/mL,由此推算重组蛋白的表达量为2 mg/L。Western blotting分析显示该纯化产物能与抗His的鼠单克隆抗体结合(图 6B),初步推断其为重组IPBD,MALDI-TOF-TOF质谱分析进一步证实了该推断。由图 7所示,在1 600.0–1 750.0 m/z的范围内捕捉到m/z 1 676.849 1的一个肽段,它代表自N端起5–19的氨基酸残基序列(VSLPWSCAALSGVCR),该序列完全符合由cDNA推断的相应残基序列,由此证明,纯化产物即为预期的重组蛋白IPBD。
 |
| 图 6 纯化产物的Tricine-SDS-PAGE (A)和Western blotting分析(B) Fig. 6 Tricine-SDS-PAGE (A) and Western blotting (B) analysis of the purified products. M: protein marker; CK: culture medium supernatant of X-33/pPICZαA; 1: purified product. |
| 图选项 |
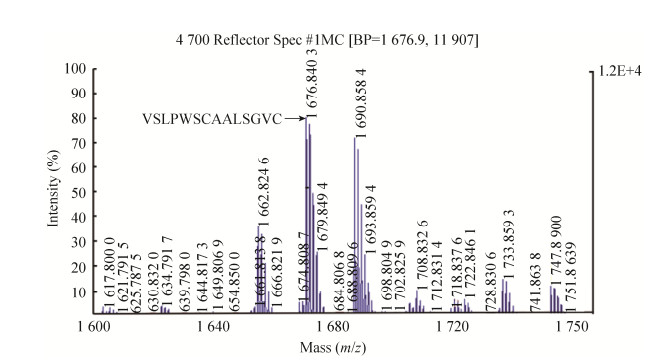 |
| 图 7 基于MALDI-TOF-TOF质谱的纯化产物鉴定 Fig. 7 Identification of the purified product based on MALDI-TOF-TOF mass spectrometry. Capital letters indicate amino acid sequences. |
| 图选项 |
2.4 重组毕赤酵母菌株产物的抑菌活性基于平板涂布法的抑菌试验结果显示(图 8A),X-33/pPICZαA-IPBD重组菌株的培养液上清分别与铜绿假单胞菌、金黄色葡萄球菌和单增李斯特菌作用2 h后涂平板,3种细菌的菌落数较阴性对照明显减少。另一方面,比浊度法的测定结果显示,X-33/pPICZαA-IPBD重组菌株的培养液上清与单增李斯特菌作用48 h的抑菌率明显高于作用24 h的抑菌率;而与铜绿假单胞菌和金黄色葡萄球菌作用24 h和48 h的抑菌率并无明显差异。可以发现,与3种细菌作用48 h后对它们的抑菌率在65.8%–71.58%,并无明显差异。
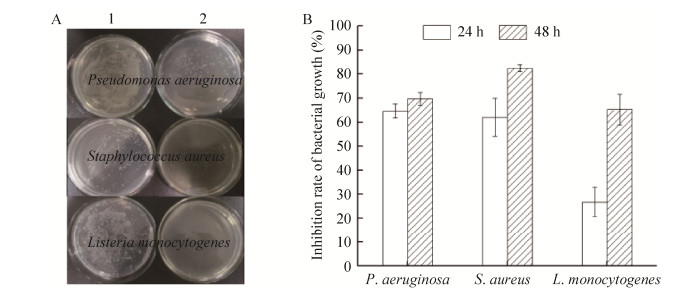 |
| 图 8 基于平板涂布法(A)和比浊度法(B)检测毕赤酵母重组菌株产物的抑菌活性 Fig. 8 Antibacterial activity of product from P.pastoris recombinant strain based on the plate coating method (A) and turbidimetric method (B). 1: treated bacteria using the culture medium supernatant of X-33/pPICZαA; 2: treated bacteria using the culture medium supernatant of X-33/pPICZαA-IPBD. Data were shown as x±s, n=3. |
| 图选项 |
3 讨论β-防御素是生物机体应对外来病原微生物侵染的重要免疫成分,它们在进化上属于保守的抗菌肽,其成熟肽一级结构中存在的6个半胱氨酸残基通过形成3对二硫键赋予了β-防御素具有β-折叠的构象元素,由此决定了它的生物学活性和稳定性[14]。本研究首次构建了产斑点叉尾鮰β-防御素成熟肽的重组毕赤酵母菌株,通过考察其在不同甲醇浓度和诱导表达时间下产重组蛋白的变化,确定了实验室摇瓶发酵的最适培养条件。但根据纯化的重组IPBD的蛋白质浓度推算的表达量仅为2 mg/L,分析原因可能与表达的IPBD的分子量偏小有关。通常,当重组菌株表达的外源蛋白质的分子量较小时,可能对菌株自身产生潜在的危害,即导致宿主细胞经历“自杀”现象[15];另一方面,小分子蛋白质易被宿主自身产生的酶降解。本研究在诱导表达96 h后发现目的蛋白条带的颜色明显变浅(图 5B),该现象也与上述分析相符。我们此前关于重组毕赤酵母产太平洋牡蛎Crassostrea gigas β-防御素和斑马鱼Danio rerio β-防御素的表达研究显示它们的表达量均为2.3 mg/L,尽管斑马鱼β-防御素基因是经密码子优化过的。上述研究结果表明通过构建重组毕赤酵母能有效合成小分子的β-防御素,但产量较低。近年来,关于如何解决小分子蛋白质表达量低的问题方面已有多个报道,有****构建了含1拷贝、2拷贝、4拷贝和8拷贝菌丝霉素基因(Plectasin)的表达载体,将其转入毕赤酵母X-33后进行发酵培养,结果发现重组毕赤酵母产物中Plectasin的浓度分别为296、409、516、879 mg/L[16];另有报道称将人源溶菌酶基因(hLY)与小分子的鲶鱼抗菌肽基因(PI)串联获得融合基因后,在毕赤酵母X-33中进行融合表达,重组融合蛋白hLY-PI的表达量为86 mg/L[17]。因此,进一步的研究将关注于构建含多拷贝斑点叉尾鮰β-防御素基因的表达载体或与其他分子量较大的抗菌肽基因进行融合表达,以期提高表达量。
通过重组毕赤酵母进行外源蛋白质的高密度发酵时,对于培养基的选择可以有多种,例如BMMY/BMGY、BMG/BMM、BSM等;而培养基的组成与酵母细胞的生长和外源蛋白质的表达密切相关,传统上因BMGY/BMMY培养基含酵母浸出物和蛋白胨而被认为对表达产物的稳定性和提高产量有利,故被作为发酵培养时的首选[18];然而,根据以往的研究我们发现使用该培养基后杂蛋白的数量也增多。相比之下,BMG/BMM培养基是以含硫酸铵、无氨基酸的YNB作为氮源,甲醇是其唯一碳源;这使发酵培养液的成分大大简化,也方便了重组毕赤酵母产物的后续处理。鉴于此,本研究在实验室摇瓶发酵阶段使用BMM培养基,通过构建的重组毕赤酵母菌株成功实现了小分子IPBD的分泌表达,为以后使用该培养基进行高密度发酵奠定了基础。另一方面,大规模生产时考虑到成本及操作上的可行性,是不可能对培养液上清进行纯化处理的,因此培养液上清是否具有抑菌活性就显得至关重要。本研究使用浓缩的含重组IPBD的培养液上清与3种细菌作用,结果显示无论平板涂布法还是比浊度法都证明其具有明显的抑制革兰氏阳性的金黄色葡萄球菌、单增李斯特菌以及革兰氏阴性的铜绿假单胞菌的活性,这意味着重组菌株X-33/pPICZαA-IPBD的培养液上清可直接作为生产天然抗菌剂的原液而无需对其进行繁琐的纯化处理,可大大简化产品的生产工艺以符合大规模生产的要求。后续将在本研究的基础上聚焦于构建含多拷贝基因表达盒的表达载体,以期提高重组IPBD的产量。
4 结论本研究首次构建了产斑点叉尾鮰β-防御素的重组毕赤酵母菌株,其在BMM培养基中的最适发酵培养条件为:28 ℃、250 r/min、1.0%甲醇诱导表达96 h;在此条件下重组IPBD的表达量为2 mg/L。重组菌株X-33/pPICZαA-IPBD的培养液上清具有明显抑制革兰氏阳性的金黄色葡萄球菌、单增李斯特菌以及革兰氏阴性的铜绿假单胞菌的活性。本研究为鱼类来源天然小分子抗菌肽的开发提供了参考。
参考文献
| [1] | Yu XB, Guo SL, Wu CL, et al. Advance in defensins. Progr Vet Med, 2006, 27(8): 47-51 (in Chinese). 余兴邦, 郭锁链, 乌翠兰, 等. 防御素研究进展. 动物医学进展, 2006, 27(8): 47-51. DOI:10.3969/j.issn.1007-5038.2006.08.013 |
| [2] | Klüver E, Adermann K, Schulz A. Synthesis and structure-activity relationship of β-defensins, multi-functional peptides of the immune system. J Pept Sci, 2006, 12(4): 243-257. DOI:10.1002/psc.749 |
| [3] | Krishnakumari V, Sharadadevi A, Singh S, et al. Single disulfide and linear analogues corresponding to the carboxy-terminal segment of bovine β-defensin-2: effects of introducing the β-hairpin nucleating sequence D-pro-gly on antibacterial activity and biophysical properties. Biochemistry, 2003, 42(31): 9307-9315. DOI:10.1021/bi034403y |
| [4] | Selsted ME, Tang YQ, Morris WL, et al. Purification, primary structures, and antibacterial activities of beta-defensins, a new family of antimicrobial peptides from bovine neutrophils. J Bio Chem, 1993, 268(9): 6641-6648. |
| [5] | Bensch KW, Raida M, M?gert HJ, et al. hBD-1: a novel β-defensin from human plasma. FEBS Lett, 1995, 368(2): 331-335. DOI:10.1016/0014-5793(95)00687-5 |
| [6] | Aghaei S, Saffar B, Ghaedi K, et al. Functional analysis of recombinant codon-optimized bovine neutrophil β-defensin. J Adv Res, 2016, 7(5): 815-821. DOI:10.1016/j.jare.2015.12.003 |
| [7] | Zhao XY, Ma H, Zhao L, et al. Secreted expression of chicken β-gallinacin-3 in Pichia pastoris and biological activities etection. Chin J Prev Vet Med, 2009, 31(1): 24-27 (in Chinese). 赵绪永, 马辉, 赵丽, 等. 鸡β-防御素-3在毕赤酵母中的分泌表达及其生物活性测定. 中国预防兽医学报, 2009, 31(1): 24-27. |
| [8] | Jin JY, Zhou L, Gui JF. The Yeast expression of grouper β-defensin and antibacterial activity of the recombinant protein. Acta Hydrobiol Sin, 2011, 35(5): 739-744 (in Chinese). 金俊琰, 周莉, 桂建芳. 石斑鱼β-防御素的酵母表达及其产物抗菌活性分析. 水生生物学报, 2011, 35(5): 739-744. |
| [9] | Zhang J, Chen SS, He YH, et al. Molecular cloning, sequence analysis and expression pattern of β-defesin 1 in Megalobrama amblycephala. J Huazhong Agric Univ, 2015, 34(3): 97-103 (in Chinese). 张涓, 陈思思, 何玉慧, 等. 团头鲂β-防御素1基因cDNA的克隆、序列分析及表达特征. 华中农业大学学报, 2015, 34(3): 97-103. |
| [10] | Zhu JY, Wang H, Wang J, et al. Identification and characterization of a β-defensin gene involved in the immune defense response of channel catfish, Ictalurus punctatus. Mol Immunol, 2017, 85: 256-264. DOI:10.1016/j.molimm.2017.03.009 |
| [11] | Li ZG, Moy A, Sohal K, et al. Expression and characterization of recombinant human secretory leukocyte protease inhibitor (SLPI) protein from Pichia pastoris. Protein Expr Purif, 2009, 67(2): 175-181. DOI:10.1016/j.pep.2009.06.001 |
| [12] | Daly R, Hearn MTW. Expression of heterologous proteins in Pichia pastoris: a useful experimental tool in protein engineering and production. J Mol Recognit, 2005, 18(2): 119-138. |
| [13] | Wang ZY, Li N, Su TT. Purification and Anti-bacterial activity evaluation of anti-bacterial peptides from skin of Rana chensinensis. Food Sci, 2010, 31(3): 132-135 (in Chinese). 王战勇, 李宁, 苏婷婷. 中国林蛙皮抗菌肽的提取纯化及抑菌活性检测. 食品科学, 2010, 31(3): 132-135. |
| [14] | Xu L, Jiang XQ, Yang JK, et al. Cloning of a novel lipase gene, lipJ08, from Candida rugosa and expression in Pichia pastoris by codon optimization. Biotechnol Lett, 2010, 32(2): 269-276. DOI:10.1007/s10529-009-0141-z |
| [15] | Deng T, Ge HR, He HH, et al. The heterologous expression strategies of antimicrobial peptides in microbial systems. Protein Expres Purif, 2017, 140: 52-59. DOI:10.1016/j.pep.2017.08.003 |
| [16] | Teng D, Xi D, Zhang J, et al. Multiple copies of the target gene enhances plectasin secretion in Pichia pastoris X-33. Process Biochem, 2015, 50(4): 553-560. DOI:10.1016/j.procbio.2015.01.010 |
| [17] | Zhao H, Tang JY, Cao L, et al. Characterization of bioactive recombinant antimicrobial peptide parasin I fused with human lysozyme expressed in the yeast Pichia pastoris system. Enzyme Microb Technol, 2015, 77(3): 61-67. |
| [18] | Invitrogen Corperation, pPICZαA, B, and C Pichia expression vectors for selection on ZeocinTM and purification of secreted, recombinant proteins.[EB].[2019-11-18]. http://www.doc88.com/p-2078106003031.html. |
