

东北林业大学东北盐碱地植被恢复与重建教育部重点实验室 生命科学学院,黑龙江 哈尔滨 150040
收稿日期:2019-12-17;接收日期:2020-03-12;网络出版时间:2020-04-03
基金项目:中央高校基本科研业务费专项资金(Nos. 2572014EA03,25720200Y15),黑龙江省自然科学基金(No. C2018002)资助
通讯作者:Qijiang Xu. Tel: +86-451-82191783; E-mail: qijiangxu@126.com.
摘要:对穗醋栗花色苷合成的分子机理知之甚少。拟探究穗醋栗花色苷合成关键基因dfr对不同颜色醋栗花色苷的影响,以黑穗醋栗(Ribes nigrum L.)、红穗醋栗(Ribes rubrum L.)和白穗醋栗(Ribes albrum L.)果实为试材,通过RACE方法克隆二氢黄酮醇4-还原酶(dfr)基因cDNA全长序列,分别命名为Rndfr、Rrdfr和Radfr (KY786100、KY786101和KY786102)。系统发育分析表明,Rndfr、Rrdfr和Radfr在进化上具有较高的同源性。测定果实发育不同时期的花色苷含量,结果显示,黑穗醋栗和红穗醋栗花色苷含量较高且随着果实的发育成熟而逐渐增加。而白色醋栗中花色苷含量极低,几乎检测不到花色苷。定量PCR分析表明,dfr在黑穗醋栗中的表达量在果实成熟的各个时期均高于红穗和白穗醋栗。随着果实直径不断变大和果皮着色加深,在黑穗醋栗中,dfr的表达量总体呈现持续上升的趋势;在红穗醋栗中,果实着色约75%时dfr的表达量最高,之后下降;在白穗醋栗中,dfr的表达量总体呈现下降趋势,其表达量最低。推测dfr基因在醋栗果实呈色中发挥作用。
关键词:穗醋栗花色苷dfr基因表达
Cloning and expression of dfr in Ribes L. during fruit maturation
Xue Liu, Qiuying Feng, Linlin Yang, Qijiang Xu


Key Laboratory of Saline-Alkali Vegetation Ecology Restoration, Ministry of Education, College of Life Sciences, Northeast Forestry University, Harbin 150040, Heilongjiang, China
Received: December 17, 2019; Accepted: March 12, 2020; Published: April 3, 2020
Supported by: The Fundamental Research Funds for the Central Universities (Nos. 2572014EA03, 25720200Y15), Natural Science Foundation of Heilongjiang Province, China (No. C2018002)
Abstract: Little is known about the molecular mechanism of currant anthocyanin synthesis. We investigated the effect of dfr, a key gene for anthocyanin synthesis in currant, on anthocyanins of different color currant. Black currant (Ribes nigrum L.), red currant (Ribes rubrum L.) and white currant (Ribes albrum L.) were used as test materials to determine the anthocyanin content at different stages of fruit development. Three full-length cDNA sequences of dfr gene were cloned by RACE (Rapid amplification of cDNA ends), and named as Rndfr, Rrdfr and Radfr. Phylogenetic analysis shows that Rndfr, Rrdfr and Radfr had high homology in evolution. The determination of anthocyanin content in different stages of fruit development shows that the content of anthocyanin in black currant and red currant was higher and gradually increased with the ripening of the fruit. While the content of anthocyanin in white currant was extremely low, and almost no anthocyanin was detected. Quantitative RT-PCR analysis shows that the expression level of dfr in black currant was higher than red currant and white currant in each period of fruit development. As the diameter of the fruit increased and the color of the peel deepened, the expression level of dfr in the black currant showed an increasing trend. In the red currant, the expression level gradually increased until the period of 75% fruit color, then the Rrdfr decreased rapidly. In white currant, the overall trend showed a downward trend, and its expression level was the lowest. All the results suggest that dfr gene plays a role in the process of fruit color.
Keywords: Ribes L.anthocyaninsdfrgene expression
自然条件下,花色素以花色苷形式积累于植物的花、果实、叶、茎的表皮以及皮下细胞层中[1],是植物新陈代谢过程中产生的次级代谢产物,属类黄酮化合物。
花色苷的生物合成主要分为3个阶段,是一个多酶途径[2]。在花色苷多酶合成途径中,二氢黄酮醇4-还原酶(Dihydroflavonol-4-reductase)发挥着重要的作用,它是最终形成色素的第一个关键酶,决定植物花、果实、叶片等器官的着色[3]。Dfr是一种关键的氧化还原酶,在产生和浓缩花青素中起关键作用[4]。Dfr属于NADPH依赖性短链还原酶家族[5],主要在花色苷合成途径后期发挥重要作用,催化二氢黄酮醇类物质在C4位发生立体特异的还原反应,决定花色苷的终产物类型。如将二氢堪非醇(Dihydrokaempferol,DHK)催化为无色花葵素,将二氢榭皮素(Dihydroquercetin,DHQ)催化为无色花青素,将二氢杨梅黄(Dihydromyricetin,DHM)催化为无色翠雀素等[6-7]。有研究表明,烟草花中不同dfr基因的过表达促进了花青素的生物合成,增加了红色素的沉着[8]。dfr基因的失活导致了大麦和拟南芥突变体中花青素和原花青素的损失[9-10]。在拟南芥中,缺乏dfr活性的tt3 (透明种皮)突变体未能在其种皮中积累原花青素的褐色单宁。此外,抑制dfr在甘薯中的表达导致其花青素积累减少并降低了其对非生物胁迫的耐受性[11]。Dfr不仅调节花青素的水平,还对底物有选择特异性,导致不同类型花青素的积累,例如矮牵牛和大花蕙兰不能产生基于天竺葵素的橙色花,这表明Dfr对底物的选择有差异[12]。根据文献所知,迄今为止已从日本莲[7]、海棠、西洋梨[13]、脐橙[14]、甘薯[11]、银杏[15]等多种植物中分离出各种dfr基因如。
穗醋栗是茶藨子科(Grossulariaceae)茶藨子属(Ribes L.)小灌木,原产于欧洲,栽培较广泛,一共有150多种,在中国主要分布在东北三省以及华北地区等,约有46种。穗醋栗果实属于浆果,除鲜食外,主要用于加工果汁、果酱、果酒,也可做清凉饮料,含有大量的维生素C和花色苷等物质,具有较大的经济价值和营养价值[16]。目前,对穗醋栗花色苷合成的分子机理知之甚少。因此,本研究以黑穗醋栗、红穗醋栗和白穗醋栗为试材,深入探究醋栗花色苷合成关键基因dfr,为不同穗醋栗花色苷合成差异的分子机理奠定研究基础。
1 材料与方法1.1 试验材料以采摘自东北农业大学的5个生长发育时期的黑穗醋栗、红穗醋栗和白穗醋栗果实为试验材料(图 1),分别采摘于2017年5月上旬至7月末,液氮速冻,置于?80 ℃保存使用。
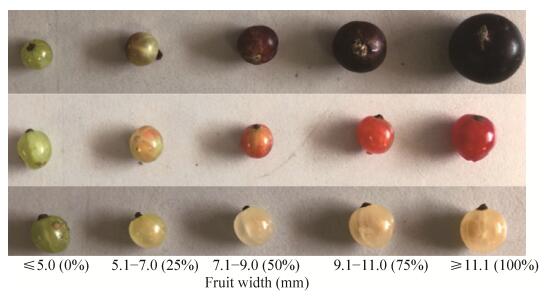 |
| 图 1 不同生长发育时期的穗醋栗果实 Fig. 1 Fruit of Ribes L. in different growing stage. From top to bottom were R. nigrum L., R. rubrum L. and R. albrum L., the color change degree of Ribes L. is indicated by numbers in brackets. |
| 图选项 |
1.2 果皮中花色苷含量分析参考王惠聪等[17]和Pirie等[18]描述的方法,分别取黑穗醋栗、红穗醋栗和白穗醋栗5个生长时期的果实果皮,切碎混合作为样品备用,利用分析天平分别称取每个时期0.5 g鲜样果皮,放入10 mL 1%的HCl甲醇缓冲液避光抽提2 h,在553 nm处用分光光度计测定提取液的吸光值,同时,在600 nm处也进行吸光值的测定,花色苷相对含量为两处吸光值之差,差值每增加0.1产生一个单位U,U=(OD553?OD600)×10。每个样品设定3个重复。花色苷的总含量单位为mg/100 g。
1.3 RNA提取及基因克隆总RNA的提取采用购自北京Bioteke生物技术有限公司的植物通用总RNA试剂盒,利用P19E (表 1)和购自北京全式金生物技术有限公司的反转录试剂盒进行反转录得到cDNA,进行特异性扩增。
表 1 穗醋栗dfr基因克隆及表达分析引物Table 1 Cloning and expression analysis primers of Rndfr, Rrdfr and Radfr
| Primer name | Primer sequence (5'–3') |
| P18E | GACTCGAGTGCACATCG |
| P19E | GACTCGAGTGCACATCG(T)17 |
| Anchor | GGCCACGCGTCGACTAGTAC(T)17 |
| Adaptor | GGCCACGCGTCGACTAGTAC |
| dfr-3' RACE | ATGCCTCCAAGCCTCATAA |
| dfr-5' RACE-GSP1 | GGGCTGCTGTCCTCAACGTCTT |
| dfr-5' RACE-GSP2 | GGACAAACTCCTATAAGGCAAA |
| Radfr-RT-F | GCCTCCAAGCCTCATAAC |
| Radfr-RT-R | GCATCACAAGCAGAGCACA |
| Rndfr-RT-F | TAACCGGACTTTCGCCAA |
| Rndfr-RT-R | AGCAAATGTAGCGTCCCTT |
| Rrdfr-RT-F | GCCTCCAAGCCTCATAAC |
| Rrdfr-RT-R | GCATCACAAGCAGAGCACA |
| Actin-R | CTCACTGAAGCTCCTCTCAACCCAAAG |
| Actin-F | CCGTCTCCAGAGTCCAGAACAATAC |
表选项
穗醋栗dfr基因3'-cDNA序列采用cDNA末端快速扩增(Rapid amplification of cDNA ends, RACE)法来获得,在NCBI (https://www.ncbi.nlm.nih.gov/)数据库中查找已发表的苹果、梨等dfr基因的cDNA序列,以此来设计克隆3′-cDNA序列所需引物(表 1)。20 μL反应体系如下:10×TransTaq HiFi缓冲液Ⅱ 2 μL,浓度为2.5 mmol/L的dNTP Mixture 2 μL,模板cDNA 1 μL,浓度为20 μmol/L上下游引物(P18E和dfr-3'RACE)各0.4 μL,TransTaq HiFi聚合酶0.2 μL (5 U/μL),其余用蒸馏水补充。反应程序:95 ℃预变性5 min;94 ℃变性30 s,53 ℃ (Rndfr)、53 ℃ (Rrdfr)、54 ℃ (Radfr)退火30 s,72 ℃延伸1 min,30个循环;最后72 ℃延伸7 min,4 ℃保存。使用pEASY-T5 Cloning Kit载体试剂盒将回收纯化的目的片段与购自北京全式金生物技术有限公司的pEASY-T5载体进行连接反应,送至新海基因检测公司测序。
再依据测序所得3′端序列设计5′RACE引物(表 1)用于巢式PCR。利用锚定引物Anchor (表 1)和dfr-5′RACE-GSP1以加dA尾的cDNA为模板进行5′ Outer PCR,再用锚定引物Adaptor和dfr-5′ RACE-GSP2进行5′ Inner PCR扩增,克隆穗醋栗dfr基因5′RACE序列,其反应体系和目的片段的回收纯化、连接转化以及测序都与3′RACE相同。
1.4 生物信息学分析将获得花色苷合成相关基因的核苷酸序列在NCBI网站的核苷酸数据库中分析;使用ORF finder工具推导基因开放阅读框,在NCBI的保守结构域(CDD)数据库(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)中对得到的氨基酸序列进行保守结构域预测,从而确定功能结构域。用MEGA6.0软件以邻近相连法(neighbor joining,NJ)构建系统发育树。
1.5 实时荧光定量分析分别提取3种穗醋栗5个不同发育时期的果实的RNA,用购自宝生物工程(大连)有限公司的PrimeScriptTM RT reagent Kit Perfect Real Time试剂盒进行反转录。分别取稀释后的穗醋栗果实不同发育时期反转录产物cDNA,使用实时定量PCR引物(表 1)和ABI7500 PCR仪进行Rndfr、Rrdfr和Radfr的实时定量PCR分析。20 μL实时定量分析反应体系如下:由1 μg cDNA加200 μL水稀释的cDNA模板8.4 μL,各0.8 μL浓度为20 μmol/L实时定量上下游引物以及10 μL Power SYBR? Green PCR Master Mix(2×)。反应程序为:95 ℃预变性2 min;95 ℃ 10 s,60 ℃ 45 s,进行40个循环。三种穗醋栗dfr基因的相对表达水平使用2-△△Ct法来分析,Actin表达水平为内参,每个样品的内参基因和目标基因的PCR反应均同时完成,且设有3个生物学重复。
2 结果与分析2.1 穗醋栗果皮花色苷含量分析如图 2和图 3所示,花色苷含量最低的果皮为白穗醋栗,花色苷含量最高的为黑穗醋栗。随着果实逐渐变大,果皮颜色逐渐加深,白穗醋栗花色苷含量一直极低,红穗和黑穗醋栗中花色苷含量也逐渐增加,且红穗醋栗果皮中的花色苷含量与黑穗醋栗的相差甚远。果皮转色完全时,白穗醋栗果皮中花色苷含量是红穗醋栗的近4 000分之一,是黑穗醋栗的近万分之一。
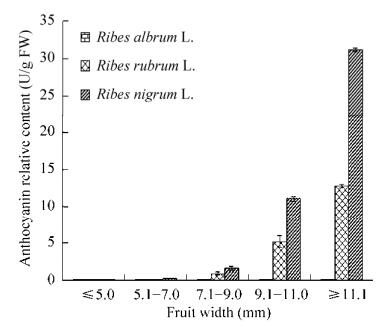 |
| 图 2 三种穗醋栗不同发育阶段果皮花色苷含量变化 Fig. 2 Variation of anthocyanins contents in peel of Ribes L. during maturing. |
| 图选项 |
 |
| 图 3 白穗醋栗不同发育阶段果皮花色苷含量变化 Fig. 3 Variation of anthocyanins contents in peel of R. albrum during maturing. |
| 图选项 |
2.2 穗醋栗dfr基因的全长cDNA克隆及序列分析利用RACE法克隆得到黑穗醋栗Rndfr (GenBank登录号为KY786100)、红穗醋栗Rrdfr (GenBank登录号为KY786101)和白穗醋栗Radfr (GenBank登录号为KY786102)的cDNA全长。Rndfr基因全长1 279 bp,开放阅读框长度1 014 bp,编码337个氨基酸;Rrdfr基因全长1 283 bp,开放阅读框长1 059 bp,编码352个氨基酸;Radfr基因全长1 325 bp,开放阅读框长1 059 bp,编码352个氨基酸。由SOPMA预测的Dfr蛋白的二级结构可知,Rndfr、Rrdfr和Radfr编码的氨基酸残基中,α螺旋分别占34.42%、36.36%和36.08%,延伸链分别占23.74%、20.74%和21.02%,β转角分别占12.46%、10.23%和9.94%,不规则卷曲分别占29.38%、32.67%和32.95%。
多重氨基酸比对结果如图 4所示,3种穗醋栗Dfr的氨基酸序列一致性达到了93%,与草莓、百脉根和柑橘等其他20种植物Dfr的同源性都在80%左右。此外3种穗醋栗dfr编码的蛋白质是NADPH依赖型的还原酶,在其N端具有两个高度保守结构域,其中一个是NADPH结合结构域,另一个是底物特异性结合结构域,经分析属于NADB-Rossmann超基因家族(NADB-Rossmann superfamily),可使黄烷酮醇发生还原反应,生成无色花色素。试验分离得到Dfr第134位氨基酸均为缬氨酸(V),属于非Asn/Asp型Dfr。
 |
| 图 4 穗醋栗Dfr与其他植物Dfr氨基酸多序列比对结构域部分 Fig. 4 Alignment domain part of the predicted amino acid sequences of RnDfr, RrDfr and RaDfr in Ribes L. and those of several other plants. The 134th amino acid in the red part of the currant Dfr shown in the picture is valine, which is a non-Asn/AspDfr. ViDfr: Vitis rotundifolia, AGJ70142.1; NgDfr: Nekemias grossedentata, AGO02174.1; VvDfr: Vitis vinifera, NP_001268144.1; LfDfr: Liquidambar formosana, AGT28278.1; PyDfr: Pyrus pyrifolia, AFF60412.1; MdDfr: Malus domestica, AAO39816.1; PcDfr: Pyrus communis, AAO39818.1; CmDfr: Crataegus monogyna, AAX16491.1; PaDfr: Prunus avium, AHL45016.1; PrDfr: Prunus cerasus, AJO67978.1; LcDfr: Lotus corniculatus, AAV71171.1; PlDfr: Paeonia lactiflora, AFI71899.1; RoDfr: Rosa rugosa, AIU34714.1; CsDfr: Citrus sinensis, NP_001275860.1; MiDfr: Mangifera indica, AIY25001.1; PsDfr: Paeonia suffruticosa, AMW36065.1; FaDfr: Fragaria x ananassa, AHL46451.1; FvDfr: Fragaria vesca, AHL46448.1; PzDfr: Pelargonium zonale, BAI78343.1; AkDfr: Acacia koa, AOX49226.1. |
| 图选项 |
将穗醋栗dfr基因和其他植物dfr基因的氨基酸序列通过MEGA6.0软件构建系统发育树,使穗醋栗dfr基因与其他植物dfr基因之间的进化关系更加清晰。图 5结果表明,大麦和欧洲水仙聚为一支,其余37个物种聚为另一支。三种穗醋栗Dfr蛋白与芍药、牡丹、葡萄、枫香树、天竺葵和藤茶聚在一类,且序列一致。
 |
| 图 5 以邻位相连法构建的Dfr蛋白系统进化树 Fig. 5 The construction of phylogenetic tree based on Dfr protein by the Neighbor-joining method. Bootstrap verification indicates that the percentage (%) of the credibility of the branch is marked at the joint. Scale bar indicates the length of the branch. |
| 图选项 |
2.3 穗醋栗dfr基因的表达分析分析dfr基因在3种穗醋栗中相对表达量,实时荧光定量结果如图 6所示,在黑穗醋栗中,随着果实不断成熟Rndfr的表达量明显高于红穗醋栗和白穗醋栗,在果皮转色达到50%之前(果径≤9.0 mm)其表达量增加较为缓慢,后期迅速增加,当果实完全成熟时(果径≥11.1 mm),其表达量达到最大值。
 |
| 图 6 穗醋栗dfr的相对表达量 Fig. 6 Relative expression levels of Rndfr, Rrdfr and Radfr. |
| 图选项 |
在红穗醋栗中,随着果皮颜色不断加深,Rrdfr的表达量也不断增加,在转色达到75% (果径9.1–11.0 mm)时的Rrdfr表达量是转色达到50% (果径7.1–9.0 mm)时的4倍,当转色完全时,虽花色苷含量仍在积累,但Rrdfr的表达量却迅速下降。
在白穗醋栗中,果实成熟过程中几乎检测不到Radfr的存在,在果实发育初期该基因的表达量最高,果实完全成熟(果径≥11.1 mm)时期,其表达量最低。
3 讨论本研究利用RACE技术克隆了穗醋栗dfr基因,将Rndfr、Rrdfr和Radfr编码氨基酸序列与其他植物Dfr进行多重氨基酸序列比对,结果显示它们均有高度保守的NADPH结合位点和底物特异性结合位点,属于NADB超基因家族[19]。有研究表明不同物种中Dfr的底物种类与Dfr底物结合区的氨基酸序列有关[20-21]。玫瑰[12]和葡萄风信子[22-23]等物种中的Dfr蛋白同样具有上述两种结构域。研究表明,大多数植物Dfr的第134位氨基酸是天冬酰胺(Asn),因此被称为Asn型Dfr,如蔓越橘等多种植物Dfr都属于此类;第二类,其134位的氨基酸是天冬氨酸(Asp),被称为Asp型Dfr,它不能有效地把DHK还原为无色花葵素,如矮牵牛和兰花;第三类第134位氨基酸既不是天冬酰胺也不是天冬氨酸,被称为非Asn/Asp型Dfr[8]。此外,底物的特异性和表达水平的不同,也是影响各种植物出现花色和果实颜色多样性的重要因素[5]。本研究所获得Rndfr、Rrdfr和Radfr属于Asp型,但3种醋栗的表型却大不相同,推测这可能是存在其他参与花色苷合成的结构基因及转录因子调控dfr基因表达,也可能是由于Dfr催化底物异构化的原因。
dfr表达的实时荧光定量PCR结果表明,5个时期中dfr基因在3种穗醋栗果实中都有表达,而且均为黑穗醋栗和红穗醋栗的整体表达水平显著高于白穗醋栗。Rndfr和Radfr的表达量与花色苷含量变化趋势一致。研究者对葡萄dfr基因进行表达分析发现该基因的表达量与花色苷积累呈正相关[16];Smdfr在紫长茄和圆白茄表达也发现紫长茄表达量要大于圆白茄,且在紫长茄成熟期的紫色果皮中,表达量最大[24];穗醋栗果实从青果时期到转色程度为75% (果径9.1–11.0 mm)为止Rrdfr的表达量逐渐增加,逐渐进入果实成熟期后,花色苷含量仍增加,但Rrdfr的表达量却发生下降,说明在果实发育过程中,果实花色苷积累是众多结构基因和转录因子协同合作的结果。花色苷生物合成途径一般分为3个阶段,分别是苯丙烷途径阶段、类黄酮代谢的关键反应阶段和各种花青素合成阶段,为了最后得到稳定的花色苷,花青素需经过一系列糖基化、甲基化、酰基化的修饰。花色苷的合成也是一个多酶途径,Pal (苯丙氨酸裂解酶)是花色苷合成途径的起始酶,Chs (查尔酮合酶)是黄酮类化合物合成途径中起着重要的作用且是第一个关键酶和限速酶,F3h (黄烷酮3-羟化酶)是花色苷多酶生物合成途径中处于Chs和Chi (查耳酮异构酶)下游的第3个关键酶、Ans/Ldox (花色苷合成酶/无色花色苷双加氧酶)是花色苷合成途径末端的另一关键酶以及Ufgt (类黄酮3-O-葡糖基转移酶)是花色苷合成途径中最后一个酶,所以3种醋栗果实颜色差异是否仅由dfr基因的表达所决定需要进一步深入研究。在紫色胡萝卜中,花色苷的积累受到Dcmyb6的调控作用[25];在葡萄中,花色苷的积累受到chi和ufgt表达水平的影响,而chi和ufgt的表达分别受VvmybPA1和VvmybA2调控[26-27];Pgmyb能促进石榴果实花色苷积累[28]等。后续试验应对参与花色苷合成的主要结构基因及转录因子进行克隆及表达分析,同时解析Rndfr、Rrdfr和Radfr与上游结构基因的调控关系, 为阐明穗醋栗果实颜色差异及花色苷合成的分子机制奠定基础。
参考文献
| [1] | Zhao SX, Yu ZY, Li XG. Research progress in anthocyanin in blackcurrant. Sci Technol Food Ind, 2010, 31(1): 446-448 (in Chinese). 赵晟锌, 于泽源, 李兴国. 黑穗醋栗花色苷研究进展. 食品工业科技, 2010, 31(1): 446-448. |
| [2] | Zhang YJ, Hu ZL, Chu GH, et al. Anthocyanin accumulation and molecular analysis of anthocyanin biosynthesis-associated genes in eggplant (Solanum melongena L.). J Agric Food Chem, 2014, 62(13): 2906-2912. |
| [3] | Winkel-Shirley B. Flavonoid biosynthesis. A colorful model for genetics, biochemistry, cell biology, and biotechnology. Plant Physiol, 2001, 126(2): 485-493. |
| [4] | Holton TA, Cornish EC. Genetics and biochemistry of anthocyanin biosynthesis. Plant Cell, 1995, 7(7): 1071-1083. |
| [5] | Zhao QM, Li F, Li P. Research advances on core enzymes of anthocyanidin biosynthesis. Biotechnol Bull, 2012, 28(12): 25-32 (in Chinese). 赵启明, 李范, 李萍. 花青素生物合成关键酶的研究进展. 生物技术通报, 2012, 28(12): 25-32. |
| [6] | Jiao SZ, Liu YL, Lou Q, et al. Cloning and expression analysis of dihydroflavonol 4-reductase gene (DFR) from grape hyacinth (Muscari armeniacum). J Agric Biotechnol, 2014, 22(5): 529-540 (in Chinese). 焦淑珍, 刘雅莉, 娄倩, 等. 葡萄风信子二氢黄酮醇4-还原酶基因(DFR)的克隆与表达分析. 农业生物技术学学报, 2014, 22(5): 529-540. |
| [7] | Shimada N, Sasaki R, Sato S, et al. A comprehensive analysis of six dihydroflavonol 4-reductases encoded by a gene cluster of the Lotus japonicus genome. J Exp Bot, 2005, 56(419): 2573-2585. |
| [8] | Luo P, Ning GG, Wang Z, et al. Disequilibrium of flavonol synthase and dihydroflavonol-4-reductase expression associated tightly to white vs. red color flower formation in plants. Front Plant Sci, 2016, 6: 1257. |
| [9] | Meldgaard M. Expression of chalcone synthase, dihydroflavonol reductase, and flavanone-3-hydroxylase in mutants of barley deficient in anthocyanin and proanthocyanidin biosynthesis. Theoret Appl Genet, 1992, 83(6/7): 695-706. |
| [10] | Shirley BW, Kubasek WL, Storz G, et al. Analysis of Arabidopsis mutants deficient in flavonoid biosynthesis. Plant J, 1995, 8(5): 659-671. |
| [11] | Wang HX, Fan WJ, Li H, et al. Functional characterization of dihydroflavonol-4-reductase in anthocyanin biosynthesis of purple sweet potato underlies the direct evidence of anthocyanins function against abiotic stresses. PLoS ONE, 2013, 8(11): e78484. |
| [12] | Johnson ET, Ryu S, Yi H, et al. Alteration of a single amino acid changes the substrate specificity of dihydroflavonol 4-reductase. Plant J, 2001, 25(3): 325-333. DOI:10.1046/j.1365-313x.2001.00962.x |
| [13] | Fischer TC, Halbwirth H, Meisel B, et al. Molecular cloning, substrate specificity of the functionally expressed dihydroflavonol 4-reductases from Malus domestica and Pyrus communis cultivars and the consequences for flavonoid metabolism. Arch Biochem Biophys, 2003, 412(2): 223-230. |
| [14] | Lo Piero AR, Puglisi I, Petrone G. Gene characterization, analysis of expression and in vitro synthesis of dihydroflavonol 4-reductase from [Citrus sinensis (L.) Osbeck]. Phytochemistry, 2006, 67(7): 684-695. |
| [15] | Cheng H, Li LL, Cheng SY, et al. Molecular cloning and characterization of three genes encoding dihydroflavonol-4-reductase from Ginkgo biloba in Anthocyanin biosynthetic pathway. PLoS ONE, 2013, 8(8): e72017. |
| [16] | Qiao XY. The research and evaluation of the genetic resources of red currants[D]. Changchun: Jilin Agricultural University, 2011(in Chinese). 乔晓颖.红穗醋栗种植资源研究与评价[D].长春: 吉林农业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10193-1011150468.htm |
| [17] | Wang HC, Huang XM, Hu GB, et al. Studies on the relationship between anthocyanin biosynthesis and related enzymes in litchi pericarp. Scientia Agri. Sin, 2004, 37(12): 2028-2032 (in Chinese). 王惠聪, 黄旭明, 胡桂兵, 等. 荔枝果皮花青苷合成与相关酶的关系研究. 中国农业科学, 2004, 37(12): 2028-2032. |
| [18] | Pirie A, Mullins MG. Changes in anthocyanin and phenolics content of grapevine leaf and fruit tissues treated with sucrose, nitrate, and abscisic acid. Plant Physiol, 1976, 58(4): 468-472. |
| [19] | Mathews H, Clendennen SK, Caldwell CG, et al. Activation tagging in tomato identifies a transcriptional regulator of anthocyanin biosynthesis, modification, and transport. Plant Cell, 2003, 15(8): 1689-1703. |
| [20] | Zhou H, Wen JF, Deng MH, et al. Research progress in plant anthocyanidin biosynthesis genes. J China Capsicum, 2011, 11(4): 1-7 (in Chinese). 周惠, 文锦芬, 邓明华, 等. 植物花青素生物合成相关基因研究进展. 辣椒杂志, 2011, 11(4): 1-7. |
| [21] | Miosic S, Thill J, Milosevic M, et al. Dihydroflavonol 4-reductase genes encode enzymes with contrasting substrate specificity and show divergent gene expression profiles in Fragaria species. PLoS ONE, 2014, 9(11): e112707. |
| [22] | Jiao SZ. Cloning and expression analysis of DFR genes from grape hyacinths[D]. Yangling: Northwest A & F University, 2014(in Chinese). 焦淑珍.葡萄风信子DFR基因克隆及表达分析[D].杨凌: 西北农林科技大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10712-1014420367.htm |
| [23] | Li G, Li HH, Zhang YL, et al. Isolation, characterization and expression analysis of anthocyanidin synthase (ANS) gene in Paeonia ostii 'Feng Dan'. J Northeast For Univ, 2016, 44(7): 64-69 (in Chinese). 李果, 李厚华, 张延龙, 等. 凤丹牡丹ANS(PoANS)基因克隆、特性及表达. 东北林业大学学报, 2016, 44(7): 64-69. |
| [24] | Li X. Cloning and expression characterization of the athocyaninbiosynthesis key genes in eggplant (Solanum melongena L.) [D]. Shanghai: Shanghai Jiaotong University, 2011(in Chinese). 李翔.茄子花青素生物合成关键基因的克隆与表达分析[D].上海: 上海交通大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10248-1011268886.htm |
| [25] | Xu ZS, Feng K, Que F, et al. A MYB transcription factor, DcMYB6, is involved in regulating anthocyanin biosynthesis in purple carrot taproots. Sci Rep, 2017, 7: 45324. |
| [26] | Passeri V, Martens S, Carvalho E, et al. The R2R3MYB VvMYBPA1 from grape reprograms the phenylpropanoid pathway in tobacco flowers. Planta, 2017, 246(2): 185-199. |
| [27] | Niu TQ, Gao ZD, Zhang PF, et al. MYBA2 gene involved in anthocyanin and flavonol biosynthesis pathways in grapevine. Genet Mol Res, 2016, 15(4). DOI:10.4238/gmr15048922 |
| [28] | Khaksar G, Tabatabaei BES, Arzani A, et al. Functional analysis of a pomegranate (Punica granatum L.) MYB transcription factor involved in the regulation of anthocyanin biosynthesis. Iran J Biotechnol, 2015, 13(1): 17-25. |
