

1. 中国科学院植物研究所 北方资源植物重点实验室,北京 100093;
2. 中国科学院大学 生命科学学院,北京 100049
收稿日期:2019-08-21;接收日期:2019-10-28;网络出版时间:2019-11-11
基金项目:国家自然科学基金(Nos. 41977131, 31770298);国家重点研发计划(No. 2017YFD0800900)资助
作者简介:何振艳 ??中国科学院植物研究所副研究员,硕士生导师,植物对重金属响应机制和植物修复课题组负责人。中国植物生理学会修复生物学专业委员会委员,北京植物学会理事。迄今承担国家自然科学基金项目、国家重点研发计划、科技基础性工作专项、中国科学院战略性先导专项任务等多个项目。研究方向:利用分子生物学技术,结合遗传学、细胞生物学和蛋白质组学等方法研究植物重金属积累特性的分子机制,着重两方面的应用开发:基于稳定分子标记技术的低积累重金属安全作物新品种的培育;基于植物分子基础的重金属污染修复技术研发。近年来在Nature Communication、Journal of Hazardous Materials、New Phytologist、Journal of Proteomics等刊物上发表论文20余篇;获得国家专利10余项.
摘要:砷是一种毒性很强的类金属元素,土壤砷污染可引发一系列食品安全问题,进而威胁人类健康。蜈蚣草具有极强的富集砷的能力,在砷污染土壤的植物修复中具有重要的应用价值。深入阐释蜈蚣草超富集砷的分子机制是植物修复技术的核心理论基础。文中综述了蜈蚣草超富集砷的组学研究进展,以及目前鉴定到的砷富集过程中的重要分子元件,并对未来的研究方向和趋势进行了展望。
关键词:蜈蚣草砷超富集分子机制
Advances in molecular mechanisms of arsenic hyperaccumulation of Pteris vittata L.
Tian Zhang1,2, Huili Yan1, Zhenyan He1


1. Key Laboratory of Plant Resources, Institute of Botany, Chinese Academy of Sciences, Beijing 100093, China;
2. College of Life Sciences, University of Chinese Academy of Sciences, Beijing 100049, China
Received: August 21, 2019; Accepted: October 28, 2019; Published: November 11, 2019
Supported by: National Natural Science Foundation of China (Nos. 41977131, 31770298), National Key Research and Development Program of China (No. 2017YFD0800900)
Corresponding author: Zhenyan He. Tel/Fax: +86-10-62836690; E-mail:hezhenyan@ibcas.ac.cn.
Abstract: Arsenic is a toxic metalloid.Arsenic pollution in soils affects food safety and threatens human health.Pteris vittata L.has enormous application value in phytoremediation of arsenic-contaminated soil for its high arsenic hyperaccumulation ability.Understanding the arsenic hyperaccumulation molecular mechanism of P.vittata is the core theoretical basis of phytoremediation technology.This review introduces the omics study on arsenic hyperaccumulation mechanisms, as well as important molecular component that is involved in arsenic hyperaccumulation of P.vittata.Further research directions and trends are also discussed.
Keywords: Pteris vittata L.arsenichyperaccumulationmolecular mechanism
砷是一种自然界中广泛存在的类金属元素,由于其强毒性而被归类于重金属。随着社会发展,化石燃料的燃烧、砷矿的开采、含砷农药及化学制品的使用、工业废水的排放等人为因素,使得土壤中的砷浓度日益增加,引起了世界范围内不同程度的土壤砷污染问题。土壤中的砷可通过食物链富集到人体中,进而诱发皮肤癌和肺癌、肝癌等疾病[1]。目前,世界范围内的许多国家和地区面临着严峻的土壤砷污染问题。土壤砷污染对食品安全和人类健康已造成严重威胁。一些国家如波兰、墨西哥的砷污染区,土壤砷浓度甚至超出标准限值(24 mg/kg US EPA)的百倍以上[2]。我国是世界上砷污染最为严重的国家之一,尤其是湖南、云南、广西、广州、贵州等省份土壤砷污染程度更为突出[3]。土壤砷污染是全球共同面临的挑战,砷污染土壤的治理对人类健康具有重要意义。
蜈蚣草Pteris vittata L.是一种砷的超富集植物,具有极强的砷抗性和超富集砷的能力,可在砷浓度高达1500mg/kg的土壤中正常生长,地上部分积累的砷可达22630mg/kg,远高于一般常见植物(<10mg/kg)[4]。与非超富集砷的植物相比,蜈蚣草中的砷从根到地上部分的易位更为高效,砷的生物转移系数可达24,能迅速将砷富集到地上部分,从而增加砷的积累量[5]。蜈蚣草作为超富集砷的典型植物,以该植物为基础开发的植物修复技术,成本低、操作简单、不易造成二次污染,近年来已在我国蜈蚣草适生的河南、湖南和广西等地进行修复技术示范[6-8]。以蜈蚣草为研究对象,对其超富集砷的分子机制进行解析,阐释蜈蚣草对砷的转运和解毒机理,可为超富集砷的工程植株的改良和开发提供依据,是砷污染植物修复技术广泛应用的核心理论基础,该领域的研究已日益成为科研人员的关注热点。
1 蜈蚣草超富集砷的组学研究蜈蚣草基因组十分庞大,有研究人员推测蜈蚣草基因组大小约为4 834 Mb[9],分别为拟南芥和人类的40倍和1.6倍,且蜈蚣草细胞组成十分复杂,包括二倍体、三倍体、四倍体、五倍体和六倍体5种细胞型[10],基因组测序难度巨大,迄今未有基因组信息的报道。为了在组学水平上对蜈蚣草超富集砷的分子机制进行解析,Yan等[11]通过优化后的三代全长转录组(Single-molecular real-time,SMRT)策略,建立了一个蜈蚣草的全长转录组数据库。作为新一代的转录组测序技术,SMRT测序的读长可达50 kb,转录本的长度和完整性高于二代测序技术(Next-generation sequencing,NGS),已广泛应用于玉米和高粱等植物的研究中。然而,SMRT测序的单碱基错误率较高,对于有参物种,研究人员通过参考基因组对测序结果进行校正。由于基因组信息的缺乏,该策略无法运用于蜈蚣草。为了解决这一问题,Yan等[11]使用二代测序NGS高质量的短读长片段对SMRT的测序质量进行优化,显著提高了SMRT测序的准确率。通过优化后的二代结合三代全长转录组策略,构建了一个包含69 615个全长转录本、381个长链非编码RNA (Long non-coding RNA, lncRNA)、1 482个可变剪切事件的蜈蚣草全长转录组数据库。
蜈蚣草高效的砷转运和区隔化效率是其超富集砷的重要基础。为探究蜈蚣草转运砷的分子机制,研究人员对蜈蚣草砷处理前后地上和地下部分的差异基因进行了鉴定,结合基因注释、KEGG (Kyoto encyclopedia of genes and genomes)富集、WGCNA (Gene co-expression network analysis)等分析结果,发现了砷响应的226个转运蛋白,主要属于六大蛋白转运家族:砷抗性蛋白家族(ACR3)、ATP结合盒(ABC)超家族、P型ATP酶、主要协助转运蛋白超家族(MFS)、水通道蛋白家族MIP和硝酸盐转运蛋白3.1家族(NRT3.1)。相比于其他转运蛋白家族,该六大家族在砷处理后表达水平极高,暗示其可能作为蜈蚣草转运砷的重要成员发挥作用。
除转录组外,Shen等[12]利用碘克沙醇(Iodixanol)密度梯度离心的方法提取了蜈蚣草羽叶液泡膜,并通过轻重链标记的定量蛋白质组学技术检测了蜈蚣草羽叶液泡膜蛋白的表达情况。研究共鉴定得到1 512个液泡膜蛋白肽段信息,并初步在NCBI绿色植物数据库中鉴定到56种液泡膜蛋白,其中24种为转运蛋白,7种在砷处理条件下差异表达。差异表达的蛋白包括表达上调的TDT family蛋白、TerC family蛋白和PDR-like蛋白(ABCG转运蛋白家族),及表达下调的H+ pump、V-ATPase C、E和G亚基以及液泡V-PPase。Yan等[11]进一步在全长转录组数据库中对蜈蚣草液泡膜蛋白质组结果重新注释,结果共得到119个液泡膜转运蛋白。其中ATP结合盒(ABC)超家族、水通道蛋白家族MIP、主要协助转运蛋白超家族(MFS)、P型ATP酶这4个转运蛋白家族对砷响应且表达水平最高,暗示其可能在砷的液泡区隔化中起关键作用。以上研究为阐明蜈蚣草超富集砷的分子机制提供了新的候选基因,尤其对转运和区隔化机制提供了重要参考。
与非超富集植物相比,蜈蚣草的另一个特点是具有极高的砷抗性,暗示其在长期进化过程中蕴含着特殊的解毒机制帮助其缓解砷的毒害。通过对砷诱导表达的转录本进行聚类分析,Yan等[11]推测出两条新的砷抗性途径:错误折叠蛋白降解途径和谷胱甘肽(Glutathione,GSH)代谢途径。前人研究表明,重金属可引发植物细胞内蛋白的错误折叠,从而引发内质网胁迫,造成细胞损伤[13]。细胞通过内质网相关蛋白质降解(Endoplasmic reticulum-associated degradation,ERAD)途径与泛素蛋白酶体途径(Ubiquitin proteasome pathway,UPP)特异性地降解内质网中的错误折叠蛋白,缓解重金属的伤害[14]。通过蜈蚣草差异转录组分析,Yan等[11]发现砷处理后的蜈蚣草中内质网胁迫相关的基因并没有响应,而参与ERAD和UPP通路的基因在地上和地下组织中都上调表达。值得注意的是,这些基因在根中的表达量显著高于地上部分。根是与环境中砷直接接触的组织,错误折叠蛋白降解途径的上调表达,减少了砷引起的内质网胁迫,保证了根正常代谢活动的进行,从而使根系具有较强的抗砷能力。
除错误折叠蛋白降解途径外,砷与硫醇类化合物的络合作用也是许多植物中一种重要的砷解毒机制[15-16]。有生理实验表明蜈蚣草中的GSH含量高于非超富集植物,且GSH含量可随砷处理浓度增加而升高[17-19]。Yan等[11]对砷处理后相关转录本的表达量进行分析,发现砷处理后催化亚砷酸盐与GSH络合的谷胱甘肽S-转移酶(GST)表达上调。但是Zhao等[20]在蜈蚣草体内仅检测到少量As-GSH复合物的存在。因此,科研人员推测蜈蚣草中的砷以As-GSH络合物的形式进入液泡,但是由于液泡不含GST且As-GSH具有高度不稳定性,液泡中的络合物很快被降解。亚砷酸盐与GSH的高效络合-转运-降解途径可能也是蜈蚣草砷抗性的重要机制之一。
2 蜈蚣草超富集砷的分子元件砷在蜈蚣草中的积累主要涉及砷的吸收、砷的还原、砷的运输和砷的区隔化4个环节[21-24]。土壤中的砷主要以砷酸盐的形式通过根的吸收进入蜈蚣草体内,并在根中还原成亚砷酸盐[5, 25]。进入根中的砷少部分被区隔化到液泡和囊泡中,大部分通过细胞水平的短距离运输到达木质部附近,并通过木质部的装载进入中柱[26-27]。到达中柱的砷通过木质部导管介导的长距离运输到达地上部分,并通过液泡区隔化作用在羽叶的液泡中聚集[28-29]。目前,砷运输的分子元件还未见报道,其他环节均已鉴定得到部分相关分子元件。
2.1 砷的吸收环境中最常见的砷形态为无机态的砷酸盐(AsⅤ)和亚砷酸盐(AsⅢ),AsⅤ是在有氧条件下土壤中主要的砷形态,但也有少量AsⅢ存在[30]。蜈蚣草可同时吸收砷酸盐和亚砷酸盐,但对砷酸盐的吸收更为高效,研究人员推测可能是蜈蚣草中的转运蛋白对砷酸盐的亲和力更高[31]。蜈蚣草体内砷形态检测结果表明,在蜈蚣草根中,砷酸盐为主要形态,占根中总砷的40%–70%。而在羽叶中,砷大多以亚砷酸盐的形态存在,其含量为植株中总砷的70%–90%[32-34]。这表明砷主要以砷酸盐的形态被蜈蚣草根吸收,在向羽叶转运的过程中被还原为亚砷酸盐。
由于砷不是生命体必需的物质,尚未在植物中鉴定到砷的特异性吸收系统。砷的吸收途径都是通过模拟其他底物利用其转运通道进行转运,例如磷酸盐通道、葡萄糖和甘油通道等[35]。研究表明蜈蚣草砷酸盐作为磷酸盐的类似物,与磷酸盐的吸收存在明显竞争,增加磷酸盐处理浓度会减少蜈蚣草对砷酸盐的吸收,增加砷酸盐处理浓度会降低根中磷酸盐含量[36]。以73AsV作为同位素示踪剂的转运实验发现蜈蚣草遵循米氏动力学,利用磷酸转运蛋白吸收砷酸盐[37]。
已有研究证明在其他植物,例如水稻和拟南芥中,砷酸盐可通过磷酸盐转运蛋白Pht1 (Phosphate transporter 1)家族成员进行转运[38-39]。在蜈蚣草中,研究人员克隆得到了3个Pht1家族成员基因PvPht1;1、PvPht1;2和PvPht1;3[40]。在酵母体系中对其进行功能验证,结果发现转化PvPht1;3的酵母表现出对砷酸盐敏感的表型,且对砷酸盐的积累量增加,说明PvPht1;3蛋白具有砷酸盐转运能力。将其与拟南芥AtPht1;5蛋白的功能进行比较,结果表明前者具有比后者更高的砷酸盐转运效率。放射性标记摄取实验表明PvPht1;3蛋白对砷酸盐的亲和力远高于AtPht1;5蛋白,进一步表明PvPht1;3是一个具有高亲和的砷酸盐转运蛋白,可能在蜈蚣草对砷酸盐的高效吸收机制发挥了重要作用。将PvPht1;3基因在烟草中异源表达,可增强烟草对砷酸盐的吸收和转运,提高地上部分对砷酸盐的积累量[41],暗示PvPht1;3基因可作为提高修复植物对砷的富集能力的候选基因元件。
在亚砷酸盐的转运过程中,Wang等[36]发现磷酸盐的存在不影响亚砷酸盐的吸收,说明砷酸盐和亚砷酸盐以不同的方式被根吸收。在植物中,水通道蛋白被证明是植物亚砷酸吸收的主要途径之一[42]。植物的水通道蛋白超家族极为丰富,包括多个亚家族,如NIPs (26-like intrinsic proteins)、PIPs (Plasma membrane intrinsic proteins)、TIPs (Tonoplast intrinsic proteins)等。其中在高等植物如拟南芥、水稻中,NIPs被证明负责根部亚砷酸盐的吸收[27]。在蜈蚣草中,He等[43]克隆到一个介导亚砷酸盐吸收的蜈蚣草TIP类水通道蛋白PvTIP4;1。将PvTIP4;1基因在酵母中进行表达可增加酵母中砷的积累量,表明PvTIP4;1蛋白为砷转运通道。进一步将PvTIP4;1基因在拟南芥中异源表达,结果发现,转基因拟南芥对砷敏感且体内砷积累量显著增加。组织和亚细胞定位结果表明,PvTIP4;1蛋白主要定位于蜈蚣草根的质膜,推测PvTIP4;1基因介导蜈蚣草根部亚砷酸盐的吸收过程。
2.2 砷的还原蜈蚣草根中的主要砷形态为砷酸盐,羽叶中为亚砷酸盐,说明蜈蚣草砷代谢存在着砷酸盐还原的过程[44]。对蜈蚣草根状茎的砷形态检测结果表明,在根的表皮和皮层中,砷主要以AsⅤ形式存在,而从内皮层到维管束AsⅢ所占比例增加。因此研究人员推测根部砷酸盐的还原主要发生在根状茎的内皮层。砷从AsⅤ被还原为AsⅢ可能有助于其从根状茎细胞中的排出及木质部装载[45]。Wang等[25]的研究发现在低浓度砷处理的条件下,蜈蚣草根中积累的砷较少,AsⅢ优先于AsⅤ被装载转运至地上部分。但是当蜈蚣草根中的砷含量超越了根部的还原能力时,会出现AsⅤ和AsⅢ竞争性的装载转移,无法在根部还原的AsⅤ会直接转运至地上部羽叶中,并在羽叶中被还原。
微生物中的砷酸盐还原机制已被广泛研究,在原核生物中,AsⅤ通过砷酸还原酶ArsC被还原为AsⅢ[46]。在真核生物酿酒酵母中ACR2砷酸还原酶介导AsⅤ的还原[47]。迄今为止,ArsC蛋白家族在植物中还未有同源蛋白被鉴定得到,但ACR2家族在植物中的同源蛋白,如拟南芥AtACR2以及水稻OsACR2.1、OsACR2.2等,都被证明具有砷酸还原酶活性,介导了AsⅤ的还原[48-49]。Ellis等[50]也从蜈蚣草配子体中克隆到了砷酸还原酶基因PvACR2,将其转入还原酶基因ScACR2缺失的酵母突变体中,可抑制其对砷敏感和超积累的表型。PvACR2蛋白与ScACR2蛋白具有类似的砷酸还原酶活性,而其在拟南芥中的同源基因CDC25既有砷酸还原酶活性,又有磷酸酶活性,而PvACR2蛋白是一个缺乏磷酸酶活性的植物砷酸还原酶。另外,PvACR2蛋白在蜈蚣草配子体中的表达不受砷处理的影响,暗示了蜈蚣草的超富集砷的能力可能是一种组成型适应特征,而不是由环境诱导的应激反应。
然而,也有研究表明,将AtACR2在拟南芥中敲除或超表达不影响拟南芥中砷的氧化还原状态与拟南芥对砷的解毒和积累,ACR2在植物中可能不是砷氧化还原的关键酶[51]。另一项研究也证实了这一点,并通过全基因组关联分析,在拟南芥中鉴定到一个新型砷酸还原酶HAC1,可以催化根部外皮层中AsV的还原[52]。该蛋白的在水稻中的同家族成员如OsHAC1;1/2和OsHAC4也被证明是AsV的还原酶,在限制稻穗和籽粒中砷的积累方面起到重要作用[53-54],在蜈蚣草中尚未见其同源基因的报道。
此外,Rathinasabapathi等[55]从蜈蚣草cDNA文库中克隆了植物磷酸丙糖异构酶(TPI)的同源基因Pv4-8,该基因表达产物具有特异性磷酸丙糖异构酶(TPI)活性。转化Pv4-8基因的AsV大肠杆菌敏感菌株WC3110对AsV的抗性增强,且细胞内AsⅢ的积累量高于转入EcTPI基因的菌株。说明Pv4-8可能直接或间接参与了蜈蚣草体内AsV的还原。Cai等[56]在蜈蚣草中鉴定得到一个新的砷酸盐还原酶PvGSTF1。PvGSTF1基因编码phi类GST蛋白的成员,其表达量可受砷酸盐诱导上调,且可以互补ΔarsC砷酸还原酶大肠杆菌突变体功能。将PvGSTF1蛋白在体外纯化,测定到其具有砷酸还原酶活性,进一步证明了PvGSTF1基因在蜈蚣草中起到AsV还原的作用。
2.3 砷的区隔化蜈蚣草中转运到地上部分的AsⅢ绝大多数贮存在羽叶细胞的液泡膜中。Yang等[57]通过直接分离细胞壁、原生质体和液泡测定砷浓度的方法,对蜈蚣草愈伤组织细胞中砷的分布进行分析。发现愈伤组织中约94%的砷存在于原生质体中,其中91%存在于液泡中,表明液泡是蜈蚣草中砷的主要贮藏部位。通过能量色散X射线光谱仪(Energy dispersive X-ray spectroscopy,EDX)技术和X射线吸收谱学(X-ray absorption spectroscopy,XAS)技术等观察砷在蜈蚣草中的亚细胞原位分布,发现在砷处理的情况下,绝大部分砷会通过区隔化作用聚集到羽叶的液泡中[29, 33, 58]。
研究人员在蜈蚣草中鉴定得到2个ACR3亚砷酸盐外排基因同源物,分别为PvACR3和PvACR3;1。2个同源基因都参与了砷的区隔化过程,但具有不同的表达模式。Indriolo等[59]报道了蜈蚣草液泡膜定位的PvACR3基因编码一个同酵母中同源的亚砷酸盐外排蛋白,可互补酵母ScACR3缺失突变体的表型,将其在蜈蚣草配子体中敲除可导致配子体对亚砷酸盐敏感,说明PvACR3基因对蜈蚣草配子体砷耐受性有重要作用。亚细胞定位结果表明,PvACR3蛋白定位在配子体液泡膜上,预测其可能负责将亚砷酸盐泵到液泡中通过区隔化作用进行解毒。Chen等[60]将PvACR3基因转化到拟南芥中,大大增加了砷从根部到地上部分的转运,转PvACR3基因拟南芥地上部分砷的积累量约为野生型的7.5倍,为超富集砷的工程植株的开发提供了重要依据。在蜈蚣草根中,Chen等[61]鉴定得到另一个液泡膜区隔化基因PvACR3;1。该基因编码的蛋白主要定位于液泡膜,介导砷在根部细胞液泡的区隔化过程。将PvACR3;1基因在拟南芥和烟草中异源表达,可增加砷在根部的储存,减少向地上部分的运输。此研究为限制砷在植物地上部分的积累提供了一种潜在策略。
研究人员在蜈蚣草羽叶中还克隆得到一种谷氧还原蛋白PvGrx5[62],该蛋白可直接或间接地与液泡跨膜蛋白相互作用,影响细胞内亚砷酸盐积累水平。该研究推测在蜈蚣草羽叶中,谷氧还蛋白PvGrx5可能通过调节液泡GlpF蛋白的同源物(如液泡内在蛋白TIPs),从而改变亚砷酸盐向液泡内的转运,影响蜈蚣草液泡的区隔化过程。
Cai等[56]提出了一条类似于细菌的蜈蚣草砷区隔化机制。前人研究表明,在铜绿假单胞菌中存在一种新的砷酸盐抗性系统,该系统将糖酵解酶甘油醛-3-磷酸脱氢酶(GAPDH)与MFS转运蛋白耦联。GAPDH可催化1-砷-3-磷酸甘油酸(1As3PGA)的形成,络合物被外排到细胞外并水解成砷酸盐和3-磷酸甘油酸(3PGA),从而达到解毒的目的。Cai等[56]通过砷处理前后的蜈蚣草配子体差异转录组鉴定得到3个砷处理后表达显著上调的基因,分别编码甘油醛-3-磷酸脱氢酶(PvGAPC1)、有机阳离子转运蛋白4(PvOCT4)和谷胱甘肽S-转移酶(PvGSTF1)。研究表明PvGAPC1蛋白具有极强的砷酸盐亲和力,PvOCT4是一种主要在囊泡上表达的膜蛋白,PvGSTF1蛋白具有较强的砷酸还原酶活性。将这3个基因分别在蜈蚣草配子体中敲除,敲除后的配子体均表现出对砷抗性减弱的表型,暗示这3个基因是赋予蜈蚣草砷抗性的必要基因。亚细胞定位表明,PvGAPC1和PvGSTF1蛋白具有相似的定位,在蜈蚣草细胞中共同定位在与膜结合的囊泡上。根据铜绿假单胞菌的抗性机制,研究人员推测,在蜈蚣草中,PvGAPC1可将细胞中的砷酸盐转化为1-砷-3-磷酸甘油酸,通过PvOCT4泵入砷代谢囊泡,在囊泡中水解,释放出砷酸盐,PvGSTF1将砷酸盐还原为亚砷酸盐。最后囊泡与液泡膜融合后将亚砷酸盐释放到液泡中,进而完成砷的区隔化过程。
3 结论与展望自砷的超富集植物蜈蚣草被发现以来,其超富集机制的研究多集中在生理生化水平。近年来,阐明蜈蚣草超富集砷的分子机制,挖掘应用于植物修复的分子元件已逐渐成为研究的热点。随着生物信息学和分子生物学的发展,转录组学和蛋白质组学已逐渐应用于蜈蚣草超富集砷的分子机制研究中,部分参与蜈蚣草超富集砷的分子元件已被鉴定。
在现有研究的基础上,蜈蚣草超富集砷的过程中已被鉴定得到的分子元件如图 1所示:土壤中的AsⅤ通过磷酸盐转运通道蛋白PvPht1;3进入根部细胞,土壤中的AsⅢ通过水通道蛋白PvTIP4;1被根部吸收。根部细胞中的AsⅤ可能经由2种途径被还原。一种是通过砷酸还原酶PvACR2,并在磷酸丙糖异构酶Pv4-8的参与下还原为AsⅢ。另一种是被PvGAPC1转化为1-砷-3-磷酸甘油酸,通过PvOCT4泵入砷代谢囊泡,在囊泡中水解并释放,最后经由PvGSTF1被还原为AsⅢ(虚线,推测途径)。还原后的AsⅢ小部分可通过PvACR3;1和PvACR3介导或通过囊泡与液泡膜的融合(虚线,推测途径)隔离在根部液泡中,大部分AsⅢ跟小部分未被还原的AsⅤ一起分别由未知的转运蛋白经由木质部转运到地上部分的羽叶中。在羽叶细胞中,AsⅤ以与根部细胞同样的方式被还原为AsⅢ。AsⅢ在PvACR3的介导下或经由囊泡融合隔离在羽叶的液泡中,完成砷在羽叶的富集。
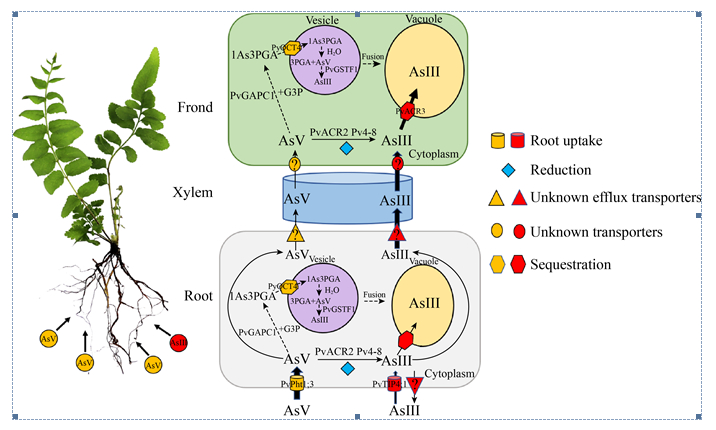 |
| 图 1 蜈蚣草超富集砷的过程及分子元件示意图 Fig. 1 Schematic diagram of arsenic hyperaccumulation process and molecular components in P.vittata. |
| 图选项 |
然而,现有研究还存在很多不足,蜈蚣草富集砷的过程中只有少数基因被鉴定到,并不能完全阐明其分子机制,解析蜈蚣草超富集砷的分子机制任重而道远。针对目前对蜈蚣草分子机制研究的不足,对未来的研究趋势提出了以下几点展望:1)蜈蚣草富集砷的4个环节中,砷的吸收、还原、区隔化3个环节中只有少数基因的功能被充分表征,砷积累的各个环节,尤其是运输过程的功能基因还有待进一步探索。蜈蚣草超富集砷的分子调控机制也将是未来重要的研究方向。2)基因组序列信息的缺乏严重限制了对蜈蚣草中超富集砷的分子机制的研究。随着测序技术的不断发展,对蜈蚣草基因组进行测序可为蜈蚣草提供更多的遗传信息,为超富集砷机制的研究提供重要的基础。3)遗传转化方法的缺乏严重限制了对蜈蚣草中超富集砷的分子机制的研究。建立起蜈蚣草的稳定遗传转化体系,会极大地促进功能基因的发现和验证,以及遗传改良的进一步发展。
参考文献
| [1] | Martinez VD, Vucic EA, Becker-Santos DD, et al. Arsenic exposure and the induction of human cancers. J Toxi col, 2011, 2011: 431287. |
| [2] | Ji DL, Meng FS, Xue H, et al. Situation and prospect of soil arsenic pollution and its remediation techniques at home and abroad. J Environ Eng Technol, 2016, 6(1): 90-99 (in Chinese). 纪冬丽, 孟凡生, 薛浩, 等. 国内外土壤砷污染及其修复技术现状与展望. 环境工程技术学报, 2016, 6(1): 90-99. |
| [3] | Duan ZB, Hu FQ, An JP, et al. Progress on soil arsenic contamination and its phytoremediation technology. Mod Agr Sci Technol, 2016(14): 190-193 (in Chinese). 段志斌, 胡丰青, 安吉平, 等. 土壤砷污染及其植物修复技术研究进展. 现代农业科技, 2016(14): 190-193. |
| [4] | Zhao FJ, Dunham SJ, Mcgrath SP. Arsenic hyperaccumulation by different fern species. New Phytol, 2002, 156(1): 27-31. |
| [5] | Ma LQ, Komart KM, Tu C, et al. A fern that hyperaccumulates arsenic:a hardy, versatile, fast-growing plant helps to remove arsenic from contaminated soils. Nature, 2001, 409(6820): 579. |
| [6] | Chen TB, Li HX, Lei M, et al. Accumulation of N, P and K in Pteris vittata L.during phytoremediation:a five-year field stud. Acta Scien Circum, 2010, 30(2): 402-408 (in Chinese). 陈同斌, 李海翔, 雷梅, 等. 植物修复过程中蜈蚣草对土壤养分的吸收动态:5年田间定位试验. 环境科学学报, 2010, 30(2): 402-408. |
| [7] | Xie JQ, Lei M, Chen TB, et al. Phytoremediation of soil co-contaminated with arsenic, lead, zinc and copper using Pteris vittata L. Acta Scien Circum, 2010, 30(1): 165-171 (in Chinese). 谢景千, 雷梅, 陈同斌, 等. 蜈蚣草对污染土壤中As、Pb、Zn、Cu的原位去除效果. 环境科学学报, 2010, 30(1): 165-171. |
| [8] | Lei M, Wan XM, Guo GH, et al. Phytoextraction of arsenic-contaminated soil with Pteris vittata in Henan province, China:comprehensive evaluation of remediation efficiency correcting for atmospheric depositions. Environ Sci Pollut Res Int, 2018, 25(1): 124-131. |
| [9] | Gumaelius L, Lahner B, Salt DE, et al. Arsenic hyperaccumulation in gametophytes of Pteris vittata.A new model system for analysis of arsenic hyperaccumulation. Plant Physiol, 2004, 136(2): 3198-3208. |
| [10] | Khare PB, Kaur S. Intraspecific polyploidy in Pteris vittata Linn. Cytologia, 1983, 48(1): 21-25. |
| [11] | Yan HL, Gao YW, Wu LL, et al. Potential use of the Pteris vittata arsenic hyperaccumulation-regulation network for phytoremediation. J Hazard Mater, 2019, 368: 386-396. |
| [12] | Shen HL, He ZY, Yan HL, et al. The fronds tonoplast quantitative proteomic analysis in arsenic hyperaccumulator Pteris vittata L. J Proteomics, 2014, 105: 46-57. |
| [13] | Hasan MK, Cheng Y, Kanwar MK, et al. Responses of plant proteins to heavy metal stress—A review. Front Plant Sci, 2017, 8: 1492. |
| [14] | Wolf DH. The ubiquitin-proteasome-system in protein quality control and the disposal of protein waste. Faseb J, 2010, 24: 1601-1614. |
| [15] | Pawlik-Skowrońska B, Pirszel J, Kalinowska R, et al. Arsenic availability, toxicity and direct role of GSH and phytochelatins in As detoxification in the green alga Stichococcus bacillaris. Aquat Toxicol, 2005, 70(3): 201-212. |
| [16] | Shri M, Kumar S, Chakrabarty D, et al. Effect of arsenic on growth, oxidative stress, and antioxidant system in rice seedlings. Ecotoxicol Environ Saf, 2009, 72(4): 1102-1110. |
| [17] | Cao XD, Ma LQ, Tu C. Antioxidative responses to arsenic in the arsenic-hyperaccumulator Chinese brake fern (Pteris vittata L.). Environ Pollut, 2004, 128(3): 317-325. |
| [18] | Singh N, Ma LQ, Srivastava M, et al. Metabolic adaptations to arsenic-induced oxidative stress in Pteris vittata L.and Pteris ensiformis L. Plant Sci, 2006, 170(2): 274-282. |
| [19] | Sakai Y, Watanabe T, Wasaki J, et al. Influence of arsenic stress on synthesis and localization of low-molecular-weight thiols in Pteris vittata. Environ Pollut, 2010, 158(12): 3663-3669. |
| [20] | Zhao FJ, Wang JR, Barker JHA, et al. The role of phytochelatins in arsenic tolerance in the hyperaccumulator Pteris vittata. New Phytol, 2003, 159(2): 403-410. |
| [21] | Xie QE, Yan XL, Liao XY, et al. The arsenic hyperaccumulator fern Pteris vittata L. Environ Sci Technol, 2009, 43(22): 8488-8495. |
| [22] | Duan GL, Wang LH, Chen Y, et al. Recent developments in understanding the mechanisms of arsenic hyperaccumulation in plants. Acta Scien Circum, 2007, 27(5): 714-720 (in Chinese). 段桂兰, 王利红, 陈玉, 等. 植物超富集砷机制研究的最新进展. 环境科学学报, 2007, 27(5): 714-720. |
| [23] | Shen HL, He ZY, Ma M. Advance of the mechanisms of arsenic hyperaccumulation in Pteris vittata L. J Plant Physiol, 2014, 50(5): 591-598 (in Chinese). 申红玲, 何振艳, 麻密. 蜈蚣草砷超富集机制及其在砷污染修复中的应用. 植物生理学报, 2014, 50(5): 591-598. |
| [24] | Chen YS, Jia MR, Cao Y, et al. Advances in molecular mechanisms of arsenic hyperaccumulation in Pteris vittata. J Agro-Environ Sci, 2018, 37(7): 1402-1408 (in Chinese). 陈焱山, 贾梦茹, 曹越, 等. 蜈蚣草砷富集的分子机制研究进展. 农业环境科学学报, 2018, 37(7): 1402-1408. |
| [25] | Wang X, Ma LQ, Rathinasabapathi B, et al. Uptake and translocation of arsenite and arsenate by Pteris vittata L.:effects of silicon, boron and mercury. Environ Exp Bot, 2010, 68(2): 222-229. |
| [26] | Su YH, Mcgrath SP, Zhu YG, et al. Highly efficient xylem transport of arsenite in the arsenic hyperaccumulator Pteris vittata. New Phytol, 2010, 180(2): 434-441. |
| [27] | Zhao FJ, Ma JF, Meharg AA, et al. Arsenic uptake and metabolism in plants. New Phytol, 2009, 181(4): 777-794. |
| [28] | Poynton CY, Huang JW, Blaylock MJ, et al. Mechanisms of arsenic hyperaccumulation in Pteris species:root As influx and translocation. Planta, 2004, 219(6): 1080-1088. |
| [29] | Chen TB, Yan XL, Liao XY, et al. Subcellular distribution and compartmentalization of arsenic in Pteris vittata L. Chin Sci Bull, 2005, 50(24): 2843-2849. |
| [30] | Mandal BK, Suzuki KT. Arsenic round the world:a review. Talanta, 2002, 58(1): 201-235. |
| [31] | Xin W, Ma LQ, Rathinasabapathi B, et al. Mechanisms of efficient arsenite uptake by arsenic hyperaccumulator Pteris vittata. Environ Sci Technol, 2011, 45(22): 9719-9725. |
| [32] | Zhang WH, Cai Y, Tu C, et al. Arsenic speciation and distribution in an arsenic hyperaccumulating plant. Sci Total Environ, 2002, 300(1/3): 167-177. |
| [33] | Pickering IJ, Gumaelius L, Harris HH, et al. Localizing the biochemical transformations of arsenate in a hyperaccumulating fern. Environ Sci Technol, 2006, 40(16): 5010-5014. |
| [34] | Webb SM, Gaillard JF, Ma LQ, et al. XAS speciation of arsenic in a hyper-accumulating fern. Environ Sci Technol, 2003, 37(4): 754-760. |
| [35] | Garbinski LD, Rosen BP, Chen J. Pathways of arsenic uptake and efflux. Environ Int, 2019, 126: 585-597. |
| [36] | Wang JR, Zhao FJ, Meharg AA, et al. Mechanisms of arsenic hyperaccumulation in Pteris vittata.Uptake kinetics, interactions with phosphate, and arsenic speciation. Plant Physiol, 2002, 130(3): 1552-1561. |
| [37] | Tu S, Ma LQ. Interactive effects of pH, arsenic and phosphorus on uptake of As and P and growth of the arsenic hyperaccumulator Pteris vittata L.under hydroponic conditions. Environ Exp Bot, 2003, 50(3): 243-251. |
| [38] | Shin H, Shin HS, Dewbre GR, et al. Phosphate transport in Arabidopsis:Pht1;1 and Pht1;4 play a major role in phosphate acquisition from both low-and high-phosphate environments. Plant J, 2004, 39(4): 629-642. |
| [39] | Wang PT, Zhang WW, Mao CZ, et al. The role of OsPT8 in arsenate uptake and varietal difference in arsenate tolerance in rice. J Exp Bot, 2016, 67(21): 6051-6059. |
| [40] | Ditusa SF, Fontenot EB, Wallace RW, et al. A member of the Phosphate transporter 1 (Pht1) family from the arsenic-hyperaccumulating fern Pteris vittata is a high-affinity arsenate transporter. New Phytol, 2016, 209(2): 762-772. |
| [41] | Cao Y, Feng HY, Sun D, et al. Heterologous expression of Pteris vittata phosphate transporter PvPht1;3 enhances arsenic translocation to and accumulation in tobacco shoots. Environ Sci Technol, 2019, 53(18): 10636-10644. |
| [42] | Bhattacharjee H, Mukhopadhyay R, Thiyagarajan S, et al. Aquaglyceroporins:ancient channels for metalloids. J Biol, 2008, 7(9): 33. |
| [43] | He ZY, Yan HL, Chen YS, et al. An aquaporin PvTIP4;1 from Pteris vittata may mediate arsenite uptake. New Phytol, 2016, 209(2): 746-761. |
| [44] | Duan GL, Zhu YG, Tong YP, et al. Characterization of arsenate reductase in the extract of roots and fronds of Chinese brake fern, an arsenic hyperaccumulator. Plant Physiol, 2005, 138(1): 461-469. |
| [45] | Lei M, Wan XM, Huang ZC, et al. First evidence on different transportation modes of arsenic and phosphorus in arsenic hyperaccumulator Pteris vittata. Environ Pollut, 2012, 161: 1-7. |
| [46] | Messens J, Silver S. Arsenate reduction:thiol cascade chemistry with convergent evolution. J Mol Biol, 2006, 362(1): 1-17. |
| [47] | Mukhopadhyay R, Rosen BP. Saccharomyces cerevisiae ACR2 gene encodes an arsenate reductase. FEMS Microbiol Lett, 1998, 168(1): 127-136. |
| [48] | Dhankher OP, Rosen BP, McKinney EC, et al. Hyperaccumulation of arsenic in the shoots of Arabidopsis silenced for arsenate reductase (ACR2). Proc Natl Acad Sci USA, 2006, 103(14): 5413-5418. |
| [49] | Duan GL, Zhou Y, Tong YP, et al. A CDC25 homologue from rice functions as an arsenate reductase. New Phytol, 2007, 174(2): 311-321. |
| [50] | Ellis DR, Gumaelius L, Indriolo E, et al. A novel arsenate reductase from the arsenic hyperaccumulating fern Pteris vittata. Plant Physiol, 2006, 141(4): 1544-1554. |
| [51] | Liu WJ, Schat H, Bliek M, et al. Knocking out ACR2 does not affect arsenic redox status in Arabidopsis thaliana:implications for as detoxification and accumulation in plants. PLoS One, 2012, 7(8): e42408. |
| [52] | Chao DY, Chen Y, Chen JG, et al. Genome-wide association mapping identifies a new arsenate reductase enzyme critical for limiting arsenic accumulation in plants. PLoS Biol, 2014, 12(12): e1002009. |
| [53] | Shi SL, Wang T, Chen Z, et al. OsHAC1; 1 and OsHAC1; 2 function as arsenate reductases and regulate arsenic accumulation. Plant Physiol, 2016, 172(3): 1708-1719. |
| [54] | Xu JM, Shi SL, Wang L, et al. OsHAC4 is critical for arsenate tolerance and regulates arsenic accumulation in rice. New Phytol, 2017, 215(3): 1090-1101. |
| [55] | Rathinasabapathi B, Wu S, Sundaram S, et al. Arsenic resistance in Pteris vittata L.:identification of a cytosolic triosephosphate isomerase based on cDNA expression cloning in Escherichia coling in Eschericha coli. Plant Mol Biol, 2006, 62(6): 845-857. |
| [56] | Cai C, Lanman NA, Withers KA, et al. Three genes define a bacterial-like arsenic tolerance mechanism in the arsenic hyperaccumulating fern Pteris vittata.. Curr Biol, 2019, 29(10): 1625-1633.e3. |
| [57] | Yang XX, Chen H, Dai XJ, et al. Evidence of vacuolar compartmentalization of arsenic in the hyperaccumulator Pteris vittata.. Chin Sci Bull, 2009, 54(22): 4229-4233. |
| [58] | Lombi E, Zhao FJ, Fuhrmann M, et al. Arsenic distribution and speciation in the fronds of the hyperaccumulator Pteris vittata.. New Phytol, 2002, 156(2): 195-203. |
| [59] | Indriolo E, Na G, Ellis D, et al. A vacuolar arsenite transporter necessary for arsenic tolerance in the arsenic hyperaccumulating fern Pteris vittata is missing in flowering plants. Plant Cell, 2010, 22(6): 2045-2057. |
| [60] | Chen YS, Xu WZ, Shen HL, et al. Engineering arsenic tolerance and hyperaccumulation in plants for phytoremediation by a PvACR3 transgenic approach. Environ Sci Technol, 2013, 47(16): 9355-9362. |
| [61] | Chen YS, Hua CY, Jia MR, et al. Heterologous expression of Pteris vittata arsenite antiporter PvACR3;1 reduces arsenic accumulation in plant shoots. Environ Sci Technol, 2017, 51(18): 10387-10395. |
| [62] | Sundaram S, Rathinasabapathi B, Ma LQ, et al. An arsenate-activated glutaredoxin from the arsenic hyperaccumulator fern Pteris vittata L.regulates intracellular arsenite. J Biol Chem, 2008, 283(10): 6095-6101. |
