

天津师范大学 生命科学学院 天津市动植物抗性重点实验室,天津 300387
收稿日期:2019-08-24;接收日期:2019-12-12;网络出版时间:2020-01-06
基金项目:天津市自然科学基金(No. 18JCZDJC979000)资助
摘要:随着工业化与农业化进程的加快,土壤重金属污染问题日益突出。铜(Cu)既是生命体生长发育的必需微量元素,也是重金属污染物之一。土壤中过量的Cu不仅会对植物产生毒害,而且能够通过食物链的富集作用,对人类健康造成严重威胁。生物修复技术作为治理重金属污染土壤的一种新型技术受到广泛关注。文中对生物修复的主要技术如植物修复、微生物修复、植物-微生物联合修复、动物修复等在治理Cu污染土壤方面的研究进展进行综述,以期为重金属污染土壤有效治理和可持续农业的发展提供理论依据。
关键词:铜污染植物修复微生物修复联合修复
Progress in bioremediation of copper-contaminated soils
Jinyu Xu, Weiwei Wang, Hui Wang, Haiyan Zhang


Tianjin Key Laboratory of Animal and Plant Resistance, College of Life Sciences, Tianjin Normal University, Tianjin 300387, China
Received: August 24, 2019; Accepted: December 12, 2019; Published: January 6, 2020
Supported by: Natural Science Foundation of Tianjin, China (No. 18JCZDJC979000)
Corresponding author: Haiyan Zhang. Tel: +86-22-23766533; E-mail: skyzhy@tjnu.edu.cn.
Abstract: With the acceleration of industrialization and agriculture, soil heavy metal pollution has become increasingly serious. Copper, though an essential trace element for the growth and development of living organisms, is one of the main heavy metal pollutants. Excess copper in soil is toxic to plants and threatens human health via food chain. Bioremediation has received extensive attention as a novel technology for heavy-metal-contaminated soils. Here, we review the development of bioremediation technologies, including phytoremediation, microbial remediation, plant-microbe combined remediation, and animal remediation, for copper-contaminated soils, in order to provide a theoretical basis for the effective management of heavy-metal-contaminated soils and the sustainable development of agriculture.
Keywords: copper pollutionphytoremediationmicrobial remediationcombined remediation
随着全球工业化与农业化进程的加快,土壤重金属污染问题日益加剧。铜(Cu)是动植物生长发育的必需微量元素,也是污染土壤的重金属元素之一。铜矿的开采、尾矿的堆积、工业废水的排放、含Cu农药的使用等使得土壤中的Cu含量极剧增加,远远超出了土壤自身的承载能力[1]。我国土壤Cu污染问题形势十分严峻,据报道未受污染的土壤中Cu含量通常为2–40 mg/kg[2],但在污染严重的地区如铜矿区土壤的Cu含量可高达5 000 mg/kg。如我国江西省德兴铜矿区及附近土壤中的Cu平均含量超出江西未污染地区Cu含量的9.6倍以上[3],浙江铜矿区附近的土壤中Cu含量也高达524–7 325 mg/kg[4],这些地区土壤Cu含量远远超出了国家规定的环境标准[5]。
土壤修复技术主要包括物理修复、化学修复和生物修复等,具体修复策略如下(图 1)。其中物理修复和化学修复虽然治理效果较好,治理速度较快,但其成本高,应用规模有限,对土壤结构有损害,容易造成二次污染。生物修复是指利用生命代谢活动,减少污染土壤中的重金属含量或使其毒性减弱,从而使得土壤部分或完全恢复到原初状态的过程。与物理和化学修复技术相比,其具有低成本、高效益且不易产生二次污染的独特优势,因此在治理Cu污染土壤方面具有广阔的应用前景[6]。
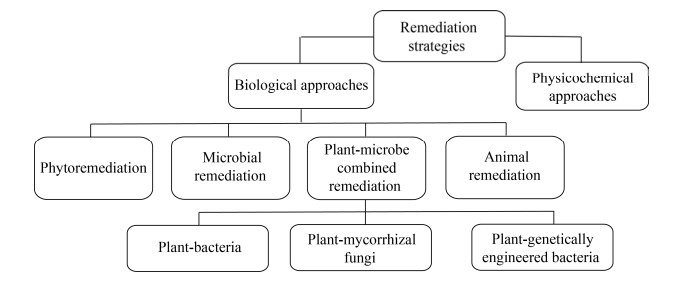 |
| 图 1 重金属污染土壤的修复策略 Fig. 1 Remediation strategies of heavy-metal contaminated soil. |
| 图选项 |
1 Cu污染土壤的生物修复近年来,土壤修复技术不断发展,由20世纪80年代之前的物理修复技术到20世纪90年代的土地复垦,再到21世纪以来的生物修复[7]。最初的生物修复是利用细菌治理石油、农药等造成的有机污染,后来其应用范围逐渐扩展,逐步应用到重金属污染的水体与土壤中,而且生物修复也逐渐由最初的细菌修复延伸到植物修复、动物修复、植物-微生物联合修复等[8]。由于生物修复的复杂性,需要与多学科技术如宏基因组学、系统生物学、基因工程等结合使用,以达到稳定的修复效果[9]。
1.1 植物修复植物修复是指利用植物对重金属离子的提取、区隔、稳定和代谢等功能来降低或去除土壤中的重金属污染物的经济高效的治理技术[10]。植物修复技术主要包括以下几种类型:植物挥发法、植物固定法、根系过滤法、植物提取法等,其中植物提取法是植物修复技术中研究最为广泛且最有发展前景的技术之一,它主要是利用超积累植物的根系吸收污染土壤中的重金属,转移并存储于地上部,然后收获地上部并集中处理。植物从土壤中吸收Cu离子及将Cu离子转运到地上部,是一个复杂的生物学过程,受到精密调控。如铜转运蛋白(Copper transporter,COPT)家族的COPT1、COPT2和COPT6以及锌铁转运蛋白(ZRT,IRT-like protein,ZIP)家族的ZIP2和ZIP4负责从外界吸收Cu,而COPT5和重金属ATP酶(Heavy metal transporting ATPase,HMA)中的HMA5则与Cu向地上部转运有关[11-14]。
1.1.1 铜超积累植物超积累植物是指对某种重金属的吸收量达到未污染土壤中植物体内重金属含量的100倍以上的植物[15]。Cu超积累植物则是指植物地上部或者叶片的Cu含量≥1 000 μg/g且地上部Cu含量与根系Cu含量比值大于1的一类植物[16]。由于植物地上部的Cu含量 > 300 μg/g非常少见,因此Cu超积累植物的标准被修改为300 μg/g[17]。目前,Cu超积累植物主要分布在非洲的刚果地区,在该地区发现了至少32种Cu超积累植物[18]。在我国也发现了一些Cu超积累植物,研究最多的是海州香薷Elsholtzia splendens Nakai和鸭跖草Commelina communis。海州香薷俗称铜草,对Cu具有较高耐性和积累能力,主要分布在我国长江中下游的铜矿区,是铜矿指示植物。Yang等报道在我国浙江省诸暨的废铜矿区发现的海州香薷为Cu超积累植物[19]。实验室研究结果显示,500 μmol/L和1 000 μmol/L的Cu溶液处理海州香薷28 d后,发现其地上部可积累的Cu含量分别为1 133 μg/g和3 417 μg/g。其幼苗能耐受250 μmol/L的Cu溶液,在此溶液中种子萌发不受影响。只有当Cu浓度高于750 μmol/L时,其种子萌发率才随着Cu浓度的增加而下降。用500 μmol/L的Cu溶液处理海州香薷6 d发现,地上部Cu含量为160 μg/g,根部Cu含量为20 200 μg/g,且Cu主要结合于根的细胞壁上,可见海州香薷的根系较地上部能积累更多的Cu[20]。另外,当外界Cu浓度在0.25–50.00 μmol/L时,海州香薷对Cu的吸收速率较低,当Cu浓度高于100 μmol/L时,其对Cu的吸收速率明显增加[21]。尽管海州香薷地上部的Cu积累水平未达到超积累植物的要求,由于其生物量大,根系发达,植株Cu积累较高,仍可考虑将其用于Cu污染土壤的植物修复。
鸭跖草最初被报道为Cu超积累植物是基于生长在我国安徽省铜陵铜矿区的鸭跖草地上部可积累高水平的Cu,其中茎和叶可分别积累731 mg/kg和547 mg/kg的Cu[22]。对我国湖北省铜绿山的鸭跖草进行研究后发现其地上部Cu含量平均达到1 224 mg/kg[23]。生长在51 mg/L Cu的溶液中,其茎和叶可分别积累1 300 mg/kg和540 mg/kg Cu[24]。而在未污染区域,比如在江苏省的汤山铜矿区生长的鸭跖草,其茎和叶对Cu的积累量仅为40 mg/kg和28 mg/kg[25]。
1.1.2 能源植物虽然超积累植物在修复Cu污染土壤方面具有广阔的应用前景,但是大多数超积累植物生物量较小,可以积累的重金属有限。因此选择一些积累量并不一定很高,但是生长周期短,具有较大生物量,较强重金属耐受能力,且应用前景好的植物以解决利用超积累植物进行修复过程中的问题,为此能源植物受到了广泛的关注。
能源植物是指光合作用强、能够产生可供利用的生物质的植物以及富含油脂、淀粉、纤维素等能源物质的一类植物[26]。一方面能源植物具有很高的开发利用价值,另一方面能源植物一般都具有生物量大、抗性强、耐贫瘠的特点,因而利用能源植物进行污染土壤的修复会产生良好的环境效益和经济效益。常见的能源植物有:富含高糖、高淀粉的甜高粱(Sorghum bicolor L. Moench);富含纤维素、半纤维素、木质素的荻Triarrhena sacchariflor;富含油脂的油菜Brassica napus、向日葵Helianthus annuus等。
甜高粱是重要的粮食作物和能源植物,其含糖量高,可作为生产乙醇的重要材料。甜高粱对铅(Pb)、镉(Cd)和锌(Zn)等重金属胁迫具有较强耐性。在含938.0 mg/kg Pb、4.9 mg/kg Cd及834.0 mg/kg Zn的土壤中种植甜高粱,发现每公顷甜高粱可从土壤中吸收0.350 kg Pb、0.052 kg Cd和1.440 kg Zn[27]。不同甜高粱品种吸收和积累重金属的能力差异很大,需要选用对重金属富集和转移能力强的品种对重金属污染土壤进行修复。Feng等[28]对96个甜高粱品种吸收重金属的能力进行鉴定,并对Cd转运能力强和Cd转运能力弱的两个品种的Cd积累机制进行了对比研究。有研究显示,在含0.1 mmol/L Cu的溶液中生长12周的甜高粱,其地上部和根部Cu含量分别为53.20 mg/g和27.75 mg/g,添加乙二胺四乙酸(EDTA)可显著增加甜高粱地上部和根部的Cu含量,同时其生物量和可溶性糖含量也有所增加,另外添加EDTA还可增加Cu向甜高粱地上部的转运[29-30]。由此可见,甜高粱不仅可以运用到Cd、Pb、Zn等重金属污染土壤的修复中,也可能适用于Cu污染土壤的修复。
芦苇Phragmites communis、象草Pennisetum purpureum Schum、香根草Vetiveria zizanioides等禾本科能源植物对Cu均具有较强耐性,其中象草对Cu的耐性最强,含1 500 mg/kg Cu的土壤对它们的生长没有明显影响[31]。油菜茎杆和籽粒中的Cu含量随外界Cu浓度增加而增加,且油菜地上部茎杆中积累的Cu大于籽粒,如当土壤含有400 mg/kg Cu时,油菜茎杆和籽粒的Cu含量分别是对照的8.51和7.12倍[32];向日葵对Cu也具有较强耐性,且可积累大量Cu[33]。
1.2 微生物修复微生物修复是指利用土壤中的细菌、真菌等微生物或者外源微生物对土壤中的重金属进行吸附、沉淀与分解作用等各种代谢功能,从而降低土壤中的重金属污染的技术。重金属在土壤中的移动性在很大程度上取决于微生物的相互作用,它们既可以利用生物吸附、生物积累、生物矿化等进行Cu的固定,也可以通过酸解、氧化或复合作用增加重金属离子的溶解性[34]。
细菌和真菌等微生物具有细胞壁,其上具有许多带负电荷的基团,能够吸附游离的带正电荷的金属离子。胞外多糖(Exopolysaccharide,EPS)能够结合金属离子,为此许多细菌可以通过分泌EPS从土壤中获得营养离子,也可以抑制重金属离子的毒害作用。有报道显示EPS对Cu具有很高的亲和力[35-36]。除微生物吸附外,重金属离子也可在微生物体内进行积累。如拟无枝酸菌属的Amycolatopsis tucumanensis能够积累高达25 mg/g Cu,其中60%的Cu存在于细胞内部[37]。这主要是由于其细胞内能够合成一种低分子量的富含半胱氨酸的蛋白,它可以与细胞质中的Cu结合[38]。另外,微生物也可以影响土壤的物理化学参数进而间接地影响重金属离子的移动性。嗜碱性细菌如假单胞菌属Pseudomonas、梭状芽孢菌属Clostridium和链霉菌属Streptomyces等与土壤的氨化作用有关,可提高土壤的pH值,降低金属离子的溶解性,进而降低它们的生态毒性[39]。另外,从Cu污染的水体中鉴定出了几种耐铜细菌,如黄色库克菌Kocuria flava和朝鲜芽孢八叠球菌Sporosarcina koreensis,然而它们是否能够用于Cu污染土壤修复尚未见报道[40-41]。
1.3 植物-微生物联合修复植物-微生物联合修复,是利用土壤-植物-微生物组成的复合体系来共同降低污染物含量、缓解污染物的一种新兴的生物修复技术,能够很大程度上克服单纯利用植物或微生物修复重金属污染土壤的缺点,为Cu污染土壤的修复提供了一个新的思路。微生物在土壤环境中与植物相互作用,一些微生物能促进植物生长发育,并能活化土壤中的Cu,从而提高植物对土壤Cu的提取效果,一些微生物增强植物应对外部胁迫的抵抗力。此外植物根系分泌物也能被微生物所利用,促进微生物的生长和繁殖。
1.3.1 植物-细菌联合修复植物根际微生物以细菌为主,根据其对植物的作用可分为有益菌、有害菌和中性菌。能够自由生活在植物根际土壤中的一类以直接或间接方式促进植物生长的有益细菌称为植物生长促进菌(Plant growth promoting bacteria,PGPB)[42]。它们通过产生植物生长激素,促进植物对营养元素的吸收,提高植物抵抗病虫害的能力,减少环境胁迫下乙烯的积累等途径促进植物的生长,从而增加植物的生物量,并有利于修复[43]。另外PGPB可以通过分泌铁载体、有机酸、生物表面活性剂以及氧化还原、甲基化等过程改变重金属在土壤中的可移动性和存在状态,而达到修复重金属污染土壤的目的[44]。
将PGPB接种至Cu浓度为63.5 mg/kg的中度Cu污染的葡萄园土壤中,可以增加蚕豆Vicia faba的果荚和种子数目,进而使得根部和地上部鲜重分别增加33%和26%,而蚕豆根部的Cu含量降低35%,果荚和种子中的Cu含量未发生变化[45]。对海州香薷和鸭跖草接种厚壁菌门(Firmicutes)的耐铜细菌之后,两种植物的生物量以及对Cu的积累量均显著增加,其中地上部和根部的生物量分别增加71%–83%和132%–155%,Cu含量增加了63%–125%[25]。硫氧化细菌(Sulfur-oxidizing bacteria)可以增强Cu在污染土壤中的移动性,进而增强大麦Hordeum vulgare对Cu的吸收[46]。随着能源植物在重金属污染土壤修复中的应用,PGPB在提高能源植物修复土壤重金属污染方面的研究也得到了越来越多的关注。Sheng等研究发现,对在Cu污染土壤中生长的能源植物玉米(Zea mays L.)接种PGPB,PGPB能够增加土壤中Cu的有效性,提高玉米根部和地上部的生物量和Cu积累量,增强能源植物玉米修复效率[47]。
产铁载体细菌(Siderophore-producing bacteria,SPB)如假单胞菌、链霉菌可分泌铁载体。铁载体是对三价铁离子高度亲和力的低分子量(150–2 000 Da)螯合剂,其对二价Cu离子具有较强的螯合能力[48]。Neubauer发现siderophore desferrioxamine B (DFOB)也可增强Cu在水铁矿以及高岭石中的流动性[49-50]。此外,SPB可以改变植物吸收金属离子的途径,如共质体吸收途径转变为质外体吸收途径,从而促进金属离子由根系向地上部的转移[51]。研究发现接种SPB促进苜蓿Medicago sativa中的Cu由根系向地上部转移。接种CPMex46和Avm等产铁载体菌株之后的苜蓿在10 mg/L Cu和10 mg/L Fe的溶液中生长8 d发现,与未接种菌株的植物相比,它们的Cu积累量分别达到了156 mg/kg和160 mg/kg[52]。
1.3.2 植物-菌根真菌联合修复菌根是土壤中的真菌菌丝与高等植物根系形成的一种互惠共生体。应用最广泛的是丛枝菌根(Arbuscular mycorrhiza,AM),丛枝菌根真菌能与90%的高等植物共生,常见于包括重金属污染土壤在内的各种生境中,影响植物的生长代谢及对重金属的吸收和积累。研究表明将丛枝菌根接种至种植玉米的土壤后,玉米地上部和根系Cu的吸收量分别增加了28.2%和60.0%[53];将摩西球囊霉Glomus mosseae接种至种植玉米的土壤后,土壤中可交换态的Cu增加了43%[54]。将外生菌根真菌彩色豆马勃Pisolithus tinctorius接种至黑松Pinus thunbergii幼苗后,既可促进植物的生长,又可以显著提高植物对Cu的积累量[55]。
1.3.3 植物-基因工程菌联合修复植物-基因工程菌联合修复是一种新兴的用于修复重金属污染土壤的技术,在这种修复技术中,将编码生物降解的酶、生物和非生物胁迫抗性相关、离子稳态相关、离子螯合蛋白和转运蛋白、离子吸收调控蛋白等的一个或者多个基因导入细菌,产生工程菌。将来自粟酒裂殖酵母Schizosaccharomyces pombe的植物螯合肽合酶(Phytochelatin synthase,PCS)基因在恶臭假单胞菌中表达,获得的重组菌株对重金属汞(Hg)、Cd和银(Ag)的抗性增强,且Cd积累量增加3–5倍。此外,该重组菌株可显著促进小麦的萌发和生长,这表明该重组菌株能够与植物共生,进而增强植物修复效率[56]。在Mesorhizobium huakuii sub sp. rengei B3中表达拟南芥PCS基因,该菌株能够产生植物螯合肽(Phytochelatins,PCs),积累比对照菌株多9–19倍的Cd。当该重组菌株与黄芪Astragalus sinicus共生时,根瘤中Cd含量增加了1.5倍[57]。将拟南芥铁调节转运蛋白1 (AtIRT1)基因导入菌株M. huakuii sub sp. rengei B3中获得新的重组基因工程菌株,将其接种至种植紫云英Astragalus sinicus的土壤中,使二者建立共生关系,发现紫云英对Cu的积累显著增强[58]。尽管关于植物-基因工程菌联合修复技术清除土壤中过多的Cu的报道还很少,但该技术在其他重金属污染土壤修复中的有效运用将为其在Cu污染土壤修复中的应用提供依据。
1.4 动物修复动物修复是利用土壤中的蚯蚓、线虫、甲螨等低等动物的吸收、转化和分解来达到修复污染土壤目的的技术。这种方法主要适用于重金属污染的土壤的修复。它不仅可以利用土著动物使得土壤中的重金属形态发生变化,而且可以提高土壤的肥力。其中蚯蚓占用于动物修复的生物数量的大多数,利用蚯蚓及其代谢物的作用来研究其对土壤污染的修复作用已经成为研究的热点。研究表明,蚯蚓对Cu具有较强的富集作用,富集系数高达2.55–11.93,然后利用电激等方法集中处理蚯蚓,在很大的程度上可以降低土壤中的Cu含量[59]。此外,蚯蚓的排泄物还可以促进Cu由根系向地上部分的转移,有利于植物对重金属形成更好的富集效果[60]。将土壤动物放入被重金属污染的土壤中,使其充当“催化剂”的作用,提高常规的生物修复技术的效率,这是动物修复技术未来的重要研究方向之一[61]。然而土壤动物对其生存环境条件有一定的要求,所以一般只适用于修复较低浓度Cu污染的土壤。
2 展望由于人类的活动,土壤Cu污染问题日益突出。尽管关于Cu污染土壤的修复技术的研究已经取得了长足的进展,然而每种技术都存在一定的局限性,仍存在诸多问题亟待解决。如植物修复技术中,植物生长周期长、容易受到外界环境因素的影响以及富集重金属的植物的正确处理方法等。因此在重金属污染区域寻找更多的超积累植物并对其重金属积累机制进行研究,结合转基因技术增强植物的Cu吸收量是未来的发展方向之一,应加强研究。另外,大多数Cu超富集植物只针对Cu这一种重金属具有富集作用,而在重金属污染区通常是多种重金属复合污染,所以应加强对多种重金属具有富集能力的植物的研究。将富集重金属的植物用于生产纳米材料的报道为超积累植物的最终处理提供了一个可行的途径[62]。另外,开发生物修复技术与其他修复技术联合创新修复,以寻找有效治理土壤Cu污染的修复技术。这就需要大力开展多学科如土壤学、微生物学、植物学和环境学等的交叉研究。总之相信随着科技的不断发展,Cu污染问题的解决将成为现实。
参考文献
| [1] | Yuan JH, Li JR, Zhang HY. Structure and function of copper transporters in plants. Chin Bull Bot, 2016, 51(6): 849-858 (in Chinese). 袁金红, 李靖锐, 张海燕. 植物铜转运蛋白的结构和功能. 植物学报, 2016, 51(6): 849-858. |
| [2] | Weng HX, Zhang XM, Chen XH, et al. The stability of the relative content ratios of Cu, Pb and Zn in soils and sediments. Environ Geol, 2003, 45(1): 79-85. |
| [3] | Huang CG, Qiu YX. Pollution of the environment Jiangxi Dexing cooper mine by copper and phytorem ediation. Chin J Soil Sci, 2005, 36(6): 991-992 (in Chinese). 黄长干, 邱业先. 江西德兴铜矿铜污染状况调查及植物修复研究. 土壤通报, 2005, 36(6): 991-992. DOI:10.3321/j.issn:0564-3945.2005.06.042 |
| [4] | Long J, Huang CY, Teng Y, et al. Research on soil microbial characteristics of soil-Elsholtzia harchowensis system in copper mine tailings. Acta Pedol Sin, 2004, 41(1): 120-125 (in Chinese). 龙健, 黄昌勇, 滕应, 等. 铜矿尾矿库土壤-海洲香薷(Elsholtzia harchowensis)植物体系的微生物特征研究. 土壤学报, 2004, 41(1): 120-125. DOI:10.3321/j.issn:0564-3929.2004.01.020 |
| [5] | State Environmental Protection Administration, State Bureau of Technical Supervision. GB15618-1995 Environmental quality STANDARD for soils. Beijing: China Standard Press, 1995 (in Chinese). 国家环境保护局, 国家技术监督局. GB15618-1995土壤环境质量标准. 北京: 中国标准出版社, 1995. |
| [6] | Tandy S, Ammann A, Schulin R, et al. Biodegradation and speciation of residual SS-ethylenediaminedisuccinic acid (EDDS) in soil solution left after soil washing. Environ Pollut, 2006, 142(2): 191-199. |
| [7] | Yang Y, He YM, Luan JL, et al. Comprehensive analysis on soil remediation technologies of international contaminated sites. Environ Sci Technol, 2012, 35(10): 92-98 (in Chinese). 杨勇, 何艳明, 栾景丽, 等. 国际污染场地土壤修复技术综合分析. 环境科学与技术, 2012, 35(10): 92-98. DOI:10.3969/j.issn.1003-6504.2012.10.020 |
| [8] | Yang XM, Hu GJ, Yang XH, et al. The application and development of bioremedation technology. China Min Mag, 2007, 16(12): 58-60 (in Chinese). 杨秀敏, 胡桂娟, 杨秀红, 等. 生物修复技术的应用及发展. 中国矿业, 2007, 16(12): 58-60. DOI:10.3969/j.issn.1004-4051.2007.12.018 |
| [9] | Checa SK, Zurbriggen MD, Soncini FC. Bacterial signaling systems as platforms for rational design of new generations of biosensors. Curr Opin Biotechnol, 2012, 23(5): 766-772. DOI:10.1016/j.copbio.2012.05.003 |
| [10] | Ibekwe AM, Angle JS, Chaney RL, et al. Enumeration and N2 fixation potential of Rhizobium leguminosarum biovar trifolii grown in soil with varying pH values and heavy metal concentrations. Agric Ecosyst Environ, 1997, 61(2/3): 103-111. |
| [11] | Sancenón V, Puig S, Mira H, et al. Identification of a copper transporter family in Arabidopsis thaliana. Plant Mol Biol, 2003, 51(4): 577-587. DOI:10.1023/A:1022345507112 |
| [12] | Jung HI, Gayomba SR, Rutzke MA, et al. COPT6 is a plasma membrane transporter that functions in copper homeostasis in Arabidopsis and is a novel target of SQUAMOSA promoter-binding protein-like 7. J Biol Chem, 2012, 287(40): 33252-33267. DOI:10.1074/jbc.M112.397810 |
| [13] | Wintz H, Fox T, Wu YY, et al. Expression profiles of Arabidopsis thaliana in mineral deficiencies reveal novel transporters involved in metal homeostasis. J Biol Chem, 2003, 278(48): 47644-47653. DOI:10.1074/jbc.M309338200 |
| [14] | Klaumann S, Nickolaus SD, Fürst SH, et al. The tonoplast copper transporter COPT5 acts as an exporter and is required for interorgan allocation of copper in Arabidopsis thaliana. New Phytol, 2011, 192(2): 393-404. DOI:10.1111/j.1469-8137.2011.03798.x |
| [15] | Brooks RR, Lee J, Reeves RD, et al. Detection of nickeliferous rocks by analysis of herbarium specimens of indicator plants. J Geochem Explorat, 1977, 7: 49-57. DOI:10.1016/0375-6742(77)90074-7 |
| [16] | Baker AJM, Brooks RR. Terrestrial higher plants which hyperaccumulate metallic elements. A review of their distribution ecology and phytochemistry. Biorecovery, 1989, 1: 81-126. |
| [17] | van der Ent A, Baker AJM, Reeves RD, et al. Hyperaccumulators of metal and metalloid trace elements: Facts and fiction. Plant Soil, 2013, 362(1/2): 319-334. |
| [18] | Reeves RD, Baker AJM. Phytoremediation of toxic metals: using plants to clean up the environment. Wiley, New York, 2000, 193-229. |
| [19] | Yang XE, Shi WY, Fu CX, et al. Copper hyperaccumulators of Chinese native plants: characteristics and possible use for phytoremediation//Bassam NEL, Ed. Sustainable Agriculture for Food, Energy and Industry. London: James & James Science Publishers Ltd, 1998: 484-489. |
| [20] | Lou LQ, Shen ZG, Li XD. The copper tolerance mechanisms of Elsholtzia haichowensis, a plant from copper-enriched soils. Environ Exp Bot, 2004, 51(2): 111-120. DOI:10.1016/j.envexpbot.2003.08.002 |
| [21] | Yang MJ, Yang XE, R?mheld V. Growth and nutrient composition of Elsholtzia splendens Nakai under copper toxicity. J Plant Nutr, 2002, 25(7): 1359-1375. DOI:10.1081/PLN-120005395 |
| [22] | Tang SR, Huang CY, Zhu ZX. Commelina communis L.: copper hyperaccumulator found in Anhui Province of China. Pedosphere, 1997, 7(3): 207-210. |
| [23] | Shu WS, Yang KY, Zhang ZQ, et al. Flora and heavy metals in dominant plants growing on an ancient copper spoil heap on Tonglushan in Hubei Province, China. Chin J Appl Environ Biol, 2001, 7(1): 7-12 (in Chinese). 束文圣, 杨开颜, 张志权, 等. 湖北铜绿山古铜矿冶炼渣植被与优势植物的重金属含量研究. 应用与环境生物学报, 2001, 7(1): 7-12. DOI:10.3321/j.issn:1006-687X.2001.01.002 |
| [24] | Liao B, Deng DM, Yang B, et al. Cu tolerance and accumulation in Commelina communis. Acta Sci Circumst, 2003, 23(6): 797-801 (in Chinese). 廖斌, 邓冬梅, 杨兵, 等. 鸭跖草(Commelina communis)对铜的耐性和积累研究. 环境科学学报, 2003, 23(6): 797-801. DOI:10.3321/j.issn:0253-2468.2003.06.018 |
| [25] | Sun LN, Zhang YF, He LY, et al. Genetic diversity and characterization of heavy metal-resistant-endophytic bacteria from two copper-tolerant plant species on copper mine wasteland. Bioresource Technol, 2010, 101(2): 501-509. DOI:10.1016/j.biortech.2009.08.011 |
| [26] | Hattori T, Morita S. Energy crops for sustainable bioethanol production; which, where and how?. Plant Prod Sci, 2010, 13(3): 221-234. DOI:10.1626/pps.13.221 |
| [27] | Zhung P, Shu WS, Li ZA, et al. Removal of metals by sorghum plants from contaminated land. J Environ Sci, 2009, 21(10): 1432-1437. DOI:10.1016/S1001-0742(08)62436-5 |
| [28] | Feng JJ, Jia WT, Lv SL, et al. Comparative transcriptome combined with morpho-physiological analyses revealed key factors for differential cadmium accumulation in two contrasting sweet sorghum genotypes. Plant Biotechnol J, 2018, 16(2): 558-571. DOI:10.1111/pbi.12795 |
| [29] | Poór P, ?rd?g A, Wodala B, et al. Effect of EDTA-assisted copper uptake on photosynthetic activity and biomass production of sweet sorghum. Cereal Res Commun, 2015, 43(4): 604-615. DOI:10.1556/0806.43.2015.028 |
| [30] | Székely á, Poór P, Bagi I, et al. Effect of EDTA on the growth and copper accumulation of sweet sorghum and sudangrass seedlings. Acta Biol Szeged, 2011, 55(1): 159-164. |
| [31] | Liu XH, Shen YX, Lou LQ, et al. Copper tolerance of the biomass crops Elephant grass (Pennisetum purpureum Schumach), Vetiver grass (Vetiveria zizanioides) and the upland reed (Phragmites australis) in soil culture. Biotechnol Adv, 2009, 27(5): 633-640. DOI:10.1016/j.biotechadv.2009.04.017 |
| [32] | Liu XH, Cao CX, Zhou Q, et al. Physiological response of rape to copper stress and copper enrichment characteristics in stem and seeds of rape. Environ Pollut Control, 2011, 33(12): 9-12 (in Chinese). 刘新华, 曹春信, 周琴, 等. 油菜对铜胁迫的生理响应及铜在茎杆和籽粒中的富集特征. 环境污染与防治, 2011, 33(12): 9-12. DOI:10.3969/j.issn.1001-3865.2011.12.002 |
| [33] | Lin JX, Jiang WS, Liu DH. Accumulation of copper by roots, hypocotyls, cotyledons and leaves of sunflower (Helianthus annuus L.). Bioresource Technol, 2003, 86(2): 151-155. DOI:10.1016/S0960-8524(02)00152-9 |
| [34] | Gadd GM. Metals, minerals and microbes: geomicrobiology and bioremediation. Microbiology, 2010, 156(3): 609-643. DOI:10.1099/mic.0.037143-0 |
| [35] | Comte S, Guibaud G, Baudu M. Biosorption properties of extracellular polymeric substances (EPS) towards Cd, Cu and Pb for different pH values. J Hazard Mater, 2008, 151(1): 185-193. DOI:10.1016/j.jhazmat.2007.05.070 |
| [36] | Fang LC, Wei X, Cai P, et al. Role of extracellular polymeric substances in Cu (Ⅱ) adsorption on Bacillus subtilis and Pseudomonas putida. Bioresource Technol, 2011, 102(2): 1137-1141. DOI:10.1016/j.biortech.2010.09.006 |
| [37] | Albarracín VH, Amoroso MJ, Abate CM. Isolation and characterization of indigenous copper-resistant actinomycete strains. Geochemistry, 2005, 65(S1): 145-156. |
| [38] | Bruins MR, Kapil S, Oehme FW. Microbial resistance to metals in the environment. Ecotoxcol Environ Safe, 2000, 45(3): 198-207. DOI:10.1006/eesa.1999.1860 |
| [39] | Cayol JL, Ollivier B, Alazard D, et al. The extreme conditions of life on the planet and exobiology//Bertrand JC, Caumette P, Lebaron P, Eds. Environmental Microbiology: Fundamentals and Applications. Dordrecht: Springer, 2015, 353-394. |
| [40] | Achal V, Pan XL, Zhang DY. Remediation of copper-contaminated soil by Kocuria flava CR1, based on microbially induced calcite precipitation. Ecol Eng, 2011, 37(10): 1601-1605. DOI:10.1016/j.ecoleng.2011.06.008 |
| [41] | Li M, Cheng XH, Guo HX. Heavy metal removal by biomineralization of urease producing bacteria isolated from soil. Int Biodeter Biodegr, 2013, 76: 81-85. DOI:10.1016/j.ibiod.2012.06.016 |
| [42] | Dardanelli MS, Manyani H, González-Barroso S, et al. Effect of the presence of the plant growth promoting rhizobacterium (PGPR) Chryseobacterium balustinum Aur9 and salt stress in the pattern of flavonoids exuded by soybean roots. Plant Soil, 2010, 328(1/2): 483-493. |
| [43] | Kamnev AA, van der Lelie D. Chemical and biological parameters as tools to evaluate and improve heavy metalphytoremediation. Bioscience Rep, 2000, 20(4): 239-258. DOI:10.1023/A:1026436806319 |
| [44] | Jing YD, He ZL, Yang XE. Role of soil rhizobacteria in phytoremediation of heavy metal contaminated soils. J Zhejiang Univ Sci B (Biomed Biotechnol), 2007, 8(3): 192-207. DOI:10.1631/jzus.2007.B0192 |
| [45] | Fatnassi IC, Chiboub M, Saadani O, et al. Phytostabilization of moderate copper contaminated soils using co-inoculation of Vicia faba with plant growth promoting bacteria. J Basic Microbiol, 2013, 55(3): 303-311. |
| [46] | Shi R, Weber G, K?ster J, et al. Senescence-induced iron mobilization in source leaves of barley (Hordeum vulgare) plants. New Phytol, 2012, 195(2): 372-383. DOI:10.1111/j.1469-8137.2012.04165.x |
| [47] | Sheng XF, Sun L, Huang Z, et al. Promotion of growth and Cu accumulation of bio-energy crop (Zea mays) by bacteria: Implications for energy plant biomass production and phytoremediation. J Environ Manage, 2012, 103: 58-64. DOI:10.1016/j.jenvman.2012.02.030 |
| [48] | Ferret C, Cornu JY, Elhabiri M, et al. Effect of pyoverdine supply on cadmium and nickel complexation and phytoavailability in hydroponics. Environ Sci Pollut Res, 2015, 22(3): 2106-2116. |
| [49] | Neubauer U, Nowack B, Furrer G, et al. Heavy metal sorption on clay minerals affected by the siderophore desferrioxamine B. Environ Sci Technol, 2000, 34(13): 2749-2755. DOI:10.1021/es990495w |
| [50] | Neubauer U, Furrer G, Schulin R. Heavy metal sorption on soil minerals affected by the siderophore desferrioxamine B: the role of Fe (Ⅲ) (hydr) oxides and dissolved Fe (Ⅲ). Eur J Soil Sci, 2002, 53(1): 45-55. DOI:10.1046/j.1365-2389.2002.00425.x |
| [51] | Nowack B, Schulin R, Robinson BH. Critical assessment of chelant-enhanced metal phytoextraction. Environ Sci Technol, 2006, 40(17): 5225-5232. DOI:10.1021/es0604919 |
| [52] | Carrillo-Casta?eda G, Mu?oz JJ, Peralta-Videa JR, et al. Plant growth-promoting bacteria promote copper and iron translocation from root to shoot in alfalfa seedlings. J Plant Nutr, 2002, 26(9): 1801-1814. DOI:10.1081/PLN-120023284 |
| [53] | Shen H, Liu Y, Li XL, et al. Influence of arbuscular mycorrhizal fungus (Glomus caledonium) on maize seedlings grown in copper contaminated soil. Plant Nutr Fert Sci, 2005, 11(2): 199-204 (in Chinese). 申鸿, 刘于, 李晓林, 等. 丛枝菌根真菌(Glomus caledonium)对铜污染土壤生物修复机理初探. 植物营养与肥料学报, 2005, 11(2): 199-204. DOI:10.3321/j.issn:1008-505X.2005.02.011 |
| [54] | Huang Y, Chen YJ, Tao S. Effect of rhizospheric environment of VA-mycorrhizal plants on forms of Cu, Zn, Pb and Cd in polluted soil. Chin J Appl Ecol, 2000, 11(3): 431-434 (in Chinese). 黄艺, 陈有键, 陶澍. 菌根植物根际环境对污染土壤中Cu、Zn、Pb、Cd形态的影响. 应用生态学报, 2000, 11(3): 431-434. DOI:10.3321/j.issn:1001-9332.2000.03.026 |
| [55] | Wen ZG, Wang J, Tang YZ, et al. The application potential of ectomycorrhizal fungus Pisolithus tinctorius assisting plant in phytoremediation of cu-contaminated soils. Biotechnol Bull, 2017, 33(4): 149-156 (in Chinese). 温祝桂, 王杰, 汤阳泽, 等. 外生菌根真菌彩色豆马勃(Pisolithus tinctorius)辅助植物修复重金属Cu污染土壤的应用潜力. 生物技术通报, 2017, 33(4): 149-156. |
| [56] | Yong X, Chen Y, Liu W, et al. Enhanced cadmium resistance and accumulation in Pseudomonas putida KT2440 expressing the phytochelatin synthase gene of Schizosaccharomyces pombe. Lett Appl Microbiol, 2014, 58(3): 255-261. DOI:10.1111/lam.12185 |
| [57] | Sriprang R, Hayashi M, Ono H, et al. Enhanced accumulation of Cd2+ by a Mesorhizobium sp. transformed with a gene from Arabidopsis thaliana coding for phytochelatin synthase. Appl Environ Microbiol, 2003, 69(3): 1791-1796. DOI:10.1128/AEM.69.3.1791-1796.2003 |
| [58] | Ike A, Sriprang R, Ono H, et al. Promotion of metal accumulation in nodule of Astragalus sinicus by the expression of the iron-regulated transporter gene in Mesorhizobium huakuii subsp. rengei B3. J Biosci Bioeng, 2008, 105(6): 642-648. DOI:10.1263/jbb.105.642 |
| [59] | Liu BP, Wang N. Advances in researches on bio-remediation technique for heavy metal polluted soil. J Anhui Agric Sci, 2016, 44(19): 67-69, 79 (in Chinese). 刘保平, 王宁. 生物修复重金属污染土壤技术研究进展. 安徽农业科学, 2016, 44(19): 67-69, 79. DOI:10.3969/j.issn.0517-6611.2016.19.023 |
| [60] | Lin SF, Li HX, Hu F. Effect of earthworm casts on copper uptake by ryegrass in copper polluted soil. Acta Pedol Sin, 2006, 43(6): 911-918 (in Chinese). 林淑芬, 李辉信, 胡锋. 蚓粪对黑麦草吸收污染土壤重金属铜的影响. 土壤学报, 2006, 43(6): 911-918. DOI:10.3321/j.issn:0564-3929.2006.06.005 |
| [61] | Liu ZP, Liu SJ. Development of bioremediation in China-a review. Chin J Biotech, 2015, 31(6): 901-916 (in Chinese). 刘志培, 刘双江. 我国污染土壤生物修复技术的发展及现状. 生物工程学报, 2015, 31(6): 901-916. |
| [62] | Qu J, Luo CQ, Cong Q, et al. Carbon nanotubes and Cu-Zn nanoparticles synthesis using hyperaccumulator plants. Environ Chem Lett, 2012, 10(2): 153-158. DOI:10.1007/s10311-011-0335-1 |
