

1. 中国科学院生态环境研究中心,北京 100085;
2. 中国科学院大学,北京 100049;
3. 中国科学院城市环境研究所,福建 厦门 361021
收稿日期:2019-12-30;接收日期:2020-03-02
基金项目:国家自然科学基金(No. 41991332)资助
作者简介:朱永官??中国科学院院士,曾任中国科学院城市环境研究所所长(现任党委书记)。长期从事环境土壤学研究,在污染效应和控制原理(特别是砷和抗生素等)、环境微生物生态学等领域作出了系统性的创新工作。先后主持国家自然科学基金委重大项目和中国科学院先导专项等,在Science、Nature等国际主流刊物发表学术论文300余篇,2016年至今连续4年入选科睿唯安全球高被引科学家,曾获国家自然科学二等奖和发展中国家科学院(TWAS)农业科学奖。目前担任Environment International主编及多个国内外学术期刊的副主编和编委,兼任国际科联(ICSU) “城市化与人类福祉”研究计划科学委员会委员.
摘要:土壤是人类赖以生存的物质基础。我国土壤重金属污染状况不容乐观,给人类健康构成严重威胁。生物修复重金属污染土壤被广泛认为是可持续的修复技术,但当前仍存在修复效率不高的科学瓶颈问题。土壤中生活着丰富的微生物、植物和动物,且这些生物之间存在着复杂的相互作用,并且通过物质循环和能量传递形成了错综复杂的食物网联系。土壤生物间的相互作用能深刻影响土壤中污染物的迁移转化和生物修复的效率,多元生物协同的修复技术集合了单一生物修复方法的优势,具有强化生物修复效果的巨大潜力。文中综述了土壤中微生物-植物-动物之间的相互作用,及其对土壤重金属迁移转化和生物修复效果的影响,并对定向调控土壤食物网结构、提高重金属污染土壤的生物修复效果、建立基于食物网的多元生物协同修复技术进行了展望。
关键词:重金属生物修复土壤生物相互作用食物网
Interactions among soil biota and their applications in synergistic bioremediation of heavy-metal contaminated soils
Guilan Duan1,2, Huiling Cui1,2, Yuping Yang1,2, Xingyun Yi1,2, Dong Zhu1,2, Yongguan Zhu1,2,3


1. Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China;
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Institute of Urban Environment, Chinese Academy of Sciences, Xiamen 361021, Fujian, China
Received: December 30, 2019; Accepted: March 2, 2020
Supported by: National Natural Science Foundation of China (No. 41991332)
Corresponding author: Yongguan Zhu. Tel: +86-10-62849158; Fax: +86-10-62936940; E-mail: ygzhu@rcees.ac.cn.
Abstract: Soil is the material basis for human survival. However, in China, soils are wildly polluted by heavy metals, which poses serious health risks to humans. Bioremediation of heavy-metal contaminated soil is widely considered as a sustainable remediation strategy, but low remediation efficiency is still a scientific bottleneck of bioremediation. There are abundant microorganisms, plants and animals living in soils. Among these soil biota, there are complex interactions to form an intricate food web through material circulation and energy transfer. These interactions among soil biota affect the transportation and transformation of pollutants in soil, and consequently influence the bioremediation efficiency. The synergistic remediation by soil biota combines the advantages of diferent organisms to enhance the efficiency of bioremediation. In this paper, the interactions among soil biota and their influence on heavy-metal transportation and transformation, as well as bioremediation efficiency are reviewed. We also propose perspectives for future researches, including targeted regulating the structure of soil food web, improving the bioremediation efficiency of heavy-metal contaminated soil, and building a synergistic remediation technology with multi-organisms based on food web.
Keywords: heavy-metalbio-remediationsoil biotainteractionfood web
1 我国土壤重金属污染及修复技术土壤是人类赖以生存、兴国安邦、文明建设的基础资源[1]。但随着我国工业化、城镇化及农业高度集约化快速发展,我国土壤重金属污染问题日益突出[2]。
1.1 我国土壤重金属污染现状及其健康风险2014年的《全国土壤污染状况调查公报》[3]显示,我国土壤总的点位超标率为16.1%,其中重金属污染最为突出,镉(Cd)、砷(As)、铜(Cu)等的重金属的超标率分别为7.0%、2.7%和2.1%;最近,生态环境部对30万hm2基本农田保护区土壤的调查发现,土壤中重金属超标率达到12.1%,其中长江三角洲地区耕地土壤重金属Cd、Cu和Pb的超标率分别为5.64%、2.73%和0.75%[4]。土壤污染可直接影响农产品的安全,近年来媒体频繁报道的“镉米”和“砷米”事件引起了社会各界的广泛关注。调查发现在我国镉污染较为严重的省份如湖南省、广东省和广西壮族自治区,稻米超标率可达60%–88%[5]。大米砷浓度超标问题也比较严重,Zhu等[6]的调查表明,湖南省和广东省受采矿影响的稻区,23%–55%的稻米出现砷超标。
大米是东南亚人们的主食,在我国,大米食用已经成为人体经食物链摄入镉、砷的主要途径[7-8]。长期食用镉砷污染的大米将对人体健康构成威胁。由于重金属具有不可生物降解和持久性的特点,人体摄入的重金属大部分会在人体内累积。Gilbert-Diamond等[9]对美国孕妇的研究表明,食用砷污染大米能显著增加尿液砷的浓度。Li等[7]对中国成年人从食品中摄入无机砷的致癌风险进行估算,结果表明,稻米砷摄入致癌风险的中值为每万人17.7人,中国南方人群由于稻米食用量高,致癌风险中值为每万人20.1人。对于Cd的积累,据汪鹏等[5]推算,在南方Cd污染严重的区域,对于一些高暴露人群,仅需4.7–8.3年就能达到中等Cd毒害症状(人体Cd累积剂量达到2.6 g),10–20年就能出现“痛痛病”等严重毒害症状(体内累积3.8 g Cd),15–30年就可能达到Cd致死剂量5.4 g。因此,耕地土壤重金属污染是关系到国计民生且亟需解决的重大环境问题之一。
1.2 重金属污染土壤的修复技术我国多数被污染的土壤(特别是耕地)尚处于轻中度污染状态,因此,发展中轻度污染耕地土壤修复技术,实现污染农田土壤的安全利用,保障农产品的安全生产是耕地土壤污染防治的重要目标。当前,修复污染耕地土壤的措施主要包括工程修复方法(如客土覆盖、表层剥离等)、农艺措施调控(如管理水分、合理施肥等)、钝化阻控技术等和生物修复[2]。工程修复技术工程量大、成本高且容易改变土壤基本性质;农艺调控技术的修复效果不稳定,且不容易操作[10]。钝化阻隔技术即通过向耕地土壤中加入无机、有机、生物等钝化剂,改变污染物质的生物有效性,以达到污染耕地土壤的安全利用。无机钝化剂如硅钙材料、黏土矿物等可以通过吸附、络合、沉淀和提高土壤pH来降低土壤重金属和有机污染物的活性;有机物料如秸秆、畜禽粪便、生物质炭和纳米材料对重金属和有机污染物污染土壤也有一定的解毒作用。但是,一些无机钝化剂存在生产成本高、容易造成二次污染和改变土壤基本性质等问题,而有机钝化剂如污泥、畜禽粪便和工业废弃物等自身含有一定量的污染物质,也可能造成土壤的二次污染或质量退化。生物修复是指土壤中的生物(如植物、动物和微生物等)通过生命活动将土壤中的有毒有害物质(重金属、有机污染物等)吸收、转化或者降解,从而降低其生物有效性或毒性,保障农作物的安全生产。生物修复方法因成本低、无二次污染、效果显著等特点逐渐成为修复重金属污染土壤的重要手段[2]。
1.3 重金属污染土壤的植物修复技术随着超富集植物的发现,植物修复技术(Phytoremediation)被认为是针对重金属污染土壤的可持续修复技术,并得到了广泛认可。植物修复技术的关键是发现污染物的超富集植物,目前,世界上共发现超富集植物有400余种。植物修复技术能够治理包括土壤、水体、大气中的重金属(Cd、Cr(Ⅵ)、Pb、Co、Cu、Ni、Zn、As)、有机污染物、放射性元素(Sr、Ur、Cs)、硝酸盐、铵盐、磷酸盐等环境污染物。研究发现,伴矿景天、东南景天、商陆、龙葵等植物均对Cd具有较强的富集能力,地上部分的Cd浓度可以达到400 mg/kg[11-12];蜈蚣草对As具有超强的富集能力,其地上部砷的浓度可达干物重的1%以上[13-14],蜈蚣草吸收的砷能在其根部被高效还原,并转运到地上部的羽叶中储存[15-16]。这些超富集植物被认为是修复重金属污染物土壤的理想植物。
尽管植物修复被认为是一种低费用和无污染的修复重金属污染土壤的新途径,但植物修复目前仍存在一些研究瓶颈:首先,大部分已知的超积累植物仅对少数几种污染物超积累(如已经发现的400余种超积累植物中,其中有近300种是Ni的超积累植物),对于其他没有发现超富集植物的污染物,无法采用植物修复技术;而且当土壤处于复合污染条件下时,植物修复技术也难以奏效;其次,超富集植物通常因生物量小,吸收累积到地上部的重金属总量并不多,而且超富集植物的生长周期一般较长,植物修复技术难以满足快速修复污染土壤的需求;另外,植物通常只能吸收可溶态的污染物,而且大多数植物根系主要集中在土壤表层,对于土壤中难溶的污染物形态,或者超过修复植物根系作用范围的污染土壤和不利于修复植物生长的土层,植物修复技术都难有效果;再次,多数超富集植物对生长环境都有特殊的要求,在世界范围内引种修复植物比较困难。因此,研究如何提高植物修复污染土壤的效果和适用性非常重要。
2 土壤中的生物资源及其相互作用当前有关超富集植物对重金属污染土壤的修复机制有较多研究,但土壤中除了地上的植物,还包括地下丰富的土壤微生物和动物资源,而且这些生物与植物之间存在复杂的相互作用。2004年,国际知名刊物Science出版了一期名为“Soils-The Final Frontier”的专刊,专刊文章指出:在陆地生态系统中,地上部分的生物与地下部分的生物是相互作用的,共同深刻影响着陆地生态系统的结构与功能,对土壤污染物的迁移转化和生物修复效率也存在深刻影响[17]。
2.1 土壤微生物与植物的相互作用土壤中存在丰富的微生物资源,主要包括细菌、真菌、放线菌、藻类等。通常1 g土壤中有几亿到几百亿个微生物,但其种类和数量会随着成土环境及土层深度的不同而变化。微生物是土壤具有生命力的根本,在全球物质循环和能量流动过程中发挥着不可替代的作用,是土壤关键元素生物地球化学循环的驱动者,在很大程度上影响温室气体排放与消纳,进而调节全球变化[18-19]。土壤微生物是维系陆地生态系统地上-地下相互作用的纽带,土壤微生物可通过自身的活动及其分泌物的作用,对土壤形成、发育、肥力演变等过程产生重大影响,是土壤生命力和生态功能的重要“调控者”[20]。另外,土壤微生物也是地球污染物的净化器,微生物转化深刻影响土壤中污染物的赋存形态和归宿,微生物也可降解或转化土壤中残留的有害物质。而且,土壤微生物的群落结构、生物量、土壤酶活性等微生物学特性对土壤环境质量的变化有敏感的响应,对土壤健康和环境污染有良好的生物指示功能[18-19]。
在土壤中,植物的根内和根际都存在大量的微生物,这些微生物与植物之间就存在复杂的相互作用[21]。植物通过光合作用形成碳水化合物,再将其输送到根部,由根系提供给土壤中的细菌,为根际微生物提供了赖以生存的有机养分和能量的重要来源,最终提高根际土壤中微生物、动物的活性[22]。植物还可以通过影响土壤养分、水分、通气情况、团聚体机构和土壤pH等土壤物理化学状况来影响土壤微生物的群落结构。有研究表明植物多样性与根际土壤微生物的关系十分密切,植物的存在有利于增加土壤微生物的多样性和生物量,而且根际微生物的群落结构随着植物的种类和生长发育过程发生非常强的时空变异[23-27]。
土壤微生物是土壤中有机质的主要分解者,也会对植物产生回馈作用。植物的凋落物、分泌物或植物死亡后的残根败叶,以及施入土壤中的有机肥料,经过土壤微生物的作用,被腐烂分解并释放出营养元素,供植物利用,并且形成腐殖质,改善土壤的结构和肥力,进而有利于植物生长。土壤微生物也能促进土壤中难溶性矿物质溶解,例如磷细菌[28]、硅细菌[29]、钾细菌[30]等能分解出矿石中的磷、硅和钾,为植物生长提供可以吸收利用的矿质元素[30-32]。丛枝菌根真菌是一类广泛存在、且能与陆地上大多数高等植物形成共生关系的土壤真菌[33-34]。丛枝菌根真菌能从宿主植物获取光合作用形成的碳水化合物以维持自身生长,也能帮助宿主植物从土壤中吸收矿质养分和水分。土壤微生物还可以是植物养分的生产者,例如,固氮微生物能将植物不能直接利用的氮气还原为氨,固定的氮素除供自身生长发育外,部分可以无机状态或简单的有机氮化物分泌于体外,供植物吸收利用[30]。另外,根际微生物也可以通过分泌维生素、生长激素、抗生素等物质,与植物形成紧密的交叉对话机制,进而直接或间接促进植物生长[35-38]。例如,Lu等[38]证明拟南芥根际分泌物能调控根际微生物的群落结构,根际微生物再通过调节土壤N循环和分泌植物激素(如吲哚乙酸,IAA)来反馈调控植物的生长和开花;水稻根系可以促进砷还原细菌成团泛菌Pantoea agglomerans的生长而减少水稻对砷的吸收[39]。还有研究表明土壤微生物还可以是植物的保护者,例如有研究发现一些植物的内生菌会产生毒素以保护植物不被草食性动物食用,如苇状羊茅内生真菌Neotyphodium coenophialum[40]。
2.2 土壤动物与植物的相互作用土壤动物包括土壤中和落叶下生存着的各种动物,约占全球生物多样性的23%[41]。土壤动物包括原生动物和后生动物。原生动物通常是单细胞动物,结构简单,大小在几微米到1 cm之间,包括鞭毛虫类、根足虫类和纤毛虫类。土壤原生动物的数量很大,分布广,形态差异大。在各类土壤中都有原生动物,通常表土中数量较多,每克土壤中大约有104–105个,下层土壤中较少,但不同地区和不同类型的土壤中原生动物的种类和数量有差异。大多数原生动物以细菌为食,对土壤细菌的数量有重要调节作用[42]。土壤后生动物主要包括线虫、节肢动物和无脊椎动物等。线虫在土壤中广泛存在、数量极大,每平方米土壤可达几百万个。线虫可分为植食性线虫和肉食性线虫,植食性线虫以细菌、单细胞藻类、真菌、植物根及腐败有机物为食,其中一部分植食性线虫寄生于高等植物根内,常常能引起多种植物根部的线虫病;肉食性线虫以原生动物、轮虫及其他线虫为食,可寄生在动物的各种器官中[42]。土壤中的节肢动物和无脊椎动物也分布广泛、种类繁多、数量庞大,主要包括螨虫、跳虫、蚂蚁、蚯蚓、鼹鼠、蜘蛛等。土壤动物是土壤生态系统的重要组成部分,一方面作为消费者,积极同化各种有用物质供其自身生长所用,另一方面,多数土壤动物能参与有机物的分解,能将落到地面上的枯枝落叶和埋于地下的植物根茎以及各类动物的粪便、尸体等进行粉碎,然后与微生物共同将各类碎片进行分解,成为可被利用的营养物质,而且,土壤动物将其排泄产物归还到土壤中不断改造土壤物理结构。因此,土壤动物在促进土壤物质循环和能量转化过程中发挥着重要作用,对维持土壤生态系统的结构和功能具有重要调节作用[42-46]。另外,土壤动物的群落结构和多样性特征对生境变化具有较为敏感的响应,能客观反映生态系统的健康和稳定程度,因此,土壤动物在环境毒理学和生态风险评估研究领域被广泛应用,是指示环境变化的良好指示生物[47]。
土壤动物与植物之间也存在复杂的相互作用,一方面,植物可通过调节进入土壤生态系统中资源的质量与数量而影响对土壤动物的营养物质供给,多数土壤动物以植物的根或茎叶为食,或依靠着植物作为其居所、以及氧气的提供者,当然,也存在少部分能捕食昆虫的植物,如捕蝇草和茅膏菜,它们捕捉及消化小动物以获取矿物质,尤其是氮。另一方面,土壤动物通过与微生物共同分解有机质促进营养周转,调节植物根系的营养状况来影响植物的初级生产力。土壤动物将其排泄产物或死亡后的残体归还到土壤中,被微生物分解成能被植物利用的养分,土壤中多数动物能与微生物共同参与有机质的分解,加速土壤营养物质的分解和还原。另外,一些土壤动物通过自身的活动改变土壤的物理结构,从而间接地影响植物的生长,例如蚯蚓通过其挖掘和排泄活动,使土壤疏松并提高土壤通气性,从而有利于植物的生长[42]。土壤动物和植物之间也存在共生关系,例如,适蚁植物是一种和蚂蚁共演化的植物,此类植物会提供蚂蚁居所,有时还有食物,作为交换,蚂蚁则会帮助植物防卫草食性动物,且有时还会帮助其和其他植物竞争,蚂蚁的废物还可以提供给植物作有机肥料。当然,也有一些土壤动物能寄生于植物体内形成寄生关系,并且对植物的生长发育造成损害,如线虫寄生于植物根部形成线虫病,吸取植物汁液的红叶螨(红蜘蛛)等。因此,有研究表明,地上植物的多样性与地下土壤动物的多样性有着紧密的联系[48-49]。
2.3 土壤微生物与土壤动物的相互作用土壤动物与微生物之间存在着复杂的相互作用,土壤动物通过捕食、消化和排泄等作用来调节土壤中微生物的群落结构。中小型的原生动物、螨虫、跳虫和蚯蚓等通常以细菌、真菌和藻类为食;大型的土壤动物等还可以通过非取食作用来影响土壤微生物的群落结构,例如,土壤动物对有机质的机械粉碎作用, 有利于扩大微生物与有机质的接触面,也可以通过改变土壤团粒结构、透气性、pH等土壤性质,或者影响养分循环和植物生长等间接作用于土壤微生物[42]。
土壤动物的肠道是土壤微生物另一重要的“栖息地”,是一个天然可移动的微生物存储库。人体肠道微生物的生态功能研究受到Nature和Science等顶尖杂志的持续关注[50-52],这些肠道微生物对宿主的健康(免疫、肥胖等)有重要的影响。近年来,土壤动物的肠道微生物的生态功能也受到关注,笔者前期开展了一系列针对土壤动物肠道微生物参与土壤养分循环、污染物迁移转化等过程的研究[54-62]。例如,Wang等[60]研究表明蚯蚓肠道中存在能将五价砷还原、三价砷甲基化的微生物,这些功能微生物能促进砷在动物肠道中的转化。Zhou等[62]研究表明蚯蚓肠道中的Fe(Ⅱ)/Fe(Ⅲ)、亚硝酸盐/硝酸盐比要比土壤高,在蚯蚓肠道内容物中Fe(Ⅲ)还原菌由具有发酵能力的梭菌Clostridium、芽孢杆菌Bacillus和脱硫肠状菌Desulfotomaculum所主导,而在原位土壤中Fe(Ⅲ)还原菌则由地杆菌Geobacter主导;并且,蚯蚓肠道内容物中多种还原Fe(Ⅲ)的微生物都具有反硝化功能,结果说明蚯蚓肠道微生物对土壤中Fe、C和N等养分循环的巨大潜能。
2.4 土壤中微生物-植物-动物的食物网关系在土壤生态系统中,微生物、植物、动物之间通过物质循环和能量传递形成一种错综复杂的网络联系[63],这种生物之间消费者-资源关系的网络被称为土壤食物网[64-65](图 1)。通常认为土壤食物网主要包含了资源基质(植物根系及其分泌物、生物残体)、土壤微生物(细菌和真菌等分解者)、食微动物(食细菌线虫、食真菌线虫、植物寄生线虫、原生动物)及其捕食者(捕食食微动物),生物之间存在取食与被取食(或竞争)的关系[64]。土壤食物网具有一定结构和功能,构成土壤食物网的各个功能群之间相互作用,同时受到上行和下行效应的控制[66]。例如,Mikola等[67]的微宇宙培养试验表明投放捕食性线虫和食细菌线虫可降低培养体系中的食微线虫和微生物的生物量。另外,当环境变化(例如土壤污染)影响土壤某类生物个体时,就可能通过营养级联等效应(如捕食、竞争等)进一步影响其他生物。如笔者前期的研究表明,当在跳虫的培养体系中投放捕食螨时,跳虫与捕食螨之间的捕食作用会提高猎物(跳虫)对重金属镉的耐性[68],类似的结果也在有机污染物如伊维菌素的研究中被证实[69]。食物网中的生物之间除了上述的直接关系外,生物间常常会通过级联效应对土壤生态系统产生重要的影响。例如,Hawlena等[70]证明食物网中草食动物对被捕食的恐惧能减缓土壤微生物对植物凋落物的分解,他们发现草食动物在有捕食者(蚱蜢和蜘蛛)的胁迫下,其体内碳氮比要高于没有捕食胁迫的动物,这种元素含量的变化能改变进入土壤中蛋白质的结构,进而干扰地下生物群落的功能,最终导致植物凋落物的分解过程减缓。
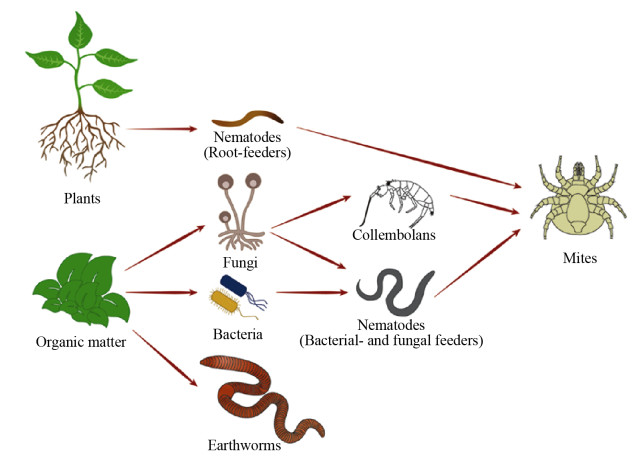 |
| 图 1 土壤中的食物网示意图 Fig. 1 Schematic diagram of food web in soils. |
| 图选项 |
土壤食物网的复杂性与稳定性与土壤的生态系统功能密切相关,对土壤生态系统的健康和可持续具有重大意义。在一个具有复杂食物网的生态系统中,一般不会由于一种生物的消失而引起整个生态系统的失调,但是任何一种生物的绝灭都会在不同程度上使生态系统的稳定性有所下降[71-74]。当一个生态系统的食物网变得非常简单的时候,任何外力(环境的改变)都可能引起这个生态系统发生剧烈的波动[75-76]。由于人为活动,Eisenhauer等[77]认为土壤无脊椎动物的多样性正在快速下降,某些种类无脊椎动物正在消亡,而一种动物的消亡会通过营养级联作用影响其他生物,从而对土壤食物网的复杂性和稳定性构成风险。
当前基于食物网的生态学研究在生态系统功能、全球气候变化、生物多样性等方面得到了比较广泛的应用[78-82],但在土壤环境研究领域的应用还比较少见。目前,有关污染物迁移转化、污染生态风险或污染生物修复方法等方面的研究通常只是针对某一类生物展开研究,这就有可能忽略了生物之间的相互作用对土壤生态系统结构和功能的调节作用,从而低估了土壤环境污染的生态风险,并且降低了生物修复污染土壤的效果。
3 微生物-植物-动物多元生物协同修复技术如前所述,土壤是一个复杂的生物体系,微生物和(或)动物强化的植物修复方法具有巨大的研究价值,该方法集合了单一生物修复方法的优势,取长补短,可以达到强化生物修复的效果。
3.1 土壤微生物-植物协同修复技术微生物可通过多种途径强化植物修复重金属污染土壤的效果,总体来说可分为直接作用和间接作用。直接作用主要是微生物对土壤重金属的活化、吸收、转化和固持等方面,而间接作用则主要是微生物通过促进植物生长,从而增强植物修复效果。研究表明,微生物可直接参与重金属的迁移转化,如吸附、沉淀、络合、氧化还原、甲基化与去甲基化等作用,从而影响根际重金属的形态和生物有效性[18-19]。例如,环境中的细菌、真菌等微生物本身会与重金属发生离子交换、细胞表面络合等作用,也可以通过分泌胞外聚合物(多糖、脂类、蛋白质等)的方式,与镉、锌、汞等重金属发生反应,起到固定重金属的作用。微生物还可以分泌有机酸、球囊霉素等物质来改变根际微环境,进而影响重金属生物有效性和植物对重金属的吸收,如Leung等[83]发现,菌根真菌的分泌物能促使磷矿物的分解,活化土壤中的砷,提高蜈蚣草对砷的吸收积累。微生物还可以通过氧化还原或者甲基化和去甲基化作用,降低变价重金属(铬、砷等)的毒性,无机砷还可以通过微生物甲基化作用挥发,从而降低土壤中砷的毒性[84]。除了上述的直接作用外,微生物还可以通过改善土壤物理结构、提高土壤养分、促进植物生长、防控病虫害等等机制来间接提高植物修复重金属污染土壤的效率。例如,Rajkumar和Freitas[85]研究发现接种产铁载体的假单胞菌和巨大芽孢杆菌能够缓解重金属离子对印度芥菜的毒害作用并提高植物生物量,促进植物修复污染土壤的效率;Wu等[86]表明印度芥菜接种植物促生菌(固氮菌、磷细菌和钾细菌)能促进印度芥菜的生长,提高印度芥菜对重金属Pb和Zn修复效果;Chen等[87]的研究表明,接种假单胞菌和热带念珠菌能促进东南景天和黑麦草对Cd和Zn的吸收;Jian等[88]的研究表明,接种根瘤菌和农杆菌能提高豆科植物苜蓿的产量,并促进了苜蓿对Cu和Zn的吸收积累。
丛枝菌根真菌是一类广泛存在的专性共生土壤真菌,能够与陆地上大多数高等植物形成共生关系[33-34]。大量研究证明菌根的共生结构对重金属有固持和区隔化作用,从而减少了重金属自植物根系向地上部的运输。Chen等发现菌根真菌能降低一系列重金属向植物地上部的转运,如Zn[89]、Cd[90]、U[91]、As[92]、Cu[93]。近年来,Wu等针对菌根真菌对植物吸收转运Cr开展了一系列的研究,他们发现菌根真菌菌丝吸收的Cr多数被固持在植物根系中,只有少量被转移到地上部,进一步基于同步辐射的软X射线扫描透射显微成像技术发现Cr在菌根根系中主要分布于真菌结构(如丛枝、泡囊等)中[94-96]。此外,利用基于同步辐射的X射线荧光分析发现Cd主要聚集在丛枝、泡囊等结构中[97]。菌根真菌不仅可以直接参与重金属的迁移转化,还可以通过对宿主的促生机制间接地提高植物修复重金属污染土壤的效果[33]。
3.2 土壤微生物-动物-植物协同修复技术与土壤微生物相比,土壤动物(如蚯蚓、线虫、甲螨、鼠妇等)对重金属的吸收、运载和富集作用研究较少。土壤动物一方面可以通过自身的吸收来富集重金属,从而降低土壤重金属含量,另一方面也可以通过自身的活动改善土壤中重金属的活化能力,从而促进植物对其富集[98]。通过盆栽实验,俞协治和成杰民[99]发现蚯蚓活动显著提高了黑麦草地上部的生物量,并且增加了黑麦草对Cu的吸收量,但Cd的吸收量无显著变化。王丹丹等[100]发现加入蚯蚓能使印度芥菜和黑麦草中的Zn总累积量分别提高57.8%–131.6%、51.4%–150.5%。Aghababaei等[101]的研究表明菌根真菌和蚯蚓共同作用能显著提高玉米对Cd污染土壤的修复效果。Lemtiri等[102]也证明蚯蚓能显著提高蚕豆和玉米对Cu、Zn、Pb和Cd几种重金属的积累,进而提高污染土壤的修复效果。Elyamine等[103]研究表明蚯蚓能提高燕麦和向日葵对Cd污染土壤的修复效果。Kaur等[104]的结果表明蚯蚓能诱导芥菜对Cd的抗氧化作用,提高对Cd的耐性和积累。土壤动物除了自身的生物强化修复作用外,其体外和体内能携带大量的微生物,这些微生物对宿主的健康有重要影响[105-107]。近年来,动物肠道微生物对重金属迁移转化的作用得到了广泛的关注,例如,Sun等[108]通过模拟人体胃肠系统,发现在结肠阶段,肠道微生物能将五价砷还原成三价砷,其中部分三价砷能够进一步被甲基化形成剧毒的还原态甲基砷。Wang等[109]的研究表明当蚯蚓暴露在五价砷污染的土壤中28 d后,蚯蚓肠道中的砷形态与土壤中的砷形态发生了显著变化,蚯蚓肠道中的砷主要是三价砷(56.17%–84.67%),而且还有约20%的砷甜菜碱和少量的二甲基砷。
近年来,国内外有大量研究证明生物之间的相互作用能够影响土壤中重金属的迁移转化,并且提高重金属污染土壤的生物修复效果(表 1)[110-126]。综上所述,在现实土壤中,微生物、植物和动物是彼此不可分割、相互紧密联系的生态网络,多元生物的协同修复技术将是未来修复重金属污染土壤的研究前沿和热点(图 2)。
表 1 生物协同作用提高土壤重金属生物修复效率Table 1 Interactions among soil biota increased the bioremediation efficiency of heavy metal contaminated soil
| Organisms | Pollutants | Refereces |
| Rhizobacterium D14 (Agrobacterium radiobacter); poplar (Populus deltoides LH05-17) | As | [108] |
| Staphylococcus arlettae strain NBRIEAG-6; Indian mustard plant [Brassica juncea (L.) Czern. Var. R-46] | As | [109] |
| Micrococcus sp. MU1; Klebsiella sp. BAM1; Helianthus annuus | Cd | [110] |
| Arbuscular mycorrhizal (AM) fungi (Rhizophagus irregularis and Funneliformis mosseae); Earthworms | Cd | [99] |
| Brassica juncea; Earthworms | [102] | |
| Bacillus megaterium; Orychophragmus violaceus | Cd | [111] |
| Rahnella sp. JN27; Amaranthus hypochondriacus; Amaranthus mangostanus | Cd | [112] |
| Oat (Avena sativa); Sunflower (Helianthus annuus); Earthworms | Cd | [101] |
| Rhizobium leguminosarum; Brassica juncea | Zn | [113] |
| Flavobacterium sp.; Orychophragmus violaceus | Zn | [114] |
| Pantoea agglomerans Jp3-3; Brassica napus | Cu | [115] |
| Pseudomonas sp. A3R3; Alyssum serpyllifolium | Ni | [116] |
| Pantoea stewartii strain ASI11, Microbacterium arborescens strain HU33; Enterobacter sp. HU38; Ryegrass | Cr | [117] |
| Bacillus pumilus E2S2; Bacillus sp. E1S2; Sedum plumbizincicola | Cd; Zn | [118] |
| Pseudomonas sp. Lk9; Solanum nigrum | Cd; Zn; Cu | [119] |
| Rahnella sp. JN6; Brassica napus | Cd; Pb; Zn | [120] |
| Enterobacter sp. JYX7; Klebsiella sp. JYX10; Brassica napus | Cu; Pb; Zn | [121] |
| Lead-tolerant fungus ZJ1; Sorghum bicolor L. | Pb; Ni; Cu | [122] |
| Vicia faba; Zea mays; Earthworms (Eisenia fetida) | Cu; Zn; Pb; Cd | [100] |
| Lupinus luteus; Bradyrhizobium sp., Pseudomonas sp. and Ochrobactrum cytisi | Cu; Cd; Pb; As Zn | [123] |
| Bacillus thuringiensis GDB-1; Alnus firma | As; Cu; Pb; Ni; Zn | [124] |
表选项
 |
| 图 2 基于食物网的多元生物修复技术 Fig. 2 Remediation technology with multi-organisms based on food web. |
| 图选项 |
4 展望我国土壤重金属污染严重,开发高效、普适的生物修复技术是当前的瓶颈科学问题。土壤中的生物通过物质循环和能量传递形成错综复杂的网络联系,未来可在已有关于重金属污染土壤生物多样性及其功能研究基础上,在食物网水平上深入研究土壤生物间的相互作用机制及其对重金属迁移转化的影响机制,提出土壤食物网的定向调控原理与技术,建立多元生物联合强化的污染土壤修复新技术,并形成基于食物网的土壤污染生态风险评估体系。
参考文献
| [1] | Zhao QG, Luo YM. The macro strategy of soil protection in China. Bull Chin Acad Sci, 2015, 30(4): 452-458 (in Chinese). 赵其国, 骆永明. 论我国土壤保护宏观战略. 中国科学院院刊, 2015, 30(4): 452-458. |
| [2] | Chen SB, Wang M, Li SS, et al. Current status of and discussion on farmland heavy metal pollution prevention in China. Earth Sci Front, 2019, 26(6): 35-41 (in Chinese). 陈世宝, 王萌, 李杉杉, 等. 中国农田土壤重金属污染防治现状与问题思考. 地学前缘, 2019, 26(6): 35-41. |
| [3] | The Ministry of Environmental Protection; The Ministry of Land and Resources Report on the national soil contamination survey. 2014[EB/OL]. [2019-12-20]. http://www.mee.gov.cn/gkml/sthjbgw/qt/201404/t20140417_270670.htm. 中华人民共和国生态环境部和中华人民共和国自然资源部, 全国土壤污染状况调查公报, 2014[EB/OL]. [2019-12-20]. http://www.mee.gov.cn/gkml/sthjbgw/qt/201404/t20140417_270670.htm. |
| [4] | Fu GW. Countermeasures for water and soil heavy metal pollution in China. China Environ Sci, 2012, 32(2): 373-376 (in Chinese). 傅国伟. 中国水土重金属污染的防治对策. 中国环境科学, 2012, 32(2): 373-376. |
| [5] | Wang P, Wang J, Chen HP, et al. Cadmium risk and mitigation in paddy systems in China. J Agro-Environ Sci, 2018, 37(7): 1409-1417 (in Chinese). 汪鹏, 王静, 陈宏坪, 等. 我国稻田系统镉污染风险与阻控. 农业环境科学学报, 2018, 37(7): 1409-1417. |
| [6] | Zhu YG, Sun GX, Lei M, et al. High percentage inorganic arsenic content of mining impacted and nonimpacted Chinese rice. Environ Sci Technol, 2008, 42(13): 5008-5013. DOI:10.1021/es8001103 |
| [7] | Li G, Sun GX, Williams PN, et al. Inorganic arsenic in Chinese food and its cancer risk. Environ Int, 37(7): 1219-1225. DOI:10.1016/j.envint.2011.05.007 |
| [8] | Song Y, Wang Y, Mao WF, et al. Dietary cadmium exposure assessment among the Chinese population. PLoS ONE, 2017, 12(5): e0177978. DOI:10.1371/journal.pone.0177978 |
| [9] | Gilbert-Diamond D, Cottingham KL, Gruber JF, et al. Rice consumption contributes to arsenic exposure in US women. Proc Natl Acad Sci USA, 2011, 108(51): 20656-20660. DOI:10.1073/pnas.1109127108 |
| [10] | Yan HJ, Wang BX, Tang Z, et al. Effects of water management and fertilizer application on cadmium and arsenic accumulation in rice plants under filed condition. J Agro-Environ Sci, 2018, 37(7): 1448-1455 (in Chinese). 颜惠君, 王伯勋, 唐仲, 等. 田间水肥管理措施及石灰施用对水稻Cd和As积累的影响. 农业环境科学学报, 2018, 37(7): 1448-1455. |
| [11] | Yang X E, Long XX, Ni WZ, et al. Sedum alfredii H:A new Zn hyperaccumulating plant first found in China. Chin Sci Bull, 2002, 47(19): 1634-1637 (in Chinese). 杨肖娥, 龙新宪, 倪吾钟, 等. 东南景天(Sedum alfredii H.)—一种新的锌超积累植物. 科学通报, 2002, 47(13): 1003-1006. |
| [12] | Wu LH, Zhou SB, Bi D, et al. Sedum plumbizincicola, a new species of the crassulaceae from Zhejiang, China. Soils, 2006, 38(5): 632-633 (in Chinese). 吴龙华, 周守标, 毕德, 等. 中国景天科植物一新种-伴矿景天. 土壤, 2006, 38(5): 632-633. |
| [13] | Ma LQ, Komar KM, Tu C, et al. A fern that hyperaccumulates arsenic. Nature, 2001, 409(6820): 579. DOI:10.1038/35054664 |
| [14] | Chen TB, Wei CY, Huang ZC, et al. Arsenic hyperaccumulator Pteris vittata L. and its arsenic accumulation. Chin Sci Bull, 2002, 47(11): 902-905 (in Chinese). 陈同斌, 韦朝阳, 黄泽春, 等. 砷超富集植物蜈蚣草及其对砷的富集特征. 科学通报, 2002, 47(3): 207-210. |
| [15] | Duan GL, Zhu YG, Tong YP, et al. Characterization of arsenate reductase in the extract of roots and fronds of chinese brake fern, an arsenic hyperaccumulator. Plant Physiol, 2005, 138(1): 461-469. DOI:10.1104/pp.104.057422 |
| [16] | Duan GL, Wang LH, Chen Y, et al. Recent developments in understanding the mechanisms of arsenic hyperaccumulation in plants. Acta Sci Circumstant, 2007, 27(5): 714-720 (in Chinese). 段桂兰, 王利红, 陈玉, 等. 植物超富集砷机制研究的最新进展. 环境科学学报, 2007, 27(5): 714-720. |
| [17] | Sugden A, Stone R, Ash C. Ecology in the Underworld. Science, 2004, 304(5677): 1613. DOI:10.1126/science.304.5677.1613 |
| [18] | Zhu YG, Shen RF, He JZ, et al. China soil microbiome initiative: progress and perspective. Bull Chin Acad Sci, 2017, 32(6): 554-565 (in Chinese). 朱永官, 沈仁芳, 贺纪正, 等. 中国土壤微生物组:进展与展望. 中国科学院院刊, 2017, 32(6): 554-565. |
| [19] | Yang GW, Wagg C, Veresoglou SD, et al. How soil biota drive ecosystem stability. Trends Plant Sci, 2018, 23(12): 1057-1067. DOI:10.1016/j.tplants.2018.09.007 |
| [20] | Zhu YG, Zhao Y, Zhu D, et al. Soil biota, antimicrobial resistance and planetary health. Environ Int, 2019, 131: 105059. DOI:10.1016/j.envint.2019.105059 |
| [21] | Ding LJ, Cui HL, Nie SA, et al. Microbiomes inhabiting rice roots and rhizosphere. FEMS Microbiol Ecol, 2019, 95(5). DOI:10.1093/femsec/fiz040 |
| [22] | Mitchell CE, Tilman D, Groth JV. Effects of grassland plant species diversity, abundance, and composition on foliar fungal disease. Ecology, 2002, 83(6): 1713-1726. DOI:10.1890/0012-9658(2002)083[1713:EOGPSD]2.0.CO;2 |
| [23] | Viketoft M, Palmborg C, Sohlenius B, et al. Plant species effects on soil nematode communities in experimental grasslands. Appl Soil Ecol, 2005, 30(2): 90-103. DOI:10.1016/j.apsoil.2005.02.007 |
| [24] | Milcu A, Allan E, Roscher C, et al. Functionally and phylogenetically diverse plant communities key to soil biota. Ecology, 2013, 94(8): 1878-1885. DOI:10.1890/12-1936.1 |
| [25] | Haichar FEZ, Santaella C, Heulin T, et al. Root exudates mediated interactions belowground. Soil Biol Biochem, 2014, 77: 69-80. DOI:10.1016/j.soilbio.2014.06.017 |
| [26] | Chen DM, Pan QM, Bai YF, et al. Effects of plant functional group loss on soil biota and net ecosystem exchange: a plant removal experiment in the Mongolian grassland. J Ecol, 2016, 104(3): 734-743. DOI:10.1111/1365-2745.12541 |
| [27] | Eisenhauer N, Be?ler H, Engels C, et al. Plant diversity effects on soil microorganisms support the singular hypothesis. Ecology, 2010, 91(2): 485-496. DOI:10.1890/08-2338.1 |
| [28] | Wahid OA, Mehana TA. Impact of phosphate-solubilizing fungi on the yield and phosphorus-uptake by wheat and faba bean plants. Microbiol Res, 2000, 155(3): 221-227. DOI:10.1016/S0944-5013(00)80036-1 |
| [29] | Sheng XF, Zhao F, He LY, et al. Isolation and characterization of silicate mineral-solubilizing Bacillus globisporus Q12 from the surfaces of weathered feldspar. Can J Microbiol, 2008, 54(12): 1064-1068. DOI:10.1139/W08-089 |
| [30] | Leaungvutiviroj C, Ruangphisarn P, Hansanimitkul P, et al. Development of a new biofertilizer with a high capacity for N2 fixation, phosphate and potassium solubilization and auxin production. Biosci Biotechnol Biochem, 2010, 74(5): 1098-1101. DOI:10.1271/bbb.90898 |
| [31] | Bashan Y. Inoculants of plant growth-promoting bacteria for use in agriculture. Biotechnol Adv, 1998, 16(4): 729-770. DOI:10.1016/S0734-9750(98)00003-2 |
| [32] | Vaid SK, Kumar A, Sharma A, et al. Role of some plant growth promotory bacteria on enhanced fe uptake of wheat. Commun Soil Sci Plant Anal, 2017, 48(7): 756-768. DOI:10.1080/00103624.2017.1298780 |
| [33] | Smith SE, Read DJ. Mycorrhizal Symbiosis. 3rd ed. San Diego: Academic Press, 2008: 13-15. |
| [34] | Chen BD, Zhang X, Wu SL, et al. The Role of Arbuscular mycorrhizal fungi in heavy metal translocation, transformation and accumulation in the soil-plant continuum: underlying mechanisms and ecological implications. Rock Min Anal, 2019, 38(1): 1-25 (in Chinese). 陈保冬, 张莘, 伍松林, 等. 丛枝菌根影响土壤-植物系统中重金属迁移转化和累积过程的机制及其生态应用. 岩矿测试, 2019, 38(1): 1-25. |
| [35] | Philippot L, Raaijmakers JM, Lemanceau P, et al. Going back to the roots: the microbial ecology of the rhizosphere. Nat Rev Microbiol, 2013, 11(11): 789-799. DOI:10.1038/nrmicro3109 |
| [36] | Edwards J, Johnson C, Santos-Medellín C, et al. Structure, variation, and assembly of the root-associated microbiomes of rice. Proce Natl Acad Sci USA, 2015, 112(8): E911-E920. DOI:10.1073/pnas.1414592112 |
| [37] | Lebeis SL. Greater than the sum of their parts: characterizing plant microbiomes at the community-level. Curr Opin Plant Biol, 2015, 24: 82-86. DOI:10.1016/j.pbi.2015.02.004 |
| [38] | Lu T, Ke MJ, Lavoie M, et al. Rhizosphere microorganisms can influence the timing of plant flowering. Microbiome, 2018, 6: 231. DOI:10.1186/s40168-018-0615-0 |
| [39] | Lakshmanan V, Shantharaj D, Li G, et al. A natural rice rhizospheric bacterium abates arsenic accumulation in rice (Oryza sativa L.). Planta, 2015, 242(4): 1037-1050. DOI:10.1007/s00425-015-2340-2 |
| [40] | Christensen MJ, Easton HS, Simpson WR, et al. Occurrence of the fungal endophyte Neotyphodium coenophialum in leaf blades of tall fescue and implications for stock health. New Zealand J Agric Res, 1998, 41(4): 595-602. DOI:10.1080/00288233.1998.9513343 |
| [41] | Deca?ns T, Jiménez JJ, Gioia C, et al. The values of soil animals for conservation biology. Eur J Soil Biol, 2006, 42(S1): S23-S38. |
| [42] | Shao YH, Zhang WX, Liu SJ, et al. Diversity and function of soil fauna. Acta Ecol Sin, 2015, 35(20): 6614-6625 (in Chinese). 邵元虎, 张卫信, 刘胜杰, 等. 土壤动物多样性及其生态功能. 生态学报, 2015, 35(20): 6614-6625. |
| [43] | Fu SL. A review and perspective on soil biodiversity research. Biodiv Sci, 2007, 15(2): 109-115 (in Chinese). 傅声雷. 土壤生物多样性的研究概况与发展趋势. 生物多样性, 2007, 15(2): 109-115. |
| [44] | Dong WH, Li XQ, Song Y. Role of soil fauna on soil organic matter formation. Soils, 2016, 48(2): 211-218 (in Chinese). 董炜华, 李晓强, 宋扬. 土壤动物在土壤有机质形成中的作用. 土壤, 2016, 48(2): 211-218. |
| [45] | Wang SJ, Wang H, Li JH, et al. Ants can exert a diverse effect on soil carbon and nitrogen pools in a Xishuangbanna tropical forest. Soil Biol Biochem, 2017, 113: 45-52. DOI:10.1016/j.soilbio.2017.05.027 |
| [46] | Nie LK, Yu ZD, Kong FL, et al. Advance in study on effects of soil fauna on soil carbon cycling. Chin J Ecol, 2019, 38(3): 882-890 (in Chinese). 聂立凯, 于政达, 孔范龙, 等. 土壤动物对土壤碳循环的影响研究进展. 生态学杂志, 2019, 38(3): 882-890. |
| [47] | Shao YH, Zhang WX, Shen JC, et al. Nematodes as indicators of soil recovery in tailings of a lead/zinc mine. Soil Biol Biochem, 2008, 40(8): 2040-2046. DOI:10.1016/j.soilbio.2008.04.014 |
| [48] | Viketoft M, Bengtsson J, Sohlenius B, et al. Long-term effects of plant diversity and composition on soil nematode communities in model grasslands. Ecology, 2009, 90(1): 90-99. DOI:10.1890/08-0382.1 |
| [49] | Yan J, Wu JH. Study advances in plant diversity effects on soil Fauna. Soils, 2018, 50(2): 231-238 (in Chinese). 严珺, 吴纪华. 植物多样性对土壤动物影响的研究进展. 土壤, 2018, 50(2): 231-238. |
| [50] | Turnbaugh PJ, Ley RE, Mahowald MA, et al. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature, 2006, 444(7122): 1027-1031. DOI:10.1038/nature05414 |
| [51] | Ross BD, Verster AJ, Radey MC, et al. Human gut bacteria contain acquired interbacterial defence systems. Nature, 2019, 575(7781): 224-228. DOI:10.1038/s41586-019-1708-z |
| [52] | Zeevi D, Korem T, Godneva A, et al. Structural variation in the gut microbiome associates with host health. Nature, 2019, 568(7750): 43-48. DOI:10.1038/s41586-019-1065-y |
| [53] | Zimmermann M, Zimmermann-Kogadeeva M, Wegmann R, et al. Separating host and microbiome contributions to drug pharmacokinetics and toxicity. Science, 2019, 363(6427): eaat9931. DOI:10.1126/science.aat9931 |
| [54] | Zhao Y, Su JQ, An XL, et al. Feed additives shift gut microbiota and enrich antibiotic resistance in swine gut. Sci Total Environ, 2018, 621: 1224-1232. DOI:10.1016/j.scitotenv.2017.10.106 |
| [55] | Zhu D, An XL, Chen QL, et al. Antibiotics disturb the microbiome and increase the incidence of resistance genes in the gut of a common soil collembolan. Environ Sci Technol, 2018, 52(5): 3081-3090. DOI:10.1021/acs.est.7b04292 |
| [56] | Zhu BK, Fang YM, Zhu D, et al. Exposure to nanoplastics disturbs the gut microbiome in the soil oligochaete Enchytraeus crypticus. Environ Pollut, 2018, 239: 408-415. DOI:10.1016/j.envpol.2018.04.017 |
| [57] | Ding J, Zhu D, Chen QL, et al. Effects of long-term fertilization on the associated microbiota of soil collembolan. Soil Biol Biochem, 2019, 130: 141-149. DOI:10.1016/j.soilbio.2018.12.015 |
| [58] | Ding J, Zhu D, Li H, et al. The gut microbiota of soil organisms show species-specific responses to liming. Sci Total Environ, 2019, 659: 715-723. DOI:10.1016/j.scitotenv.2018.12.445 |
| [59] | Ma J, Zhu D, Sheng GD, et al. Soil oxytetracycline exposure alters the microbial community and enhances the abundance of antibiotic resistance genes in the gut of Enchytraeus crypticus. Sci Total Environ, 2019, 673: 357-366. DOI:10.1016/j.scitotenv.2019.04.103 |
| [60] | Wang HT, Ding J, Xiang C, et al. Exposure to microplastics lowers arsenic accumulation and alters gut bacterial communities of earthworm Metaphire californica. Environ Pollut, 2019, 251: 110-116. DOI:10.1016/j.envpol.2019.04.054 |
| [61] | Xiang Q, Zhu D, Chen QL, et al. Effects of diet on gut microbiota of soil collembolans. Scie Total Environ, 2019, 676: 197-205. DOI:10.1016/j.scitotenv.2019.04.104 |
| [62] | Zhou GW, Yang XR, Sun AQ, et al. Mobile incubator for Iron(Ⅲ) reduction in the gut of the soil-feeding earthworm Pheretima guillelmi and interaction with denitrification. Environ Sci Technol, 2019, 53(8): 4215-4223. DOI:10.1021/acs.est.8b06187 |
| [63] | Goudard A, Loreau M. Nontrophic interactions, biodiversity, and ecosystem functioning: an interaction web model. Am Nat, 2008, 171(1): 91-106. DOI:10.1086/523945 |
| [64] | Lavelle P. Faunal activities and soil processes: Adaptive strategies that determine ecosystem function. Adv Ecol Res, 1997, 27: 93-132. DOI:10.1016/S0065-2504(08)60007-0 |
| [65] | Sackett TE, Classen AT, Sanders NJ. Linking soil food web structure to above-and below ground ecosystem processes: a meta-analysis. Oikos, 2010, 119(12): 1984-1992. DOI:10.1111/j.1600-0706.2010.18728.x |
| [66] | Du XF, Li YB, Liu F, et al. Structure and ecological functions of soil micro-food web. Chin J Appl Ecol, 2018, 29(2): 403-411 (in Chinese). 杜晓芳, 李英滨, 刘芳, 等. 土壤微食物网结构与生态功能. 应用生态学, 2018, 29(2): 403-411. |
| [67] | Mikola J, Set?l? H. No evidence of trophic cascades in an experimental microbial-based soil food web. Ecology, 1998, 79(1): 153-164. DOI:10.1890/0012-9658(1998)079[0153:NEOTCI]2.0.CO;2 |
| [68] | Zhu D, Ke X, Wu LH, et al. Ecotoxicity of cadmium in a soil collembolan-predatory mite food chain: Can we use the N-15 labeled litter addition method to assess soil functional change?. Environ Pollut, 2016, 219: 37-46. DOI:10.1016/j.envpol.2016.09.051 |
| [69] | Jensen J, Scott-Fordsmand JJ. Ecotoxicity of the veterinary pharmaceutical ivermectin tested in a soil multi-species (SMS) system. Environ Pollut, 2012, 171: 133-139. DOI:10.1016/j.envpol.2012.07.014 |
| [70] | Hawlena D, Strickland MS, Bradford MA, et al. Fear of predation slows plant-litter decomposition. Science, 2012, 336(6087): 1434-1438. DOI:10.1126/science.1220097 |
| [71] | Koricheva J, Mulder CPH, Schmid B, et al. Numerical responses of different trophic groups of invertebrates to manipulations of plant diversity in grasslands. Oecologia, 2000, 125(2): 271-282. DOI:10.1007/s004420000450 |
| [72] | Roscher C, Schumacher J, Baade J, et al. The role of biodiversity for element cycling and trophic interactions: an experimental approach in a grassland community. Basic Appl Ecol, 2004, 5(2): 107-121. DOI:10.1078/1439-1791-00216 |
| [73] | Haddad NM, Crutsinger GM, Gross K, et al. Plant species loss decreases arthropod diversity and shifts trophic structure. Ecol Lett, 2010, 12(10): 1029-1039. |
| [74] | Scherber C, Eisenhauer N, Weisser WW, et al. Bottom-up effects of plant diversity on multitrophic interactions in a biodiversity experiment. Nature, 2010, 468(7323): 553-556. DOI:10.1038/nature09492 |
| [75] | Loreau M, Naeem S, Inchausti P, et al. Biodiversity and ecosystem functioning: current knowledge and future challenges. Science, 2001, 294(5543): 804-808. DOI:10.1126/science.1064088 |
| [76] | Tylianakis JM, Tscharntke T, Lewis OT. Habitat modification alters the structure of tropical host-parasitoid food webs. Nature, 2007, 445(7124): 202-205. DOI:10.1038/nature05429 |
| [77] | Eisenhauer N, Bonn A, Guerra CA. Recognizing the quiet extinction of invertebrates. Nat Commun, 2019, 10: 50. DOI:10.1038/s41467-018-07916-1 |
| [78] | Fretwell SD. Food chain dynamics: the central theory of ecology?. Oikos, 1987, 50(3): 291-301. DOI:10.2307/3565489 |
| [79] | Wardle DA, Verhoef HA, Clarholm M. Trophic relationships in the soil microfood-web: Predicting the responses to a changing global environment. Global Change Biol, 1998, 4(7): 713-727. DOI:10.1046/j.1365-2486.1998.00206.x |
| [80] | Cardinale BJ, Srivastava DS, Duffy JE, et al. Effects of biodiversity on the functioning of trophic groups and ecosystems. Nature, 2006, 443(7114): 989-992. DOI:10.1038/nature05202 |
| [81] | Finke DL, Denno RF. Predator diversity dampens trophic cascades. Nature, 2004, 429(6990): 407-410. DOI:10.1038/nature02554 |
| [82] | France KE, Duffy JE. Diversity and dispersal interactively affect predictability of ecosystem function. Nature, 2006, 441(7097): 1139-1143. DOI:10.1038/nature04729 |
| [83] | Leung HM, Wu FY, Cheung KC, et al. Synergistic effects of arbuscular mycorrhizal fungi and phosphate rock on heavy metal uptake and accumulation by an arsenic hyperaccumulator. J Hazardous Mater, 2010, 181(1/3): 497-507. |
| [84] | Wang PP, Chen SC, Zhu YG, et al. Advances in the research of arsenic methylation and volatilization by microorganisms. J Agro-Environ Sci, 2018, 37(7): 1377-1385 (in Chinese). 王培培, 陈松灿, 朱永官, 等. 微生物砷甲基化及挥发研究进展. 农业环境科学学报, 2018, 37(7): 1377-1385. |
| [85] | Rajkumar M, Freitas H. Effects of inoculation of plant-growth promoting bacteria on Ni uptake by Indian mustard. Bioresour Technol, 2008, 99(9): 3491-3498. DOI:10.1016/j.biortech.2007.07.046 |
| [86] | Wu SC, Cheung KC, Luo YM, et al. Effects of inoculation of plant growth-promoting rhizobacteria on metal uptake by Brassica juncea. Environ Pollut, 2006, 140(1): 124-135. DOI:10.1016/j.envpol.2005.06.023 |
| [87] | Chen F, Tan M, Ma J, et al. Efficient remediation of PAH-metal co-contaminated soil using microbial-plant combination: A greenhouse study. J Hazardous Mater, 2016, 302: 250-261. DOI:10.1016/j.jhazmat.2015.09.068 |
| [88] | Jian LR, Bai XL, Zhang H, et al. Promotion of growth and metal accumulation of alfalfa by coinoculation with Sinorhizobium and Agrobacterium under copper and zinc stress. PeerJ, 2019, 7: e6875. DOI:10.7717/peerj.6875 |
| [89] | Chen BD, Li XL, Tao HQ, et al. The role of arbuscular mycorrhiza in zinc uptake by red clover growing in a calcareous soil spiked with various quantities of zinc. Chemosphere, 2003, 50(6): 839-846. DOI:10.1016/S0045-6535(02)00228-X |
| [90] | Chen BD, Liu Y, Shen H, et al. Uptake of cadmium from an experimentally contaminated calcareous soil by arbuscular mycorrhizal maize (Zea mays L.). Mycorrhiza, 2004, 14(6): 347-354. DOI:10.1007/s00572-003-0281-2 |
| [91] | Chen BD, Jakobsen I, Roos P, et al. Effects of the mycorrhizal fungus Glomus intraradices on uranium uptake and accumulation by Medicago truncatula L. from uranium-contaminated soil. Plant Soil, 2005, 275(1/2): 349-359. |
| [92] | Chen BD, Zhu YG, Smith FA. Effects of arbuscular mycorrhizal inoculation on uranium and arsenic accumulation by Chinese brake fern (Pteris vittata L.) from a uranium mining-impacted soil. Chemosphere, 2006, 62(9): 1464-1473. DOI:10.1016/j.chemosphere.2005.06.008 |
| [93] | Chen BD, Zhu YG, Duan J, et al. Effects of the arbuscular mycorrhizal fungus Glomus mosseae on growth and metal uptake by four plant species in copper mine tailings. Environ Pollut, 2007, 147(2): 374-380. DOI:10.1016/j.envpol.2006.04.027 |
| [94] | Wu SL, Zhang X, Sun YQ, et al. Transformation and immobilization of chromium by arbuscular mycorrhizal fungi as revealed by SEM-EDS, TEM-EDS, and XAFS. Environ Sci Technol, 2015, 49(24): 14036-14047. DOI:10.1021/acs.est.5b03659 |
| [95] | Wu SL, Zhang X, Chen BD, et al. Chromium immobilization by extraradical mycelium of arbuscular mycorrhiza contributes to plant chromium tolerance. Environental Exp Bot, 2016, 122: 10-18. DOI:10.1016/j.envexpbot.2015.08.006 |
| [96] | Wu SL, Zhang X, Sun YQ, et al. Chromium immobilization by extra- and intraradical fungal structures of arbuscular mycorrhizal symbioses. J Hazardous Mater, 2016, 316: 34-42. DOI:10.1016/j.jhazmat.2016.05.017 |
| [97] | Nayuki K, Chen BD, Ohtomo R, et al. Cellular imaging of cadmium in resin sections of arbuscular mycorrhizas using synchrotron micro X-ray fluorescence. Microb Environ, 2014, 29(1): 60-66. DOI:10.1264/jsme2.ME13093 |
| [98] | Xu Y, Deng FL. Application of fauna in remediation of soil pollution. Mod Agric Sci Technol, 2018(23): 192, 197 (in Chinese). 徐艳, 邓富玲. 土壤动物在土壤污染修复中的应用. 现代农业科技, 2018(23): 192, 197. |
| [99] | Yu XZ, Cheng JM. Effect of earthworm on bio-availability of Cu and Cd in soils. Acta Ecol Sin, 2003, 23(5): 922-928 (in Chinese). 俞协治, 成杰民. 蚯蚓对土壤中铜、镉生物有效性的影响. 生态学报, 2003, 23(5): 922-928. |
| [100] | Wang DD, Li HX, Wei ZG, et al. Effects of earthworm on Zn concentration and total-Zn uptake of ryegrass and indian mustard in Zn polluted soil. Soils, 2008, 40(1): 73-77 (in Chinese). 王丹丹, 李辉信, 魏正贵, 等. 蚯蚓对污染土壤中黑麦草和印度芥菜吸收累积锌的影响. 土壤, 2008, 40(1): 73-77. |
| [101] | Aghababaei F, Raiesi F, Hosseinpur A. The significant contribution of mycorrhizal fungi and earthworms to maize protection and phytoremediation in Cd-polluted soils. Pedobiologia, 2014, 57(4/6): 223-233. |
| [102] | Lemtiri A, Liénard A, Alabi T, et al. Earthworms Eisenia fetida affect the uptake of heavy metals by plants Vicia faba and Zea mays in metal-contaminated soils. Appl Soil Ecol, 2016, 104: 67-78. DOI:10.1016/j.apsoil.2015.11.021 |
| [103] | Elyamine AM, Moussa MG, Ismael MA, et al. Earthworms, rice straw, and plant interactions change the organic connections in soil and promote the decontamination of cadmium in soil. Int J Environ Res Public Health, 2018, 15(11): 2398. DOI:10.3390/ijerph15112398 |
| [104] | Kaur P, Bali S, Sharma A, et al. Cd induced generation of free radical species in Brassica juncea is regulated by supplementation of earthworms in the drilosphere. Sci Total Environ, 2019, 655: 663-675. DOI:10.1016/j.scitotenv.2018.11.096 |
| [105] | Thakuria D, Schmidt O, Finan D, et al. Gut wall bacteria of earthworms: a natural selection process. ISME J, 2010, 4(3): 357-366. DOI:10.1038/ismej.2009.124 |
| [106] | Zhu D, Chen QL, An XL, et al. Exposure of soil collembolans to microplastics perturbs their gut microbiota and alters their isotopic composition. Soil Biol Biochem, 2018, 116: 302-310. DOI:10.1016/j.soilbio.2017.10.027 |
| [107] | Zhu D, Zheng F, Chen QL, et al. Exposure of a soil collembolan to Ag nanoparticles and AgNO3 disturbs its associated microbiota and lowers the incidence of antibiotic resistance genes in the gut. Environ Sci Technol, 2018, 52(21): 12748-12756. DOI:10.1021/acs.est.8b02825 |
| [108] | Sun GX, Van De Wiele T, Alava P, et al. Arsenic in cooked rice: effect of chemical, enzymatic and microbial processes on bioaccessibility and speciation in the human gastrointestinal tract. Environ Pollut, 2012, 162: 241-246. DOI:10.1016/j.envpol.2011.11.021 |
| [109] | Wang HT, Ding J, Xiong C, et al. Exposure to microplastics lowers arsenic accumulation and alters gut bacterial communities of earthworm Metaphire californica. Environ Pollut, 2019, 251: 110-116. DOI:10.1016/j.envpol.2019.04.054 |
| [110] | Wang Q, Xiong D, Zhao P, et al. Effect of applying an arsenic-resistant and plant growth-promoting rhizobacterium to enhance soil arsenic phytoremediation by Populus deltoides LH05‐17. J Appl Microbiol, 2011, 111(5): 1065-1074. DOI:10.1111/j.1365-2672.2011.05142.x |
| [111] | Srivastava S, Verma PC, Chaudhry V, et al. Influence of inoculation of arsenic-resistant Staphylococcus arlettae on growth and arsenic uptake in Brassica juncea (L.). Czern. Var. R-46. J Hazard Mater, 2013, 262: 1039-1047. DOI:10.1016/j.jhazmat.2012.08.019 |
| [112] | Prapagdee B, Chanprasert M, Mongkolsuk S. Bioaugmentation with cadmium-resistant plant growth-promoting rhizobacteria to assist cadmium phytoextraction by Helianthus annuus. Chemosphere, 2013, 92(6): 659-666. DOI:10.1016/j.chemosphere.2013.01.082 |
| [113] | Liang X, He CQ, Ni G, et al. Growth and Cd accumulation of Orychophragmus violaceus as affected by inoculation of Cd-tolerant bacterial strains. Pedosphere, 2014, 24(3): 322-329. DOI:10.1016/S1002-0160(14)60018-7 |
| [114] | Yuan M, He HD, Xiao L, et al. Enhancement of Cd phytoextraction by two Amaranthus species with endophytic Rahnella sp. JN27. Chemosphere, 2014, 103: 99-104. DOI:10.1016/j.chemosphere.2013.11.040 |
| [115] | Adediran GA, Ngwenya BT, Mosselmans JFW, et al. Mechanisms behind bacteria induced plant growth promotion and Zn accumulation in Brassica juncea. J Hazard Mater, 2015, 283: 490-499. DOI:10.1016/j.jhazmat.2014.09.064 |
| [116] | He CQ, Tan GE, Liang X, et al. Effect of Zn-tolerant bacterial strains on growth and Zn accumulation in Orychophragmus violaceus. Appl Soil Ecol, 2010, 44(1): 1-5. DOI:10.1016/j.apsoil.2009.07.003 |
| [117] | Zhang YF, He LY, Chen ZJ, et al. Characterization of ACC deaminase-producing endophytic bacteria isolated from copper-tolerant plants and their potential in promoting the growth and copper accumulation of Brassica napus. Chemosphere, 2011, 83(1): 57-62. DOI:10.1016/j.chemosphere.2011.01.041 |
| [118] | Ma Y, Rajkumar M, Luo Y, et al. Inoculation of endophytic bacteria on host and non-host plants-effects on plant growth and Ni uptake. J Hazard Mater, 2011, 195: 230-237. DOI:10.1016/j.jhazmat.2011.08.034 |
| [119] | Khan MU, Sessitsch A, Harris M, et al. Cr-resistant rhizo-and endophytic bacteria associated with Prosopis juliflora and their potential as phytoremediation enhancing agents in metal-degraded soils. Front Plant Sci, 2015, 5: 755. |
| [120] | Ma Y, Oliveira RS, Nai FJ, et al. The hyperaccumulator Sedum plumbizincicola harbors metal-resistant endophytic bacteria that improve its phytoextraction capacity in multi-metal contaminated soil. J Environ Manage, 2015, 156: 62-69. DOI:10.1016/j.jenvman.2015.03.024 |
| [121] | Chen L, Luo SL, Li XJ, et al. Interaction of Cd-hyperaccumulator Solanum nigrum L. and functional endophyte Pseudomonas sp. Lk9 on soil heavy metals uptake. Soil Biol Biochem, 2014, 68: 300-308. DOI:10.1016/j.soilbio.2013.10.021 |
| [122] | He HD, Ye ZH, Yang DJ, et al. Characterization of endophytic Rahnella sp. JN6 from Polygonum pubescens and its potential in promoting growth and Cd, Pb, Zn uptake by Brassica napus. Chemosphere, 2013, 90(6): 1960-1965. DOI:10.1016/j.chemosphere.2012.10.057 |
| [123] | Jing YX, Yan JL, He HD, et al. Characterization of bacteria in the rhizosphere soils of Polygonum pubescens and their potential in promoting growth and Cd, Pb, Zn uptake by Brassica napus. Int J Phytoremediation, 2014, 16(4): 321-333. DOI:10.1080/15226514.2013.773283 |
| [124] | Oh K, Cao T, Cheng HY, et al. Phytoremediation potential of sorghum as a biofuel crop and the enhancement effects with microbe inoculation in heavy metal contaminated soil. J Biosci Med (Irvine), 2015, 3(6): 57100. |
| [125] | Dary M, Chamber-Pérez MA, Palomares AJ, et al. "In situ" phytostabilisation of heavy metal polluted soils using Lupinus luteus inoculated with metal resistant plant-growth promoting rhizobacteria. J Hazard Mater, 2010, 177(1/3): 323-330. |
| [126] | Babu AG, Kim JD, Oh BT. Enhancement of heavy metal phytoremediation by Alnus firma with endophytic Bacillus thuringiensis GDB-1. J Hazard Mater, 2013, 250-251: 477-483. DOI:10.1016/j.jhazmat.2013.02.014 |
