

中国医学科学院北京协和医学院放射医学研究所 天津市放射医学与分子核医学重点实验室,天津 300192
收稿日期:2020-08-03;接收日期:2020-10-08;网络出版时间:2020-10-13
基金项目:国家自然科学基金(Nos. 81703042, 81730086)资助
摘要:组织基质金属蛋白酶抑制剂-2 (TIMP-2)抑制肿瘤迁移及侵袭。文中以人TIMP-2为研究对象,探索人TIMP-2蛋白的原核表达特征,并进行纯化及活性鉴定。以人肺癌A549细胞的总RNA反转录得到的cDNA为模板,克隆人TIMP-2基因,构建pET28a重组表达载体;经酶切检测和测序分析的重组表达载体pET28a-TIMP-2转入大肠杆菌Escherichia coli BL21(DE3)中,利用异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达,并对表达条件进行优化。经镍亲和柱纯化后,用Western blotting法鉴定融合蛋白His-TIMP-2,并用明胶酶谱法检测融合蛋白的活性。研究发现融合蛋白His-TIMP-2在E. coli BL21(DE3)中以包涵体的形式存在;在一定范围内,IPTG浓度对His-TIMP-2的表达量没有显著影响;而在该表达系统中,诱导温度和时间是关键参数,His-TIMP-2的表达量随诱导温度升高而增加;纯化并复性后的融合蛋白His-TIMP-2能有效抑制人肺癌A549细胞表达的基质金属蛋白酶的活性。具有活性的融合蛋白的获得为后续深入研究人TIMP-2的功能及机制奠定基础,并对肿瘤治疗具有重要意义。
关键词:基质金属蛋白酶抑制剂-2重组表达载体包涵体纯化基质金属蛋白酶
Prokaryotic expression, purification and characterization of tissue inhibitor of metalloproteinase-2
Aiying Xue, Guoxing Feng, Changchun Zhu, Saijun Fan


Tianjin Key Laboratory of Radiation Medicine and Molecular Nuclear Medicine, Institute of Radiation Medicine, Chinese Academy of Medical Sciences, Peking Union Medical College, Tianjin 300192, China
Received: August 3, 2020; Accepted: October 8, 2020; Published: October 13, 2020
Supported by: National Natural Science Foundation of China (Nos. 81703042, 81730086)
Corresponding author: Saijun Fan. Tel: +86-22-85685301; E-mail: fansaijun@irm-cams.ac.cn.
Abstract: Tissue inhibitor of metalloproteinases-2 (TIMP-2) inhibits tumor migration and invasion. Obtaining TIMP-2 protein is conducive to a comprehensive and in-depth study of its function and mechanism in tumorigenesis and development. We collected human TIMP-2 protein through prokaryotic expression in vitro. We expressed, purified and characterized human TIMP-2 protein. First, the human TIMP-2 gene was cloned from the cDNA obtained by reverse transcription of total RNA of human lung cancer A549 cells, and constructed to pET28a vector. The recombinant plasmid pET28a-TIMP-2 was transformed into Escherichia coli BL21(DE3) after restriction endonuclease digestion and sequencing analysis. The expression of TIMP-2 protein was induced by isopropyl-β-D-thiogalactoside (IPTG), and the expression conditions were optimized. After purification by nickel affinity column, the fusion protein His-TIMP-2 was identified by Western blotting method and its biological activity was detected by gelatin zymography. The fusion protein His-TIMP-2 existed in the form of inclusion body in E. coli. In a certain range, the concentration of IPTG had no significant effect on the expression amount of His-TIMP-2. But in this expression system, induction temperature and time were the key parameters, and the expression amount of His-TIMP-2 in E. coli increased with the increase of induction temperature. The purified and refolded fusion protein could effectively inhibit the activity of matrix metalloproteinases expressed by human lung cancer A549 cells. The acquisition of active fusion protein lays a foundation for further study of the function and mechanism of human TIMP-2, and is of great significance for tumor therapy.
Keywords: tissue inhibitor of metalloproteinase-2recombinant expression vectorinclusion bodypurificationmatrix metalloproteinase
组织基质金属蛋白酶抑制剂-2 (Tissue inhibitor of metalloproteinases-2,TIMP-2)是基质金属蛋白酶(MMPs)的内源性抑制剂[1],在哺乳动物正常组织间隙中广泛表达,相对分子量约为22 kDa[1-3]。哺乳动物TIMP家族有4个成员,在结构上均具有两个结构域,即由125个氨基酸构成的N端和由65个氨基酸构成的C端;单独的N端即可有效地抑制MMPs的活性[4-8]。TIMP-2和MMPs特异性结合[2],抑制MMPs的催化活性,从而减少细胞外基质的降解,降低肿瘤的侵袭活性和转移能力[5, 9]。近年来研究表明,TIMP-2以不依赖抑制MMPs活性的方式发挥作用,减少内皮细胞增殖和迁移[3, 5]、减少血管生成[7],以及通过改变肿瘤微环境抑制肿瘤生长[2]。因此,TIMP-2在肿瘤发生发展中的作用及机制的研究越来越受到关注。临床研究表明,蛋白TIMP-2在某些器官损伤诊断、肿瘤早期及预后诊断中可作为一个参考指标[10-12]。此外,Castellano等[13]发现脐带血血浆中的TIMP-2通过提高海马神经元的可塑性和活性,改善衰老小鼠学习记忆与空间探索能力,表明TIMP-2可能具有抗脑衰老功能,这为治疗中枢神经系统退行性疾病(如记忆减退、阿尔茨海默病等)提供新思路。
从较多的临床病理中发现,TIMP-2在人肿瘤(如食管癌、胃癌等[14])组织和血清中的表达水平较低,可能是增强的肿瘤侵袭导致[2];相反,增加TIMP-2的表达水平,肿瘤生长受到抑制,且化疗敏感性增强[15-16]。TIMP-2抑制肿瘤生长和减少血管生成等功能已被发现,而且对TIMP-2在生物体内的作用及相关机制的深入研究也在不断进行。TIMP-2在大肠杆菌中能高效表达[17],但对TIMP-2在胞内的具体存在形式没有研究,融合蛋白在胞内以溶解或包涵体的形式存在,或者两种形式均存在;而且,融合蛋白的表达条件及纯化后的活性鉴定均有待研究。因此,本文通过构建含有人TIMP-2基因的原核表达载体,在大肠杆菌中诱导表达,进而获得融合蛋白His-TIMP-2,并优化诱导表达条件,纯化及复性后验证His-TIMP-2的活性,为后期深入研究TIMP-2的作用及机制提供支持。
1 材料与方法1.1 材料1.1.1 实验材料人肺癌A549细胞,大肠杆菌Escherichia coli DH5α、E. coli BL21(DE3)菌株和原核表达载体pET28a (卡那霉素抗性)均由本实验室保存。
1.1.2 主要试剂高保真DNA聚合酶、反转录试剂盒、T4 DNA连接酶、卡那霉素、还原型谷胱甘肽、氧化型谷胱甘肽、异丙基-β-D-硫代半乳糖苷(IPTG)、细菌培养用胰蛋白胨和酵母提取物购自Solarbio公司;限制性内切酶(NheⅠ/XhoⅠ)和质粒提取试剂盒购自TransGen Biotech公司;TIMP-2小鼠单克隆抗体购于Abacam公司,HRP标记的羊抗鼠二抗购于Proteintech公司;明胶酶谱检测试剂盒购自南京信帆生物技术有限公司;色谱柱HisTrap? HP购于Cytiva公司。
1.2 方法1.2.1 人TIMP-2基因的克隆及载体pET28a的双酶切根据GenBank提供的人TIMP-2基因序列(GenBank登录号:NM_003255)以及原核表达载体pET28a上的多克隆位点,设计并合成引物,上游引物5′端和下游引物5′端分别加入NheⅠ和XhoⅠ酶切位点,引物序列见表 1。
表 1 引物序列Table 1 The primer sequences
| Primer name | Sequence (5′–3′) | Restriction enzyme |
| TIMP-2-F | CTAGCTAGCATGGGCGCCGCGGCCCGC | NheⅠ |
| TIMP-2-R | CCGCTCGAGTTATGGGTCCTCGATGTCG | XhoⅠ |
| The single underlined sequences indicate restriction enzyme sites. | ||
表选项
采用Trizol法提取人肺癌A549细胞的总RNA,反转录获得cDNA。以cDNA为模板,克隆人TIMP-2基因。用1%琼脂糖凝胶电泳鉴定克隆产物,切胶回收人TIMP-2基因片段。同时,在37 ℃条件下用限制性内切酶NheⅠ和XhoⅠ双酶切处理表达载体pET28a,得到线性化载体,同样经电泳鉴定后,切胶回收待用。
1.2.2 原核表达载体的构建用T4 DNA连接酶将回收的人TIMP-2基因片段与线性化表达载体pET28a在4 ℃条件下过夜连接,得到的连接产物转化E. coli DH5α,然后涂于含卡那霉素的LB平板上,37 ℃培养过夜。挑选菌落,即含重组表达载体pET28a-TIMP-2,扩大培养后提取质粒,进行双酶切处理,用琼脂糖凝胶电泳分析检测;同时对菌液进行测序分析,测序结果与GenBank提供的人TIMP-2的基因序列进行比对。
1.2.3 TIMP-2蛋白的诱导表达1) 将测序比对正确的重组质粒pET28a- TIMP-2转化于E. coli BL21(DE3)感受态细胞中,37 ℃培养。待长出单菌落后,挑选并接种到含卡那霉素的LB液体培养基中,在37 ℃摇床中振荡培养,转速为180 r/min;12 h后将菌液扩大培养,扩大比例为1︰100;当菌液的OD600为0.7–0.8时,加入IPTG诱导His-TIMP-2蛋白表达。
取1 mL诱导表达后的菌液,离心弃上清,用无菌水重悬菌体,加入电泳上样缓冲液混匀,然后100 ℃煮沸5 min,对全菌蛋白进行SDS-PAGE分析,鉴定融合蛋白的存在,其中分离胶浓度为12%。
2) 表达产物存在形式:取1 mL诱导表达的菌液,离心弃上清;用PE缓冲液(20 mmol/L NaH2PO4-K2HPO4,1 mmol/L EDTA,pH 7.2)重悬菌体,超声破菌。4 ℃离心15 min,转速为12 000 r/min,利用SDS-PAGE检测离心后得到的上清和沉淀,分析His-TIMP-2蛋白在大肠杆菌中的存在形式。
3) 诱导条件筛选:向37 ℃条件下培养的菌液(OD600为0.7–0.8)中,加IPTG溶液,使其终浓度分别为0.2、0.4、0.6、0.8、1.0、1.5、2.0 mmol/L,继续培养4 h,取1 mL菌液进行电泳,分析IPTG浓度对His-TIMP-2蛋白表达含量的影响。
向菌液中加入终浓度为1.0 mmol/L的IPTG溶液,分别于30 ℃、37 ℃、42 ℃条件下诱导,每个温度下分别于诱导2、4、6、8、10 h后取1 mL菌液进行电泳,分析诱导温度、诱导时间对His-TIMP-2蛋白表达含量的影响。
1.2.4 TIMP-2蛋白的纯化及复性包涵体的提取:经分析His-TIMP-2蛋白基本都存在于包涵体中,因此需从包涵体中分离纯化该蛋白。在上述得到的优化条件下诱导表达蛋白,然后破碎菌体,离心收集沉淀,向其中加入2 mol/L尿素,待沉淀完全溶解后静置30 min,离心弃上清;依次用Triton X-EDTA溶液(0.5% Triton X-100,10 mmol/L EDTA)、PE缓冲液重悬沉淀,离心弃上清。再用TE缓冲液(20 mmol/L Tris-HCl,1 mmol/L EDTA,pH 8.0)重悬沉淀,离心弃上清;重复3次,得到包涵体。
包涵体的溶解:向包涵体中加入变性缓冲液(50 mmol/L Tris-HCl,8 mol/L尿素,2 mmol/L DTT,pH 8.0),50 ℃加热2 h,使包涵体溶解变性,离心收集上清[18]。
纯化:色谱柱HisTrap? HP经平衡缓冲液(20 mmol/L Tris-HCl,0.1 mol/L NaCl,2 mol/L尿素,20 mmol/L咪唑,pH 8.0)冲洗平衡后,进样蛋白溶液,然后用平衡缓冲液冲洗。最后用缓冲液(20 mmol/L Tris-HCl,0.1 mol/L NaCl,2 mol/L尿素,0.5 mol/L咪唑,pH 8.0)洗脱吸附的蛋白,并收集。
复性:将纯化的蛋白缓慢加入到含还原型和氧化型谷胱甘肽的复性缓冲液(50 mmol/L Tris-HCl,0.8 mol/L尿素,pH 8.8)中,His-TIMP-2蛋白的终浓度不超过10 μg/mL;同时,在室温下缓慢搅拌,4 ℃静置过夜。浓缩蛋白溶液,再用缓冲液(50 mmol/L NaH2PO4-NaOH,pH 6.0)透析16 h,然后35 ℃孵育45 min。最后离心除去沉淀物,得到复性的His-TIMP-2蛋白。
1.2.5 融合蛋白的鉴定及活性检测1) Western blotting鉴定:以未诱导的菌液超声破碎后的总蛋白作为对照。向对照蛋白和复性的融合蛋白His-TIMP-2中分别加入电泳上样缓冲液,加热处理。选用鼠源抗TIMP-2抗体(一抗)及HRP标记的羊抗鼠二抗,用Western blotting免疫学法对复性的融合蛋白His-TIMP-2进行鉴定。
2) 活性检测:采用明胶酶谱法[9]检测复性后融合蛋白His-TIMP-2的活性。将生长状态良好的人肺癌A549细胞清洗后,加入不含血清的培养基DMEM培养。24 h后收集培养基,用10 kDa超滤离心管浓缩样品。取25 μL浓缩的细胞上清,向其中加入25 μL复性后的融合蛋白His-TIMP-2,得到混合样品。取相同体积浓缩的细胞上清和混合样品,分别加入等体积的2×非还原型电泳上样缓冲液,加热处理。按说用书进行明胶酶谱实验。
明胶酶谱中条带的亮度和面积可半定量表征明胶酶的活性[19],由软件分析图像中条带的密度值,并以活性明胶酶的比活表示明胶酶的含量。其中,
密度值=条带面积×(条带灰度?背景灰度)。
比活=条带密度值÷蛋白浓度。
比活单位为mL/mg。
根据明胶酶谱结果,分析复性后融合蛋白对A549细胞表达的MMPs的抑制能力。
本研究中所有电泳凝胶成像和Western blotting成像均用BIO-RAD化学发光凝胶成像仪完成。
2 结果与分析2.1 目的基因的克隆及表达载体的构建从人肺癌A549细胞株中提取的总RNA反转录得到的cDNA,经PCR反应克隆得到目的基因TIMP-2,在琼脂糖凝胶电泳图谱中约665 bp处有一条明显的条带(图 1A),与目的基因大小一致。重组质粒经双酶切得到的产物,琼脂糖凝胶电泳分析的结果如图 1B所示,在约665 bp处有明显条带,为目的基因,表明成功构建重组表达载体pET28a-TIMP-2。鉴定为重组表达载体pET28a-TIMP-2阳性的菌液经测序分析,证明pET28a-TIMP-2中人TIMP-2的基因序列与GenBank提供的序列(NM-003255)一致。
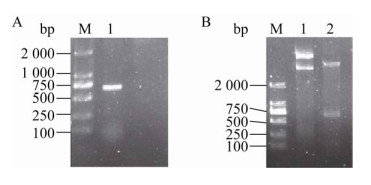 |
| 图 1 pET28a-TIMP-2重组质粒的构建 Fig. 1 Construction of recombinant expression plasmid of pET28a-TIMP-2. (A) PCR amplification of TIMP-2 gene. M: marker; 1: amplification of the gene TIMP-2. (B) Double enzyme digestion of pET28a-TIMP-2 plasmid. 1: pET28a-TIMP-2 recombinant plasmid; 2: pET28a- TIMP-2 was digested by restriction enzymes of NheⅠ and XhoⅠ; M: marker. |
| 图选项 |
2.2 融合蛋白的表达诱导表达的菌体处理后,用SDS-PAGE鉴定,结果如图 2A所示。与不含重组表达载体pET28a-TIMP-2的菌体及未加诱导剂IPTG的菌体的总蛋白相比,在诱导表达菌体的蛋白泳道中,约23 kDa处出现一条明显的蛋白条带。本研究中,TIMP-2蛋白与载体pET28a上的His标签蛋白融合表达,其分子量分别为22 kDa和0.8 kDa左右,与SDS-PAGE结果显示的融合蛋白分子量约23 kDa一致。这表明融合蛋白被成功诱导表达。
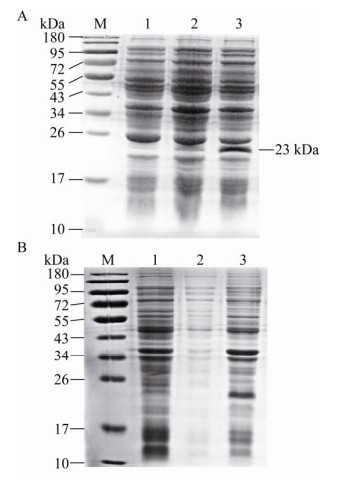 |
| 图 2 SDS-PAGE检测融合蛋白的表达及其存在形式 Fig. 2 Detection of fusion protein expression and its existing form by SDS-PAGE. (A) Detection of induced fusion protein His-TIMP-2 by SDS-PAGE. 1: the total protein in control E. coli BL21(DE3) without pET28a-TIMP-2 recombinant plasmid; 2: the total protein without IPTG induction in E. coli transformed by recombinant plasmid pET28a-TIMP-2; 3: the total protein induced by IPTG in E. coli transformed by recombinant plasmid pET28a-TIMP-2; M: protein marker. (B) SDS-PAGE analysis of existence form of His-TIMP-2 in E. coli transformed by recombinant plasmid pET28a-TIMP-2. After induction by IPTG, E. coli was broken by ultrasound and then centrifuged to collect the supernatant and precipitate. 1: the total protein in broken E. coli; 2: the supernatant; 3: the precipitate. |
| 图选项 |
对融合蛋白在大肠杆菌中存在形式的分析结果如图 2B所示,菌液破碎后离心,在上清中基本不含融合蛋白His-TIMP-2,说明蛋白表达后以不溶的包涵体形式存在。这一现象主要是因为TIMP-2结构中含有6个二硫键[7],融合蛋白在大肠杆菌中表达时,巯基间不能在还原性细胞液中形成二硫键,导致蛋白错误折叠,形成包涵体[20]。
2.3 融合蛋白诱导表达条件的优化在添加诱导剂IPTG时,融合蛋白成功表达,从图 2A和图 3中均能直观地看出,图 3表示IPTG浓度对大肠杆菌中His-TIMP-2表达含量的影响。分析电泳结果,不同IPTG浓度下融合蛋白His-TIMP-2表达含量的结果见表 2,发现IPTG浓度对大肠杆菌表达融合蛋白的影响较小,可能是因为大肠杆菌高效表达融合蛋白,0.2–2 mmol/L范围内的IPTG均能有效诱导融合蛋白表达。因此,选择常用的IPTG诱导浓度为1 mmol/L,研究诱导温度和诱导时间对大肠杆菌中融合蛋白His-TIMP-2表达含量的影响。
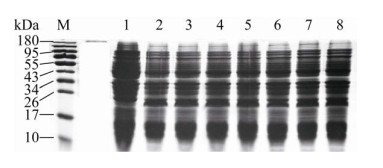 |
| 图 3 SDS-PAGE分析37 ℃诱导时IPTG浓度对融合蛋白His-TIMP-2诱导表达的影响 Fig. 3 SDS-PAGE analysis for the effect of IPTG concentration on the expression amount of His-TIMP-2 in E. coli induced at 37 ℃. 1: 0 mmol/L IPTG; 2: 0.2 mmol/L IPTG; 3: 0.4 mmol/L IPTG; 4: 0.6 mmol/L IPTG; 5: 0.8 mmol/L IPTG; 6: 1.0 mmol/L IPTG; 7: 1.5 mmol/L IPTG; 8: 2.0 mmol/L IPTG. |
| 图选项 |
表 2 37 ℃时不同浓度ITPG诱导的大肠杆菌中融合蛋白His-TIMP-2的表达含量Table 2 The amount of His-TIMP-2 in E. coli induced by different concentrations of ITPG at 37 ℃
| IPTG concentration (mmol/L) | His-TIMP-2 amount (%) |
| 0 | 0 |
| 0.2 | 12.9 |
| 0.4 | 11.3 |
| 0.6 | 12.4 |
| 0.8 | 14.3 |
| 1.0 | 14.8 |
| 1.5 | 14.1 |
| 2.0 | 12.5 |
| The experiment was done three times and the results presented the same trend. | |
表选项
大肠杆菌中融合蛋白的表达含量均采用SDS-PAGE分析,不同诱导温度、不同诱导时间下融合蛋白His-TIMP-2的表达含量见表 3。分析比较发现,在特定温度下,融合蛋白含量随诱导时间的增加而增加,例如37 ℃时,融合蛋白含量从0增加到20.7%。在诱导时间相同时,融合蛋白含量随诱导温度升高而呈增加的趋势,例如诱导4 h,温度从30 ℃升至42 ℃时,融合蛋白含量从10.3%增加到23.3%。而且,随着诱导温度的升高,融合蛋白含量达到最大值所需时间缩短,在30 ℃时,融合蛋白含量的增加趋势在研究范围内未出现平台;37 ℃时,融合蛋白含量在诱导8 h后基本不变;42 ℃时,融合蛋白含量在诱导4 h后基本达到最大值。因此,在His-TIMP-2的原核表达中,诱导温度和时间是关键因素。根据上述结果,融合蛋白His-TIMP-2诱导表达的最适条件为37 ℃诱导8 h或42 ℃诱导4 h。
表 3 1.0 mmol/L IPTG时不同诱导温度和时间下大肠杆菌中融合蛋白His-TIMP-2表达含量Table 3 The amount of His-TIMP-2 in E. coli induced by 1.0 mmol/L IPTG
| Temperature (℃) | His-TIMP-2 amount (%) | |||||
| 0 h | 2 h | 4 h | 6 h | 8 h | 10 h | |
| 30 | 0 | 7.3 | 10.3 | 12.2 | 14.8 | 16.6 |
| 37 | 0 | 8.2 | 16.0 | 17.9 | 20.2 | 20.7 |
| 42 | 0 | 10.7 | 23.3 | 24.4 | 21.4 | 22.3 |
| The experiment was done three times and the results presented the same trend. | ||||||
表选项
2.4 融合蛋白的纯化利用HisTrap? HP亲和色谱柱纯化融合蛋白His-TIMP-2,杂质蛋白不能吸附在色谱柱上,形成穿透峰;吸附蛋白用高浓度咪唑竞争洗脱,结果如图 4A所示。在洗脱峰后,紫外基线较高,是因为洗脱液中含高浓度咪唑,而咪唑在280 nm处有吸收。收集穿透峰和洗脱峰,进行电泳分析(图 4B),穿透峰中不含融合蛋白,洗脱峰中融合蛋白的纯度为94%,进而得到融合蛋白His-TIMP-2一步纯化后的收率为88%,说明HisTrap? HP色谱柱能有效纯化融合蛋白His-TIMP-2。
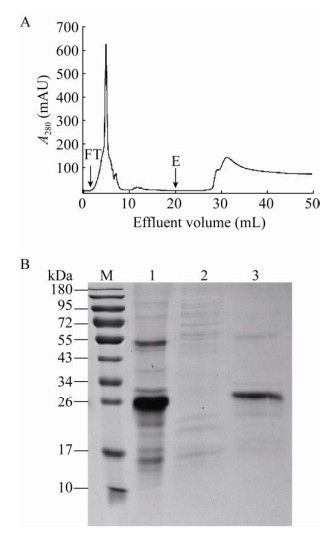 |
| 图 4 大肠杆菌中融合蛋白的纯化及其电泳分析 Fig. 4 Purification and SDS-PAGE analysis of fusion protein in E. coli. (A) Purification of His-TIMP-2 from the inclusion body produced by E. coli. Dissolved inclusion body of 5 mL was injected into the affinity column at a flow rate of 1.0 mL/min. After washing with 15 mL equilibration buffer, bound proteins were eluted with the elution buffer. The fractions of the detected peaks, flow-through (FT) peak and elution (E) peak, were collected to further analysis. (B) SDS-PAGE analysis for His-TIMP-2 purification. 1: dissolved inclusion body; 2: FT fraction; 3: elution fraction; M: molecular weight marker. |
| 图选项 |
2.5 复性后融合蛋白的鉴定与活性分析纯化的融合蛋白经复性后,用Western blotting法分析,结果如图 5A所示,在约23 kDa处有特异性蛋白条带,而未诱导的细菌总蛋白中没有His-TIMP-2蛋白条带,验证了复性后的融合蛋白;而且复性得到的融合蛋白收率为35%,与文献中稀释法复性的有关结果相当[20]。
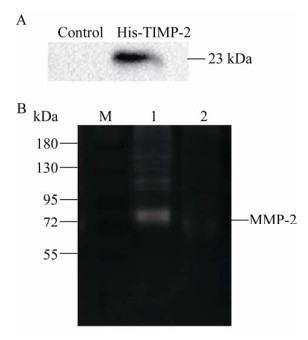 |
| 图 5 Western blotting鉴定融合蛋白及明胶酶谱法分析融合蛋白的活性 Fig. 5 Identification of fusion protein by Western blotting and biological activity analysis of fusion protein by gelatin zymography. (A) Identification of His-TIMP-2 by Western blotting. The total protein without IPTG induction in E. coli transformed by recombinant plasmid pET28a-TIMP-2 was used as control. (B) Zymography of MMP-2 activity. 1: concentrated supernatant of A549 cell culture medium without bovine serum albumin; 2: mixture of the concentrated supernatant of A549 cell culture medium and the refolded His-TIMP-2 at a volume ratio of 1:1. |
| 图选项 |
复性后融合蛋白(浓度为0.15 mg/mL)活性通过明胶酶谱法检测。在加有明胶的聚丙烯酰胺凝胶中进行SDS-PAGE,电泳结束后用酶反应缓冲液孵育凝胶,然后染色、脱色。凝胶中含底物明胶而被染色,形成深色背景;而在有明胶酶条带的位置处,底物被降解,因而不被染色,形成透亮区域。人肺癌A549细胞表达的MMP-2 (明胶酶A)能分解明胶,如图 5B所示,在MMP-2相应位置处(约72 kDa)呈现透亮条带;用明胶酶谱法定量分析,A549上清液浓缩得到的样品中MMP-2的比活为(1 797 559.43±83 821.86) mL/mg。加入复性的融合蛋白后,未出现明显的透亮条带,表明融合蛋白能有效抑制基质金属蛋白酶的活性,使明胶未被降解。因此,复性的融合蛋白具有抑制MMP-2活性的能力。
人TIMP-2能抑制多种MMPs的活性[21],明胶酶谱法可对MMP-2 (明胶酶A)和MMP-9 (明胶酶B)两种酶进行活性鉴定,但是本研究中MMP-2处条带比较明显,MMP-9处(92 kDa)没有出现明显条带。在明胶酶谱中,条带强弱与酶活性成正比,可能是样品中MMP-9含量较少,导致未检出明显的MMP-9条带。
3 讨论与TIMP家族其他成员蛋白相比,人TIMP-2在大多数正常成人的组织间隙内表达量较大,以抑制或独立于抑制MMPs活性的方式发挥抑制肿瘤生长等作用[2, 5, 7]。研究发现,人TIMP-2表达后不进行糖基化修饰[21],该特点使体外表达的人TIMP-2的状态更接近体内的天然状态,进而使体外研究人TIMP-2的功能及机理更有意义。因此,本研究借助广泛使用的原核系统对人TIMP-2进行体外表达,并优化诱导表达条件。
IPTG是一种非常有效的诱导剂,但有一定潜在毒性,且价格昂贵。本研究中,0.2–2 mmol/L浓度范围内的IPTG均能有效诱导融合蛋白表达;且增大IPTG浓度,融合蛋白His-TIMP-2的表达含量没有显著变化,文献中亦有类似报道[22]。因此,融合蛋白His-TIMP-2在较低浓度IPTG诱导下就有高效表达,而且低浓度IPTG产生较低毒性,并能节省成本。
诱导温度和诱导时间是影响融合蛋白表达的关键因素。在一定范围内,随诱导温度的升高和诱导时间的增长,融合蛋白His-TIMP-2的表达含量增大,这与E. coli BL21(DE3)表达外源蛋白的相关研究一致[23]。本研究中融合蛋白His-TIMP-2诱导表达的最适温度和时间为37 ℃诱导8 h或42 ℃诱导4 h。
研究发现融合蛋白His-TIMP-2在大肠杆菌中以包涵体的形式存在,这与蛋白本身存在6个二硫键有关[7]。经一步亲和纯化,得到高纯度(94%)融合蛋白His-TIMP-2。初步采用最简单的稀释法对融合蛋白进行复性,得到的复性蛋白能有效抑制MMP-2的催化活性。后期将深入探索不同的复性方法,如添加剂(低浓度脲等)辅助复性、色谱柱复性等,或多种复性方法联合使用,来提高蛋白的复性收率。此外,研究采用明胶酶谱法半定量分析人肺癌A549细胞表达的MMP-2的比活,初步测定复性后融合蛋白对MMP-2的抑制能力。该方法测定的酶种类及酶比活的精确度有限,后续将采用更精确的方法测定融合蛋白对不同MMPs的抑制能力,并与天然TIMP-2及重组TIMP-2蛋白比较,进一步分析融合蛋白His-TIMP-2的活性。
本研究深入揭示人TIMP-2蛋白在原核系统中的表达特征,为研究蛋白的高效表达、纯化及复性提供数据支持,并为后期体内外研究人TIMP-2的功能及机制奠定基础,对提高肿瘤治疗效果具有重要意义。
参考文献
| [1] | Butler GS, Hutton M, Wattam BA, et al. The specificity of TIMP-2 for matrix metalloproteinases can be modified by single amino acid mutations. J Biol Chem, 1999, 274(29): 20391-20396. DOI:10.1074/jbc.274.29.20391 |
| [2] | Stetler-Stevenson WG, Gavil NV. Normalization of the tumor microenvironment: evidence for tissue inhibitor of metalloproteinase-2 as a cancer therapeutic. Connect Tissue Res, 2014, 55(1): 13-19. DOI:10.3109/03008207.2013.867339 |
| [3] | Peeney D, Jensen SM, Castro NP, et al. TIMP-2 suppresses tumor growth and metastasis in murine model of triple-negative breast cancer. Carcinogenesis, 2020, 41(3): 313-325. DOI:10.1093/carcin/bgz172 |
| [4] | Huang W, Suzuki K, Nagase H, et al. Folding and characterization of the amino-terminal domain of human tissue inhibitor of metalloproteinases-1 (TIMP-1) expressed at high yield in E. coli. FEBS Let, 1996, 384(2): 155-161. DOI:10.1016/0014-5793(96)00304-3 |
| [5] | Stetler-Stevenson WG. Tissue inhibitors of metalloproteinases in cell signaling: metalloproteinase-independent biological activities. Sci Signal, 2008, 1(27): re6. |
| [6] | Williamson RA, Marston FAO, Angal S, et al. Disulphide bond assignment in human tissue inhibitor of metalloproteinases (TIMP). Biochem J, 1990, 268(2): 267-274. DOI:10.1042/bj2680267 |
| [7] | Remillard TC, Bratslavsky G, Jensen-Taubman S, et al. Molecular mechanisms of tissue inhibitor of metalloproteinase 2 in the tumor microenvironment. Mol Cell Ther, 2014, 2: 17. DOI:10.1186/2052-8426-2-17 |
| [8] | Cruz-Munoz W, Khokha R. The role of tissue inhibitors of metalloproteinases in tumorigenesis and metastasis. Crit Rev Clin Lab Sci, 2008, 45(3): 291-338. DOI:10.1080/10408360801973244 |
| [9] | Waleh NS, Murphy BJ, Zaveri NT. Increase in tissue inhibitor of metalloproteinase-2 (TIMP-2) levels and inhibition of MMP-2 activity in a metastatic breast cancer cell line by an anti-invasive small molecule SR13179. Cancer Lett, 2010, 289(1): 111-118. DOI:10.1016/j.canlet.2009.08.006 |
| [10] | Wang W, Zhang YF, Liu MX, et al. TIMP2 is a poor prognostic factor and predicts metastatic biological behavior in gastric cancer. Sci Rep, 2018, 8(1): 9629. DOI:10.1038/s41598-018-27897-x |
| [11] | Adler C, Heller T, Schregel F, et al. TIMP-2/IGFBP7 predicts acute kidney injury in out-of-hospital cardiac arrest survivors. Crit Care, 2018, 22(1): 126. DOI:10.1186/s13054-018-2042-9 |
| [12] | Groblewska M, Mroczko B, Gryko M, et al. Serum levels and tissue expression of matrix metalloproteinase 2 (MMP-2) and tissue inhibitor of metalloproteinases 2 (TIMP-2) in colorectal cancer patients. Tumor Biol, 2014, 35(4): 3793-3802. DOI:10.1007/s13277-013-1502-8 |
| [13] | Castellano JM, Mosher KI, Abbey RJ, et al. Human umbilical cord plasma proteins revitalize hippocampal function in aged mice. Nature, 2017, 544(7651): 488-492. DOI:10.1038/nature22067 |
| [14] | Groblewska M, Mroczko B, Kozlowski M, et al. Serum matrix metalloproteinase 2 and tissue inhibitor of matrix metalloproteinases 2 in esophageal cancer patients. Folia Histochem Cytobiol, 2012, 50(4): 590-598. DOI:10.5603/FHC.2012.0083 |
| [15] | Ha?oń A, Nowak-Markwitz E, Donizy P, et al. Enhanced immunoreactivity of TIMP-2 in the stromal compartment of tumor as a marker of favorable prognosis in ovarian cancer patients. J Histochem Cytochem, 2012, 60(7): 491-501. DOI:10.1369/0022155412446978 |
| [16] | Suemitsu R, Yoshino I, Tomiyasu M, et al. Serum tissue inhibitors of metalloproteinase-1 and -2 in patients with non-small cell lung cancer. Surg Today, 2004, 34(11): 896-901. DOI:10.1007/s00595-004-2853-y |
| [17] | Xu GQ, Wang W, Sun DQ, et al. Gene clone and expression of human tissue inhibitor of matrix metalloproteinases 2 in Escherichia coli. Guizhou Med J, 2016, 40(4): 344-347 (in Chinese). 徐国强, 王伟, 孙达权, 等. 人TIMP-2基因的克隆及其原核表达. 贵州医药, 2016, 40(4): 344-347. DOI:10.3969/j.issn.1000-744X.2016.04.003 |
| [18] | Nasrabadi D, Rezaeiani S, Sayadmanesh A, et al. Inclusion body expression and refolding of recombinant bone morphogenetic protein-2. Avicenna J Med Biotechnol, 2018, 10(4): 202-207. |
| [19] | Zhang XP, Zhou FJ, Shen PF, et al. Significance of activated matrix metalloproteinase 2 (MMP2) in progression of bladder transitional cell carcinoma. Chin J Cancer, 2003, 22(6): 637-639. |
| [20] | Williamson RA. Refolding of TIMP-2 from Escherichia coli inclusion bodies//Clark IM, Ed. Matrix Metalloproteinase Protocols. Methods in Molecular Biology?. Totowa, N.J.: Humana Press, 2001, 151: 257-265. |
| [21] | Brew K, Nagase H. The tissue inhibitors of metalloproteinases (TIMPs): an ancient family with structural and functional diversity. Biochim Biophys Acta, 2010, 1803(1): 55-71. DOI:10.1016/j.bbamcr.2010.01.003 |
| [22] | Ding JY, Yi Y, Lu XX, et al. Effect of different temperature, time and different concentration of IPTG and strains on HDVAg expression. J Med Res, 2012, 41(5): 31-34 (in Chinese). 丁军颖, 伊瑶, 卢学新, 等. 不同温度、时间、IPTG和菌种浓度对丁肝抗原蛋白表达量的影响. 医学研究杂志, 2012, 41(5): 31-34. |
| [23] | Collins T, Azevedo-Silva J, Costa AD, et al. Batch production of a silk-elastin-like protein in E. coli BL21(DE3): key parameters for optimisation. Microb Cell Fact, 2013, 12(1): 21. DOI:10.1186/1475-2859-12-21 |
