

1. 江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;
2. 江南大学 药学院,江苏 无锡 214122;
3. 无锡宸明生物科技有限公司,江苏 无锡 214122
收稿日期:2018-11-06;接收日期:2019-01-09
基金项目:国家轻工技术与工程一流学科自主课题(No. LITE2018-08),江苏省科技支撑计划社会发展项目(No. BE2018623)资助
摘要:α-酮酸是一种同时含有羧基和酮基的双官能团有机化合物,广泛应用于食品、药品和化妆品等行业。为了满足环境友好、安全高效和可持续发展的社会要求,利用酶转化法生产α-酮酸受到人们的广泛关注。文中从酶的筛选、酶的改造以及酶的转化条件优化3个方面介绍丙酮酸、α-酮戊二酸、酮亮氨酸、酮缬氨酸、苯丙酮酸和酮蛋氨酸酶法合成的研究状况,并展望了α-酮酸进一步高效生产的发展方向。
关键词:α-酮酸酶转化蛋白质工程
Recent advances in enzymatic production of alpha-keto acids
Quan Zhang1,3, Wei Song1, Can Zhang1, Shanshan Pei1,2, Xiulai Chen1, Jia Liu1, Qiuling Luo1,3, Liming Liu1


1. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China;
2. School of Pharmaceutical Science, Jiangnan University, Wuxi 214122, Jiangsu, China;
3. Wuxi Chenming Biotechnology Co., Ltd., Wuxi 214122, Jiangsu, China
Received: November 6, 2018; Accepted: January 9, 2019
Supported by: National First-class Discipline Program of Light Industy Technology and Engineering (No. LITE2018-08), Key Technologies R & D Program of Jiangsu Province (No. BE2018623)
Corresponding author: Liming Liu. Tel: +86-510-85197357; Fax: +86-510-85197875; E-mail: mingll@jiangnan.edu.cn.
Abstract: Alpha-keto acid is a bifunctional organic compound containing both carboxyl and ketone groups, and widely applied in the industries of food, pharmaceutical and cosmetics. Based on the demand of eco-friendly process, safety and sustainable development, production of α-keto acids by enzymatic conversion technology has been paid more and more attention. In this article, we review the status of α-keto acids biosynthesis from three aspects: enzymatic screening, enzymatic modification and optimization of enzymatic conversion conditions. Meanwhile, we also indicate future research directions for further improving α-keto acids production.
Keywords: α-keto acidsenzymatic conversionprotein engineering
酮酸是一类同时含有羧基和酮基的双官能团有机化合物。根据分子中羧基和酮基的相对位置可以将其分为α-酮酸和β-酮酸。其中α-酮酸包括丙酮酸、α-酮戊二酸、酮亮氨酸、酮缬氨酸、苯丙酮酸和酮蛋氨酸等。α-酮酸是有机药物合成及生物合成的重要中间体,已广泛用于食品、医药、化工和化妆品等领域。
目前,α-酮酸的生产技术主要可以分为化学合成法、微生物发酵法和酶转化法3种。化学合成法是指某些特定的化学物质在苛刻的反应条件下生成目标产物,主要包括氧化法、水解法、双羰基化法和海因法等,化学法以一氯戊烷和一氧化碳为底物,八羰基二钴和钯络合物为催化剂在60 ℃条件下合成α-酮亮氨酸,转化率达到了71.1%[1]。但是反应过程中原料昂贵且复杂,工艺繁琐,反应条件苛刻不易被人们采用。发酵法指微生物直接发酵糖质原料或其他碳源生成α-酮酸。但是采用直接发酵法生产某些α-酮酸时产量较低,底物转化率低,比如α-酮亮氨酸的碳酸转化率仅仅达到了0.17 g α-酮亮氨酸/g葡萄糖,难以满足工业化的要求[2-3]。酶转化法指利用微生物中某些酶高选择性的催化性质,将底物特定分子氨基酸催化转化为价值更高的α-酮酸(图 1)。在部分α-酮酸的合成过程中,酶转化法与其他方法相比具有独特的优势,比如高选择性、高效性、无毒、低污染等特点。
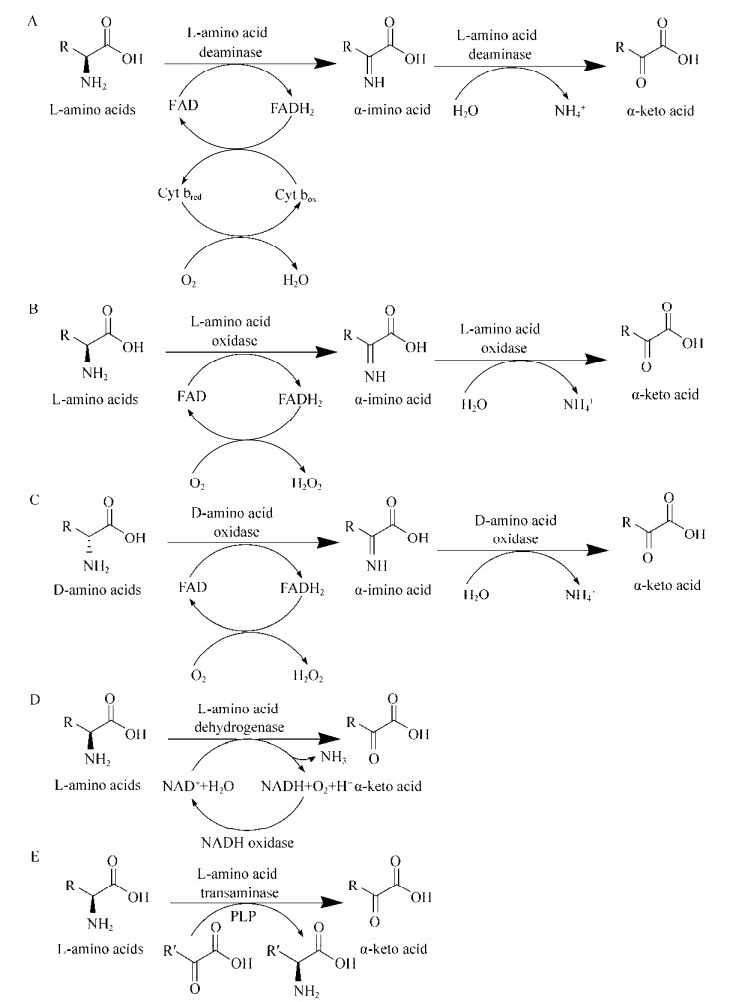 |
| 图 1 酶法转化氨基酸合成α酮酸 Fig. 1 Production of α-keto acids from amino acid by enzymatic conversion technology. PLP: Pyridoxal 5?-phosphate. |
| 图选项 |
近年来,酶法转化生产α-酮酸已经成为研究热点,总结于表 1。本综述以丙酮酸、α-酮戊二酸、酮亮氨酸、酮缬氨酸、苯丙酮酸和酮蛋氨酸为目标产物,从酶的筛选、酶的改造以及酶的转化条件优化3个方面详细论述α-酮酸酶法合成的研究状况,并对未来α-酮酸的高效生产进行了展望。
表 1 酶转化法生产α-酮酸Table 1 Production of α-keto acids by enzymatic conversion technology
| Product | Substrate | Enzyme | Source of enzyme | Coenzyme | Expressing host | Titer (g/L) | Conversion rate (%) | Reference |
| Pyruvic acid | L-alanine | Mutant of L-amino acid deaminase | P. mirabilis | FAD | E. coli BL21 | 14.57 | 29.14 | [4] |
| α-ketoglutarate acid | L-glutamic acid | L-amino acid deaminase | P. mirabilis | FAD | E. coli BL21 | 1.52 | 12.67 | [5] |
| α-ketoglutarate acid | L-glutamic acid | L-amino acid deaminase | P. mirabilis KCTC2566 | FAD | B. subtilis 168 | 4.65 | 31.00 | [6] |
| α-ketoglutarate acid | L-glutamic acid | Mutant of L-amino acid deaminase | P. mirabilis KCTC2566 | FAD | B. subtilis 168 | 10.08 | 83.30 | [7] |
| α-ketoglutarate acid | L-glutamic acid | L-glutamate oxidase | S. ghanaensis ATCC14672 | FAD | E. coli BL21 | 104.70 | 96.10 | [8] |
| α-ketoglutarate acid | L-glutamic acid | L-glutamate oxidase | S. ghanaensis ATCC14672 | FAD | E. coli BL21 | 127.20 | 97.00 | [9] |
| α-ketoglutarate acid | L-glutamic acid | L-glutamate oxidase, Catalase-peroxidase | S. ghanaensis ATCC14672, E. coli W3110 | FAD | E. coli BL21 | 103.10 | 94.60 | [10] |
| α-ketoisocaproate | L-leucine | L-amino acid deaminase | R. opacus DSM 43250 | FAD | NR | 1.27 | NR | [11] |
| α-ketoisocaproate | L-leucine | L-amino acid deaminase | P. mirabilis | FAD | E. coli BL21 | 61.50 | 95.70 | [12] |
| α-ketoisocaproate | L-leucine | Mutant of L-amino acid deaminase | P. mirabilis | FAD | E. coli BL21 | 106.20 | 97.70 | [13] |
| α-ketoisocaproate | L-leucine | L-amino acid deaminase | P. vulgaris | FAD | E. coli BL21 | 86.55 | 94.25 | [14] |
| α-ketoisovalerate | L-valine | L-amino acid deaminase | P. myxofaciens | FAD | E. coli BL21 | 8.197 | 72.54 | [15] |
| α-ketoisovalerate | L-valine | L-amino acid oxidase | C. glutamicum | FAD | E. coli BL21 | 51.00 | 79.10 | [16] |
| α-ketoisovalerate | L-valine | Mutant of Lamino acid oxidase | C. glutamicum | FAD | E. coli BL21 | 54.60 | 84.60 | [17] |
| Phenylpyruvate | L-phenylalanine | Mutant of L-amino acid deaminase | P. mirabilis KCTC2566 | FAD | E. coli BL21 | 72.50 | 96.67 | [18] |
| Phenylpyruvate | L-phenylalanine | Mutant M5 optimized by codon | P. mirabilis KCTC2566 | FAD | E. coli BL21 | 83.00 | 98.20 | [19] |
| α-keto-γ- methylthiobutyric acid | L-methionine | L-amino acid oxidase optimized by codon | R. erythropolis | FAD | E. coli BL21 | 95.18 | 95.84 | [20] |
| NR: not reported. | ||||||||
表选项
1 丙酮酸丙酮酸(Pyruvic acid, PA)又称α-氧代丙酸,是在α碳上含有羰基的三碳一羧酸化合物,分子式为C3H4O3,相对分子质量为88.06。丙酮酸是许多酶催化的中间代谢物,参与体内的TCA循环,对于维持体内的氧化还原状态也发挥重要的作用,此外,丙酮酸还是一种重要的工业原料[21]。
1.1 酶的筛选酶转化法合成丙酮酸的底物包括乳酸和丙氨酸。当以乳酸为底物时,涉及的酶包括L-乳酸氧化酶(L-lactate oxidase,LOD,EC 1.1.3.2)、乳酸脱氢酶(Lactate dehydrogenase,LDH,EC 1.1.1.27)和乙醇酸氧化酶(Glycolate oxidase,GO,EC 1.1.3.15)。谷劲松等从土壤样品中富集、筛选和纯化获得乳酸氧化酶的菌株SM-10#、SM-29#、SM-14#,总酶活力为1 469.50、1 310.64、1 103.55 U/mL。LDH借助辅酶的氧化型或还原型(NAD+或NADH)在糖酵解过程中参与乳酸和丙酮酸的可逆转化[22]。郁书怀在乳酸片球菌Pediococcus acidilactici和戊糖片球菌Pediococcus pentosaceus中克隆LDH基因并在E. coli中实现了表达,对丙酮酸的比活性分别为422.1和835 U/mg,Kcat/Km值分别为3 157和658 mmol/(L·S)[23]。赵婷从副干酪乳杆菌Lactobacillus paracasei W2中克隆了LDH基因,表达成功后对丙酮酸具有较高的酶活性[24]。乙醇酸氧化酶能将乳酸氧化为丙酮酸,并伴随过氧化氢的生成,此过程以FMN为辅酶,氧气作为最终的电子受体[25]。Amy利用多形汉逊酵母Hansenula polymorpha和毕赤酵母Pichia pastoris分别表达来源于菠菜的乙醇酸氧化酶。当pH为8.0时,乙醇酸氧化酶活性最高,L-乳酸和丙酮酸对应的pKa分别为3.79和2.49,并且发现L-乳酸不会对该酶产生抑制效应,而底物丙酮酸会抑制该酶的活性[25]。
当以丙氨酸为底物时,主要包括L-丙氨酸脱氢酶(Alanine dehydrogenase,ALDH,EC 1.4.1.1)、L-氨基酸脱氨酶和氨基酸氧化酶。研究表明,来源于产气肠杆菌Enterobacter aerogenes的丙氨酸脱氢酶分别以丙氨酸和丙酮酸为底物进行催化反应时,最适pH为10.9和8.7。对丙氨酸、NAD+、丙酮酸、NADH和氨的Km值分别为0.47、0.16、0.22、0.067和66.7 mmol/L[26]。L-氨基酸脱氨酶催化的氧化脱氨反应主要是酶与细胞膜上电子传递链相关,电子经过电子传递链传递给细胞色素氧化酶,使分子氧还原为水,生成α-酮酸和氨[27]。L-氨基酸氧化酶是利用分子氧直接氧化还原型的FAD,再生成氧化型的FAD,生成过氧化氢、α-酮酸和氨[28]。
1.2 酶的表达与改造2016年,Hossain等以大肠杆菌Escherichia coli BL21 (DE3)为表达宿主,表达来自奇异变形杆菌Proteus mirabilis的L-氨基酸脱氨酶基因pm1,构建了重组菌株pET-20b(+)-pm1 (E. coli BL21),丙氨酸经过全细胞转化丙酮酸的产量达到了1.14 g/L[4]。为了阻断丙氨酸和丙酮酸的去路,敲除了基因cycA、amaP和lldP,丙酮酸的产量进一步得到提高,达到了5.38 g/L。为了提高转氨酶的催化效率,Hossain等对pm1进行了定向进化,经过3轮易错PCR,得到了突变体pm1ep3,使得丙酮酸的产量达到了14.57 g/L,转化率达到了29.14%[4]。该突变体对L-丙氨酸的亲和力(Km)和催化效率(Kcat/Km)分别提高至6.76 mmol/L和0.085 mmol/(L·s)。上述结果表明,酶转化技术结合定向进化策略和代谢工程策略可以显著提高丙酮酸的产量。Simona等将来源于红酵母Rhodotorula gracilis的氨基酸氧化酶用于丙氨酸的转化实验,最终转化率达到了90%以上[29]。
乳酸脱氢酶可以催化乳酸生成丙酮酸。Ping Xu课题组以假单胞杆菌Pseudomonas stutzeri SDM为出发菌株,以25.5 g/L的D/L-乳酸为底物,转化24 h,丙酮酸的产量达到了22.6 g/L,转化率高达88.6%[30]。
2 α-酮戊二酸α-酮戊二酸(α-ketoglutaric acid, α-KG)是戊二酸的两种含酮基衍生物中的一种,分子式为C5H6O5,相对分子质量为146.1。α-KG是连接微生物细胞碳-氮代谢的关键节点,是微生物三羧酸循环中重要的代谢中间物,在氨基酸形成和氮转运中扮演着重要的角色[31]。α-KG作为保健品原料,增加蛋白质的合成,作为饲料添加剂可以缓解免疫性应激对畜牧氨基代谢的影响[32]。
2.1 酶的筛选以L-谷氨酸为底物酶法合成α-KG的酶包括谷氨酸脱氢酶(Glutamate dehydrogenase,GDH)、L-氨基酸脱氨酶(L-amino acid deaminase)和L-谷氨酸氧化酶(L-glutamate oxidase,LGOX,EC:1.4.3.11)。Paul等以黄化瘤胃球菌Ruminococcus flavefaciens FD1为出发菌株,纯化并研究了谷氨酸脱氢酶(EC:1.4.1.4)的性质,该酶以NADP+辅酶,在0.5 mol/L KCl溶液中的最适pH为6.9–7.0,对NH3、α-KG、谷氨酸的Km值分别为19、0.41、62 mmol/L[33]。此外,张克旭等研究了天津短杆菌T6-13谷氨酸脱氢酶的特性,研究表明,该酶对还原型辅酶Ⅱ(NADPH)、α-KG、NH3、谷氨酸的Km值分别为0.076、3.23、4.0、120.48 mmol/L。并且该酶受反应产物的抑制,正反应受NADPH、α-KG和NH4+的抑制,逆反应受NADP+和谷氨酸的抑制[34]。
LGOX是一种核黄素酶,是以FAD为辅酶,在不添加外源性辅助因子的条件下,专一性地将L-谷氨酸氧化脱氨,生成氨、α-KG和过氧化氢。研究者测定了来源于链霉菌属Streptomyces endus、Streptomyces sp. 18G和Streptomyces sp. X-119-6的LGOX的生化特性[35-37]。LGOX的蛋白大小分别为90、120、77 kDa,比酶活分别为0.0024、0.15、0.056 U/mL。来源于Streptomyces endus的LGOX Km值最大为1.1 mmol/L。Amina等还对Streptomyces sp. X-119-6中的LGOX晶体结构进行了分析,发现其蛋白活性部位在蛋白中心、底物和产物进出通道较窄,并且活性部位残基不同造成底物专一性强[38]。
2.2 酶的表达与改造2014年,Hossain等以枯草芽孢杆菌Bacillus subtilis 168和E. coli BL21 (DE3)为表达宿主,表达来自P. mirabilis KCTC2566的L-氨基酸脱氨酶基因pmAAD,构建了重组菌株pHT43-pmAAD (B. subtilis)和pET-20b(+)-pmAAD (E. coli BL21)。通过以L-谷氨酸为底物进行全细胞转化24 h,重组菌株pHT43-pmAAD (B. subtilis)转化率优于pET-20b(+)-pmAAD (E. coli BL21),α-KG产量和转化率分别达到了4.65 g/L和31%[6],其原因可能是B. subtilis可以去除错误折叠和不完整的蛋白来促进高质量蛋白的合成。为了提高pmAAD的催化效率,Hossain等在前期的基础上对pmAAD进行蛋白质工程改造。首先,通过易错PCR手段确定了影响催化效率的6个关键点,分别为F110、A255、E349、R228、T249和I352,随后,采用定点饱和突变的方法将6个位点分别突变为F110I、A255T、E349D、R228C、T249S和I352A,α-KG的产量从之前的4.65 g/L提高到了10.08 g/L,转化率从31%提高到了83.25%,此时,酶的亲和效率也有所提高(Km值从49.21 mmol/L降低到了23.58 mmol/L)[7]。最后,Hossain等采用Cre/lox无痕敲除系统阻断了B. subtilis中α-KG的降解路径,α-KG的产量得以提高,达到了12.21 g/L。上述研究表明,蛋白质工程改造技术能够增强底物特异性和催化速率,进而提高α-KG的产量。
利用LGOX催化L-谷氨酸生成α-酮戊二酸的过程会产生大量的H2O2,该副产物不仅能影响菌体的生长还能抑制LGOX的活性,进而影响转化反应的进行,常常需要通过外源添加过氧化氢酶才能够保证转化反应的顺利进行,此举提高了原料的成本。因此如何解决H2O2的添加问题成为酶法转化生产α-酮戊二酸的关键问题之一。为了解决上述H2O2积聚问题,Wu等将来源于E. coli K12 W3110的过氧化氢酶基因katG异源表达于E. coli BL21 (DE3)中,并结合重组酶LGOX和KatG的生化性质,从转录水平和翻译水平构建了LGOX和KatG共表达菌株[10]。在转录水平上,以pET28a为表达载体设定了3种不同策略构建共表达菌株F008、FXC008、FXC009,分别为:策略一,采用单启动模式将LGOX和KatG串联表达,两个酶分别带有相同的RBS序列;策略二,采用双启动子模式于LGOX和KatG前面添加同样的启动子及相关序列;策略三,采用单启动子模式将LGOX和KatG通过Hind Ⅲ直接串联在一起。结果发现F008更有利于α-KG的生产[10]。随后,对单启动子双酶串联表达菌株中KatG基因前的SD序列与ATG之间的间隔进行了优化,分别间隔3、6、9、12 bp,获得重组菌株FXC003、FXC004、FXC005、FXC006,重组菌株FXC005产酶效果和转化效果最优,α-KG产量达到了86.7 g/L,转化率为79.6%[10]。在翻译水平上,通过预测合适起始翻译速率的RBS序列以提高KatG有效表达量,构建重组菌株F006。重组菌株F006 α-KG产量达到了103.1 g/L,转化率达到了94.6%,实现了不添加过氧化氢酶高效生产α-酮戊二酸[10]。上述结果表明,借助启动子工程策略优化多酶级联催化反应可以平衡H2O2的合成与消耗问题,从而提高α-KG的产量。
2.3 酶的转化条件优化在转化体系中添加过氧化氢酶解除过氧化氢对LGOX的抑制作用。牛盼清等通过优化底物L-谷氨酸的浓度与H2O2酶的添加量,发现当L-谷氨酸浓度与H2O2酶酶活的最适比例为12:5 (g:kV),此时α-KG产量为32.9 g/L,较优化前提高了126.9%[39]。此外,Mn2+对LGOX有激活作用,牛盼清等研究了在转化过程中不同浓度的Mn2+对α-KG产量的影响。研究表明,当MnCl2的添加量为5 mmol/L时,转化24 h,α-KG产量达到最高38.1 g/L,较未添加Mn2+提高了15.8%[39]。樊祥臣也研究了Mn2+浓度对α-KG产量的影响,当Mn2+浓度为1 mmol/L时,结合正交实验最优的结果,转化24 h,α-KG的产量达到最大值127.2 g/L,转化率为97.0%[9]。
3 酮亮氨酸α-酮异己酸(α-ketoisocaperate, KIC)又名α-酮亮氨酸,是亮氨酸的前体物质,分子式为C6H10O3,相对分子质量为130.14。α-酮亮氨酸作为生理必需物质,对氨基酸代谢具有平衡和刺激的作用,同时α-酮亮氨酸也可以作为氨基酸的替代物质,降低生物体内的氮代谢负担。在临床中,α-酮亮氨酸饮食疗法治疗肝肾病患者体内代谢的紊乱,保健品中可作为运动补充剂提高健身效果。在动物饲料中,适量加入α-酮亮氨酸可以提高饲料转化率,促进蛋白质积累与家畜生长,提高动物免疫力。
3.1 酶的筛选以L-亮氨酸为底物催化合成α-酮亮氨酸的酶为L-氨基酸脱氨酶,是一类以FAD为辅酶的黄素蛋白,可以催化L-亮氨酸脱氨形成α-酮亮氨酸和氨。L-氨基酸脱氨酶来源广泛,包括蛇毒、不透明红球菌、链霉菌和变形杆菌等。其中,结构功能研究最彻底的来源于蛇毒的L-氨基酸脱氨酶难以异源表达,不利于工业化制备和应用,来源于红球菌的L-氨基酸脱氨酶将氨基酸脱氨后会形成过氧化氢,并且生产周期较长,也不适合制备α-酮亮氨酸。因此,来源于变形杆菌的L-氨基酸脱氨酶定位在细胞膜上,采用非典型的脱氨机制将L-亮氨酸脱氨成α-酮亮氨酸具有非常大的优势。然而,来源于不同变形杆菌的L-氨基酸脱氨酶对底物L-亮氨酸的转化效率也存在着差异,来自P. myxofaciens的L-氨基酸脱氨酶(Ladf)的转化效率为99.2%[40],来自P. mirabillis的L-氨基酸脱氨酶(Pma、Pml)的转化效率却只有41.7%和7.6%[41-42]。宋阳测定了P. vulgaris来源的L-氨基酸脱氨酶的酶学性质,Km为17.71 mmol/L,(max为1.62 μmol/(L·min·mg),Kcat值为1.41 s–1[43]。
3.2 酶的表达与改造2011年,Zhu等首次利用不透明红球菌Rhodococcus opacus DSM 43250自身合成L-氨基酸脱氨酶催化L-亮氨酸合成α-酮亮氨酸,并且取得了成功,采用响应面分析的方法对菌体培养条件和转化条件优化后,α-酮亮氨酸的产量达到了1.27 g/L[11]。为了提高α-酮亮氨酸的产量,研究者们选择了变形杆菌属来源的L-氨基酸脱氨酶。Song和刘立明分别将来源于普通变形杆菌和奇异变形杆菌的L-氨基酸脱氨酶克隆至表达载体pET-28a上,转入表达宿主E. coli BL21(DE3)后均能检测到L-氨基酸脱氨酶的活性[12-14]。
为了进一步提高L-氨基酸脱氨酶的表达量,Song等对其转录水平和翻译水平进行了调控,通过对非编码区的RBS序列优化控制翻译的起始速率,通过改变质粒拷贝数影响转录水平,α-酮亮氨酸的产量得到了大幅度的提高,达到了86.55 g/L[14]。虽然α-酮亮氨酸的产量得到了大幅度的提高但是其转化率为94.25%,还有进一步上升的空间。针对上述转化率低的问题,刘立明课题组对L-氨基酸氧化酶进行了蛋白质工程改造,首先在奇异变形杆菌L-氨基酸脱氨酶同源建模的基础上,通过分析确定了突变位点T436A,突变体T436A α-酮亮氨酸的产量达到了106.2 g/L,转化率为97.7%,此突变体T436对L-亮氨酸的催化效率较原L-氨基酸脱氨酶提高了72.7%[13]。此研究工作增强了α-酮亮氨酸的工业应用价值。
3.3 酶的转化条件优化在大肠杆菌细胞中存在两种亮氨酸的转运系统。高亲和性的分支氨基酸转运系统LivFGHMJ和LivFGHMK是细胞膜上的ATP结合转运家族的组成部分。LivJ可转运亮氨酸、缬氨酸和异亮氨酸3种支链氨基酸,LivK专一性地转运L-亮氨酸,BrnQ需要钠离子梯度电势。因此,为了减少L-亮氨酸的转运,宋阳等采用不同浓度的转运抑制剂3-羰基氰酯(Cyanide-3-chlorophenylhydrazone, CCCP)抑制livK、livJ和BrnQ的转运效率,提高了酶的转化效率。但是CCCP价格昂贵,未来可以通过基因敲除的策略敲除livK和BrnQ基因以降低生产成本[43]。
4 酮缬氨酸α-酮异戊酸(α-ketoisovalerate, α-KIV)又名酮缬氨酸,是缬氨酸的前体物质,分子式为C5H8O3,相对分子质量为116.12。作为支链酮酸的一种,α-酮异戊酸是重要的中间体,它主要应用于食品、医药、化妆品等领域。在饲料内加入酮缬氨酸可以促进家畜的肌肉生长。同时α-酮酸具有降低肾过滤压力的效果,可用于治疗慢性尿毒症和氮代谢的相关疾病。
4.1 酶的筛选以L-缬氨酸为底物酶转化法合成酮缬氨酸所用的酶包括氨基酸氨基转移酶、L-氨基酸氧化酶和L-氨基酸脱氨酶。氨基酸氨基转移酶通常以α-酮戊二酸和缬氨酸为底物生成对应的酮缬氨酸和谷氨酸,该方法添加α-酮戊二酸增加了成本,副产物谷氨酸的出现增加了后续的纯化分离步骤,因此,研究者更倾向于选择L-氨基酸氧化酶和L-氨基酸脱氨酶。然而,文献报道L-氨基酸脱氨酶和L-氨基酸氧化酶催化L-缬氨酸生成α-酮缬氨酸的催化效率都比较低[41-42]。吴静等选取的L-氨基酸氧化酶的催化效率是目前文献中报道最高的,达到了84.6%[17]。
4.2 酶的表达与改造Li等在E. coli BL21(DE3)中建立了酶转化体系合成酮缬氨酸。表达来自P. myxofaciens的L-氨基酸脱氨酶基因ladf,构建了重组菌株E. coli BL21 (ladf),为了提高底物L-缬氨酸的利用率,继续敲除了细胞膜支链氨基酸转运蛋白基因livF和氨基酸转氨酶基因ilvE,得到了重组菌株E. coli BL21 (△livF△ilvE, ladf),此菌株以5 g/L的L-缬氨酸为底物进行转化实验得到了0.585 g/L的酮缬氨酸[15]。吴静等同样以E. coli BL21作为表达宿主表达L-氨基酸氧化酶,构建了重组菌株E. coli BL21-LAAO,α-酮缬氨酸的产量最高可达51 g/L,转化率为79.1%。
为了提高L-氨基酸脱氨酶的催化效率,Li等借助了蛋白质工程改造技术对L-氨基酸脱氨酶进行了改造[15]。首先,根据同源建模和分子对接分析确定了4个关键氨基酸位点F318、R316、N100和Q276,然后对这4个位点进行饱和突变得到最优单突变体F318T。在此基础之上,对F318T进行N100饱和突变,得到最优突变体N100H,其转化效率比F318T提高了28.24%;最后在F318T/N100H的基础上对Q276进行饱和突变,三突变体F318T/N100H/Q276E的产量为8.197 g/L,转化率达到72.54%,转化时间缩短至10 h[15]。上述研究中对L-氨基酸脱氨酶的改造工作一定程度上提高了酶的催化效率。
4.3 酶的转化条件优化在酶催化过程中酶的转化效率会受到温度、pH、金属离子、催化剂浓度的影响,甚至反应体系的大小也会影响酶催化的效率。Li等[15]和吴静等[16]分别对转化温度、转化pH和金属离子进行了优化。重组菌株E. coli (pET20b-ladf,△livF△ilvE)全细胞转化L-缬氨酸的最优转化条件为pH 6.5、底物浓度为100 mmol/L、菌体量为10 g/L DCW细胞,转化12 h,α-酮异戊酸的产量达到了1.49 g/L[15]。重组菌株E. coli BL21-LAAO的最优转化条件为25 ℃、pH 8.0、菌体量为30 g/L湿菌体,转化24 h,α-酮异戊酸的产量最高可达51 g/L,转化率为79.1%,大幅度提高了生产效率,实现了L-缬氨酸向α-酮缬氨酸的高效合成[16]。
5 苯丙酮酸α-苯丙酮酸(Phenylpyruvic acid, PPA)是一种含有双羰基的多功能有机酸,分子式为C9H8O3,相对分子质量为164.16。PPA作为苯丙氨酸合成的原材料,苯丙氨酸是合成手性药物的重要中间体。
5.1 酶的筛选D-氨基酸氧化酶以D-苯丙氨酸为底物催化合成苯丙酮酸,D-氨基酸氧化酶主要来源于三角酵母、毕赤酵母和红酵母。此外,以L-苯丙氨酸为底物催化合成苯丙酮酸的酶包括苯丙氨酸脱氢酶、氨基酸氨基转移酶和L-氨基酸脱氨酶。对于氨基酸脱氢酶,需要构建辅酶NAD+再生系统。而且苯丙氨酸脱氢酶一般属于胞内酶,构建全细胞催化剂后,不利于底物和酶的结合。L-氨基酸脱氨酶反应只需一种氨基酸参与反应,无需外源添加辅酶或构建辅酶再生系统。因此,L-氨基酸脱氨酶成为催化苯丙酮酸的最佳选择。L-氨基酸脱氨酶的来源主要包括链霉属、变形杆菌属和红球菌属。链霉菌属来源的L-氨基酸脱氨酶具有底物专一性,对L-谷氨酸表现出较高的催化活性,红球菌属的L-氨基酸脱氨酶(L-AAO)对L-苯丙氨酸的转化效率为53%[45],然而变形杆菌来源的L-氨基酸脱氨酶(Pma)的催化效率为100%[41],其突变体M5的Km值为33 mmol/L,较野生型的Pma提高了20.88%。
5.2 酶的表达与改造Pantaleone课题组建立了酶法生产苯丙酮酸的路径,在大肠杆菌异源表达来自P. mirabilis KCTC2566的L-氨基酸脱氨酶,通过优化条件(菌体添加量、底物投量等),最终苯丙酮酸的产量提高至42.50 g/L,转化率为85%[46]。但是,随着PPA产量的提高,对L-氨基酸脱氨酶有很强的产物抑制,导致产量无法进一步提高。产物抑制的原因主要是产物释放慢,产物与底物竞争性结合催化位点。刘佳等应用构象动力学思想,从产物周围的loop结构入手,调节对结构影响较小的loop上的氨基酸,从而增大产物结合位点的构象动力学,促进产物释放,减弱产物抑制,达到提高产量的目的[18]。首先,通过对酶结构的分析选择了18个氨基酸位点(Y103、T105、S106、D144、E145、R315、I316、F317、E340、L341、V411、S412、T414、F415、E417、T434、T436、V437),将其突变为丙氨酸,构建单点突变库,突变体T105、S412、E417、E340和E145的转化能力得到提高;随后,采用组合突变的策略,对上述5个有益突变进行组合突变,构建了部分双突变体、三突变体、四突变体和五突变体,得到最佳的五突变体为M5 (T105A、S412A、E417A、E340A、E145A),M5的苯丙酮酸的产量最高,达到了72.5 g/L,此时底物转化率为96.67%[18]。杨彬等测定了突变体M5的产物抑制常数和动力学参数,产物抑制常数KPI提高到了86.6 g/L,较野生型提高了3.7倍。Kcat值比野生型增加了2倍,催化效率(Kcat/Km)也有所增加,是野生型的1.6倍[47]。
5.3 酶的转化条件优化Hou等将来自P. mirabilis KCTC 2566中的L-氨基酸脱氨酶基因克隆至pET-20b(+)并且成功转入表达宿主E. coli BL21(DE3)中,研究了温度、pH、酶浓度、底物浓度、金属离子(Ba+、Mg2+、Li+、Ca2+、Zn2+等)、辅酶FAD的浓度对全细胞转化L-苯丙氨酸生成苯丙酮酸的影响。条件优化后,转化2.5 h,苯丙酮酸的产量达到最大值,为2.7 g/L,底物转化率为86.7%[48]。同时,Hou等继续研究了两阶段全细胞转化,即生长态细胞转化和静止态细胞转化,建立了两阶段温度控制策略,最终在3-L罐上苯丙酮酸的产量为77.6 g/L,苯丙氨酸的转化率为99.3%[49]。刘佳等对L-氨基酸脱氨酶突变体催化制备苯丙酮酸的体系也进行了优化。首先,对重组大肠杆菌产酶条件进行了优化,包括不同的表达载体(pET-28a、pET-20b、pET-22b、pET-24a)、不同的培养基(LB、TB、SB、LBA、TBA、SBA和SOC)、诱导条件(诱导剂种类、浓度、诱导温度和诱导时间),然后优化了L-苯丙氨酸转化生产苯丙酮酸的条件,转化条件包括pH、温度、底物浓度、催化剂用量和添加剂种类(CTAB、曲拉通-100、吐温-80、Mn2+和DMSO)。经过条件优化后,在30-L罐上苯丙酮酸的最高产量达到了83.0 g/L,底物转化率高达98.20%[18],该研究的产量与转化率为目前报道最高。
6 酮蛋氨酸酮蛋氨酸(α-keto-γ-methylthiobutyric acid, KMTB)又称α-酮-γ-甲硫基丁酸,是由蛋氨酸脱氨基生成的含酮化合物,分子式为C5H8O3S,分子量为148.21。KMTB作为L-甲硫氨酸的衍生物,不仅可以增加机体的利用效率还能抑制肿瘤细胞的生长,也被用来治疗尿毒症的病人。此外,KMTB还是一种安全无毒的禽畜饲料添加剂。
6.1 酶的筛选以蛋氨酸为底物酶法合成酮蛋氨酸的酶主要包括L-氨基酸脱氨酶、氨基酸氧化酶和L-氨基酸转氨酶。其中,氨基酸氧化酶和L-氨基酸脱氨酶全细胞转化都以胞内FAD为辅酶,不可逆的催化L-蛋氨酸生成α-亚蛋氨酸,α-亚蛋氨酸由于结构的不稳定性,会自发水解形成α-酮蛋氨酸和氨。来源于P. vulgaris的氨基酸脱氨酶对蛋氨酸的转化效率为100%[50],而来源于P. mirabillis的氨基酸脱氨酶Pma和Pml对蛋氨酸的转化效率只有16.7%和2.6%[41-42]。
6.2 酶的表达优化与改造2014年,Hossain等建立了酶转化法合成KMTB的方法。以E. coli BL21 (DE3)为表达宿主,表达来自Proteus vulgaris的L-氨基酸脱氨酶基因pvAAD,构建了重组菌株pET-20b(+)-pvAAD (E. coli BL21)。重组菌株以L-蛋氨酸为底物,进行全细胞转化,转化24 h,KMTB产量和转化率分别达到了49.5 g/L和71.2%。在此基础上,Hossain等对pvAAD进行蛋白质工程改造。首先,通过易错PCR技术获得了2个能提高L-蛋氨酸转化为KMTB效率的突变体K104R和A337S,转化率分别达到了82.2%和80.8%。随后,采用组合突变的方法将2个突变位点组合在一起获得了最佳的突变体pvAADK104R/A337S。KMTB的产量从49.5 g/L提高到了63.6 g/L,转化率从71.2%提高到了91.4%[51]。上述研究表明,蛋白质工程改造技术能够增强酶的催化速率,进而提高KMTB的产量。
密码子优化能够提高酶的翻译,进而提高酶的表达水平。刘立明课题组将来源于红平红球菌的L-氨基酸氧化酶经过密码子优化后连接pET28a后导入E. coli BL21 (DE3)中进行异源表达。通过对湿菌体的添加量(30 g/L、40 g/L、50 g/L、60 g/L)、转化温度(15 ℃、20 ℃、30 ℃、37 ℃)和转化pH (7.0、7.5、8.0、8.5、9.0)优化后,KMTB的产量达到95.18 g/L,转化率为95.84%,时空产率为3.97 g/(L·h)[20]。
7 结论与展望针对酶法转化L-氨基酸生产相应的α-酮酸,国内外研究人员开展了卓有成效的研究工作。主要包括两个方面:重组菌株的构建,包括酶的筛选、酶的表达和酶的蛋白质工程改造;另一方面为酶转化条件的优化。然而,由于酶制剂自身的催化效率低,转化过程条件繁多且复杂,造成了α-酮酸产量、产率和生产强度较低。因此,为了提高α-酮酸的生产效率以及经济效益,今后需要在以下几个方面进行深入研究。第一,利用蛋白质工程改造策略对酶进行精准改造,提高酶的催化效率,从而降低酶的用量,缩短催化反应的时间;第二,可以发展多酶级联催化反应转化生成附加值更高的酮酸衍生物,使得效益最大化;第三,深入研究酶的循环利用,做到酶制剂的多次重复利用,以降低生产成本;第四,利用代谢工程策略对表达宿主进行改造,协调产物合成路径与其他竞争性路径之间的关系,增强酮酸的合成,为α-酮酸工业化生产奠定坚实基础。
参考文献
| [1] | Waters KL. The a-keto acids.Chem Rev, 2002, 3: 585–598. |
| [2] | Bückle-Vallant V, Krause FS, Messerschmidt S, et al. Metabolic engineering of Corynebacterium glutamicum for 2-ketoisocaproate production.Appl Microbiol Biotechnol, 2014, 98(1): 297–311.DOI: 10.1007/s00253-013-5310-2 |
| [3] | Vogt M, Haas S, Polen T, et al. Production of 2-ketoisocaproate with Corynebacterium glutamicum strains devoid of plasmids and heterologous genes. Microb Biotechnol, 2015, 8(2): 351–360. |
| [4] | Hossain GS, Shin HD, Li JH, et al. Transporter engineering and enzyme evolution for pyruvate production from D/L-alanine with a whole-cell biocatalyst expressing L-amino acid deaminase from Proteus mirabilis.RSC Adv, 2016, 6(86): 82676–82684.DOI: 10.1039/C6RA16507A |
| [5] | Liu L, Hossain GS, Shin HD, et al. One-step production of α-ketoglutaric acid from glutamic acid with an engineered L-amino acid deaminase from Proteus mirabilis.J Biotechnol, 2013, 164(1): 97–104.DOI: 10.1016/j.jbiotec.2013.01.005 |
| [6] | Hossain GS, Li JH, Shin HD, et al. Bioconversion of L-glutamic acid to α-ketoglutaric acid by an immobilized whole-cell biocatalyst expressing L-amino acid deaminase from Proteus mirabilis.J Biotechnol, 2014, 169: 112–120.DOI: 10.1016/j.jbiotec.2013.10.026 |
| [7] | Hossain GS, Li JH, Shin HD, et al. Improved production of α-ketoglutaric acid (α-KG) by a Bacillus subtilis whole-cell biocatalyst via engineering of L-amino acid deaminase and deletion of the α-KG utilization pathway.J Biotechnol, 2014, 187: 71–77.DOI: 10.1016/j.jbiotec.2014.07.431 |
| [8] | Niu PQ, Dong XX, Wang YC, et al. Enzymatic production of α-ketoglutaric acid from L-glutamic acid via L-glutamate oxidase.J Biotechnol, 2014, 179: 56–62.DOI: 10.1016/j.jbiotec.2014.03.021 |
| [9] | Fan XC, Chen RD, Chen LL, et al. Enhancement of alpha-ketoglutaric acid production from L-glutamic acid by high-cell-density cultivation.J Mol Catal B: Enzym, 2016, 126: 10–17.DOI: 10.1016/j.molcatb.2016.01.009 |
| [10] | Wu J, Fan XC, Liu J, et al. Promoter engineering of cascade biocatalysis for α-ketoglutaric acid production by coexpressing L-glutamate oxidase and catalase.Appl Microbiol Biotechnol, 2018, 102(11): 4755–4764.DOI: 10.1007/s00253-018-8975-8 |
| [11] | Zhu YH, Li JH, Liu L, et al. Production of α-ketoisocaproate via free-whole-cell biotransformation by Rhodococcus opacus DSM 43250 with L-leucine as the substrate.Enzyme Microb Technol, 2011, 49(4): 321–325.DOI: 10.1016/j.enzmictec.2011.06.008 |
| [12] | Liu LM, Yuan YX, Liu J, et al. Method for efficiently producing α-ketoisocaproic by enzyme: CN, CN108587993A. 2018-09-28 (in Chinese). 刘立明, 袁宇翔, 刘佳, 等.一种酶法催化高产α-酮异己酸的方法: CN, CN108587993A. 2018-09-28. |
| [13] | Liu LM, Yuan YX, Chen XL, et al. A method for constructing L-amino acid deaminase mutant and its application: CN, CN108624576A. 2018-10-09 (in Chinese). 刘立明, 袁宇翔, 陈修来, 等.一种L-氨基酸脱氨酶的突变体及其制备方法与应用: CN, CN108624576A. 2018-10-09. |
| [14] | Song Y, Li JH, Shin H, et al. Tuning the transcription and translation of L-amino acid deaminase in Escherichia coli improves α-ketoisocaproate production from L-leucine.PLoS ONE, 2017, 12(6): e0179229.DOI: 10.1371/journal.pone.0179229 |
| [15] | Li RX, Sakir HG, Li JH, et al. Rational molecular engineering of L-amino acid deaminase for production of α-ketoisovaleric acid from L-valine by Escherichia coli.RSC Adv, 2017, 7(11): 6615–6621.DOI: 10.1039/C6RA26972A |
| [16] | Wu J, Pei SS, Liu J, et al. Method for efficiently producing α-ketoisocaproate: CN, 201811350903.7. 2018-11-20 (in Chinese). 吴静, 裴杉杉, 刘佳, 等.一种高产α-酮异戊酸的方法: CN, 201811350903.7. 2018-11-20. |
| [17] | Wu J, Pei SS, Liu J, et al. A method for constructing L-amino acid oxidase mutant: CN, 201811350819.5. 2018-11-20 (in Chinese). 吴静, 裴杉杉, 刘佳, 等.一种L-氨基酸氧化酶的突变体: CN, 201811350819.5. 2018-11-20. |
| [18] | Liu J, Wu J, Yang B, et al. Method for efficiently producing phenylpyruvic acid: CN, CN108841844A. 2018-11-20 (in Chinese). 刘佳, 吴静, 杨彬, 等.一种高效生产苯丙酮酸的方法: CN, CN108841844A. 2018-11-20. |
| [19] | Liu J, Wu J, Yang B, et al. A method for production of phenylpyruvic acid by enzyme bioconversion: CN, CN109022338A. 2018-12-18 (in Chinese). 刘佳, 吴静, 杨彬, 等.一种酶转化苯丙氨酸生产苯丙酮酸的工艺: CN, CN109022338A. 2018-12-18. |
| [20] | Liu LM, Zhang C, Liu J, et al. Method for efficiently producing KMTB (alpha-keto-gamma-methylthiobutyric acid): CN, CN107988131A. 2018-05-04 (in Chinese). 刘立明, 张灿, 刘佳, 等.一种高产α-酮-γ-甲硫基丁酸的方法: CN, CN107988131A. 2018-05-04. |
| [21] | Liu LM, Li Y, Du GC, et al. Progress in biotechnological production of pyruvic acid.Chin J Biotech, 2002, 18(6): 651–655.(in Chinese). 刘立明, 李寅, 堵国成, 等. 生物技术法生产丙酮酸的研究进展.生物工程学报, 2002, 18(6): 651-655.DOI:10.3321/j.issn:1000-3061.2002.06.001 |
| [22] | Gu JS, Xu P, Li TL, et al. Preparation of pyruvate from lactateby lactate oxidase.Chin J Appl Environ Biol, 2001, 7(6): 617–620. |
| [23] | Mu WM, Yu SH, Jiang B, et al. Characterization of D-lactate dehydrogenase from Pediococcus acidilactici that converts phenylpyruvic acid into phenyllactic acid.Biotechnol Lett, 2012, 34(5): 907–911.DOI: 10.1007/s10529-012-0847-1 |
| [24] | Zhao T. Cloning, overexpression and properties of ldh gene from Lactobacillus paracasei[D]. Suzhou: Soochow University, 2012 (in Chinese). 赵婷.副干酪乳杆菌乳酸脱氢酶的克隆表达及酶学性质的研究[D].苏州: 苏州大学, 2012. |
| [25] | Eisenberg A, Seip JE, Gavagan JE, et al. Pyruvic acid production using methylotrophic yeast transformants as catalyst.J Mol Catal B: Enzym, 1997, 2(4/5): 223–232. |
| [26] | Chowdhury EK, Saitoh T, Nagata S, et al. Alanine dehydrogenase from Enterobacter aerogenes: purification, characterization, and primary structure.Biosci Biotechnol Biochem, 1998, 62(12): 2357–2363.DOI: 10.1271/bbb.62.2357 |
| [27] | Molla G, Melis R, Pollegioni L. Breaking the mirror: L-amino acid deaminase, a novel stereoselective biocatalyst.Biotechnol Adv, 2017, 35(6): 657–668.DOI: 10.1016/j.biotechadv.2017.07.011 |
| [28] | Pollegioni L, Motta P, Molla G. L-amino acid oxidase as biocatalyst: a dream too far?.Appl Microbiol Biotechnol, 2013, 97(21): 9323–9341.DOI: 10.1007/s00253-013-5230-1 |
| [29] | Butò S, Pollegioni L, D'Angiuro L, et al. Evaluation of D-amino acid oxidase from Rhodotorula gracilis for the production of α-keto acids: a reactor system.Biotechnol Bioeng, 1994, 44(11): 1288–1294.DOI: 10.1002/bit.v44:11 |
| [30] | Hao JR, Ma CQ, Gao C, et al. Pseudomonas stutzeri as a novel biocatalyst for pyruvate production from DL-lactate.Biotechnol Lett, 2007, 29(1): 105–110. |
| [31] | Chernyavskaya OG, Shishkanova N(, Il'Chenko AP, et al. Synthesis ofα-ketoglutaric acid by Yarrowia lipolytica yeast grown on ethanol.Appl Microbiol Biotechnol, 2000, 53(2): 152–158.DOI: 10.1007/s002530050002 |
| [32] | Yang SH, Tan LL, Liao M, et al. Effects of α-ketoglutarate on growth performance and meat quality of broilers under heat stress.Feed Ind Mag, 2014, 35(22): 11–16.(in Chinese). 杨书慧, 谭灵琳, 廖满, 等. α-酮戊二酸对热应激肉鸡生长性能和肌肉品质的影响.饲料工业, 2014, 35(22): 11-16. |
| [33] | Duncan PA, White BA, Mackie RI. Purification and properties of NADP-dependent glutamate dehydrogenase from Ruminococcus flavefaciens FD-1.Appl Environ Microbiol, 1992, 58(12): 4032–4037. |
| [34] | Zhang KX, Liu YS. Studies on glutamate dehydrogenase from Brevibacterium Tianjinese T6-13.Acta Microbiol Sin, 1991, 31(4): 281–286.(in Chinese). 张克旭, 刘永生. 天津短杆菌T6-13谷氨酸脱氢酶的研究.微生物学报, 1991, 31(4): 281-286. |
| [35] | B?hmer A, Müller A, Passarge M, et al. A novel L-glutamate oxidase from Streptomyces endus purification and properties.Eur J Biochem, 1989, 182(2): 327–332.DOI: 10.1111/ejb.1989.182.issue-2 |
| [36] | Wachiratianchai S, Bhumiratana A, Udomsopagit S. Isolation, purification, and characterization of L-glutamate oxidase from Streptomyces sp. 18G.Electron J Biotechnol, 2004, 7(3): 274–281. |
| [37] | Kusakabe H, Midorikawa Y, Kuninaka A, et al. Occurrence of a new enzyme, L-glutamate oxidase in a wheat bran culture extract of Streptomyces sp. X-119–6.Agricul Biol Chem, 1983, 47(1): 175–177. |
| [38] | Arima J, Sasaki C, Sakaguchi C, et al. Structural characterization of L-glutamate oxidase from Streptomyces sp. X‐ 119‐ 6.FEBS J, 2010, 276(47): 3894–3903. |
| [39] | Niu PQ, Zhang ZY, Liu LM. Enzymatic production of α-ketoglutaric acid by L-glutamate oxidase from L-glutamic acid.Chin J Biotech, 2014, 30(8): 1318–1322.(in Chinese). 牛盼清, 张震宇, 刘立明. 酶法转化L-谷氨酸生产α-酮戊二酸.生物工程学报, 2014, 30(8): 1318-1322. |
| [40] | Motta P, Molla G, Pollegioni L, et al. Structure-function relationships in L-amino acid deaminase, a flavoprotein belonging to a novel class of biotechnologically relevant enzymes.J Biol Chem, 2016, 291(20): 10457–10475.DOI: 10.1074/jbc.M115.703819 |
| [41] | Baek JO, Seo JW, Kwon O, et al. Heterologous expression and characterization of L-amino acid deaminase from Proteus mirabilis in Escherichia coli.Chin J Biotechnol, 2011, 24(12): 2129–2129.(in Chinese). Baek JO, Seo JW, Kwon O. 奇异变形杆菌的L-氨基酸脱氢酶在大肠杆菌中的异源表达和鉴定.生物工程学报, 2011, 24(12): 2129-2129. |
| [42] | Baek JO, Seo JW, Kwon O, et al. Expression and characterization of a second L-amino acid deaminase isolated from Proteus mirabilis in Escherichia coli.J Basic Microbiol, 2011, 51(2): 129–135.DOI: 10.1002/jobm.v51.2 |
| [43] | Song Y. Molecular modification of L-amino acid deaminase and biosynthesis of α-ketoisocaproate[D]: Wuxi: Jiangnan University, 2018 (in Chinese). 宋阳. L-氨基酸脱氨酶分子改造及生物合成α-酮异己酸[D].无锡: 江南大学, 2018. |
| [44] | Song Y, Li JH, Shin HD, et al. One-step biosynthesis of α-ketoisocaproate from L-leucine by an Escherichia coli whole-cell biocatalyst expressing an L-amino acid deaminase from Proteus vulgaris.Sci Rep, 2015, 5: 12614.DOI: 10.1038/srep12614 |
| [45] | Geueke B, Hummel W. A new bacterial L-amino acid oxidase with a broad substrate specificity: purification and characterization.Enzyme Microb Technol, 2002, 31(1/2): 77. |
| [46] | Pantaleone DP, Geller AM, Taylor PP. Purification and characterization of an L-amino acid deaminase used to prepare unnatural amino acids.J Mol Catal B: Enzym, 2001, 11(4/6): 795–803. |
| [47] | Yang B. Engineering of the conformational dunamics of enzymes to improve properties to produce pharmaceutical intermediates[D]. Wuxi: Jiangnan University, 2018 (in Chinese). 杨彬.构象动力学方法改造酶性能以生产医药中间体[D].无锡: 江南大学, 2018. |
| [48] | Hou Y, Hossain GS, Li JH, et al. Production of phenylpyruvic acid from L-phenylalanine using an L-amino acid deaminase from Proteus mirabilis: comparison of enzymatic and whole-cell biotransformation approaches.Appl Microbiol Biotechnol, 2015, 99(20): 8391–8402.DOI: 10.1007/s00253-015-6757-0 |
| [49] | Hou Y, Hossain GS, Li JH, et al. Two-step production of phenylpyruvic acid from L-phenylalanine by growing and resting cells of engineered Escherichia coli: process optimization and kinetics modeling.PLoS ONE, 2016, 11(11): e0166457.DOI: 10.1371/journal.pone.0166457 |
| [50] | Takahashi E, Ito K, Yoshimoto T. Cloning of L-amino acid deaminase gene from Proteus vulgaris.Biosci Biotechnol Biochem, 1999, 63(12): 2244–2247.DOI: 10.1271/bbb.63.2244 |
| [51] | Hossain GS, Li JH, Shin HD, et al. One-step biosynthesis of α-keto-γ-methylthiobutyric acid from L-methionine by an Escherichia coli whole-cell biocatalyst expressing an engineered L-amino acid deaminase from Proteus vulgaris.PLoS ONE, 2014, 9(12): e114291.DOI: 10.1371/journal.pone.0114291 |
