
 , 崔红娟1,2,3
, 崔红娟1,2,3 1. 西南大学 家蚕基因组生物学国家重点实验室,重庆 400716;
2. 重庆市蚕丝生物材料与再生医学工程研究中心,重庆 400716;
3. 西南大学 肿瘤生物医学与转化工程研究中心,重庆 400716;
4. 西南大学 西南大学医院,重庆 400716
收稿日期:2018-10-23;接收日期:2018-12-28;网络出版时间:2019-01-09
基金项目:中央高校基本科研业务费(No. XDJK2018C010)资助
摘要:丝蛋白生物材料具有优异的力学性能、良好的生物相容性及可降解性,在生物医学领域具有巨大的应用潜力。现有丝蛋白生物材料在结构和功能方面的相关知识,为设计合成新型丝蛋白生物材料提供了理论基础。此外,利用基因工程技术可将编码新肽或结构域的基因序列添加到编码丝蛋白的基因序列中,以获得具有新功能的丝蛋白生物材料,并更好地满足现代生物医学的需求。文中总结了基因工程功能化的丝蛋白生物材料在生物医学领域中的应用现状和发展前景。
关键词:丝蛋白生物材料功能化基因工程生物医学
Functionalized genetic engineered silk-based biomaterials and their applications
Lei Zhang1,2,3, Zhonghuai Xiang1,2,3, Gaichao Zhao1,2,3, Zonghui Wu4

 , Hongjuan Cui1,2,3
, Hongjuan Cui1,2,3 1. State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400716, China;
2. Chongqing Engineering and Technology Research Center for Silk Biomaterials and Regenerative Medicine, Chongqing 400716, China;
3. Engineering Research Center for Cancer Biomedical and Translational Medicine, Southwest University, Chongqing 400716, China;
4. Hospital of Southwest University, Southwest University, Chongqing 400716, China
Received: October 23, 2018; Accepted: December 28, 2018; Published: January 9, 2019
Supported by: Fundamental Research Funds for the Central Universities (No. XDJK2018C010)
Corresponding author: Zonghui Wu. Tel: +86-23-68253565; E-mail: wuzh@swu.edu.cn.
Abstract: Silk-based biomaterials are featured with excellent mechanical properties, good biocompatibility and biodegradability, which contribute to their potential applications in biomedical field. The current recognition of silk protein materials in structure and function provides a basic theory for the transformation of silk protein into new types of biomaterials. In addition, exogenous sequences encoding new peptide or structural domain can be inserted into the maternal gene sequences encoding silk proteins through genetic engineering technology to synthesize novel silk-based biomaterials with unique functions. This review summarizes the current trend and development perspective of genetically engineered functional silk-based materials for biomedical applications.
Keywords: silk proteinbiomaterialsfunctionalizationgenetic engineeringbiomedicine
天然丝纤维具有极高的拉伸强度和延展性,同时具有质轻的特点[1]。基于这种天然聚合物的新型材料有许多潜在的应用。例如应用丝素蛋白制备的防弹背心、多功能绳索、降落伞显示了良好的应用前景[2-5]。因其卓越的生物相容性和生物可降解性,丝蛋白材料在生物医学中的应用受到了越来越多的关注。天然丝蛋白和重组丝蛋白可以加工成各种形貌,如薄膜、海绵、无纺布垫、水凝胶、支架、胶囊或球体[2, 6]。应用丝蛋白材料构建组织工程基质以及构建药物、核酸和蛋白质载体系统被证明具有巨大潜力[2-3, 5-7]。
天然丝蛋白可以从不同的生物体中提取,蜘蛛和蚕是最常见的天然丝蛋白源。天然蛛丝蛋白因来源个体不同而材料性质存在差异[8],此外在蚕丝蛋白加工过程中需要去除丝胶蛋白,通常还需要进一步的改性[9-11]。
以上问题都可以通过基因工程的手段来解决。通过基因重组技术可以个性化合成重组丝蛋白,以解决丝蛋白的可及性问题。此外,通过添加特定功能的基因片段可操纵氨基酸的组成,以实现丝蛋白生物材料的功能化(图 1)。这类改性可以增强丝蛋白纤维的优异性能,并为进一步修饰丝蛋白生物材料以实现应用个性化提供可能。文中涵盖了基因工程功能化丝蛋白生物材料的应用现状及其在生物医学领域的潜在应用。
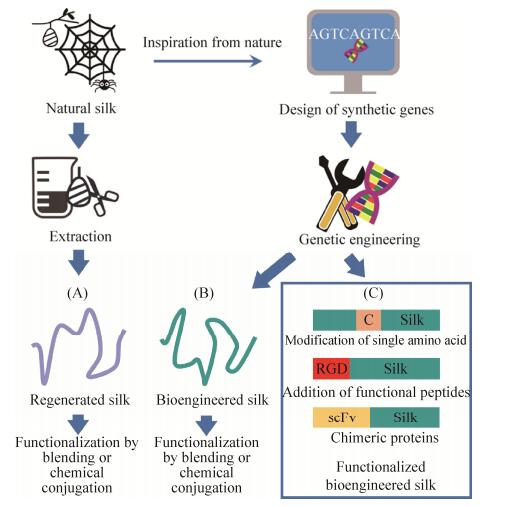 |
| 图 1 丝蛋白的获取和功能化策略[11] Fig. 1 Strategy for silk protein acquisition and functionalization[11]. |
| 图选项 |
1 丝蛋白及其重组变体1.1 天然丝蛋白的主要来源最常用于生物医学应用研究的天然蛛丝蛋白(Spidroins)主要来自于络新妇属的金纺蜘蛛Nephila clavipes和圆蛛属的十字园蛛Araneus diadematus[12]。络新妇属蜘蛛拖牵丝蛋白MaSp1、MaSp2以及十字园蛛丝素蛋白ADF4、ADF3是具有代表性的蜘蛛拖牵丝蛋白[13]。这些蛋白由富含甘氨酸和丙氨酸的重复结构域组成[14-15]。富含丙氨酸的(A)n或(GA)n基序形成β-折叠构象,从而提高蛛丝的强度;富含甘氨酸的基序易于形成螺旋结构,赋予蛛丝优良的弹性。两个含甘氨酸的GGX基序形成31-螺旋,与含脯氨酸的GPGXX基序一同参与β-转角螺旋的形成[14]。这些重复单元的两端由非重复且保守的N端和C端构成,从而控制丝蛋白的溶解度及牵引丝的形成[12, 16-17]。另一种表征较多的丝蛋白来自家蚕蚕茧的蚕丝蛋白。家蚕生产出的丝纤维由两种丝蛋白组成:轻链(约26 kDa)和重链(约390 kDa),并通过二硫键连接。此外,糖蛋白P25以1:6:6 (P25:重链:轻链)的比例通过非共价键与重-轻链复合物连接。重链的核心区域有大段重复的(GAGAGS)n基序,这些基序形成的β-折叠构象有助于增加蚕丝纤维的强度[18]。
1.2 重组丝蛋白的获取如上所述,蚕丝蛋白可从家蚕蚕茧中获得,但蛛丝蛋白需要利用生物技术工艺生产。利用天然cDNA在细菌中表达重组丝蛋白的方法是不可行的[19]。蚕丝蛋白的大型结构及其片段重复的特点容易导致翻译错误及包涵体中的蛋白积累,最终导致丝蛋白的产量很低[19]。表达重组丝蛋白最有效的策略是采用具有重复核酸片段的可编码丝蛋白多聚体的合成基因。可以根据天然丝蛋白的氨基酸序列,设计并合成出短单体模块[20]。利用串联、逐步连接或递归定向连接的方法,可以得到更大的多聚体结构[20-21]。合成出的生物工程丝蛋白的编码基因可以在不同宿主中表达。目前,生物工程重组丝蛋白已能够在细菌(如大肠杆菌)、酵母(巴斯德毕赤酵母)、昆虫(蚕幼虫)、植物(大豆、拟南芥、马铃薯、烟草)、哺乳动物细胞系(幼仓鼠肾BHK细胞系)以及转基因动物(小鼠、山羊)中表达生成[22-27]。合成重组丝蛋白的最常用的表达系统是细菌。生产过程简单、扩增时间较短、成本低以及生产过程可规模化是细菌表达系统的主要优势[21, 28]。
尽管通过合成基因生产重组丝蛋白的方法为获取理想特性的丝蛋白材料提供了可能,但这种方法仍需要改进。编码丝蛋白的基因序列在异源宿主中的表达产量会受到其序列大小和高度重复性片段的限制。为满足丝蛋白表达的需求,需对宿主中核苷酸、tRNA、RNA聚合酶和核糖体的存量进行评估。已有报道指出可以通过工程化宿主代谢途径来提高重组丝蛋白的产量和质量[28]。Xia等利用基因重组技术在大肠杆菌表达出来自络新妇属的金纺蜘蛛的一个284.9 kDa大小的拖牵丝蛋白,并成功将其纺成高强度的丝样纤维,该纤维的机械性能可以与天然蛛丝媲美[28]。此外,在代谢组学、合成/系统生物学、数学和计算模型方面的最新进展也有助于克服重组丝蛋白生产过程中的问题[29]。
除了蜘蛛和家蚕外,蜜蜂、蚂蚁和大黄蜂等昆虫也能生产丝纤维。与蚕丝和蜘蛛丝不同,这些物种的丝纤维不是由大段的重复性纤维蛋白组成的,而是由4个小的非重复性卷曲蛋白组成,编码这些蛋白的基因已被鉴定[30-31]。由于其大小和结构的特点,卷曲螺旋丝更适合于异源宿主中的重组生产[32-33]。重组获得的丝蛋白可以通过自组装形成原生卷曲螺旋结构并能够形成纤维[32]。此外,由单一重组丝蛋白组装而成的纤维在结构和功能上与由4个卷曲蛋白形成的天然丝相似[34]。其简单的转基因生产方式和独特的结构性质使得卷曲螺旋丝蛋白在开发用于生物医学的新材料方面有潜在的应用价值。
利用丝蛋白材料的结构和相应功能的信息,可以设计出模仿天然丝蛋白特性的等价新材料[35]。这种方法为精确控制丝蛋白特性提供了可能。丝蛋白的分子量和氨基酸序列的改变以及基序位置的变化可影响丝蛋白的性质,如二级结构组成、溶解度、疏水性及电荷,这些反过来又会影响最终材料的形态[36]。此外,最近的一项研究指出,重组丝蛋白纯化的方法也会影响最终丝蛋白生物材料的形态和性质[37]。此外,计算机建模有助于生成具有可调特性的材料[38-39]。介观耗散粒子动力学(Dissipative particle dynamics,DPD)模拟被用于描述蚕丝蛋白作为多嵌段共聚物的粗粒度,然后应用该模型得出控制丝蛋白纤维组装的加工条件和设计参数,该模型得到了实验数据验证[38]。模拟程序能够大大减少设计和表征丝蛋白新材料所需的时间。
除了直接控制材料特性之外,基因工程还能够实现丝蛋白生物材料的功能化。编码其他肽链或结构域的核酸序列可以融合进丝蛋白的编码序列,这些新增的氨基酸序列可以赋予丝蛋白聚合物更多理想的特性。在扩大丝蛋白生物材料在生物医学领域的应用方面,基因工程起着至关重要的作用。
2 通过改变氨基酸序列实现丝蛋白生物材料的功能化可以通过修饰丝蛋白的氨基酸序列来实现丝蛋白生物材料的功能化。针对丝蛋白序列关键位置上具有特定性质的侧链序列,添加或替换单个或多个氨基酸可以实现对丝蛋白生物材料性质的控制(表 1)。
表 1 通过改变氨基酸序列实现丝蛋白生物材料的功能化Table 1 Functionalization of bioengineered silk by changing its amino acid sequence
| Functionalization | Amino acid sequence | Bioengineered silk/Origin | References |
| Solubility control | Polyalanine region | 6-mer/MaSp1 N. clavipes | [40] |
| Aspartic acid | NT/MaSp1 E. australis | [47] | |
| Molecular binding | Anionic side groups | Fibroin/B. mori | [41-42] |
| Cysteine | eADF4 (C16)/ADF4 A. diadematus | [46] | |
| Faster degradation | Glycine | Heavy chain/B. mori | [43-44] |
| Enhanced cellular uptake | Glutamine | eADF4 (C16)/ADF4 A. diadematus | [45] |
表选项
2.1 修饰氨基酸序列可以控制丝蛋白的溶解度将6-mer丝蛋白(基于络新妇属蜘蛛拖牵丝蛋白MaSp1)的聚丙氨酸区域与甲硫氨酸侧接,可以有效控制蚕丝的溶解度[40]。甲硫氨酸有触发氧化还原的作用。β-折叠结构在还原态下形成,而甲硫氨酸残基选择性氧化可以抑制β-折叠结构的形成,加大蛋白结构的体积并增加丝蛋白的亲水性[40]。加强对溶解度的控制,能够防止丝蛋白过早沉淀,从而大大提高丝蛋白材料的净化效率。还可以利用这种方式来设计刺激响应性材料,使其在刺激下从水相转变为固相。此外,与结晶度高的丝素膜相比,结晶度较低的丝素膜能更有效地结合带正电荷的药物[41-42]。通过操纵丝蛋白的二级结构,可以控制丝蛋白生物材料与药物结合和释放的特性及其可生物降解性[43-44]。
2.2 修饰氨基酸序列可以改变丝蛋白的总电荷修饰氨基酸序列可导致重组丝蛋白的总电荷发生变化。用带正电荷的氨基酸取代带负电荷的氨基酸可以极大地增强细胞摄取丝蛋白载体的能力。用赖氨酸取代重组丝蛋白eADF4 (C16) (基于十字园蛛丝素蛋白ADF4)中所有的谷氨酸残基所得到的阳离子变体(eADF4(κ16))形成的球体,其内化速率与未修饰的eADF4 (C16)球体相比显著增加[45]。在eADF4 (C16)的氨基酸序列中插入半胱氨酸,可以引入一种新的分子结合位点[46]。半胱氨酸残基上的巯基可与多种化合物如染料、生物素或β-半乳糖苷酶形成共价键[46]。并且,这种修饰方法得到的丝蛋白可以用于合成具有多层结构的多用途材料。
2.3 修饰氨基酸序列可以控制丝蛋白的生成和纯化通过氨基酸序列修饰的功能化不仅限于丝蛋白的重复区域,其末端结构域也可以进行氨基酸序列的修饰。非洲育儿网蛛Euprosthenops australis丝蛋白MaSp1 N末端结构域的双重突变体,可以应用于重组丝蛋白的生成和纯化[47]。在N末端结构域用赖氨酸替换40位天冬氨酸,并用天冬氨酸取代65位赖氨酸,将其产生的突变体命名为NT*。与野生型相比,NT*变体对pH不敏感,其性质稳定并且溶解度极高。与其他常用的溶解性标签相比,这种突变体使重组生成各种疏水和/或聚集倾向性丝蛋白成为可能,且产量更高,通过这种方法可以合成药学相关的重组丝蛋白并在临床中应用。
3 通过添加功能性肽实现丝蛋白生物材料的功能化功能性肽由多个(通常为8–12个)氨基酸组成并具有一定的性质,例如抗微生物活性、酶活性、受体配体识别或与靶分子结合的特性。通过基因工程的方法,可以将这些肽的编码序列引入生物工程丝蛋白的编码序列中。这种简单的基因修饰能够形成适用于药物递送和组织工程的功能化丝蛋白材料。本文中论述的通过添加功能肽实现丝蛋白生物材料功能化的实例见表 2。
表 2 通过添加功能性肽实现丝蛋白生物材料的功能化Table 2 Functionalization of bioengineered silks with functional peptides
| Functionalization | Peptide | Function of peptide | Bioengineered silk/origin | References |
| Cellular uptake | R8G, Tat | Cell penetrating | eADF4(C16)/ADF4 A. diadematus | [45] |
| ppTG1, K15 | Cell penetrating | 6-mer/MaSp1 N. clavipes | [48, 55] | |
| KN | Cell penetrating | MS2/MaSp2 N. clavipes | [49] | |
| Anti-microbial | Mag | Anti-microbial | 4RepCT/MaSp1 E. australis | [4] |
| HNP-2, HNP-4, hepcidin | Anti-microbial | 6-mer/MaSp1 N. clavipes | [70] | |
| Nucleic acid Binding | KN | Binding nucleic acids | MS2/MaSp2 N. clavipes | [49] |
| K15 | Binding nucleic acids | 1-mer, 6-mer/MaSp1 N. clavipes | [55, 58, 61] | |
| Cell binding | IKVAV | Targeting integrins | 4RepCT/MaSp1 E. australis | [66-67] |
| YIGSR | Targeting integrins | 4RepCT/MaSp1 E. australis | [67] | |
| Targeting integrins | Light chain, heavy chain/B. mori | [68] | ||
| RGD | Targeting integrins | eADF4(C16)/ADF4 A. diadematus | [65] | |
| Targeting integrins | 4RepCT/MaSp1 E. australis | [4, 66-67, 69] | ||
| Targeting integrins | Light chain, heavy chain/B. mori | [68] | ||
| Inorganic Molecules binding | R5 | Binding silica | 15-mer/MaSp1 N. clavipes | [73] |
| A1, A3, R5 | Binding silica | 6-mer/MaSp1 N. clavipes | [72] | |
| VTK | Binding hydroxyapatite | 15-mer/MaSp1 N. clavipes | [74] | |
| Metal binding | Ag-4 | Binding silver | 6-mer, 15-mer/MaSp1 N. clavipes | [75] |
| Ag-P35 | Binding silver | 6-mer/MaSp1 N. clavipes | [75] | |
| U1, U2 | Binding uranium | 6-mer/MaSp1 N. clavipes | [76] | |
| Tumor targeting | Lyp1 | Targeting lymphatic vessels | 1-mer/MaSp1 N. clavipes | [58] |
| F3 | Targeting nucleolin | 1-mer, 6-mer/MaSp1 N. clavipes | [58, 61] | |
| CGKRK | Targeting tumor vessels | 6-mer/MaSp1 N. clavipes | [61] | |
| H2.1, H2.2 | Targeting Her2-positive receptor | MS1/MaSp1, MS2/MaSp2 N. clavipes | [50, 63] |
表选项
3.1 用于细胞靶向药物递送系统的丝蛋白材料的功能化药物递送系统应通过减少药物与生物体之间的不良相互作用,将治疗剂的不利影响降至最低。使用载体包埋药物不仅是为了降低其毒性,还应保护药物在递送过程中不被降解。递送系统的另一个特性应该是在释放上载药物之前到达靶向器官、组织或细胞。此外,用于药物输送的载体应该是无毒并可生物降解的。未经修饰的基于丝蛋白的药物递送系统只能解决上述提到的部分问题。尽管有无毒和可生物降解的已知丝蛋白载体,并且能够有效地保护其包埋的药剂免于降解[48-49],但是这些未经修饰的丝蛋白载体无法实现靶向递送,并且其细胞内化的效率极低[49-50]。已被报道的利用未经修饰的丝素蛋白载体的抗癌疗法,可以递送小分子药物如阿霉素[51]、紫杉醇[52]、姜黄素[53]或顺铂[54],这些研究指出载体会因为高通透性和滞留效应(Enhanced permeability and retention,EPR)而沉积在肿瘤部位。
通过将适当的功能性肽引入生物工程化丝蛋白,可以有效改善丝蛋白载体的细胞内化效率。添加聚赖氨酸(KKKKKKKKKKKKKKK)或聚精氨酸片段(RRRRRRRR)显著增加了细胞对丝蛋白球的摄取[45, 49, 55]。这些残基的正电荷还能够通过与磷酸主链上的负电荷相互作用实现与核酸的结合[46-47]。这些肽的插入不会影响MS2 (基于络新妇属蜘蛛拖牵丝蛋白MaSp2)和6-mer丝蛋白(基于络新妇属蜘蛛拖牵丝蛋白MaSp1)的自组装能力,并且这些功能化丝蛋白能够形成与核酸结合的球体或复合物[46-47]。与带正电荷的肽融合的6-mer丝蛋白可应用于合成丝蛋白膜以递送治疗性基因[55]。目前可用的病毒载体在体内应用后可能产生副作用,而基于丝蛋白的基因递送系统是较好的替代品[56]。
为了进一步改善细胞内化,整合素结合基序及各种细胞穿膜肽(Cell-penetrating peptides,CPPs)已应用于生物工程化丝蛋白载体[7, 45, 48, 57-58]。虽然CPPs能促进细胞内化作用,但其缺乏细胞特异性。为了获得更高的选择性,可以将识别细胞表面特定分子的肽与丝蛋白融合。肿瘤归巢肽(Tumor-homing peptides,THPs)能够有效靶向肿瘤微环境[59],F3肽(KDEPQRRSARLSAKPAPPKP EPKPKKAPAKK)能够特异性结合核仁素(在血管内皮细胞及一些肿瘤细胞表面上表达的分子),CGKRK肽能够与肿瘤血管中存在的硫酸乙酰肝素特异性结合[60]。这些肽都已成功地融合到聚赖氨酸肽功能化的6-mer蛋白中[58]。CGKRK肽和F3功能化丝/pDNA复合物对MDA-MB-435黑素瘤癌细胞及MDA-MB-231高转移性人乳腺癌细胞显示出了靶向特异性,但对非致瘤性的MCF10A乳腺上皮细胞(对照组)则没有靶向特异性[61]。在体外实验中,这两种复合物在测试的癌细胞中的转染率显著高于对照细胞。Numata等合成了pDNA的纳米复合物以及一种工程化丝蛋白单体(1-mer) (基于络新妇属蜘蛛拖牵丝蛋白MaSp1),其经聚赖氨酸肽功能化可与核酸结合,同时也具有F3或Lyp1肽的特性[58]。Lyp1肽(CGNKRTRGC)可靶向某些肿瘤的淋巴管[62]。与未修饰的变体和非致瘤性乳腺上皮细胞相比,这种功能化丝蛋白/pDNA的纳米复合物在MDA- MB-231和MDA-MB-435细胞中也显示出更高的转染率[58]。
还有研究提出针对人表皮生长因子受体2 (Her2)的丝蛋白修饰[50, 63]。Her2在20%–30%的浸润性乳腺癌中过度表达[64]。由Her2结合肽功能化的重组MS1 (基于络新妇属蜘蛛拖牵丝蛋白MaSp1)蛋白球在呈Her2阳性的SKOV3和SKBR3细胞系中有细胞内化现象,这与普通MS1蛋白球和Her2阴性细胞系对照组观察到的情形相反[50]。两种肿瘤归巢肽的变体H2.1 (MYWGDS HWLQYWYE)和H2.2 (LTVSPWY)在不同的构型(在N和C末端融合)情况下被评估。在N末端具有H2.1或H2.2结合肽的变体显示出比C末端变体更高的结合效率。此外,这些用于靶向递送的肽不会损害丝蛋白自组装的能力,因此能够成功生成球体。另外,载有模型药物多柔比星(Dox)的功能化球体能够有效地将细胞毒性药物递送到靶细胞中[50]。使用相同的肽(H2.1或H2.2)对MS2功能化得到的球体与靶细胞的结合作用明显低于MS1功能化丝蛋白球[63]。根据不同重量比(8:2)混合功能化MS1和MS2丝蛋白球与靶细胞的结合水平与功能化MS1丝蛋白球相同,但其物理化学性质有了显著的改善。此外,与功能化MS1丝蛋白球相比,装载药物的功能化MS1:MS2颗粒可以通过诱导相当低的非特异性毒性而有效杀死靶细胞[63]。
丝蛋白药物递送系统的替代策略涉及使用肿瘤特异性配体,例如CpG-siRNA的核酸序列[49]。由聚赖氨酸肽KN (KKKKKKKKKKKKKKK)功能化的MS2丝蛋白球显示出CpG-siRNA的有效加载。这些丝蛋白球保护其搭载物在血清中被降解,使其内化进入靶细胞,并可持续性释放基于siRNA的治疗剂到细胞质中[49]。此外,工程化丝蛋白球的封装改变了CpG-STAT3siRNA加工的动力学,导致靶分子延迟并延长了CpG-STAT3siRNA的沉默[49]。在该策略中,特异靶向性由核酸CpG序列提供,并可以选择性地影响细胞对Toll样受体9 (Toll-like receptor 9,TLR9)的表达。另外,此系统可以通过加载不同的基于核酸的治疗剂(靶向不同的细胞或沉默不同的基因),扩展基于丝蛋白核酸递送系统的潜在靶标。
3.2 具细胞粘附性的丝蛋白材料的功能化丝蛋白材料的生物相容性及独特的物理性质使其在组织工程领域中非常有用。丝蛋白材料的功能化有助于更好地满足再生医学的需求。整合素结合基序(如RGD)的添加不仅可以介导丝蛋白药物载体进入细胞的内化作用[45, 57],而且还能促进细胞在丝蛋白基质上的粘附和增殖[65-67]。RGD功能化的生物工程丝蛋白比用RGD基序化学修饰的丝蛋白在细胞粘附和增殖方面的表现更为突出[65]。其优势在于其合成比化学偶联反应更容易、更快,另外化学偶联反应还需要一些额外的步骤[65]。此外,化学改性的丝蛋白还存在污染及副作用等潜在问题。
Widhe等分析了成纤维细胞、角质形成细胞、内皮细胞和Schwann细胞对用整合素蛋白结合肽如RGD或IKVAV功能化的生物工程4RepCT丝蛋白(基于育儿网蛛拖牵丝蛋白MaSp1)基质的粘附作用[66]。研究显示RGD功能化的丝蛋白基质(纤维、薄膜和泡沫)的细胞粘附性明显高于未修饰的丝蛋白基质。与未修饰的4RepCT基质相比,Schwann细胞对含有IKVAV肽的薄膜也显示出更好的粘附性[66]。这些功能化材料可用作研究细胞培养或组织再生的支架材料。结合肽(RGD、IKVAV和YIGSR)也可以与4RepCT生物工程丝蛋白融合,用作体外胰腺细胞培养的支架[67]。这些修饰(特别是RGD肽)强化了丝蛋白支架维持人胰岛细胞培养的能力,并使细胞的增殖能力得到增强[67]。该系统可用于糖尿病治疗。由于有效移植需要大量的活细胞,可行有效的方法是在移植前分离胰岛并对其进行体外培养。功能化的丝蛋白支架有助于获取足够数量的胰岛细胞以进行有效的糖尿病治疗。
科学家还利用家蚕胚胎发育期的卵进行转化,将YIGSR和RGD基序成功引入了丝素蛋白序列,获得了能够产生功能化丝蛋白的转基因家蚕品系。研究表明,含有层粘连蛋白肽YIGSR的丝蛋白材料具有良好的生物相容性,在血管移植物应用方面具有前景[68]。
含有RGD基序的肽的长度、数量、相邻的氨基酸及二级结构在细胞粘附过程中起重要作用。在与4RepCT丝蛋白融合的RGD基序的3种不同形式的肽中(一种环形和两种线性对照形),环形肽对角质细胞与丝蛋白基质(膜)的粘附有最佳增强效果。肽的环化是通过将半胱氨酸残基插入其序列(CTGRGDSPAC)中来实现的[69]。
3.3 具有抗菌特性的丝蛋白材料的功能化用于组织工程的具有抗菌特性的生物材料将有助于防止植入部位的局部感染,从而显著缩短患者的康复时间。生物工程丝蛋白已被具有抗菌特性的肽功能化,如人中性粒细胞防御素HNP-2 (CYCRIPACIAGERRYTSGTCIYQGRLWAFCC)、HNP-4(VCSCRLVFCRRTELRVTSGNCCLIGGVSFTYCCTRV)和铁调素(DTHFPICIFCCGCCHRSK CGMCCKT)[70]。丝蛋白和抗菌肽的融合在合成防止植入后感染的材料方面很有潜力。除了生物医学中的潜在应用(如上所述,例如血管移植物、植入物涂层和组织工程基质),具有抗菌活性的丝蛋白在化妆品和食品工业中也有应用潜力。
3.4 结合无机分子的丝蛋白材料的功能化在温和的生理条件下,诸如筒柱藻Cylindrotheca fusiformis等生物能够生成多功能二氧化硅三维多孔结构。Silaffin亲硅蛋白在这一过程中起着重要作用。来自亲硅蛋白的R5肽(SSKKSGSYSGSKGSKRRIL)能够以受控方式结合并沉积二氧化硅[71]。据报道,R5肽功能化的6-mer丝蛋白薄膜不仅能够在其表面沉积生物硅,还能通过控制丝蛋白的β-折叠含量来控制二氧化硅矿化的尺寸和速率[72]。此外,用R5肽功能化15-mer丝蛋白形成的复合丝/二氧化硅膜,能够促进hMSCs的增殖及其向成骨谱系的分化[73]。这些性质使R5肽功能化的丝蛋白基质可在以骨再生为目的的应用中发挥作用。
适用于骨重建的丝蛋白材料的另一种合成方法,涉及到VTK肽(VTKHLNQISQSY)与15-mer丝蛋白的融合[74]。由丝蛋白-VTK形成的薄膜是无毒的,并且与未改性丝蛋白制成的对照材料相比,它不仅能够成功地诱导生物矿化,还可以增强hMSC的分化[74]。
丝蛋白材料也已被成功改性以结合金属。结合银纳米粒子的肽的功能化使得具抗菌特性的丝蛋白膜的设计得以实现[75]。12-氨基酸肽Ag-4 (NPSSLFRYLPSD)和Ag-P35 (WSWRSPTPHVVT)与6-mer和15-mer生物工程丝蛋白融合后,成功诱导了银纳米颗粒从硝酸银溶液(AgNO3)中的生成[75]。并且这种功能化不会影响丝蛋白的自组装功能。在沉积银纳米颗粒后,这种功能化的丝蛋白薄膜对革兰氏阳性和革兰氏阴性细菌具有更长效的抗菌活性[75]。
衍生自草履虫钙调蛋白的突变片段用U1肽(EQIAEFKEAFALCTKDGTGYITTKELGTCMRSLTS)和U2肽(EQIAEFKEAFALCTKDGTGYITT KELGTCMRSLTS)2肽功能化后,铀酰离子可与丝蛋白结合[76]。天然肽中钙结合位点的点突变实现了对铀酰离子的选择性结合[77]。用这些肽修饰6-mer丝蛋白,可以获得能够螯合铀酰离子的功能性融合蛋白[76]。这种改性丝蛋白可用于设计新的生物材料,实现治疗暴露性铀污染、环境污染的生物修复及构建生物传感器等目的。能够强化细胞粘附的功能化丝蛋白材料可以作为植入材料的涂层使用。丝蛋白涂层可以帮助周围的细胞附着到植入物的表面,进而缩短恢复期并增加植入材料(例如钛)的生物相容性。生物工程4RepCt丝蛋白通过纤连蛋白的细胞结合肽(CTGRGDSPAC)和抗菌基序Mag (GIGKFLH SAGKFGKAFVGEIMKS)功能化后,被成功地加工到了钛、不锈钢、羟磷灰石和聚苯乙烯基质的涂层中[4]。涂覆过程并不影响生物工程丝蛋白的功能。Fn功能化丝蛋白更强的细胞粘附性及Mag肽功能化丝蛋白更好的抗菌性能证明,这种生物工程丝蛋白可以用于无机植入物涂层材料的合成[4]。
4 通过设计嵌合蛋白实现丝蛋白生物材料的功能化设计者可以从天然丝蛋白获得设计新生物材料的灵感,利用蛋白质结构和功能之间的关系,将衍生自不同蛋白的序列融合,从而生成新的生物材料。这种新的生物材料可以拥有独特的生物物理和生物化学性质。通过该策略产生的丝蛋白嵌合体可以拥有丝蛋白的强度、生物相容性及自组装能力,而结合到丝蛋白中的其他蛋白的基序/结构域则能够提供额外的功能。对这些功能加以控制,则能够使这些新材料准确适用于各种应用。本文中论述的通过设计并添加嵌合蛋白实现丝蛋白生物材料功能化的实例见表 3。
表 3 通过设计嵌合蛋白实现丝蛋白生物材料的功能化Table 3 Functionalization of bioengineered silks with chimeric proteins
| Functionalization | Motif/domain | Function of motif/domain | Bioengineered silk/origin | References |
| Chimeric biopolymers | Elastin | Cell binding, drug release, stimuli responsive | (GAGAGS)6/B. mori | [78-85] |
| Collagen | Stimuli responsive material | Histidine-rich silk/B. mori | [86] | |
| Inorganic molecules binding | BSP | Binding hydroxyapatite | 6-mer/MaSp1/N. clavipes | [88] |
| DMP1 | Binding hydroxyapatite | 15-mer/MaSp1/N. clavipes | [87] | |
| Organic molecules binding | scFv | Specific binding of molecules | 4RepCt/MaSp1/E. australis | [91] |
| CBD | Binding cellulose | 15-mer/MaSp1/N. clavipes | [93] | |
| Enzyme fusion | Xylanase | Degradation of polysaccharides | 4RepCt/MaSp1/E. australis | [92] |
表选项
4.1 嵌合生物聚合物丝弹性蛋白聚合物(Silk elastin-like protein, SELP)是基于家蚕丝蛋白基序(GAGAGS)和哺乳动物弹性蛋白基序(GXGVP,其中X可以是除脯氨酸之外的任何氨基酸)的串联重复单元[78]。SELP由半结晶(丝)块和弹性(弹性蛋白)嵌段组成。丝肽自组装成不溶性β-折叠结构以提供热稳定性、化学稳定性和机械稳定性,而弹性蛋白通过可逆的结构转变以提供动态功能[78]。在适当的浓度和温度下,SELP可以通过快速的亲水-疏水转变以响应温度、pH及离子强度变化等刺激,实现由可溶状态向水凝胶状态的转变[78-79]。弹性蛋白序列中重复区段和X残基的数量决定了该材料的物理化学性质[80-81]。由于其在一定温度下能表现出可溶状态及在体温下呈固体状态,该材料可用作组织定位药物或基因递送的可注射、无溶剂的储存库,或用于以组织再生为目的应用[82-85]。
由疏水胶原蛋白和富含组氨酸的丝蛋白组成的丝-胶原蛋白嵌合体能够为刺激响应水凝胶提供稳定的平台。由于在丝蛋白的侧翼位置存在胶原结构域,嵌合蛋白在生理pH下能够从可溶状态转化为固体纤维和水凝胶。由于在这种丝-胶原蛋白嵌合体中缺乏细胞结合基序,细胞不会像对照(胶原蛋白)组中的细胞那样扩散和附着;这种丝-胶原水凝胶能够支持大鼠骨间充质干细胞在成骨培养基中的生长。丝-胶原蛋白嵌合体的主要优点是在细胞培养的21 d期间没有观察到材料的收缩。材料的收缩是胶原蛋白凝胶的主要缺点,因为水凝胶网络的收紧可能导致钙的流失[86]。
4.2 用于结合无机分子的丝嵌合蛋白牙本质基质蛋白1 (Carboxyl terminal domain of dentin matrix protein 1,CDMP1)与15-mer蜘蛛丝蛋白重复嵌段的融合产生了新的功能材料DMP1。DMP1具有成核能力,并能够在成骨细胞、骨细胞或成釉细胞中表达。DMP1能够通过羟基磷灰石的成核影响骨重建过程。由这种嵌合蛋白制成的耐用薄膜,也能够使羟基磷灰石成核[87]。这些特性使得丝-牙本质嵌合膜成为骨组织工程和牙组织工程上具有应用前景的新材料。
基于6-mer丝蛋白和骨涎蛋白(Bone sialoprotein,BSP)的嵌合蛋白可用于制备模拟ECM的骨组织再生薄膜[88]。BSP由成骨细胞(特别是矿化结缔组织)表达,能够促进细胞粘附和分化,在骨形成和重塑中起重要作用[89]。体外研究表明,丝-BSP嵌合蛋白可诱导磷酸钙(CaP)的成核[88],hMSC细胞在丝-BSP膜上培养2周后,能够在成骨培养基中维持增殖并分化为成骨细胞[88]。
4.3 用于结合有机分子的丝嵌合蛋白拥有结合各种有机分子的能力可以显著增加丝蛋白作为生物材料的相关性。蛋白质片段,如白蛋白结合域(Albumin-binding domain,ABD)、生物素结合域(M4)、链球菌蛋白G (Streptococcal protein G,SPG)的IgG结合域(C2)及葡萄球菌蛋白A (Staphylococcal protein A,SPA)的IgG结合域(Z),均已成功融合到4RepCT生物工程丝蛋白上,并且不会影响丝蛋白自组装成纤维和薄膜的能力[90]。此外,融合和加工成基质并不会损害所添加的结构域选择性结合靶分子的能力。由两种不同的丝融合蛋白制成的基质还显示出了结合特性。许多分子在固定时容易失去生物活性,因此通过融合进行丝蛋白材料功能化的方法非常重要。合成材料结合特定分子的能力可以用于不同类型的测试,而丝蛋白则可以充当固定分子的平台[90]。
Thatikonnda等提出了一种由丝蛋白与人抗体衍生的单链可变片段(Single-chain variable fragment,scFv)融合而成的丝蛋白材料[91]。scFv结合了轻抗体链和重抗体链中负责抗原识别的可变片段。通过两种识别不同血清蛋白的scFv和两种部分丝蛋白变体(称为RC和NC)的基因融合,产生了几种丝蛋白嵌合体的变体。在这些丝蛋白嵌合体中保留了scFv结构域的抗原识别,并且这些杂合蛋白能够选择性地结合它们的靶标。此外,scFv/NC变体显示出更好的溶解性,能够将丝蛋白纳米分散成纳米阵列[91]。这种材料是下一代免疫测定和生物传感器的潜在选择。
用于诊断和生物传感器的丝蛋白材料的另一种功能化是通过丝蛋白与酶的融合实现的。丝可以作为稳固的框架,而酶可以为生物工程材料提供催化功能。木聚糖酶与4RepCT丝蛋白的成功融合表明这种修饰确实可行且有效。这种材料在乙醇清洗时很耐用,并可以重复使用和储存。此外,将嵌合蛋白加工成不同的形态(纤维、薄膜和泡沫)后,这些特性仍得以保留[92]。
纤维素结合结构域(Cellulose-binding domain,CBD)与15-mer丝蛋白融合得到的重组丝蛋白可以有效地结合纤维素纳米晶体(Cellulose nanocrystals,CNCs),从而形成丝蛋白-CBD-CNC纳米复合材料[93]。与丝蛋白一样,纤维素具有突出的机械性能,常用于形成透明薄膜和水凝胶。然而,由于其加工所需的环境要求较高,其在体内的应用相当有限。CBD结构域的存在使丝蛋白通过丝蛋白-CBD二聚体而能够形成更高的有序结构(即纤维)[93]。向丝蛋白-CBD溶液中添加CNCs可以进一步排列纤维,从而形成高度有序和透明的材料[93]。生成的薄膜可应用于再生医学。由于其高度透明的特性,该生物材料特别适合促进角膜再生。
5 总结及展望5.1 基因工程化丝蛋白的应用现状目前,在大量已有的生物材料平台中,丝蛋白因其机械性能高、生物相容性好和可生物降解脱颖而出(图 2)。在分子水平上利用基因工程的手段改造丝蛋白,可以使其更多样化地应用在生物医学工程领域。此外,基因工程化方法可以进一步改善丝蛋白生物材料的显著特性。已有报道证实了丝蛋白材料在癌症治疗[94]、再生医学[95]及基因传递系统[55]中具有巨大的应用价值,并且某些丝蛋白生物材料已经进入临床测试阶段[96]。此外,肽序列数据库(PepBank)有助于进一步设计和开发具备更多功能的丝蛋白生物材料[97]。对新型个性化生物材料的需求在持续增加,基因工程为设计新的生物聚合物以匹配生物材料的特殊功能提供了新的途径。
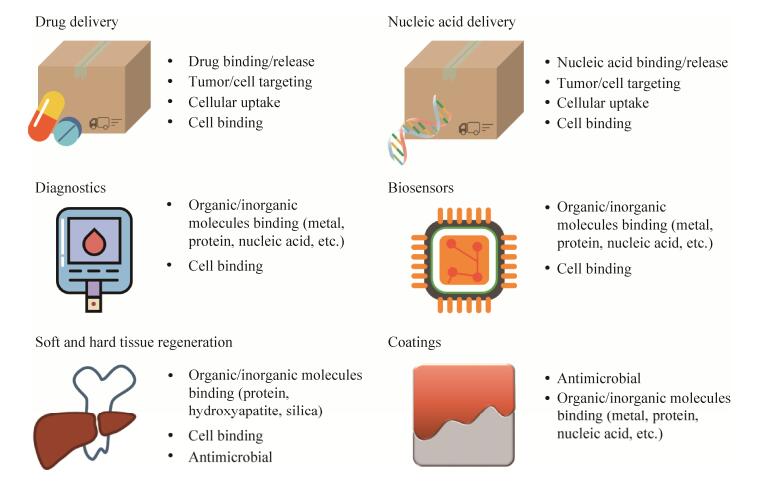 |
| 图 2 生物工程丝的功能化应用[11] Fig. 2 Functional applications of bioengineered silk[11]. |
| 图选项 |
5.2 基因工程化丝蛋白的应用前景和挑战由于利用基因工程技术可以在分子水平上对结构进行合理的设计并实现更便利的控制,基因重组技术促进了丝蛋白生成的产量和质量,但这些蛋白的高度重复性序列以及其表达量和结构的大小依然是主要的挑战,合成生物学新策略的开发将在这些问题上提供更多的可能。而生物技术策略的使用不仅解决了丝蛋白材料易获得性的问题,而且能够使丝蛋白的性能得到改变,并为丝蛋白生物材料添加更多新的特性。
虽然基因工程拓宽了丝蛋白材料的潜在应用范围,但其仍可能存在一些局限性。一种新的生物工程丝蛋白必须保留源丝蛋白的特性,即具有自组装能力。此外,添加新的结构域可能会诱导丝蛋白的免疫原性或毒性,这是在体内应用具有关联性的关键问题。因此,有必要对改性丝蛋白生物材料的性能进行详细的评价。目前,基因工程化的方法修饰丝蛋白材料还有较大研究潜力,相信未来具有可调可控特性的丝蛋白聚合物作为安全的功能材料会在生物医学工程领域得到更广泛的应用。
参考文献
| [1] | Shao ZZ, Vollrath F. Materials: surprising strength of silkworm silk.Nature, 2002, 418(6899): 741–741.DOI: 10.1038/418741a |
| [2] | Altman GH, Diaz F, Jakuba C, et al. Silk-based biomaterials.Biomaterials, 2003, 24(3): 401–416.DOI: 10.1016/S0142-9612(02)00353-8 |
| [3] | Kluge JA, Rabotyagova O, Leisk GG, et al. Spider silks and their applications.Trends Biotechnol, 2008, 26(5): 244–251.DOI: 10.1016/j.tibtech.2008.02.006 |
| [4] | Nileb?ck L, Hedin J, Widhe M, et al. Self-assembly of recombinant silk as a strategy for chemical-free formation of bioactive coatings: a real-time study.Biomacromolecules, 2017, 18(3): 846–854.DOI: 10.1021/acs.biomac.6b01721 |
| [5] | Vendrely C, Scheibel T. Biotechnological production of spider-silk proteins enables new applications.Macromol Biosci, 2007, 7(4): 401–409.DOI: 10.1002/(ISSN)1616-5195 |
| [6] | Schacht K, Scheibel T. Processing of recombinant spider silk proteins into tailor-made materials for biomaterials applications.Curr Opin Biotechnol, 2014, 29: 62–69.DOI: 10.1016/j.copbio.2014.02.015 |
| [7] | Numata K, Kaplan DL. Silk-based delivery systems of bioactive molecules.Adv Drug Deliv Rev, 2010, 62(15): 1497–1508.DOI: 10.1016/j.addr.2010.03.009 |
| [8] | Du WH, Zhao TF, Zhu Y. Advances in genetic engineering of spider silk proteins.Sci Sericul, 2011, 37(05): 892–898.(in Chinese). 杜文华, 赵天福, 朱勇. 蜘蛛丝蛋白基因工程的研究进展.蚕业科学, 2011, 37(05): 892-898.DOI:10.3969/j.issn.0257-4799.2011.05.017 |
| [9] | Wray LS, Hu X, Gallego J, et al. Effect of processing on silk-based biomaterials: reproducibility and biocompatibility.J Biomed Mater Res B Appl Biomater, 2011, 99(1): 89–101. |
| [10] | Wang JH, Wang SJ, Xia JH, et al. Review on methods for silk modification.Chin J Chem Edu, 2018, 39(10): 1–4.(in Chinese). 王嘉禾, 王淑娟, 夏嘉豪, 等. 蚕丝改性方法概述.化学教育, 2018, 39(10): 1-4. |
| [11] | Deptuch T, Dams-Kozlowska H. Silk materials functionalized via genetic engineering for biomedical applications.Materials, 2017, 10(12): 1417.DOI: 10.3390/ma10121417 |
| [12] | Tokareva O, Jacobsen M, Buehler M, et al. Structure-function-property-design interplay in biopolymers: spider silk.Acta Biomater, 2014, 10(4): 1612–1626.DOI: 10.1016/j.actbio.2013.08.020 |
| [13] | Pan HC, Song DX, Zhou KY, et al. Cloning and prokaryotic expression of major ampullate spidroin gene of spider.Chin J Biotech, 2007, 23(3): 446–451.(in Chinese). 潘红春, 宋大祥, 周开亚, 等. 蜘蛛大壶状腺丝蛋白基因的克隆和原核表达.生物工程学报, 2007, 23(3): 446-451.DOI:10.3321/j.issn:1000-3061.2007.03.016 |
| [14] | Lewis RV. Spider silk: ancient ideas for new biomaterials.Chem Rev, 2006, 106(9): 3762–3774.DOI: 10.1021/cr010194g |
| [15] | Xu M, Lewis RV. Structure of a protein superfiber: spider dragline silk.Proc Natl Acad Sci USA, 1990, 87(18): 7120–7124.DOI: 10.1073/pnas.87.18.7120 |
| [16] | Gaines WA, Sehorn MG, Marcotte WR Jr. Spidroin n-terminal domain promotes a ph-dependent association of silk proteins during self-assembly.J Biol Chem, 2010, 285(52): 40745–40753.DOI: 10.1074/jbc.M110.163121 |
| [17] | Ittah S, Cohen S, Garty S, et al. An essential role for the C-terminal domain of a dragline spider silk protein in directing fiber formation.Biomacromolecules, 2006, 7(6): 1790–1795.DOI: 10.1021/bm060120k |
| [18] | Qi Y, Wang H, Wei K, et al. A review of structure construction of silk fibroin biomaterials from single structures to multi-level structures.Int J Mol Sci, 2017, 18(3): 237.DOI: 10.3390/ijms18030237 |
| [19] | Arcidiacono S, Mello C, Kaplan D, et al. Purification and characterization of recombinant spider silk expressed in Escherichia coli.Appl Microbiol Biotechnol, 1998, 49(1): 31–38. |
| [20] | Lewis RV, Hinman M, Kothakota S, et al. Expression and purification of a spider silk protein: a new strategy for producing repetitive proteins.Protein Expr Purif, 1996, 7(4): 400–406.DOI: 10.1006/prep.1996.0060 |
| [21] | Tokareva O, Michalczechen-Lacerda VA, Rech EL, et al. Recombinant DNA production of spider silk proteins.Microb Biotechnol, 2013, 6(6): 651–663.DOI: 10.1111/mbt.2013.6.issue-6 |
| [22] | Scheller J, Gührs KH, Grosse F, et al. Production of spider silk proteins in tobacco and potato.Nat Biotechnol, 2001, 19(6): 573–577.DOI: 10.1038/89335 |
| [23] | Lazaris A, Arcidiacono S, Huang Y, et al. Spider silk fibers spun from soluble recombinant silk produced in mammalian cells.Science, 2002, 295(5554): 472–476.DOI: 10.1126/science.1065780 |
| [24] | Kuwana Y, Sezutsu H, Nakajima K, et al. High-toughness silk produced by a transgenic silkworm expressing spider (Araneus ventricosus) dragline silk protein.PLoS ONE, 2014, 9(8): e105325.DOI: 10.1371/journal.pone.0105325 |
| [25] | Fahnestock SR, Bedzyk LA. Production of synthetic spider dragline silk protein in Pichia pastoris.Appl Microbiol Biotechnol, 1997, 47(1): 33–39. |
| [26] | Heidebrecht A, Scheibel T. Recombinant production of spider silk proteins.Adv Appl Microbiol, 2013, 82: 115–153.DOI: 10.1016/B978-0-12-407679-2.00004-1 |
| [27] | Williams D. Sows' ears, silk purses and goats' milk: new production methods and medical applications for silk.Med Device Technol, 2003, 14(5): 9–11. |
| [28] | Xia XX, Qian ZG, Ki CS, et al. Native-sized recombinant spider silk protein produced in metabolically engineered Escherichia coli results in a strong fiber.Proc Natl Acad Sci USA, 2010, 107(32): 14059–14063.DOI: 10.1073/pnas.1003366107 |
| [29] | Dinjaski N, Kaplan DL. Recombinant protein blends: silk beyond natural design.Curr Opin Biotechnol, 2016, 39: 1–7. |
| [30] | Sutherland TD, Campbell PM, Weisman S, et al. A highly divergent gene cluster in honey bees encodes a novel silk family.Genome Res, 2006, 16(11): 1414–1421.DOI: 10.1101/gr.5052606 |
| [31] | Sezutsu H, Kajiwara H, Kojima K, et al. Identification of four major hornet silk genes with a complex of alanine-rich and serine-rich sequences in Vespa simillima xanthoptera cameron.Biosci Biotechnol Biochem, 2007, 71(11): 2725–2734.DOI: 10.1271/bbb.70326 |
| [32] | Shi JH, Lua SX, Du N, et al. Identification, recombinant production and structural characterization of four silk proteins from the asiatic honeybee Apis cerana.Biomaterials, 2008, 29(18): 2820–2828.DOI: 10.1016/j.biomaterials.2008.03.020 |
| [33] | Weisman S, Haritos VS, Church JS, et al. Honeybee silk: recombinant protein production, assembly and fiber spinning.Biomaterials, 2010, 31(9): 2695–2700.DOI: 10.1016/j.biomaterials.2009.12.021 |
| [34] | Sutherland TD, Church JS, Hu XA, et al. Single honeybee silk protein mimics properties of multi-protein silk.PLoS ONE, 2011, 6(2): e16489.DOI: 10.1371/journal.pone.0016489 |
| [35] | Krishnaji ST, Bratzel G, Kinahan ME, et al. Sequence-structure-property relationships of recombinant spider silk proteins: integration of biopolymer design, processing, and modeling.Adv Funct Mater, 2013, 23(2): 241–253.DOI: 10.1002/adfm.201200510 |
| [36] | Tokareva OS, Lin SC, Jacobsen MM, et al. Effect of sequence features on assembly of spider silk block copolymers.J Struct Biol, 2014, 186(3): 412–419.DOI: 10.1016/j.jsb.2014.03.004 |
| [37] | Jastrzebska K, Felcyn E, Kozak M, et al. The method of purifying bioengineered spider silk determines the silk sphere properties.Sci Rep, 2016, 6: 28106.DOI: 10.1038/srep28106 |
| [38] | Lin SC, Ryu S, Tokareva O, et al. Predictive modelling-based design and experiments for synthesis and spinning of bioinspired silk fibres.Nat Commun, 2015, 6: 6892.DOI: 10.1038/ncomms7892 |
| [39] | Huang WW, Ebrahimi D, Dinjaski N, et al. Synergistic integration of experimental and simulation approaches for the de novo design of silk-based materials.Acc Chem Res, 2017, 50(4): 866–876.DOI: 10.1021/acs.accounts.6b00616 |
| [40] | Szela S, Avtges P, Valluzzi R, et al. Reduction-oxidation control of β-sheet assembly in genetically engineered silk.Biomacromolecules, 2000, 1(4): 534–542.DOI: 10.1021/bm0055697 |
| [41] | Coburn JM, Na E, Kaplan DL. Modulation of vincristine and doxorubicin binding and release from silk films.J Control Release, 2015, 220: 229–238.DOI: 10.1016/j.jconrel.2015.10.035 |
| [42] | Seib FP, Kaplan DL. Doxorubicin-loaded silk films: drug-silk interactions and in vivo performance in human orthotopic breast cancer.Biomaterials, 2012, 33(33): 8442–8450.DOI: 10.1016/j.biomaterials.2012.08.004 |
| [43] | Numata K, Cebe P, Kaplan DL. Mechanism of enzymatic degradation of beta-sheet crystals.Biomaterials, 2010, 31(10): 2926–2933.DOI: 10.1016/j.biomaterials.2009.12.026 |
| [44] | Brown J, Lu CL, Coburn J, et al. Impact of silk biomaterial structure on proteolysis.Acta Biomater, 2015, 11: 212–221.DOI: 10.1016/j.actbio.2014.09.013 |
| [45] | Elsner MB, Herold HM, Müller-Herrmann S, et al. Enhanced cellular uptake of engineered spider silk particles.Biomater Sci, 2015, 3(3): 543–551.DOI: 10.1039/C4BM00401A |
| [46] | Spie? K, Wohlrab S, Scheibel T. Structural characterization and functionalization of engineered spider silk films.Soft Matter, 2010, 6(17): 4168–4174.DOI: 10.1039/b927267d |
| [47] | Kronqvist N, Sarr M, Lindqvist A, et al. Efficient protein production inspired by how spiders make silk.Nat Commun, 2017, 8: 15504.DOI: 10.1038/ncomms15504 |
| [48] | Numata K, Kaplan DL. Silk-based gene carriers with cell membrane destabilizing peptides.Biomacromolecules, 2010, 11(11): 3189–3195.DOI: 10.1021/bm101055m |
| [49] | Kozlowska AK, Florczak A, Smialek M, et al. Functionalized bioengineered spider silk spheres improve nuclease resistance and activity of oligonucleotide therapeutics providing a strategy for cancer treatment.Acta Biomater, 2017, 59: 221–233.DOI: 10.1016/j.actbio.2017.07.014 |
| [50] | Florczak A, Mackiewicz A, Dams-Kozlowska H. Functionalized spider silk spheres as drug carriers for targeted cancer therapy.Biomacromolecules, 2014, 15(8): 2971–2981.DOI: 10.1021/bm500591p |
| [51] | Seib FP, Jones GT, Rnjak-Kovacina J, et al. pH-dependent anticancer drug release from silk nanoparticles.Adv Healthc Mater, 2013, 2(12): 1606–1611.DOI: 10.1002/adhm.v2.12 |
| [52] | Chen MJ, Shao ZZ, Chen X. Paclitaxel-loaded silk fibroin nanospheres.J Biomed Mater Res A, 2012, 100A(1): 203–210.DOI: 10.1002/jbm.a.v100a.1 |
| [53] | Gupta V, Aseh A, Ríos CN, et al. Fabrication and characterization of silk fibroin-derived curcumin nanoparticles for cancer therapy.Int J Nanomedicine, 2009, 4: 115–122. |
| [54] | Qu J, Liu Y, Yu YN, et al. Silk fibroin nanoparticles prepared by electrospray as controlled release carriers of cisplatin.Mater Sci Eng C Mater Biol Appl, 2014, 44: 166–174.DOI: 10.1016/j.msec.2014.08.034 |
| [55] | Numata K, Subramanian B, Currie HA, et al. Bioengineered silk protein-based gene delivery systems.Biomaterials, 2009, 30(29): 5775–5784.DOI: 10.1016/j.biomaterials.2009.06.028 |
| [56] | Vannucci L, Lai M, Chiuppesi F, et al. Viral vectors: a look back and ahead on gene transfer technology.New Microbiol, 2013, 36(1): 1–22. |
| [57] | Ruan CR, Huang JX, Wei MH, et al. Construction, fermentation and purification of high polymer spider dragline silk protein containing RGD peptide.Chin J Biotech, 2007, 23(5): 858–861.(in Chinese). 阮超然, 黄晶星, 魏梅红, 等. 高分子量RGD-蛛丝蛋白重组体的构建、高密度发酵及纯化.生物工程学报, 2007, 23(5): 858-861.DOI:10.3321/j.issn:1000-3061.2007.05.017 |
| [58] | Numata K, Mieszawska-Czajkowska AJ, Kvenvold LA, et al. Silk-based nanocomplexes with tumor-homing peptides for tumor-specific gene delivery.Macromol Biosci, 2012, 12(1): 75–82.DOI: 10.1002/mabi.v12.1 |
| [59] | Laakkonen P, Vuorinen K. Homing peptides as targeted delivery vehicles.Integr Biol, 2010, 2(7/8): 326–337. |
| [60] | Hoffman JA, Giraudo E, Singh M, et al. Progressive vascular changes in a transgenic mouse model of squamous cell carcinoma.Cancer Cell, 2003, 4(5): 383–391.DOI: 10.1016/S1535-6108(03)00273-3 |
| [61] | Numata K, Reagan MR, Goldstein RH, et al. Spider silk-based gene carriers for tumor cell-specific delivery.Bioconjug Chem, 2011, 22(8): 1605–1610.DOI: 10.1021/bc200170u |
| [62] | Porkka K, Laakkonen P, Hoffman JA, et al. A fragment of the HMGN2 protein homes to the nuclei of tumor cells and tumor endothelial cells in vivo.Proc Natl Acad Sci USA, 2002, 99(11): 7444–7449.DOI: 10.1073/pnas.062189599 |
| [63] | Florczak A, Jastrzebska K, Mackiewicz A, et al. Blending two bioengineered spider silks to develop cancer targeting spheres.J Mater Chem B, 2017, 5(16): 3000–3011.DOI: 10.1039/C7TB00233E |
| [64] | Witton CJ, Reeves JR, Going JJ, et al. Expression of the HER1-4 family of receptor tyrosine kinases in breast cancer.J Pathol, 2003, 200(3): 290–297.DOI: 10.1002/(ISSN)1096-9896 |
| [65] | Wohlrab S, Müller S, Schmidt A, et al. Cell adhesion and proliferation on RGD-modified recombinant spider silk proteins.Biomaterials, 2012, 33(28): 6650–6659.DOI: 10.1016/j.biomaterials.2012.05.069 |
| [66] | Widhe M, Johansson U, Hillerdahl CO, et al. Recombinant spider silk with cell binding motifs for specific adherence of cells.Biomaterials, 2013, 34(33): 8223–8234.DOI: 10.1016/j.biomaterials.2013.07.058 |
| [67] | Johansson U, Ria M, ?vall K, et al. Pancreatic islet survival and engraftment is promoted by culture on functionalized spider silk matrices.PLoS ONE, 2015, 10(6): e0130169.DOI: 10.1371/journal.pone.0130169 |
| [68] | Asakura T, Isozaki M, Saotome T, et al. Recombinant silk fibroin incorporated cell-adhesive sequences produced by transgenic silkworm as a possible candidate for use in vascular graft.J Mater Chem B, 2014, 2(42): 7375–7383.DOI: 10.1039/C4TB01301H |
| [69] | Widhe M, Shalaly ND, Hedhammar M. A fibronectin mimetic motif improves integrin mediated cell biding to recombinant spider silk matrices.Biomaterials, 2016, 74: 256–266.DOI: 10.1016/j.biomaterials.2015.10.013 |
| [70] | Gomes SC, Leonor IB, Mano JF, et al. Antimicrobial functionalized genetically engineered spider silk.Biomaterials, 2011, 32(18): 4255–4266.DOI: 10.1016/j.biomaterials.2011.02.040 |
| [71] | Senior L, Crump MP, Williams C, et al. Structure and function of the silicifying peptide R5.J Mater Chem B, 2015, 3(13): 2607–2614.DOI: 10.1039/C4TB01679C |
| [72] | Zhou S, Huang WW, Belton DJ, et al. Control of silicification by genetically engineered fusion proteins: silk-silica binding peptides.Acta Biomater, 2015, 15: 173–180.DOI: 10.1016/j.actbio.2014.10.040 |
| [73] | Mieszawska AJ, Nadkarni LD, Perry CC, et al. Nanoscale control of silica particle formation via silk-silica fusion proteins for bone regeneration.Chem Mater, 2010, 22(20): 5780–5785.DOI: 10.1021/cm101940u |
| [74] | Dinjaski N, Plowright R, Zhou S, et al. Osteoinductive recombinant silk fusion proteins for bone regeneration.Acta Biomater, 2017, 49: 127–139.DOI: 10.1016/j.actbio.2016.12.002 |
| [75] | Currie HA, Deschaume O, Naik RR, et al. Genetically engineered chimeric silk-silver binding proteins.Adv Funct Mater, 2011, 21(15): 2889–2895.DOI: 10.1002/adfm.201100249 |
| [76] | Krishnaji ST, Kaplan DL. Bioengineered chimeric spider silk-uranium binding proteins.Macromol Biosci, 2013, 13(2): 256–264.DOI: 10.1002/mabi.201200272 |
| [77] | Pardoux R, Sauge-Merle S, Lemaire D, et al. Modulating uranium binding affinity in engineered calmodulin EF-hand peptides: effect of phosphorylation.PLoS ONE, 2012, 7(8): e41922.DOI: 10.1371/journal.pone.0041922 |
| [78] | Huang WW, Rollett A, Kaplan DL. Silk-elastin-like protein biomaterials for the controlled delivery of therapeutics.Expert Opin Drug Deliv, 2015, 12(5): 779–791.DOI: 10.1517/17425247.2015.989830 |
| [79] | Nagarsekar A, Crissman J, Crissman M, et al. Genetic synthesis and characterization of pH- and temperature-sensitive silk-elastinlike protein block copolymers.J Biomed Mater Res, 2002, 62(2): 195–203.DOI: 10.1002/(ISSN)1097-4636 |
| [80] | Wang Q, Xia XX, Huang WW, et al. High throughput screening of dynamic silk-elastin-like protein biomaterials.Adv Funct Mater, 2014, 24(27): 4303–4310.DOI: 10.1002/adfm.v24.27 |
| [81] | Xia XX, Xu QB, Hu X, et al. Tunable self-assembly of genetically engineered silk-elastin-like protein polymers.Biomacromolecules, 2011, 12(11): 3844–3850.DOI: 10.1021/bm201165h |
| [82] | Gustafson JA, Ghandehari H. Silk-elastinlike protein polymers for matrix-mediated cancer gene therapy.Adv Drug Deliv Rev, 2010, 62(15): 1509–1523.DOI: 10.1016/j.addr.2010.04.006 |
| [83] | Yang MY, Tanaka C, Yamauchi K, et al. Silklike materials constructed from sequences of Bombyx mori silk fibroin, fibronectin, and elastin.J Biomed Mater Res A, 2008, 84(2): 353–363. |
| [84] | Qiu WG, Huang YD, Teng WB, et al. Complete recombinant silk-elastinlike protein-based tissue scaffold.Biomacromolecules, 2010, 11(12): 3219–3227.DOI: 10.1021/bm100469w |
| [85] | Shi P, Gustafson JA, MacKay JA. Genetically engineered nanocarriers for drug delivery.Int J Nanomedicine, 2014, 9: 1617–1626. |
| [86] | W?odarczyk-Biegun MK, Werten MWT, de Wolf FA, et al. Genetically engineered silk-collagen-like copolymer for biomedical applications: production, characterization and evaluation of cellular response.Acta Biomater, 2014, 10(8): 3620–3629.DOI: 10.1016/j.actbio.2014.05.006 |
| [87] | Huang J, Wong C, George A, et al. The effect of genetically engineered spider silk-dentin matrix protein 1 chimeric protein on hydroxyapatite nucleation.Biomaterials, 2007, 28(14): 2358–2367.DOI: 10.1016/j.biomaterials.2006.11.021 |
| [88] | Gomes S, Leonor IB, Mano JF, et al. Spider silk-bone sialoprotein fusion proteins for bone tissue engineering.Soft Matter, 2011, 7(10): 4964–4973.DOI: 10.1039/c1sm05024a |
| [89] | Mizuno M, Imai T, Fujisawa R, et al. Bone sialoprotein (BSP) is a crucial factor for the expression of osteoblastic phenotypes of bone marrow cells cultured on type Ⅰ collagen matrix.Calcif Tissue Int, 2000, 66(5): 388–396.DOI: 10.1007/s002230010078 |
| [90] | Jansson R, Thatikonda N, Lindberg D, et al. Recombinant spider silk genetically functionalized with affinity domains.Biomacromolecules, 2014, 15(5): 1696–1706.DOI: 10.1021/bm500114e |
| [91] | Thatikonda N, Delfani P, Jansson R, et al. Genetic fusion of single-chain variable fragments to partial spider silk improves target detection in micro- and nanoarrays.Biotechnol J, 2016, 11(3): 437–448.DOI: 10.1002/biot.v11.3 |
| [92] | Jansson R, Courtin CM, Sandgren M, et al. Rational design of spider silk materials genetically fused with an enzyme.Adv Funct Mater, 2015, 25(33): 5343–5352.DOI: 10.1002/adfm.201501833 |
| [93] | Meirovitch S, Shtein Z, Ben-Shalom T, et al. Spider silk-CBD-cellulose nanocrystal composites: mechanism of assembly.Int J Mol Sci, 2016, 17(9): 1573.DOI: 10.3390/ijms17091573 |
| [94] | Jastrzebska K, Kucharczyk K, Florczak A, et al. Silk as an innovative biomaterial for cancer therapy.Rep Pract Oncol Radiother, 2015, 20(2): 87–98.DOI: 10.1016/j.rpor.2014.11.010 |
| [95] | Gomes S, Leonor IB, Mano JF, et al. Natural and genetically engineered proteins for tissue engineering.Prog Polym Sci, 2012, 37(1): 1–17.DOI: 10.1016/j.progpolymsci.2011.07.003 |
| [96] | Zhang W, Chen LK, Chen JL, et al. Silk fibroin biomaterial shows safe and effective wound healing in animal models and a randomized controlled clinical trial.Adv Healthc Mater, 2017, 6(10): 1700121.DOI: 10.1002/adhm.v6.10 |
| [97] | Shtatland T, Guettler D, Kossodo M, et al. PepBank — a database of peptides based on sequence text mining and public peptide data sources.BMC Bioinformatics, 2007, 8: 280.DOI: 10.1186/1471-2105-8-280 |
