
 , 陈伟1,2
, 陈伟1,2

1. 山东农业大学 动物科技学院,山东 泰安 271018;
2. 山东农业大学 山东省动物生物工程与疾病防治重点实验室,山东 泰安 271018;
3. 潍坊科技学院,山东 潍坊 262700
收稿日期:2018-10-24;接收日期:2019-02-20;网络出版时间:2019-02-26
基金项目:国家自然科学基金(No. 31401055),山东省自然科学基金项目(No. ZR2018BC046),山东省“双一流”奖补资金项目(No.SYL2017YSTD12),山东省现代农业产业技术体系生猪创新团队建设专项(No. SDAIT-08-02)资助
摘要:本研究旨在阐明猪miR-331-3p对细胞增殖的影响,探讨其对细胞增殖的作用机制首先构建了miR-331-3p的过表达载体pcDNA 3.1 (+)-miR-331-3p,并将将PK15细胞分为4组,分别为实验组、实验组对照组、抑制剂组和抑制剂对照组。实验组和对照组分别转染pcDNA 3.1(+)-miR-331-3p和pcDNA 3.1(+)。抑制剂组和抑制剂对照组分别转染miR-331-3p Inhibitor和miR-331-3p阴性对照(miR-331-3p NC)。通过在各组添加CCK-8试剂绘制细胞增殖曲线,并使用PI染色检测细胞所处周期比例。同时,利用实时荧光定量PCR (Quantitative real-time PCR,qPCR)检测生长抑制蛋白家族成员5 (Inhibitor of growth family member 5,ING5)、细胞周期蛋白依赖性激酶2 (Cyclin dependent kinase 2,CDK2)、细胞周期蛋白依赖性激酶3 (Cyclin dependent kinase 3,CDK3)、细胞周期蛋白依赖性激酶4 (Cyclin dependent kinase 4,CDK4)、细胞周期蛋白B (Cyclin B)和细胞周期蛋白依赖性激酶抑制剂1A (Cyclin dependent kinase inhibitor 1A,CDKN1A)的表达变化。结果表明,实验组miR-331-3p表达量显著升高,细胞增殖曲线表明48 h和72 h时细胞数目均呈现出实验组 > 实验对照组和抑制剂对照组 > 抑制剂组的趋势(P < 0.05)。与实验对照组相比,实验组处于G0/G1期的细胞比例下调,S期和G2/M细胞的比例上调,抑制剂对照组趋势与之相反;同时,实验组中与促进增殖的基因CDK2、CDK3、CDK4和Cyclin B的mRNA表达水平均显著升高,而抑制增殖的基因ING5和CDKN1A均表现出显著下降的趋势。本研究成功构建了miR-331-3p过表达载体,且发现miR-331-3p具有促进猪肾上皮细胞增殖的能力,研究结果为深入研究miR-331-3p在猪生长发育中的作用机制奠定了基础。
关键词:miR-331-3p细胞增殖过表达载体PK15猪
Construction of miR-331-3p overexpression vector and its effect on cell proliferation
Tao Chen1,2, Lixia Ma1,2, Jingxiang Cui1,3, Jinhong Geng1,2, Yongqing Zeng1,2

 , Wei Chen1,2
, Wei Chen1,2

1. College of Animal Science and Technology, Shandong Agricultural University, Tai'an 271018, Shandong, China;
2. Shandong Provincial Key Laboratory of Animal Biotechnology and Disease Control and Prevention, Shandong Agricultural University, Tai'an 271018, Shandong, China;
3. Weifang University of Science and Technology, Weifang 262700, Shandong, China
Received: October 24, 2018; Accepted: February 20, 2019; Published: February 26, 2019
Supported by: National Natural Science Foundation of China (No. 31401055), Shandong Provincial Natural Science Foundation (No.ZR2018BC046), Shandong "Double Tops" Program (No. SYL2017YSTD12), Shandong Provincial Modern Pig Technology and Industry System Project (No. SDAIT-08-02)
Corresponding author: Yongqing Zeng. Tel: +86-538-8249222-8311; E-mail: yqzeng@sdau.edu.cn;
Wei Chen. Tel: +86-538-8242478; E-mail: wchen@sdau.edu.cn.
Abstract: To investigate the effect of miR-331-3p on the proliferation of porcine renal epithelial cells (PK15) and its mechanism, the pcDNA 3.1(+) overexpression vector of miRNA-331-3p (pcDNA 3.1(+)-miR-331-3p) was constructed. PK15 cells were divided into four groups, including experimental group, experimental control group, inhibitor group and inhibitor control group. Experimental group and experimental control group were transfected with pcDNA 3.1(+)-miR-331-3p and pcDNA 3.1(+), respectively. Inhibitor group and inhibitor control group were transfected with miR-331-3p inhibitor and miR-331-3p negative control (miR-331-3p NC), respectively. Above all, CCK-8 reagent was used to plot the cell proliferation curve and Propidium (PI) staining was used to detect the proportion of cell stages. Secondly, its expression change were detected by quantitative real-time PCR that included the growth inhibitory protein family member 5 (ING5), cyclin-dependent kinase 2 (CDK2), cyclin-dependent kinase 3 (CDK3), cyclin-dependent kinase 4 (CDK4), Cyclin B and cyclin-dependent kinase inhibitor 1A (CDKN1A). The results showed that the expression of miRNA-331-3p was significantly increased in the experimental group. The cell proliferation curve showed that the number of cells in experimental group was significantly higher than that in experimental control group or inhibitor control group at 48 h and 72 h (P < 0.05). Simultaneously, Inhibitor group was significantly lower than experimental control group or inhibitor control group in the number of cells at 48 h and 72 h (P < 0.05), but there was no significant difference between the experimental group and the control group. Compared with the experimental control group, the proportion of cells of experimental group in G0/G1 phase decreased, the proportion of S phase and G2/M phase increased, and the inhibitor control group showed the opposite trend. Simultaneously, the expression levels of CDK2, CDK3, CDK4 and Cyclin B genes in the experimental group were significantly increased, while ING5 and CDKN1A genes inhibiting proliferation showed a significant downward trend. These results demonstrate that the miR-331-3p overexpression vector was successfully constructed, and miR-331-3p has the ability to promote the proliferation of PK15 cells. The study lays a solid foundation for further research for its role in pig growth and development.
Keywords: miR-331-3pcell proliferationoverexpression vectorPK15pig
miRNA是长度为18–24 nt的短序列的单链非编码RNA,在进化上具有高度的保守性,主要通过调控基因表达的水平起作用。许多研究已表明,miRNA主要通过与靶基因的3? UTR互补配对,引起靶基因mRNA的降解或者抑制其翻译[1],实现对基因表达水平的调控,从而参与细胞的增殖、分化、凋亡和代谢等许多生物学过程[2-3]。
miR-331-3p是一种在各种物种中高度保守的miRNA,目前研究发现miR-331-3p在癌细胞的增殖分化以及癌症的发生、发展中发挥着重要作用[4],在功能上具有多种作用。miR-331-3p可以靶向作用于细胞周期相关基因E2F1 (E2F transcription factor 1),具有抑制胃癌细胞生长和克隆的形成的能力[5]。研究发现,miR-331-3p的受体lncRNA-HOTAIR参与调节人表皮生长因子受体2 (Glutamyl-tRNA (Gln) amidotransferase subunit HER2,HER2)的去阻遏,并强化额外水平的转录后调控可降低HER2蛋白的表达,进而降低胃癌细胞的增殖、迁移和侵袭[6]。ING5是一个肿瘤抑制基因,抑制细胞生长并且诱导细胞凋亡。miR-331-3p能够通过抑制ING5表达促进肝癌(HCC)细胞的增殖[7]。综上所述,miR-331-3p一直被认为是一种肿瘤相关因子,本身的作用也具有多样性,但这些研究都仅限于人类的癌症细胞中,miR-331-3p对于其他物种或细胞的作用研究很少。
猪是人类重要的肉食来源,其自身生长受多种因素的影响。miRNA作为目前较热门的研究领域,已经有很多研究表明miRNA在猪生长发育过程中发挥着重要的作用,例如miR-1、miR-133和miR-206都是肌肉特异性的miRNA,在肌肉形成过程中起着关键作用[8],但是miR-331-3p在猪细胞增殖方面的研究鲜有报道。猪肾上皮细胞系即PK15细胞,是一种常见的细胞系,对于猪圆环病毒(PCV)、猪细小病毒(PPV)和猪瘟病毒(CSFV)等多种病毒比较敏感,现已广泛应用于猪瘟病毒、猪伪狂犬病病毒和猪细小病毒等的分离、体外培养以及相关疫苗的生产中,具有非常重要的作用[9]。因此,本研究选取PK15细胞作为研究对象,通过研究miR-331-3p对PK15细胞增殖的影响,为进一步探讨miR-331-3p在猪生长发育中的作用机制奠定基础。
1 材料与方法1.1 材料及主要试剂猪肾上皮细胞(PK15)、pcDNA 3.1(+)哺乳动物表达载体均由实验室保存。莱芜猪耳组织采于莱芜猪原种场;DMEM培养基、Opti-MEM无血清培养基、PBS、0.25%胰酶、胎牛血清(Fetal bovine serum,FBS)均购于Gibco公司(美国);青链霉素混合液购于北京索莱宝科技有限公司(中国北京);反转录和荧光定量试剂购于TaKaRa (中国大连)。CCK-8试剂盒购于碧云天生物技术有限公司(中国上海);微量RNA提取试剂盒购于Omega Bio-Tek (美国);细胞周期与凋亡检测试剂盒购于碧云天生物技术有限公司(中国上海);miR-331-3p inhibitor和miR-331-3p NC购于上海吉玛制药技术有限公司(中国上海);T4 DNA连接酶、KpnⅠ内切酶和XbaⅠ内切酶均购于Thermo Scientific (美国);DNA提取试剂盒、质粒大提试剂盒和普通琼脂糖凝胶DNA回收试剂盒购于天根生化科技有限公司(中国北京);转染试剂Lipofectamine? 3000购于Invitrogen (美国);实验所用引物合成以及测序均由生工生物工程(上海)股份有限公司完成。实验地点为山东农业大学动物育种学研究室。
1.2 培养基的配制10%完全培养基:10%胎牛血清+100 IU/mL青链霉素+DMEM。5%完全培养基:5%胎牛血清+100 IU/mL青链霉素+DMEM。无双抗培养基:10%胎牛血清+DMEM。
1.3 方法1.3.1 miR-331-3p过表达载体的构建首先利用Primer 5.0设计包含miR-331-3p前体序列的上下游引物,分别在其5?端添加KpnⅠ内切酶和XbaⅠ内切酶的酶切位点以及2 bp的保护碱基AA (表 1)[10]。然后提取莱芜猪耳组织的基因组,以DNA为模板通过普通PCR扩增的方式获得目的片段,PCR产物经琼脂糖凝胶电泳分离,经纯化回收。最后将目的片段和载体同时酶切、琼脂糖凝胶电泳分离、纯化回收、T4 DNA酶连接构建到pcDNA 3.1(+)载体上。
表 1 实验中用到的基因的引物序列Table 1 Primer sequences of genes used in this experiment
| Gene | GenBank accession number | Primer sequence (5?–3?) | Fragment size (bp) |
| miR-331-3p | F: GGTATGGGCCTATCCTAGAA | ||
| Pre-miR-331-3p | 100498734 | F: AAGGTACCCCAAGTCCTCGTGTATGC | 558 |
| R: AATCTAGATGTCCACTGTCATCCTTC | |||
| CDK2 | 100154715 | F: AAGATGGACGGAGCTTGTTATCGC | 108 |
| R: CTGGCTTGGTCACATCCTGGAAG | |||
| CDK3 | 100523273 | F: TCATCCACCGAGACCTGAAGCC | 192 |
| R: AGACATCCACAGCCGTCGAGTAG | |||
| CDK4 | 100144492 | F: TGAGATGGAGGAGTCTGGAGCAC | 80 |
| R: CTCGGAAGGCAGAGATTCGCTTG | |||
| Cyclin B | 397662 | F: GACTGGCTAGTGCAGGTTCAGATG | 137 |
| R: ATGGCAGTGACACCAACCAGTTG | |||
| ING5 | 110256977 | F: TGGAGCACTACCTGGACAGTATCG | 146 |
| R: GGTCTTCACCGTGGCAATGTACTC | |||
| CDKN1A | 100152215 | F: CGAGAGCGATGGAACTTCGACTTC | 200 |
| R: TCCACATGGTCCTCCTGAGACG | |||
| GAPDH | 396823 | F: AGGTCGGAGTGAACGGATTTG | 118 |
| R: ACCATGTAGTGGAGGTCAATGAAG | |||
| Note: ?denotes the protective bases; _____denotes the restriction site. | |||
表选项
1.3.2 细胞培养PK15细胞培养使用完全培养基,培养在CO2培养箱中,培养条件为5% CO2、37 ℃。当细胞密度大于80%,换用无双抗培养基进行实验。该实验所用的所有细胞均处于对数生长期,细胞活性大于95%。
1.3.3 细胞转染将细胞接种到培养板上,生长到一定密度时,换用无双抗培养基继续培养。将实验分为4组:1)实验组:转染pcDNA3.1(+)-miR-331-3p载体;2)实验对照组:转染pcDNA3.1(+)载体;3)抑制剂组:转染miR-331-3p inhibitor;4)抑制剂对照组:转染miR-331-3p NC。转染步骤按照Lipofectamine? 3000说明书操作,转染4 h更换新的无双抗的培养基,24 h后更换完全培养基继续培养,48 h后收集细胞。
1.3.4 绘制细胞生长曲线将生长良好的PK15细胞1×104/mL的密度接种到96孔板,每孔加入100 μL 5%完全培养基。分别在第0 h、24 h、48 h、72 h和96 h,每孔加入10 μL CCK8试剂,37 ℃培养2 h,然后用酶标仪(Promega,美国)检测细胞在450 nm下的OD值,计算平均值,并绘制实验组、实验对照组、抑制剂组和抑制剂对照组的生长曲线。
1.3.5 细胞RNA提取及荧光定量PCR将PK15细胞接种到6孔板,待细胞汇合度达到80%时转染细胞,48 h后提取细胞总RNA,然后反转录为cDNA。利用Primier 5.0设计CDK2、CDK3、CDK4、Cyclin B、ING5、CDKN1A和GAPDH (Glyceraldehyde-3-phosphate dehydrogenase)基因的荧光定量引物(表 1),其中GAPDH持家基因作为内参[11]。利用LightCycler? 96实时荧光定量PCR系统,检测过表达miR-331-3p后细胞周期相关基因的表达情况,其定量结果通过2-ΔΔCt的方法计算。反应体系(20 μL)为:2× TB Green Premix Ex Taq 10 μL,上下游引物各0.4 μL,cDNA模板2 μL,ddH2O 7.2 μL。
同样,设计miR-331-3p的上游引物(表 1),下游引物使用试剂盒内的通用下游引物,以U6作为内参基因[12],引物使用miRNA反转录试剂盒内的U6上下游引物。同样使用LightCycler? 96实时荧光定量PCR系统,检测miR-331-3p的表达变化。反应体系(20 μL)为:2× TB Green Premix Ex Taq 10 μL,上下游引物各0.8 μL,cDNA模板2 μL,ddH2O 6.4 μL。
1.3.6 细胞周期检测将细胞接种到6孔板,待细胞汇合度达到30%左右时分别转染实验组、实验对照组、抑制剂组和抑制剂对照组,当细胞密度达到80%–90%时,小心收集细胞培养液到1.5 mL离心管内备用。用胰酶消化细胞,至细胞可以被轻轻用移液管或枪头吹打下来时,加入前面收集的细胞培养液,终止胰酶消化过程,吹打下所有的贴壁细胞,并轻轻吹散细胞。再次收集到离心管内。300×g离心3 min去除培养基,再用1 mL预冷PBS洗1遍。然后进行细胞固定,加入1 mL冰浴预冷的70%乙醇中,4 ℃固定12 h,300×g离心去除70%乙醇,使用PBS再洗1遍。最后加入碘化丙啶染色液(PI),37 ℃避光水浴30 min,结束后锡箔纸包裹离心管放到冰盒上,经0.75 μm滤膜过滤后使用BD FACSCalibur流式细胞仪上机检测细胞所处周期的比例[13]。
1.3.7 实验设计与数据处理所有实验均设置不少于3次重复,所有数据均以平均值±标准差(x±s)表示,采用SPSS 20统计分析软件中的One-way ANOVA进行方差分析,通过Duncan氏方法进行多重比较,显著性水平定为P < 0.05。
2 结果与分析2.1 miR-331-3p过表达载体的构建实验所克隆的miR-331-3p前体大小为558 bp,并且以其为模板进行菌液PCR后经琼脂糖凝胶电泳检测,发现扩增的目的片段与预期大小一致,且条带单一、无杂带(图 1A)。提取质粒经测序比对,结果与预期相符,无杂峰干扰(图 1B),所提取的质粒经核酸蛋白浓度测定仪检测质粒浓度高、质量好,可用于细胞转染实验。
 |
| 图 1 菌液PCR扩增结果和pre-miR-331-3p测序分析 Fig. 1 Bacterial liquid PCR and pcDNA 3.1(+)-miR-331-3p sequencing map. (A) Agarose gel electrophoresis of bacterial PCR. (B) Sequencing map of pcDNA 3.1(+)-miR-331-3p. |
| 图选项 |
2.2 miR-331-3p对细胞生长曲线的影响经检测发现,4组细胞的生长曲线均呈S型(图 2),符合体外细胞培养的生长特点。在转染24 h后,实验组细胞数显著高于实验对照组、抑制剂组和抑制剂对照组(P < 0.05);但是实验对照组、抑制剂组与抑制剂对照组之间差异均不显著(P > 0.05),可能是由于miR-331-3p抑制剂在24 h时作用效果不显著,导致此时miR-331-3p的表达下调不显著。在48 h和72 h时均呈现出实验组 > 实验对照组和抑制剂对照组 > 抑制剂组的趋势(P < 0.05),在96 h时实验组、实验对照组、抑制剂组和抑制剂对照组差异已不显著。
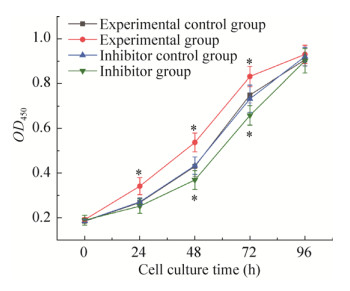 |
| 图 2 miR-331-3p对细胞生长曲线的影响 Fig. 2 Effect of miRNA-331-3p on cell growth curve. * P < 0.05. |
| 图选项 |
2.3 miR-331-3p的表达差异分析利用qPCR方法分别检测实验组、实验对照组、抑制剂组和抑制剂对照组细胞在转染48 h后miR-331-3p的表达差异。实验组miR-331-3p的表达量显著高于实验对照组(P < 0.05),这表明所构建的pcDNA3.1(+)-miR-331-3p载体在PK15细胞中能够发挥作用,提高了细胞自身miR-331-3p的表达水平,效果良好。相反,抑制剂组miR-331-3p的表达水平相对于抑制剂对照组显著下降(P < 0.05),这表明miR-331-3p inhibitor确实可以达到抑制细胞本身的miR-331-3p表达的水平,符合实验要求(图 3)。
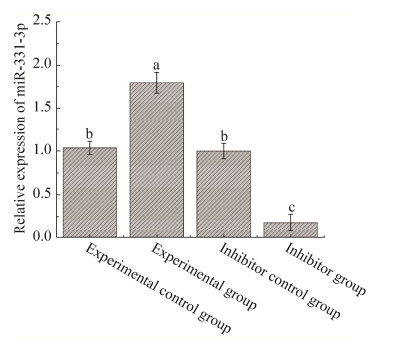 |
| 图 3 miR-331-3p表达变化分析 Fig. 3 Analysis of expression changes of miR-331-3p. Different lower-case letters denoted significant difference (P < 0.05). |
| 图选项 |
2.4 过表达miR-331-3p对细胞增殖相关基因的影响为了探讨miR-331-3p对细胞增殖的影响,利用RT-qPCR法检测了miR-331-3p的靶基因ING5,以及周期相关基因CDK2、CDK3、CDK4、Cyclin B和CDKN1A的表达变化。结果表明,促进细胞增殖的CDK2、CDK3、CDK4和Cyclin B基因的mRNA表达趋势均为实验组 > 实验对照组和抑制剂对照组 > 抑制剂组(P < 0.05) (图 4);而具有抑制细胞增殖作用的CDKN1A和ING5基因的mRNA表达量具有相反的变化趋势,即实验组 < 实验对照组和抑制剂对照组 < 抑制剂组(P < 0.05) (图 4)。
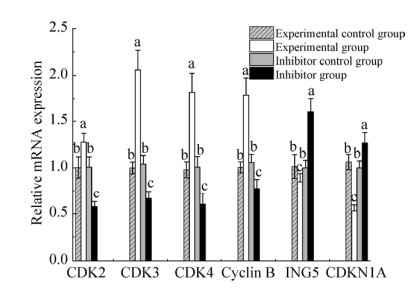 |
| 图 4 细胞增殖相关基因的表达变化分析 Fig. 4 Analysis of expression changes of cell proliferation related genes. Different lower-case letters of the same group denoted significant difference (P < 0.05). |
| 图选项 |
2.5 miR-331-3p对细胞周期的影响PI染色后利用流式细胞仪检测各组PK15细胞的周期分布,得到的实验数据经ModFit软件分析后得到流式细胞图(图 5)。由图可知各组中DNA合成前期(G0/G1期)的细胞所占比例,实验组 < 实验对照组和抑制剂对照组 < 抑制剂组(P < 0.05)。各组中处于DNA合成期(S期)的细胞所占比例,实验组 > 实验对照组和抑制剂对照组 > 抑制剂组(P < 0.05)。并且各组中处于DNA合成后期和分裂期(G2/M期)的细胞所占的比例也是实验组 > 实验对照组和抑制剂对照组 > 抑制剂组(P < 0.05),与细胞处于S期的比例具有相同趋势。
 |
| 图 5 流式细胞术分析细胞所处周期 Fig. 5 Flow cytometric analysis of the indicated cells. Different lower-case letters of the same group denoted significant difference (P < 0.05). |
| 图选项 |
3 讨论miRNA作为内源非编码短链RNA,在细胞增殖、凋亡、分化等细胞过程中发挥着重要的作用。不同的miRNA可能发挥着相同或相反的作用,甚至同种miRNA在不同的细胞中也具有不同的作用。研究表明miR-331-3p作用机制复杂,在不同的癌细胞中可能发挥着完全相反的作用机制[14-16]。
过表达miR-331-3p后相对于实验对照组和抑制剂对照组,流式细胞术结果表明G0/G1期细胞比例显著降低,抑制剂组显著升高,G0/G1期细胞所占比例降低说明细胞增殖速度加快,反之增殖速度减慢[17]。同时DNA合成期(S期),处于S期的细胞所占比例也显著性升高,表明过表达miR-331-3p后促使大量细胞由G1期过渡到S期,S期细胞所占比例升高,DNA、组蛋白合成速度加快,组装成染色体使细胞内染色体数目加倍为进入细胞分裂期做准备,抑制剂组结果相反。过表达miR-331-3p后在G0/G1期细胞所占比例降低S期细胞所占比例升高的基础上,DNA合成后期(G2期)和细胞分裂期(M期)细胞所占比例也显著地高于实验对照组、抑制剂组和抑制剂对照组。其中G2期是DNA复制结束与开始有丝分裂之间的间隙,在这期间细胞合成某些蛋白质和RNA分子,做好细胞进入M期的物质准备。M期为细胞分裂期,M期细胞所占比例升高直接说明了分裂期细胞增多,表明细胞生长分裂加速。所以处于G2/M期的细胞所占比例显著升高(P < 0.05),表明了细胞此时增殖能力较强能够快速大量分裂,使细胞数目增加。与其相反的是抑制剂组相对于其他分组均表现出细胞G2/M期所占比例下降,也从反面证明了这一点。因此流式细胞分析的结果表明miR-331-3p具有促进细胞增殖的效果,这与细胞增殖曲线实验组增殖速度增快,抑制剂组增殖速度减慢相符合。
细胞周期蛋白依赖性激酶(CDKs),如CDK2、CDK3和CDK4已被公认为真核生物细胞生长和增殖的关键调控因子,这是哺乳动物细胞G1-S相变所必需的[18-19]。Cyclin B是细胞进入和退出细胞周期M期所必需的[20]。相反地,细胞CDKN1A的过度表达可能通过诱导细胞抑制细胞增殖周期阻滞,它是CDKs的抑制剂[21]。荧光定量表明实验组随着miR-331-3p表达升高显著上调CDK2、CDK3和CDK4促进细胞周期由G1期到S期的转变,促使处于S期的细胞所占比例显著上调(P < 0.05),同时上调Cyclin B基因的表达促进细胞周期由G2期进入M期,使实验组处于G2/M期细胞的比例上调。随着miR-331-3p的高表达,细胞内的CDKN1A基因表达下调,CDKN1A具有阻滞细胞增殖的作用。其表达下调从另一个方面表明,miR-331-3p具有促进细胞增殖的作用。综合各个周期相关基因的荧光定量的表达结果说明,miR-331-3p具有促进细胞增殖的功能。有研究表明ING5为miR-331-3p的靶基因[7],miR-331-3p的过表达和抑制表达导致ING5基因发生相应的下调和上调也证明了这一观点,因此在猪肾上皮细胞中miR-331-3p有可能是通过作用于ING5基因达到促使细胞增殖的效果。
4 结论本研究成功构建了miR-331-3p的过表达载体,并且发现miR-331-3p可以通过促进周期相关基因CDK2、CDK3、CDK4、Cyclin B基因的表达,以及抑制ING5和CDKN1A的表达,从而促进猪肾上皮细胞增殖,这为深入研究miR-331-3p在猪生长发育中的作用机制奠定了基础。
参考文献
| [1] | Lund E, Güttinger S, Calado A, et al. Nuclear export of MicroRNA precursors.Science, 2004, 303(5654): 95–98.DOI: 10.1126/science.1090599 |
| [2] | Zhuang M, Qiu XB, Cheng D, et al. MicroRNA-524 promotes cell proliferation by down-regulating PTEN expression in osteosarcoma.Cancer Cell Int, 2018, 18: 114.DOI: 10.1186/s12935-018-0612-1 |
| [3] | Pogue AI, Cui JG, Li YY, et al. Micro RNA-125b (miRNA-125b) function in astrogliosis and glial cell proliferation.Neurosci Lett, 2015, 476(1): 18–22. |
| [4] | Chang RM, Yang H, Fang F, et al. MicroRNA-331-3p promotes proliferation and metastasis of hepatocellular carcinoma by targeting PH domain and leucine-rich repeat protein phosphatase.Hepatology, 2015, 60(4): 1251–1263. |
| [5] | Guo XB, Guo L, Ji J, et al. miR-331-3p directly targets E2F1 and induces growth arrest in human gastric cancer.Biochem Bioph Res Commun, 2010, 398(1): 1–6.DOI: 10.1016/j.bbrc.2010.05.082 |
| [6] | Giles KM, Barker A, Zhang PM, et al. MicroRNA regulation of growth factor receptor signaling in human cancer cells//Wu W, ed. MicroRNA and Cancer. Totowa, NJ: Humana Press, 2011. |
| [7] | Cao YY, Chen J, Wang D, et al. Upregulated in Hepatitis B virus-associated hepatocellular carcinoma cells, miR-331-3p promotes proliferation of hepatocellular carcinoma cells by targeting ING5.Oncotarget, 2015, 6(35): 38093–38106. |
| [8] | Ge YJ, Chen J. MicroRNAs in skeletal myogenesis.Cell Cycle, 2011, 10(3): 441–448.DOI: 10.4161/cc.10.3.14710 |
| [9] | Walia R, Dardari R, Chaiyakul M, et al. Porcine circovirus-2 capsid protein induces cell death in PK15 cells.Virology, 2014, 468-470: 126–132.DOI: 10.1016/j.virol.2014.07.051 |
| [10] | Li CH, Chen W, Hu JQ, et al. miRNA-29a targets COL3A1 to regulate the level of type Ⅲ collagen in pig.Gene, 2016, 592(1): 140–147. |
| [11] | Shi T, Yan XR, Qiao LY, et al. MiR-330-5p negatively regulates ovine preadipocyte differentiation by targeting branched-chain aminotransferase 2.Anim Sci J, 2018, 89(6): 858–867.DOI: 10.1111/asj.2018.89.issue-6 |
| [12] | Mi L, Chen YS, Zheng XL, et al. MicroRNA-139-5p suppresses 3T3-L1 preadipocyte differentiation through notch and IRS1/PI3K/Akt insulin signaling pathways.J Cell Biochem, 2015, 116(7): 1195–1204.DOI: 10.1002/jcb.v116.7 |
| [13] | Xu LN, Qi YL, Lv LW, et al. In vitro anti-proliferative effects of Zuojinwan on eight kinds of human cancer cell lines.Cytotechnology, 2014, 66(1): 37–50.DOI: 10.1007/s10616-013-9534-x |
| [14] | Fujii T, Shimada K, Asano A, et al. MicroRNA- 331-3p suppresses cervical cancer cell proliferation and E6/E7 expression by targeting NRP2.Int J Mol Sci, 2016, 17(8): 1351–1364.DOI: 10.3390/ijms17081351 |
| [15] | Lai YJ, He S, Ma LM, et al. HOTAIR functions as a competing endogenous RNA to regulate PTEN expression by inhibiting miR-19 in cardiac hypertrophy.Mol Cell Biochem, 2017, 432(1/2): 179–187. |
| [16] | Li J, Zhang YY. Research progress of miR-331-3p in malignant tumors.Prac Oncol J, 2018, 32(2): 125–129.(in Chinese). 李静, 张云艳. miR-331-3p在恶性肿瘤中的研究进展.实用肿瘤学杂志, 2018, 32(2): 125-129. |
| [17] | Ye P, Ke XP, Zang XH, et al. Up-regulated MiR-27-3p promotes the G1-S phase transition by targeting inhibitor of growth family member 5 in osteosarcoma.Biomed Pharmacother, 2018, 101: 219–227.DOI: 10.1016/j.biopha.2018.02.066 |
| [18] | Tsai LH, Lees E, Faha B, et al. The cdk2 kinase is required for the G1-to-S transition in mammalian cells.Oncogene, 1993, 8(6): 1593–1602. |
| [19] | Sherr CJ, Roberts JM. Inhibitors of mammalian G1 cyclin-dependent kinases.Genes Dev, 1995, 9(10): 1149–1163.DOI: 10.1101/gad.9.10.1149 |
| [20] | Ito M. Factors controlling cyclin B expression.Plant Mol Biol, 2000, 43(5/6): 677–690.DOI: 10.1023/A:1006336005587 |
| [21] | Zhang YY, Xu ZN. miR-93 enhances cell proliferation by directly targeting CDKN1A in nasopharyngeal carcinoma.Oncol Lett, 2018, 15(2): 1723–1727. |
