

武汉科技大学 生命科学与健康学院,湖北 武汉 430000
收稿日期:2018-09-03;接收日期:2018-12-20;网络出版时间:2019-02-19
基金项目:国家自然科学基金(No. 31501149),湖北省科技计划自然科学基金(No. 2017CFB537)资助
摘要:信号转导和转录活化因子3 (STAT3)与趋化因子CX3C配体1 (Fractalkine/CX3CL1)在血管炎症和损伤中起重要作用,为了探讨STAT3是否通过CX3CL1促进血管内皮细胞增殖和迁移,在血管内皮细胞(HUVEC)中过表达或敲降STAT3,通过quantitative real-time PCR、Western blotting实验确定STAT3对CX3CL1表达的影响。构建含有STAT3结合位点及突变STAT3结合位点的CX3CL1启动子荧光素酶报告基因质粒,利用荧光素酶活性分析实验研究STAT3对CX3CL1启动子转录活性的作用。利用MTT实验检测过表达或敲降STAT3或CX3CL1对血管内皮细胞增殖率的影响。利用划痕实验检测过表达或敲降STAT3或CX3CL1对血管内皮细胞迁移率的影响。结果显示,过表达STAT3可以促进CX3CL1表达,敲降STAT3可以使CX3CL1表达下调。STAT3可以直接结合到CX3CL1的启动子促进其转录激活,其促进作用依赖于CX3CL1启动子上的GAS位点。敲降STAT3可以抑制血管内皮细胞的迁移,过表达CX3CL1拮抗该抑制作用。总结得出,STAT3通过结合到CXCL1启动子促进CX3CL1转录与表达进而促进血管内皮的增殖与迁移。
关键词:人脐静脉血管内皮细胞CX3CL1STAT3增殖迁移
Signal transducer and activator of transcription 3 promotes vascular endothelial cell proliferation and migration by fractalkine
Lijuan Fan, Hui Li, Huimin Zhang, Hanhan Li, Feng Huang, Zijian Zhang, Zhoutong Dai, Yuan Xiang, Ao Yao, Jiapeng Li, Xinghua Liao


College of Life Sciences and Health, Wuhan University of Science and Technology, Wuhan 430000, Hubei, China
Received: September 3, 2018; Accepted: December 20, 2018; Published: February 19, 2019
Supported by: National Natural Science Foundation of China (No. 31501149), Hubei Science and Technology Program Natural Science Fund General Project (No. 2017CFB537)
Corresponding author: Xinghua Liao. Tel: +86-27-68893396; E-mail: xinghualiao@hotmail.com.
Abstract: Signal transducer and activator of transcription 3 (STAT3) and Chemokine CX3C ligand 1 (Fractalkine/CX3CL1) play important roles in vascular inflammation and injury. To study if STAT3 promotes vascular endothelial cell proliferation and migration through fractalkine, we overexpressed or knocked down STAT3 in vascular endothelial cells, and used quantitative real-time PCR and Western blotting to determine the effect of STAT3 on fractalkine expression. The wild type and STAT3 binding site mutant fractalkine promoter luciferase reporter plasmids were constructed, and luciferase activity assays were used to explore the effect of STAT3 on the transcriptional activity of the fractalkine promoter. MTT assays were used to detect the effect of overexpression or knockdown of STAT3 or fractalkine on the proliferation rate of vascular endothelial cells. Scratch assays were used to detect the effect of overexpression or knockdown of STAT3 or fractalkine on vascular endothelial cell migration. There results showed that overexpression of STAT3 could promote fractalkine expression, and knockdown of STAT3 could down-regulate fractalkine expression. STAT3 could directly bind to the promoter of fractalkine to promote its transcriptional activity via binding the GAS site of the fractalkine promoter. Knockdown of STAT3 could inhibit the migration of vascular endothelial cell, and overexpression of fractalkine antagonized this inhibition. Our data concluded that STAT3 promotes the proliferation and migration of vascular endothelial cell by binding the GAS site of the fractalkine promoter to promote fractalkine transcriptional activity and expression.
Keywords: human umbilical vein endothelial cellsCX3CL1STAT3proliferationmigration
动脉粥样硬化(Atherosclerosis,AS)是许多心血管病形成的主要病理基础,由多因素共同作用引起,发病机制复杂,目前尚未完全阐明。炎症学说认为AS是一种慢性炎性反应,长期反复的内皮细胞(Endothelial cells,EC)损伤是其发生的病理基础。在高脂血症、高血压、糖尿病或吸烟等危险因素作用下,EC发生形态改变及功能障碍,导致血管损伤[1]。关于信号转导和转录活化因子3 (Signal transducer and activator of transcription 3,STAT3)在参与动脉粥样硬化炎症机制方面的研究是目前的热点。各种炎症因子可能通过STAT3转导的信号通路在血管炎症中发挥作用。
细胞因子和生长因子识别表面受体后,受体偶联的JAK激酶与STAT3相互作用发生磷酸化,形成同源或异源二聚体,并作为转录激活因子转运到细胞核参与调控[2-3]。近年来JAK-STAT信号通路被发现与细胞因子刺激而形成的信号转导过程密切相关,并通过这一形式参与许多重要生物学过程,该通路的异常会导致各种疾病的形成。炎症因子IL-6就被报道通过激活JAK/STAT3通路参与了动脉粥样硬化的病变[4]。
趋化因子CX3C的配体1 (Chemokine CX3C ligand 1,Fractalkine /CX3CL1)是一种独特的膜结合分子,在内皮细胞(ECs)中表达,分为可溶性(游离型)和膜结合性两种形式。它是一种长蛋白质,具有扩展的粘蛋白样茎和顶部的趋化因子结构域。粘蛋白样茎可以使其与某些细胞表面结合。可溶性CX3CL1能有效地化学诱导T细胞和单核细胞[5],相对可溶性CX3CL1的趋化性而言,细胞结合趋化因子促进白细胞与活化的内皮细胞强烈粘附[6-7]。CX3C趋化因子受体1 (CX3C chemokine receptor 1,CX3CR1)是CX3CL1的特异性受体,主要在某些白细胞群上表达[8-9],也被发现来源于血管壁损伤后平滑肌细胞分化的物质[10]。有研究报道CX3CL1和CX3CR1在血管炎症和损伤中起重要作用,促进动脉粥样硬化的形成[11]。
虽然由ECs表达,但CX3CL1和STAT3对内皮细胞的增殖迁移的影响并不清楚。根据生物信息学发现CX3CL1基因序列上有STAT3的作用位点,STAT3是否也同时与CX3CL1相互作用共同调节内皮细胞的增殖迁移情况也并不明确。这些问题的解决可能为动脉粥样硬化不稳定斑块里的血管新生机制提供依据。又根据其他研究表明,STAT3能够上调平滑肌细胞中CX3CL1的表达[12]。因此本文创新性研究STAT3介导的CX3CL1对血管内皮细胞本身增殖能力的影响,为动脉粥样硬化血管新生的研究奠定基础。
1 材料与方法1.1 材料1.1.1 细胞采用的人脐静脉内皮细胞株来源于中国上海细胞库。所用细胞系为EA.HY926,置于-80 ℃保存。在进行动脉血管内皮细胞实验时,通常选用的细胞模型为人脐静脉内皮细胞(Human umbilical vein endothelial cells,简称HUVECs),因为脐静脉内皮细胞具有干细胞的潜能,其特性与动脉血管内皮细胞相似,它们常被用作研究内皮细胞功能和病理学(例如血管生成)[13]。
1.1.2 试剂DMEM培养基(Hyclone,美国);胰蛋白酶(Biosharp,中国);胎牛血清FBS (Gibco,美国);双抗/青链霉素合剂(Gibco,美国)。培养细胞使用的完全培养基含10% FBS 1%的双抗。PBS液、TBST (自配);RIPA裂解液;磷酸酶抑制剂(Roche,瑞士);SDS-PAGE蛋白上样缓冲液(碧云天,中国);Trizol (Invitrogen,美国);荧光定量试剂盒(TaKaRa,日本);人源STAT3抗体(鼠抗人,STAT3 (124H6) (mAbs,CST),二抗使用羊抗鼠抗体;人源CX3CL1抗体(兔抗人,(CX3CL1 (ab25088) (mAbs,Abcam)),二抗使用羊抗兔抗体;PVDF膜(Bio-Rad,美国);SIRNA-STAT3及对照、SIRNA-CX3CL1及对照(RIBOBIO,广州锐博);一步法克隆试剂盒(上海翊圣,中国);Western Bright ECL (Advansta,美国);荧光素酶报告基因检测试剂盒(Promega,美国)。
1.1.3 仪器电泳仪(BIO-RAD,美国),核酸蛋白凝胶图像系统(BIO-RAD,美国;酶标仪(Leica,德国);荧光定量PCR仪(BIO-RAD);冷冻超速离心机(Beckman,美国);气套式二氧化碳恒温培养箱(Astec,日本);倒置显微镜(Olympus,日本)。
1.2 方法1.2.1 质粒构建在CX3CL1启动子上发现有STAT3的结合元件GAS区,以人脐静脉内皮细胞基因组为模板构建CX3CL1启动子的荧光素酶报告基因质粒pGL3-CX3CL1-WT,并构建其突变质粒pGL3- CX3CL1-MUT,空载为pGL3。同时以人脐静脉内皮细胞的cDNA为模板构建STAT3、CX3CL1的表达质粒pCDNA3.1-STAT3、pCDNA3.1-CX3CL1,空载为pCDNA3.1。质粒构建引物设计采用上海翊圣一步法克隆试剂盒所提供的方法,原理为末端同源重组,引物序列见表 1。实时荧光定量核酸扩增检测所用的引物来源于PrimerBank,引物序列见表 2。
表 1 质粒构建引物设计Table 1 Primer sequence
| Primer name | Primer sequence (5′–3′) | Size (bp) | Product size (bp) |
| CX3CL1-WT-promoter-F | TACCGAGCTCTTACGCGTGCTAGCAGACTGTGTTCTAATGTGCT | 42 | 1 009 |
| CX3CL1-WT-promoter-R | CCAACAGTACCGGAATGCCAAGCTTATCTGTGGCTTTTTATAATG | 45 | |
| STAT3-F | AACGGGCCCTCTAGACTCGAGATGGCCCAATGGAATCAGCTACAGCA | 47 | 2 342 |
| STAT3-R | CAGCGGTTTAAACTTAAGCTTCGTATCTTTCTGCAGCTTCCGTTCTCA | 48 | |
| CX3CL1-F | AACGGGCCCTCTAGACTCGAGATGCAGCATCTGGACCGCCAG | 42 | 939 |
| CX3CL1-R | CAGCGGTTTAAACTTAAGCTTTCACACGGGCACCAGGACATATGAA | 46 |
表选项
表 2 实时荧光定量核酸扩增检测引物序列Table 2 QPCR primer sequence
| Primer name | Primer sequence (5′–3′) | Size (bp) |
| STAT3-qF | CAGCAGCTTGACACACGGTA | 20 |
| STAT3-qR | AAACACCAAAGTGGCATGTGA | 21 |
| CX3CL1-qF | ACCACGGTGTGACGAAATG | 19 |
| CX3CL1-qR | TGTTGATAGTGGATGAGCAAAGC | 26 |
表选项
1.2.2 细胞培养及转染为研究过表达和干扰CX3CL1和STAT3的表达对HUVEC细胞的增殖迁移作用,构建表达质粒和合成相应的SIRNA,由广州锐博公司设计合成。合成的SIRNA要在无RNA酶环境下进行溶解分装并置于-20 ℃保存。实验分组:转染STAT3过表达质粒(STAT3组)及其对照质粒pCDNA3.1 (NC组);转染SIRNA-STAT3 (SI-STAT3组)干扰STAT3的表达及其对照SIRNA-STAT3-Control (SI-NC1组)。转染CX3CL1过表达质粒(CX3CL1组)及其对照组pCDNA3.1 (NC组);转染SIRNA-CX3CL1 (SI-CX3CL1组)干扰CX3CL1的表达及其对照组SIRNA-CX3CL1-Control (SI-NC2组)。转染前保证培养细胞处于对数生长期,此时转染细胞状态最好。应用FPF-g-PEI (Folate-poly (Ethylene glycol)-folate-grafted-polyethylenimine,PEI)化合物作为转染试剂进行转染。根据6孔板1×106/2 mL、12孔板5×105/mL浓度种植细胞,用完全培养基培养细胞6 h后完全贴壁,准备转染液配制。配制前提前半小时将细胞培养更换为无血清低糖DMEM培养基,然后按质粒:PEI化合物 = 1:3比例分别用无血清低糖DMEM培养基配置细胞转染液200 μL,每100 μL中分别加转染质粒和对应的转染试剂,然后在室温下放置5–10 min后混匀;混匀后37 ℃放置30 min。最后根据每个孔总培养基的量加入转染液并补足无血清培养基,作好标记放置于37 ℃、5% CO2培养箱内培养8 h后弃掉转染液更换为完全培养基继续培养至48 h。
1.2.3 荧光素酶报告基因活性的测定(Luciferase)荧光素酶报告基因是指以荧光素(Luciferin)为底物来检测萤火虫荧光素酶(Firefly luciferase)活性的一种报告系统。荧光素酶可以催化luciferin氧化成oxyluciferin,在luciferin氧化的过程中,会发出生物荧光(Bioluminescence)。先按pCDNA3.1+CX3CL1-WT组(共转pCDNA3.1和pGL3-CX3CL1-WT)、STAT3+CX3CL1-WT组(共转pCDNA3.1-STAT3和pGL3-CX3CL1-WT)、pCDNA3.1+CX3CL1-MUT组(共转pCDNA3.1和pGL3-CX3CL1-MUT)、STAT3+CX3CL1-MUT组(共转pCDNA3.1-STAT3和pGL3-CX3CL1-MUT)转染细胞并进行培养。然后从孵育箱中取出经过处理好并培养48 h的细胞,弃去24孔板培养基,用PBS洗3次,动作轻柔避免细胞漂浮。后按150 μL/孔加入细胞裂解液,轻轻摇动让裂解液完全覆盖细胞后放冰上裂解30 min。小心刮下细胞,吸走裂解液转到EP管,在冷冻超速离心机中于4 ℃、12 000 r/min离心20 min。离心后每个样取上清和检测底物,测20 s内的发光值。
1.2.4 MTT细胞增殖检测将对数期细胞均匀铺在96孔板中,细胞浓度为1×104个/mL,每孔加100 μL。按照实验分组,设6个复孔,37 ℃、5% CO2培养至24 h后,每孔加MTT溶液(5 mg/mL,用pH 7.4的PBS缓冲液配制) 20 μL。继续孵育4 h,终止培养,小心弃去孔内培养上清液,对于悬浮细胞,需要离心后再吸弃孔内培养上清液。每孔加150 μL DMSO,振荡10 min,使结晶物充分溶解。后选择490 nm波长,在酶联免疫监测仪上测各组光密度(Optical density,OD)值。记录测定结果。
1.2.5 细胞划痕实验检测细胞迁移能力将处理好的对数期细胞均匀铺在12孔板中,待细胞贴壁并找到合适的密度开始划线,划线采用20 μL移液枪头笔直地划4条线,然后用PBS将漂浮的细胞洗涤3次。加入培养基放入37 ℃、5% CO2培养箱培养,针对同一视野选取不同的时间来拍摄记录细胞增殖迁移情况。
1.2.6 实时荧光定量核酸扩增检测(qPCR)将细胞培养并进行转染处理后培养48 h,分别收集各组细胞至EP管中,离心后用Trizol裂解细胞快速提取RNA,提取时应防止污染导致RNA降解。然后进行逆转录合成cDNA。最后用荧光定量PCR试剂盒检测基因的表达,获取数据进行处理。
1.2.7 蛋白质印迹法检测(Western blotting)在6孔板中种板细胞,待细胞进入对数生长期后,进行实验分组并对细胞进行转染。培养至48 h后分别收集细胞约5×106个,离心去上清,用裂解液裂解细胞,提取总蛋白进行定量,根据相应的实验分组进行SDS-PAGE、300 mA转膜1 h。用5%奶牛封闭1 h,一抗(一抗STAT3孵育浓度为1:1 000,一抗CX3CL1孵育浓度为1:1 500) 4 ℃孵育过夜,TBST洗膜5次,5 min/次。用二抗37 ℃孵育2 h,洗膜后加化学底物发光试剂ECL,用核酸蛋白凝胶图像系统显影。用Origin 8软件分析。
1.2.8 统计学方法数据采用SSPS 13.0统计软件单因素方差分析,以x±s表示,组间比较用t检验或非参数检验,以P < 0.05为差异显著,以α = 0.05为显著检验水准。
2 结果与分析2.1 质粒构建及转染效率图图 1A显示PCR扩增出带有CX3CL1启动子片段、表达CX3CL1基因片段、表达STAT3基因片段以及构建成功的CX3CL1启动子荧光素酶质粒和突变质粒、CX3CL1表达质粒和STAT3表达质粒。图 1B中红色是转染CY3后在荧光显微镜下观察到的结果,代表SIRNA的转染效率。绿色是转染GFP后在荧光显微镜下观察到的结果,代表质粒的转染效率。CY3的转染效率为70%左右,GFP的转染效率为30%左右。
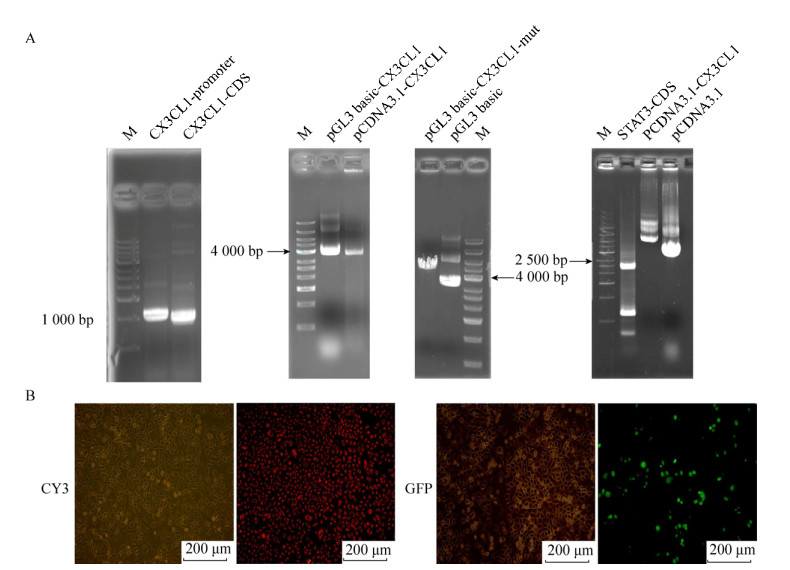 |
| 图 1 质粒构建和转染效率 Fig. 1 Plasmid construction and transfection efficiency. (A) Electrophoresis map of plasmid construction. (B) Transfection efficiency observed under fluorescence microscopy. The scale of the picture is 200 μm |
| 图选项 |
2.2 过表达STAT3上调CX3CL1的表达Western blotting、QPCR检测结果显示,过表达STAT3组STAT3、CX3CL1水平比对照组高,SI-STAT3组STAT3、CX3CL1水平有所降低(图 2A、2B)。
 |
| 图 2 过表达和干扰STAT3影响CX3CL1的表达 Fig. 2 Overexpression and interference with the expression of STAT3 affect the expression of CX3CL1. (A) The protein expression levels of CX3CL1 after overexpression and inhibition of STAT3 expression. (B) The STAT3 and CX3CL1 mRNA expression levels after overexpression and inhibition of STAT3 expression. *: P < 0.05;**: P < 0.01 |
| 图选项 |
2.3 STAT3影响CX3CL1的启动子活性CX3CL1启动子上TGCTGGGAA序列为GAS位点,为检测STAT3与CX3CL1启动子的相互作用,故将该位点序列突变为非GAS位点(图 3A)。进行荧光素酶活性分析时,实验组为共转STAT3和野生型或者突变型CX3CL1启动子荧光素酶质粒,共转pCDNA3.1和CX3CL1启动子荧光素酶质粒作为对照组。结果显示,共转STAT3和野生型CX3CL1启动子荧光素酶质粒的实验组荧光素酶活性明显高于对照组(P < 0.05),而共转STAT3和突变型CX3CL1启动子荧光素酶质粒的荧光素酶活性相比对照组变化不显著(图 3B)。
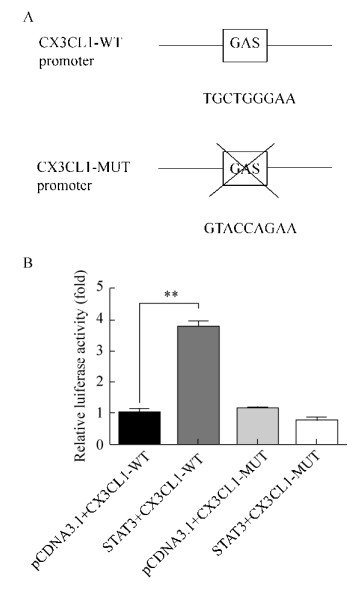 |
| 图 3 STAT3影响CX3CL1的启动子活性及其作用位点 Fig. 3 STAT3 affects the promoter activity and site of CX3CL1. (A) The schematic of the GAS sequence on the CX3CL1 promoter and mutations in the GAS region. (B) The LUC results after co-transfection of STAT3 and CX3CL1 recombinant plasmids and co-transformed STAT3 and CX3CL1 mutant recombinant plasmids in 293T cells. *: P < 0.05; **: P < 0.01 |
| 图选项 |
2.4 STAT3、CX3CL1促进HUVECs增殖MTT检测结果显示,转染STAT3、CX3CL1组HUVEC细胞在490 nm处测得的OD值与对照组相比明显增高,而分别用SI-STAT3、SI-CX3CL1处理后的实验组OD值明显下降(P < 0.05) (图 4A、4B)。
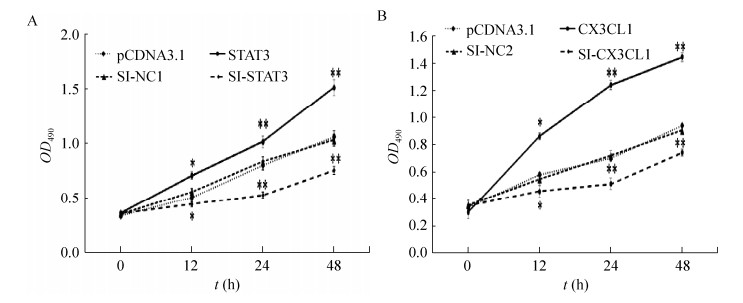 |
| 图 4 MTT测STAT3、CX3CL1对HUVEC细胞增殖的影响 Fig. 4 Effects of STAT3 and CX3CL1 on proliferation of HUVEC cells measured by MTT. (A) Over-express STAT3 and measure OD490. (B) Over-expresses STAT3 and measures OD490. *: P < 0.05;**: P < 0.01 |
| 图选项 |
2.5 STAT3、CX3CL1对HUVECs迁移能力的影响采用细胞划痕试验检测各组细胞迁移能力。48 h后,观察到STAT3、CX3CL1组相对于对照组细胞增殖迁移能力明显增强,SI-STAT3和SI-CX3CL1组细胞迁移能力下降(图 5A、5B)。表明STAT3和CX3CL1促进HUVECs迁移,而干扰STAT3以后,可能下调CX3CL1的水平从而抑制细胞迁移。
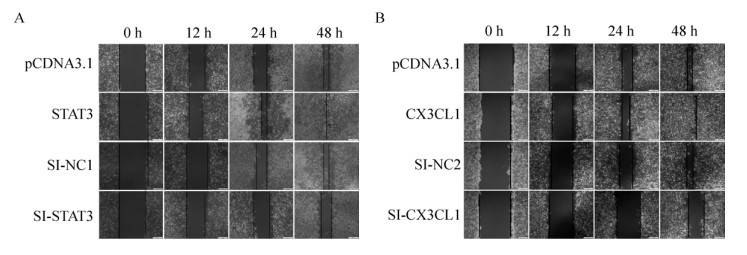 |
| 图 5 STAT3和CX3CL1对HUVEC的迁移能力的影响 Fig. 5 Effect of STAT3 and CX3CL1 on HUVEC migration ability. (A) Overexpression of STAT3 enhances the proliferation and migration of HUVEC, inhibiting the expression of the opposite. (B) Overexpression of CX3CL1 promotes proliferation and migration of HUVEC, inhibiting the expression of the opposite. The scale of the picture is 200 μm |
| 图选项 |
2.6 敲降CX3CL1时过表达STAT3对HUVEC的迁移能力的影响为进一步验证STAT3对HUVEC的迁移能力的影响是通过作用于CX3CL1来实现的,在敲降CX3CL1水平的同时过表达STAT3,通过图 6A可观察到并没有明显地促进细胞迁移,而图 6B中敲低STAT3时过表达CX3CL1仍然能促进细胞迁移。这说明,CX3CL1可能作为STAT3的下游靶基因,对HUVEC的迁移有着更直接的影响。
 |
| 图 6 敲低CX3CL1时过表达STAT3对HUVEC的迁移能力的影响 Fig. 6 Effect of overexpression of STAT3 on the migration ability of HUVEC when knocking down CX3CL1. (A) Overexpression of STAT3 while knocking down CX3CL1 did not significantly promote cell migration. (B) Overexpression of CX3CL1 while knocking down STAT3 still promotes cell migration. The scale of the picture is 200 μm |
| 图选项 |
3 讨论信号转导子和转录激活子STAT3参与机体内多种生物学过程,包括细胞存活、增殖、纤维化、氧化应激、免疫功能改变及炎性反应等[14-15]。STAT3基因中的功能获得性突变会引起多种疾病的产生。在与血管有关的疾病中,STAT3作为重要转录因子参与血管平滑肌细胞增殖过程[16-17]。JAK/STAT信号通路与CX3CL1密切相关,其调节异常可促使CX3CL1的表达[18]。CX3CL1是一种结构独特的趋化因子,膜结合性CX3CL1被2个肽酶ADAM10和ADAM17裂解后能形成可溶性CX3CL1[19]。CX3CL1-CX3CR1轴活性在不稳定性心绞痛和斑块破裂或心血管疾病患者中表现增强[20-21]。据报道,CX3CL1和CX3CR1在动脉粥样硬化中起重要作用,最有可能是通过促进血管壁炎症[22]。在动脉粥样硬化晚期的人动脉中观察到高水平的CX3CL1 mRNA,在载脂蛋白基因apoE缺陷(apoE-/-)小鼠的动脉粥样硬化病变中CX3CL1上调[23]。CX3CL1在正常的ECs中表达水平较低,由促炎因子如脂多糖、肿瘤坏死因子-α、白细胞介素-1和干扰素-α激活的EC中表达显著增加[24]。肿瘤坏死因子-α和白细胞介素-1通过核因子kβ信号通路诱导CX3CL1的表达,而干扰素-β通过JAK/STAT1诱导CX3CL1的表达[25-26]。
为研究STAT3参与细胞的增殖过程是否通过调控CX3CL1来实现,以及探讨在STAT3转录因子介导下CX3CL1对血管内皮细胞本身增殖能力的影响,本文针对STAT3对CX3CL1作用方式、STAT3对CX3CL1表达的调控以及其相互作用对内皮细胞增殖和迁移的影响也进行了初步的探索。结果表明STAT3可能通过作用于CX3CL1启动子上的GAS区来调控CX3CL1水平,并且结果也显示CX3CL1可以促进细胞增殖和迁移,STAT3能诱导血管内皮细胞CX3CL1表达上调。以上说明STAT3可能是通过直接作用于CX3CL1的启动子上调CX3CL1的水平,从而促进细胞增殖和迁移。而干扰血管内皮细胞中STAT3的表达,则能下调CX3CL1的水平并能抑制血管内皮细胞增殖和迁移。这些结论对动脉粥样硬化的机制研究具有重大意义,并且炎症因子CX3CL1成为动脉粥样硬化的治疗靶点对寻找动脉粥样硬化的治疗药物具有潜在的应用价值。
参考文献
| [1] | Sorci-Thomas MG, Thomas MJ. Microdomains, inflammation, and atherosclerosis.Circ Res, 2016, 118(4): 679–691.DOI: 10.1161/CIRCRESAHA.115.306246 |
| [2] | Kiu H, Nicholson SE. Biology and significance of the JAK/STAT signalling pathways.Growth Factors, 2012, 30(2): 88–106.DOI: 10.3109/08977194.2012.660936 |
| [3] | O'Shea JJ, Schwartz DM, Villarino AV, et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention.Annu Rev Med, 2015, 66: 311–328.DOI: 10.1146/annurev-med-051113-024537 |
| [4] | Zhao GB, Zhu GW, Huang YJ, et al. IL-6 mediates the signal pathway of JAK-STAT3-VEGF-C promoting growth, invasion and lymphangiogenesis in gastric cancer.Oncol Rep, 2016, 35(3): 1787–1795. |
| [5] | postolakis S, Spandidos D. Chemokines and atherosclerosis: focus on the CX3CL1/CX3CR1 pathway.Acta Pharmacol Sin, 2013, 34(10): 1251–1256.DOI: 10.1038/aps.2013.92 |
| [6] | Flierl U, Bauersachs J, Sch?fer A. Modulation of platelet and monocyte function by the chemokine fractalkine (CX3CL1) in cardiovascular disease.Eur J Clin Invest, 2015, 45(6): 624–633.DOI: 10.1111/eci.2015.45.issue-6 |
| [7] | Wong BW, Wong D, Mcmanus BM. Characterization of fractalkine (CX3CL1) and CX3CR1 in human coronary arteries with native atherosclerosis, diabetes mellitus, and transplant vascular disease.Cardiovasc Pathol, 2002, 11(6): 332–338. |
| [8] | Furio E, García-Fuster MJ, Redon J, et al. CX3CR1/CX3CL1 Axis mediates platelet-leukocyte adhesion to arterial endothelium in younger patients with a history of idiopathic deep vein thrombosis.Thromb Hhemostasis, 2018, 118(3): 562–571.DOI: 10.1055/s-0038-1629897 |
| [9] | Ou D, He RZ. Research progress of cytokines in the pathogenesis of pulmonary hypertension.Guangzhou Med J, 2016, 47(2): 100–102.(in Chinese). 欧东, 贺仁忠. 细胞因子在肺动脉高压发病中作用的研究进展.广州医药, 2016, 47(2): 100-102.DOI:10.3969/j.issn.1000-8535.2016.02.035 |
| [10] | Rowinska Z, Koeppel TA, Sanati M, et al. Role of the CX3C chemokine receptor CX3CR1 in the pathogenesis of atherosclerosis after aortic transplantation.PLoS ONE, 2017, 12(2): e0170644. |
| [11] | McDermott DH, Fong AM, Yang Q, et al. Chemokine receptor mutant CX3CR1-M280 has impaired adhesive function and correlates with protection from cardiovascular disease in humans.J Clin Invest, 2003, 111(8): 1241–1250.DOI: 10.1172/JCI16790 |
| [12] | Gan AM, Butoi E, Manea A, et al. Functional analysis of the fractalkine gene promoter in human aortic smooth muscle cells exposed to proinflammatory conditions.FEBS J, 2015, 281(17): 3869–3881. |
| [13] | Park HJ, Zhang YL, Georgescu SP, et al. Human umbilical vein endothelial cells and human dermal microvascular endothelial cells offer new insights into the relationship between lipid metabolism and angiogenesis.Stem Cell Rev, 2006, 2(2): 93–101. |
| [14] | O'Shea JJ, Plenge R. JAK and STAT signaling molecules in immunoregulation and immune-mediated disease.Immunity, 2012, 36(4): 542–550. |
| [15] | Matsui F, Meldrum KK. The role of the Janus kinase family/signal transducer and activator of transcription signaling pathway in fibrotic renal disease.J Surg Res, 2012, 178(1): 339–345. |
| [16] | Li F, Xia K, Ali Sheikh MS, et al. Retinol binding protein 4 promotes hyperinsulinism-induced proliferation of rat aortic smooth muscle cells.Mol Med Rep, 2014, 9(5): 1634–1640.DOI: 10.3892/mmr.2014.2028 |
| [17] | Lim S, Park S. Role of vascular smooth muscle cell in the inflammation of atherosclerosis.BMB Rep, 2014, 47(1): 1–7. |
| [18] | Huang LY, Ma BW, Ma JW, et al. Fractalkine/CX3CR1 axis modulated the development of pancreatic ductal adenocarcinoma via JAK/STAT signaling pathway.Biochem Biophys Res Commun, 2017, 493(4): 1510–1517. |
| [19] | Clark AK, Malcangio M. Fractalkine/CX3CR1 signaling during neuropathic pain.Front Cell Neurosci, 2014, 8: 121. |
| [20] | Yin XY, Zhang SF, Yu D, et al. Circulating fractalkine levels predict the development of the metabolic syndrome.Int J Endocrinol, 2014, 2014: 715148. |
| [21] | Zhang HL, Guo CF, Wu DJ, et al. Hydrogen sulfide inhibits the development of atherosclerosis with suppressing CX3CR1 and CX3CL1 expression.PLoS ONE, 2012, 7(7): e41147.DOI: 10.1371/journal.pone.0041147 |
| [22] | Imai T, Yasuda N. Therapeutic intervention of inflammatory/immune diseases by inhibition of the fractalkine (CX3CL1)-CX3CR1 pathway.Inflammat Regenerat, 2016, 36: 9. |
| [23] | Ebaid H, Salem A, Sayed A, et al. Whey protein enhances normal inflammatory responses during cutaneous wound healing in diabetic rats.Lipids Health Dis, 2011, 10(1): 235–235.DOI: 10.1186/1476-511X-10-235 |
| [24] | Matsuura T, Ichinose S, Akiyama M, et al. Involvement of CX3CL1 in the migration of osteoclast precursors across osteoblast layer stimulated by interleukin‐1?.J Cell Physiol, 2017, 232(7): 1739–1745.DOI: 10.1002/jcp.v232.7 |
| [25] | Garcia GE, Xia YY, Chen SZ, et al. NF-κB-dependent fractalkine induction in rat aortic endothelial cells stimulated by IL-1β, TNF-α, and LPS.J Leukocyte Biol, 2000, 67(4): 577–584.DOI: 10.1002/jlb.2000.67.issue-4 |
| [26] | Jang J, Yoon Y, Oh DJ. A calpain inhibitor protects against fractalkine production in lipopolysaccharide- treated endothelial cells.Kidney Res Clin Pract, 2017, 36(3): 224–231.DOI: 10.23876/j.krcp.2017.36.3.224 |
