

1. 广西医科大学 药学院,广西 南宁 530021;
2. 广西中医药大学附属广西国际壮医院,广西 南宁 530001
收稿日期:2018-06-16;接收日期:2018-10-08
基金项目:国家自然科学基金(No. 81373403)资助
摘要:为探讨27nt-miRNA对间充质干细胞向血管平滑肌细胞分化影响,构建27nt-miRNA过表达、反义序列Anti-27nt-miRNA以及阴性对照的表达质粒,慢病毒包装后分别转染人脐带间充质干细胞(hUCMSC),加入Ⅳ型胶原诱导hUCMSC定向分化为血管平滑肌细胞。四唑盐(MTT)比色法检测分化后细胞活力,免疫细胞化学染色法检测分化后细胞SM22α (兔抗平滑肌22α,smooth muscle 22α)的表达,Western印迹法和RT-PCR检测分化后细胞内的SMA (兔抗平滑肌肌动蛋白,smooth muscle actin) mRNA、SM 22α mRNA及其蛋白质表达情况。经检测,27nt-miRNA过表达分化组与阴性对照组相比,细胞活力下降20.48% (P < 0.05),SMA mRNA、SM22α mRNA及其蛋白质表达量明显升高(P < 0.05);而Anti-27nt-miRNA分化组细胞活力上升了18.07% (P < 0.05),SMA mRNA、SM22α mRNA及其蛋白质表达量下降(P < 0.05)。综上所述,27nt-miRNA能够促进间充质干细胞向血管平滑肌细胞分化,并且抑制分化后的细胞活力。
关键词:27nt-miRNA间充质干细胞血管平滑肌细胞SM22αSMA
Effect of 27nt-miRNA on the differentiation of mesenchymal stem cells into vascular smooth muscle cells
Feng Shen1, Peng Yang1, Xiaojing Tao1, Yuanyuan Yan1, Dan Li1, Hesheng Ou1,2


1. College of Pharmaceutical Sciences, Guangxi Medical University, Nanning 530021, Guangxi, China;
2. The Affiliated Guangxi International Zhuang Hospital, Guangxi Traditional Chinese Medicine, Nanning 530001, Guangxi, China
Received: June 16, 2018; Accepted: October 8, 2018
Supported by: National Natural Science Foundation of China (No. 81373403)
Corresponding author: Hesheng Ou. Tel: +86-771-3376878; E-mail: 2676611767@qq.com.
Abstract: To investigate the effect of 27nt-miRNA on the differentiation of mesenchymal stem cells into vascular smooth muscle cells. The highly expression plasmids of 27nt-miRNA and anti-27nt-miRNA, and negative control plasmids were constructed, packaged with lentivirus and transfected into human umbilical cord mesenchymal stem cells (hUCMSCs). Collagen Ⅳ was added to induce hUCMSCs differentiation into blood vessel smooth muscle cells (VSMCs). The cell viability was measured by MTT assay. The expression of SMA, SM22α at mRNA and protein levels was determined by RT-PCR, immunocytochemical staining and Western blotting. Compared with the negative control group, the viability of the 27nt-miRNA overexpression group was decreased by 20.48% (P < 0.05), and the expression of SMA mRNA and SM22α mRNA and protein was significantly increased (P < 0.05); the viability of Anti-27nt-miRNA group was increased 18.07% (P < 0.05), and the expression of SMA mRNA and SM22α mRNA and protein was decreased (P < 0.05). In summary, 27nt-miRNA promotes mesenchymal stem cells differentiation into vascular smooth muscle cells and inhibits cells viability.
Keywords: 27nt-miRNAmesenchymal stem cellsvascular smooth muscle cellsSM22αSMA
血管组织工程是一门利用血管组织中相关细胞和对应的细胞外基质,通过人工制取并重建形成三维血管组织的科学,它为临床心血管疾病的细胞治疗、移植治疗开辟了新的方向。获取种子细胞、构建合适种子细胞支架并成功种植是血管组织工程的3个关键步骤。血管平滑肌细胞(Vascular smooth muscle cells,VSMCs)位于血管中膜,在血管舒缩功能的维持及血管相关疾病如高血压、缺血性心脑血管疾病、动脉粥样硬化等疾病的诊疗中发挥重要作用[1-2]。此外,VSMC是构建血管组织工程中的重要种子细胞[3]。目前,用于构建组织工程的VSMC主要来源自成体血管组织和成体干细胞[4],但从成体血管分离的成熟血管平滑肌细胞体外增殖能力有限,很难满足血管组织工程中的种子细胞数量。因此,可以高效分化为有功能的VSMC的干细胞,在血管组织工程具有良好的应用前景。
干细胞具有无限增殖能力、多分化潜能的优点,成为血管组织工程的理想种子细胞来源。根据来源不同,干细胞大致分为胚胎干细胞和成体干细胞。间充质干细胞(Mesenchymal stem cells,MSCs)是成体干细胞中的一种,它来源中胚层,易于分离培养,增殖速度快,异体排斥反应小,具有多向分化潜能。在特定的诱导环境下,MSCs可以定向分化为骨细胞、脂肪细胞、内皮细胞、心肌细胞等。据报道,MSCs还可以分化为VSMC,成为研究VSMC分化的理想模型[5]。
微小RNA (MicroRNAs,miRNAs)是真核生物中一类长度约为22个核苷酸的非编码小分子RNA,它们在序列和结构上多样化,参与基因转录后水平调控。近年来研究发现,miRNAs通过调节基因的表达参与干细胞自我更新和分化过程的调控,在干细胞定向分化过程中起重要作用[6-7],更重要的是某些miRNAs通过调节干细胞定向分化过程为心血管疾病治疗提供新策略[8]。27nt-miRNA来源于内皮型一氧化氮合酶(Endothelial nitric oxide synthase,eNOS)基因第4内含子中的27碱基重复序列,它在心血管疾病的诊疗中已被广泛研究,内含子源性27nt-miRNA可以抑制内皮细胞的增殖、迁移,同时可以调节内皮细胞代谢产物一氧化氮(Nitric oxide,NO)的产生和释放[9],但其在干细胞定向分化为VSMC的研究尚未见报道。因此,本研究的目的是探讨27nt-miRNA对间充质干细胞向血管平滑肌细胞分化影响,其结果可能为干细胞在心血管相关疾病的预防和治疗提供新依据。
1 材料与方法1.1 材料与仪器人脐带间充质干细胞hUCMSCs (上海华雅思创生物科技有限公司);血清替代品(PALL,美国);培养基(LONZA,美国);DMEM培养基(Gibco公司);胎牛血清(Lonsera公司);胰蛋白酶消化液(Gibco公司);Ⅳ型胶原(Thermo Fisher);四甲基偶氮唑盐(MTT) (索莱宝科技有限公司);RNA提取试剂盒(北京百泰克生物技术有限公司);RT试剂盒(MBI);PCR试剂盒(天根生化科技有限公司);慢病毒载体(上海吉凯基化学技术有限公司);兔抗平滑肌22α单抗(Smooth muscle 22α,SM22α)、内参GAPDH抗体(Proteintech);兔抗平滑肌肌动蛋白单抗(Smooth muscle actin,SMA) (Abcam,美国);酶标二抗山羊抗兔IgG (Proteintech);超敏ECL化学发光试剂盒(碧云天);免疫组化通用性试剂盒(中杉)。
超净工作台(新加坡艺思高科技有限公司);倒置显微镜(日本Olympus公司);CO2饱和湿度培养箱(美国Thermo Forma公司);酶联免疫检测仪Model-450 (美国Thermo Forma公司);低速离心机(上海菲恰尔分析仪器有限公司);立式压力蒸汽灭菌锅(海博讯实业有限公司医疗设备厂);?80 ℃冰箱(Haier公司);蛋白电泳仪、蛋白质转膜仪(Bio-Rad,美国);Alpha化学发光凝胶成像系统Fluor Chem HD2 (美国Protein Simple公司);ABI7700荧光定量PCR仪(ABI公司)。
1.2 方法1.2.1 27nt-miRNA病毒的构建和鉴定以eNOS第4内含子中27碱基重复序列(5′-GA AGTCTAGACCTGCTGCAGGGGTGAG-3′)为设计根据,以Ubi-MCS-SV40-EGFP-IRES-puromycin为载体,用AgeⅠ/NheⅠ进行酶切,转染293FT细胞后,浓缩得到27nt-miRNA过表达慢病毒颗粒,同时根据发夹结构构建反义序列Anti-27nt-miRNA和阴性对照病毒NC。病毒载体上带有绿色荧光并含有嘌呤霉素抗性,绿色荧光可用来识别慢病毒是否成功转染,加入嘌呤霉素进行筛选,建立稳定细胞株。
1.2.2 人脐带间充质干细胞(hUCMSC)的培养和转染hUCMS用含2%血清替代品、2%谷氨酰胺和1%青霉素/链霉素的培养基进行培养,放置37 ℃、5% CO2恒温饱和湿度培养箱中培养,待细胞密度大于90%时,倾去培养液,用PBS洗涤细胞。加入0.15%胰蛋白酶进行消化传代。选择生长状态良好的第3–5代细胞转染,按5×105细胞/孔的浓度接种6孔板,混匀后正常静置培养24 h。3种慢病毒以MOI=70分别感染hUCMS,置于培养箱孵育48 h,在倒置荧光显微镜下观察荧光表达情况,加入嘌呤霉素(8 μg/mL)进行筛选。实验分为3组:27nt-miRNA组、NC组、Anti-27nt-miRNA组。
1.2.3 hUCMSC分化转染后的3组细胞进行消化传代,将吹打成单细胞的hUCMSC接种到Ⅳ型胶原(5 g/mL)包被的细胞培养瓶中,添加分化培养液(含10%胎牛血清、1%青霉素/链霉素的DMEM培养基),连续培养14 d,根据情况2–3 d换液。
1.2.4 MTT法检测细胞活力诱导分化14 d后的3组细胞,以每孔6×103个细胞接种到96孔板中,放置37 ℃、5% CO2恒温培养箱培养。12 h后更换无血清的DMEM培养基继续培养。于24 h后更换成含PDGF-BB (5 ng/mL)的5% FBS/DMEM培养24 h后加入MTT培养4 h,使用酶联免疫检测仪在490 nm波长处测每孔OD值。
1.2.5 免疫组化检测VSMC分化标志物SM 22α的表达采用免疫组化检测。将转染成功的3组hUCMSC接种到Ⅳ型胶原包被的盖玻片上进行分化培养。第14天时,取出玻片,PBS冲洗3次,中性树脂粘片,4%甲醛固定。用Triton X-100 (10 min)和3%过氧化氢(30 min)处理后双蒸水冲洗3次,敷一抗、二抗后显色剂显色。显微镜观察、拍照,并计算细胞阳性率。实验重复3次,取平均值。
1.2.6 RT-PCR检测细胞SM A mRNA、SM22α mRNA的表达分化第14天时,收集3组细胞样本,根据TRIzol试剂盒说明书提取各组细胞的总RNA,利用Primer Premier 5.0软件设计合成SMA、SM22α和GAPDH的引物,见表 1。分别取各组细胞RNA 1 μg,加入1 μL (0.5 g/L) Oligo(dT)18 Primer,70 ℃变性5 min后立即放置冰上冷却。加4 μL反应缓冲液(5×),1 μL Ribo LockTM Ribonuclease Inhibitor (20 U/μL),2 μL 10 mmol/L dNTP Mix,37 ℃温育5 min,加入1 μL逆转录酶,42 ℃反应1 h,之后70 ℃孵育10 min终止反应,得到cDNA第一条链。PCR扩增反应:94 ℃预变性5 min后,开始30个循环(94 ℃ 30 s、56 ℃ 1 min、72 ℃ 1 min),最后72 ℃ 5 min,终止反应。取5 μL PCR产物进行1.5%琼脂糖凝胶电泳分析。
表 1 引物序列Table 1 The primer sequences
| Primer name | Primer sequence (5′–3′) |
| SM22α-F | CTTGAAGGCAGCTGAGGATTAT |
| SM22α-R | CAAACTGCCCAAAGCCATTAC |
| SMA-F | AGGGAGTGATGGTTGGAATG |
| SMA-R | GGTGATGATGCCGTGTTCTA |
| GAPDH-F | GATGACATCAAGAAGGTGGTGA |
| GAPDH-R | ACCCTGTTGCTGTAGCCATATTC |
表选项
1.2.7 Western blotting检测细胞内SMA和SM 22α蛋白表达分化第14天时,收集3组细胞样本,分别用RIPA缓冲液裂解,12 000 r/min、4 ℃离心15 min,取上清。分别取各组的蛋白30 μg进行SDS-PAGE (10%)分离并转移到PVDF膜上。用脱脂奶粉封闭1 h后加入SMA (1:1 000)、SM22α (1:1 000)一抗湿盒过夜(4 ℃)。第二天用TBST冲洗3次(每次10 min),然后加入酶标二抗山羊抗兔IgG (1:2 000)孵育2 h,重复用TBST冲洗3次(每次10 min)。加入显色剂,利用Alpha化学发光凝胶成像系统分析。实验重复3次,取平均值。
1.2.8 统计学方法采用SPSS 19.0统计软件进行单因素方差分析,实验重复3次,数据均用均数±标准差(x ± s)表示,两两比较采用t检验。P < 0.05为差异有统计学意义。
2 结果与分析2.1 27nt-miRNA高表达、Anti-27nt-miRNA、NC转染效果分别将3种慢病毒以MOI=70分别感染hUCMS,48 h后在荧光电子显微镜下观察转染效率(显微镜下观察到的绿色荧光代表成功转染慢病毒的细胞),结果如图 1所示,3种慢病毒转染效率达90%以上,用嘌呤霉素进行筛选,用于后续实验。
 |
| 图 1 显微镜下观察到hUCMS的转染情况 Fig. 1 Transfection of hUCMS was observed under the microscope. |
| 图选项 |
2.2 27nt-miRNA对分化后VSMC的活力影响各组细胞分化14 d后,用MTT法检测27nt-miRNA对PDGF-BB诱导分化后细胞活力的影响(图 2)。与阴性对照NC组比较,27nt-miRNA组的OD值下降20.48% (0.66±0.06 vs. 0.83±0.03,P < 0.05),而Anti-27nt-miRNA组升高18.07% (0.83±0.03 vs. 0.98±0.07,P < 0.05)。以上结果提示,27nt-miRNA抑制hUCMSC分化后细胞的活力。
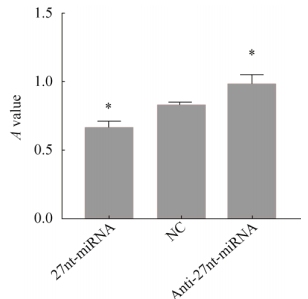 |
| 图 2 MTT检测27nt-miRNA对细胞活力影响 Fig. 2 MTT detects the effect of 27nt-miRNA on cell viability. x ± s. n=3. *P < 0.05 vs. NC. |
| 图选项 |
2.3 27nt-miRNA对VSMC分化标志物SM22α表达的影响用免疫细胞化学染色方法(ICC)检测分化后各组细胞中的VSMC特异性蛋白SM22α的表达量,如图 3所示,SM22α蛋白主要表达于细胞胞浆,阳性染色呈棕黄色颗粒。运用IPP6.0软件对SM22α蛋白表达量进行计算:平均光密度(Mean optical density)越大,SM22α蛋白表达越高。与阴性对照NC组比较,27nt-miRNA组SM22α表达量增加63.64% (0.22±0.02 vs. 0.36±0.04,P < 0.05);而Anti-27nt-miRNA组SM22α表达量下降36.36% (0.22±0.02 vs. 0.14±0.03,P < 0.05)。结果提示,27nt-miRNA促进了VSMC分化标志物SM22α表达。
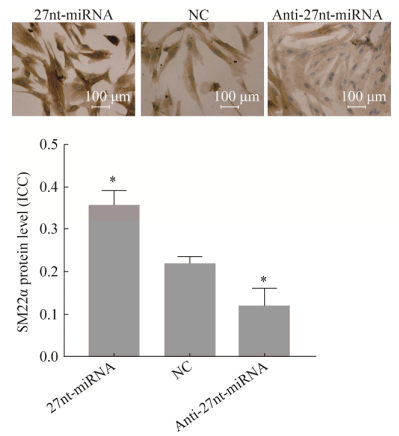 |
| 图 3 免疫组化检测27nt-miRNA对细胞SM22α蛋白表达的影响 Fig. 3 Effect of 27nt-miRNA on the protein expression of SM22α was detected by immunohistochemistry, x ± s. n=3, * P < 0.05 vs NC. |
| 图选项 |
2.4 RT-PCR检测27nt-miRNA对SMA mRNA和SM22α mRNA的影响用RT-PCR检测分化后各组细胞的SMA mRNA、SM22α mRNA的表达水平(图 4)。与阴性对照NC组比较,27nt-miRNA组的SM22α mRNA表达量增加31.40% (0.86±0.03 vs. 1.13±0.08,P < 0.05)、SMA mRNA表达量上升25.00% (0.72±0.03 vs. 0.90±0.03,P < 0.05);而Anti-27nt-miRNA组SM22α mRNA表达量降低12.80% (0.86±0.03 vs. 0.75±0.04,P < 0.05)、SMA mRNA表达量下降27.78% (0.72±0.03 vs. 0.52±0.05,P < 0.05)。结果提示,27nt-miRNA促进了SMA mRNA、SM22α mRNA的转录。
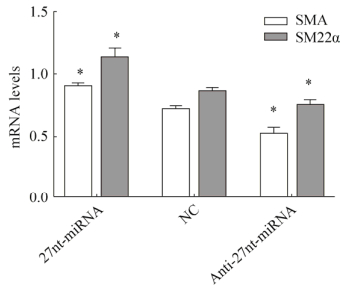 |
| 图 4 PT-PCR检测27nt-miRNA对SMA mRNA和SM22α mRNA表达的影响 Fig. 4 Effect of 27nt-miRNA on the mRNA expression of SMA mRNA and SM22α mRNA was detected by RT-PCR. x ± s. n=3. * P < 0.05 vs NC. |
| 图选项 |
2.5 Western blotting检测27nt-miRNA对SMA、SM22α蛋白质表达的影响用Western blotting检测分化后各组细胞的SMA、SM22α蛋白质的表达水平,如图 5所示。与阴性对照NC组比较,27nt-miRNA组的SM22α表达量增加28.33% (0.60±0.03 vs. 0.77±0.04,P < 0.05)、SMA表达量上升30.00% (0.40±0.02 vs. 0.52±0.04,P < 0.050);而Anti-27nt-miRNA组SM22α表达量降低18.33% (0.60±0.03 vs. 0.49±0.03,P < 0.05)、SMA表达量下降22.50% (0.40±0.02 vs. 0.31±0.03,P < 0.05)。结果提示,27nt-miRNA促进SMA、SM22α的表达。
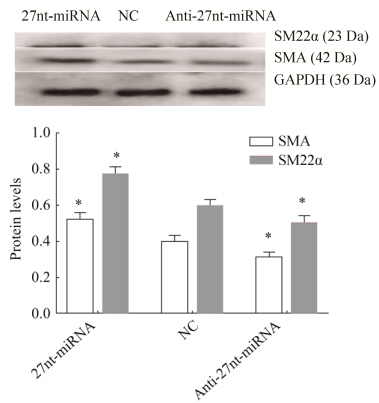 |
| 图 5 Western blotting检测27nt-miRNA对SMA和SM22α蛋白表达的影响 Fig. 5 Effect of 27nt-miRNA on the protein expression of SMA and SM22α by Western blotting, x ± s. n=3. * P < 0.05 vs NC. |
| 图选项 |
3 讨论本研究通过向hUCMSCs分别转染27nt-miRNA过表达、反义序列Anti-27nt-miRNA及阴性对照NC三种慢病毒后,定向分化为VSMCs,结果发现27nt-miRNA可以促进hUCMSCs向VSMCs分化,表现为VSMCs分化标志物SMA、SM22α表达增高,同时抑制分化后细胞的增殖。SMA是VSMCs最常用的分化标志物,但它特异性不强,在胚胎期的心肌、成纤维细胞、内皮细胞及多种肿瘤细胞中均有表达[10]。为提高研究的可信度,我们还增加了SM22α分化标志物,它的特异性比SMA高,仅表达于内脏平滑肌和VSMCs[11]。SMA、SM22α在27nt-miRNA过表达组均显著提高,表明27nt-miRNA可特异性促进VSMCs分化。
干细胞的多向分化潜能及可塑性已经得到普遍的认可,是组织工程中的理想种子细胞。研究发现,干细胞在诱导条件下可以定向分化为神经样细胞,在神经退行性疾病和神经细胞保护中发挥重要作用[12];在一定条件下,干细胞定向分化为脂肪细胞,为自体脂肪移植的临床应用提供新思路[13];此外,干细胞还可以分化为成骨细胞,促使成骨细胞和破骨细胞趋于平衡[14]。更令人感兴趣的是,干细胞在心血管疾病中也起了重要作用[15]。心血管疾病已成为威胁人类健康的重要疾病之一,高血压、心肌梗死、先天性心脏病等心血管疾病发病率及病死率逐年升高。VSMCs、内皮细胞及心肌细胞的功能改变及其凋亡与这些疾病发生发展有着密切的联系,因此,找到理想的种子细胞是关键。来自于人类脐带间充质干细胞(MSCs)可能是VSMCs新来源,因为它们表现出非常低的同种免疫反应和致瘤风险[16-17]。研究表明,间充质干细胞可以定向分化为内皮细胞[18]、心肌细胞[19]及血管平滑肌细胞[20],其分化VSMCs的条件有TGF-β、PDGF-BB、Ⅳ型胶原、高浓度的血清等[21-22]。本研究中采用了Ⅳ型胶原作为诱导剂,MSCs分化过程中出现VSMCs分化标志物SMA、SM22α,表明分化成功。
miRNAs在心血管疾病和干细胞分化的关键调节作用获得越来越多的关注,并被认为是治疗心血管疾病的新靶点。Wu等[23]研究发现,miR-214通过靶向结合QKI蛋白促进胚胎干细胞分化为VSMCs;Gu等[5]研究发现miR503通过靶目标SMAD7促进间充质干细胞分化为VSMCs,而miR-222-5P通过ROCK2抑制VSMCs分化。这些miRNAs在干细胞定向分化VSMCs起到重要作用。据我们所知,27nt-miRNA在心血管系统发挥重要作用[9, 24],但是它的表达和生物功能在干细胞定向分化VSMCs中的调控作用尚不清楚。本研究中hUCMSCs定向分化VSMCs模型中分别转染被病毒包装的27nt-miRNA过表达、反义序列Anti-27nt-miRNA以及阴性对照NC质粒,分化14 d后发现27nt-miRNA过表达组的SMA、SM22α表达量明显增高,表明27nt-miRNA可以促进hUCMSCs定向分化VSMCs,并且可能是通过调控SMA、SM22α基因从而影响VSMCs分化。但是VSMCs的分化机制十分复杂,涉及到多个不同层面的调节,包括表观遗传学修饰、基因转录和转录后水平、翻译以及翻译后调节等[25],这些VSMCs分化机制问题有待今后深入探讨。
综上,本研究初步明确27nt-miRNA可以促进hUCMSCs定向分化VSMCs,并且能够抑制PDGF-BB诱导的VSMCs增殖,这一作用对于组织工程血管的构建有重要意义,可能为其提供VSMCs种子细胞。但是,本研究也存在一些不足之处,例如,VSMCs分化是一个多因素调节的过程,不是单一分子或基因所调控,可能还通过其他通路起作用。此外,没有明确分化成功VSMCs的表型,这些问题都有待进一步探讨。
参考文献
| [1] | Wadey K, Lopes J, Bendeck M, et al. Role of smooth muscle cells in coronary artery bypass grafting failure.Cardiovasc Res, 2018, 114(4): 601–610.DOI: 10.1093/cvr/cvy021 |
| [2] | Hays TT, Ma B, Zhou N, et al. Vascular smooth muscle cells direct extracellular dysregulation in aortic stiffening of hypertensive rats.Aging Cell, 2018, 17(3): e12748.DOI: 10.1111/acel.2018.17.issue-3 |
| [3] | Row S, Peng HF, Schlaich EM, et al. Arterial grafts exhibiting unprecedented cellular infiltration and remodeling in vivo: the role of cells in the vascular wall.Biomaterials, 2015, 50: 115–126.DOI: 10.1016/j.biomaterials.2015.01.045 |
| [4] | Espagnolle N, Guilloton F, Deschaseaux F, et al. CD146 expression on mesenchymal stem cells is associated with their vascular smooth muscle commitment.J Cell Mol Med, 2014, 18(1): 104–114.DOI: 10.1111/jcmm.2013.18.issue-1 |
| [5] | Gu WD, Hong XC, Le Bras A, et al. Smooth muscle cells differentiated from mesenchymal stem cells are regulated by microRNAs and suitable for vascular tissue grafts.J Biol Chem, 2018, 293(21): 8089–8102.DOI: 10.1074/jbc.RA118.001739 |
| [6] | Feng L, Shi L, Lu YF, et al. Linc-ROR promotes osteogenic differentiation of mesenchymal stem cells by functioning as a competing endogenous RNA for miR-138 and miR-145.Mol Ther Nucleic Acids, 2018, 11: 345–353.DOI: 10.1016/j.omtn.2018.03.004 |
| [7] | Khosravi M, Azarpira N, Shamdani S, et al. Differentiation of umbilical cord derived mesenchymal stem cells to hepatocyte cells by transfection of miR-106a, miR-574-3p, and miR-45.Gene, 2018, 667: 1–9.DOI: 10.1016/j.gene.2018.05.028 |
| [8] | Li B, Meng XM, Zhang LB. microRNAs and cardiac stem cells in heart development and disease.Drug Disc Today, 2018.DOI: 10.1016/j.drudis.2018.05.032 |
| [9] | Luo XL, Chen W, Mo GJ, et al. The regulation of 27-nt miRNA on vascular endothelial cells eNOS expression/activity and the impact of its metabolites.Progr Mod Biomed, 2017, 17(8): 1442–1447.(in Chinese). 罗雪兰, 陈伟, 莫国君, 等. 27nt-miRNA对血管内皮细胞eNOS表达/活性的调节及其代谢产物的影响.现代生物医学展, 2017, 17(8): 1442-1447. |
| [10] | Kennedy E, Hakimjavadi R, Greene C, et al. Embryonic rat vascular smooth muscle cells revisited - a model for neonatal, neointimal SMC or differentiated vascular stem cells?.Vasc Cell, 2014, 6(1): 6.DOI: 10.1186/2045-824X-6-6 |
| [11] | Solway J, Seltzer J, Samaha FF, et al. Structure and expression of a smooth muscle cell-specific gene, SM22α.J Biol Chem, 1995, 270(22): 13460–13469.DOI: 10.1074/jbc.270.22.13460 |
| [12] | Aikins AR, Hong SW, Kim HJ, et al. Extremely low-frequency electromagnetic field induces neural differentiation of hBM-MSCs through regulation of (Zn)- metallothionein-3.Bioelectromagnetics, 2017, 38(5): 364–373.DOI: 10.1002/bem.v38.5 |
| [13] | Wang Q, Wang X, Lai DF, et al. BIX-01294 promotes the differentiation of adipose mesenchymal stem cells into adipocytes and neural cells in Arbas Cashmere goats.Res Vet Sci, 2018, 119: 9–18.DOI: 10.1016/j.rvsc.2018.05.009 |
| [14] | Ren G, Sun J, Li MM, et al. MicroRNA-23a-5p regulates osteogenic differentiation of human bone marrow-derived mesenchymal stem cells by targeting mitogen-activated protein kinase-13.Mol Med Rep, 2018, 17(3): 4554–4560. |
| [15] | Forte A, Finicelli M, Mattia M, et al. Mesenchymal stem cells effectively reduce surgically induced stenosis in rat carotids.J Cell Physiol, 2008, 217(3): 789–799.DOI: 10.1002/jcp.v217:3 |
| [16] | Shende P, Subedi M. Pathophysiology, mechanisms and applications of mesenchymal stem cells for the treatment of spinal cord injury.Biomed Pharmacother, 2017, 91: 693–706.DOI: 10.1016/j.biopha.2017.04.126 |
| [17] | Lo Furno D, Mannino G, Giuffrida R. Functional role of mesenchymal stem cells in the treatment of chronic neurodegenerative diseases.J Cell Physiol, 2018, 233(5): 3982–3999.DOI: 10.1002/jcp.v233.5 |
| [18] | Khaki M, Salmanian AH, Abtahi H, et al. Mesenchymal stem cells differentiate to endothelial cells using recombinant vascular endothelial growth factor-A.Rep Biochem Mol Biol, 2018, 6(2): 144–150. |
| [19] | Dai FJ, Du PZ, Chang YW, et al. Downregulation of MiR-199b-5p inducing differentiation of bone-marrow Mesenchymal Stem Cells (BMSCs) toward cardiomyocyte-like cells via HSF1/HSP70 pathway.Med Sci Monit, 2018, 24: 2700–2710.DOI: 10.12659/MSM.907441 |
| [20] | Pajoohesh M, Naderi-Manesh H, Soleimani M. MicroRNA-145-based differentiation of human mesenchymal stem cells to smooth muscle cells.Biotechnol Lett, 2016, 38(11): 1975–1981.DOI: 10.1007/s10529-016-2177-1 |
| [21] | Jin M, Wu YT, Wang YM, et al. MicroRNA-29a promotes smooth muscle cell differentiation from stem cells by targeting YY1.Stem Cell Res, 2016, 17(2): 277–284.DOI: 10.1016/j.scr.2016.07.011 |
| [22] | Dennis JE, Charbord P. Origin and differentiation of hnman and murine stroma.Stem Cells, 2002, 20(3): 205–214.DOI: 10.1634/stemcells.20-3-205 |
| [23] | Wu YT, Li ZB, Yang M, et al. MicroRNA-214 regulates smooth muscle cell differentiation from stem cells by targeting RNA-binding protein QKI.Oncotarget, 2017, 8(12): 19866–19878. |
| [24] | Li YM, Wang H, Zhang WY, et al. Intronic miRNA regulates human endothelial nitric oxide synthase gene and proliferation of endothelial cells by the transcription factor AP1.Chin J Arterioscl, 2017, 22(7): 649–654.(in Chinese). 李玉媚, 王辉, 张文宇, 等. 内含子源性miRNA通过转录因子AP1调节内皮型一氧化氮合酶表达及血管内皮细胞增殖作用.中国动脉硬化杂志, 2017, 22(7): 649-654.DOI:10.3969/j.issn.1007-3949.2017.07.001 |
| [25] | Xie C, Ritchie RP, Huang H, et al. Smooth muscle cell differentiation in vitro: models and underlying molecular mechanisms.Arterioscler Thromb Vasc Biol, 2011, 31(7): 1485–1494.DOI: 10.1161/ATVBAHA.110.221101 |
