
 , 刘博, 周宇, 余熠杭, 沈炼桔, 龙春兰, 刘星, 林涛, 何大维, 魏光辉
, 刘博, 周宇, 余熠杭, 沈炼桔, 龙春兰, 刘星, 林涛, 何大维, 魏光辉

重庆医科大学附属儿童医院 泌尿外科 儿童泌尿生殖发育与组织工程重点实验室 儿童发育重大疾病国家国际科技合作基地 儿童发育疾病研究教育部重点实验室 儿科学重庆市重点实验室,重庆 400014
收稿日期:2018-07-01;接收日期:2018-09-06;网络出版时间:2019-01-11
基金项目:国家自然科学基金(Nos. 81771566,81800618),重庆市留学人员回国创业创新支持计划(No. cx2017015)资助
摘要:本研究旨在探索优化肾脏脱细胞支架的制备方法,为肾脏组织工程及肾脏体外病理、毒理研究提供实验基础。取大鼠肾脏灌注PBS作为对照组(Control组),在不同流速下分别以十二烷基磺酸钠(Sodium dodecyl sulfate,SDS)灌注(S组),Triton X-100联合SDS灌注(TS组),反复冻融后Triton X-100联合SDS灌注(FTS组),制备肾脏脱细胞支架,并测定其流体分布及脉管阻力。HE染色、DAPI染色、DNA定量检测脱细胞支架脱细胞程度,Masson染色、PAS染色、免疫组织化学染色检测脱细胞支架主要成分的保留和结构的完整,扫描电镜检测支架的超微结构,MTT法检测支架的细胞毒性,ELISA检测支架中生长因子的含量。结果显示,FTS组脱细胞用时较S组、TS组少,10 mL/min组支架脉管阻力较低,S组、TS组、FTS组流体分布与Control组存在差异。HE染色和DAPI染色显示各组支架未见细胞成分残留,DNA含量<50 ng/mg。Masson染色和PAS染色可见细胞外网状胶原及多糖,免疫组织化学染色见Ⅰ型胶原(CollagenⅠ)、Ⅳ型胶原蛋白(Collagen Ⅳ)、纤维连接蛋白(Fibronectin)、层粘连蛋白(Laminin)表达。扫描电镜见支架呈蜂窝状结构。MTT法检测支架细胞毒性分级在0–1级之间。ELISA检测提示FTS组VEGF、EGF、IGF-1、PDGF含量明显高于S组和TS组。综上,联合冻融和灌注法能够制备更为理想且有效的大鼠肾脏整器官脱细胞支架,为肾脏组织工程及肾脏体外病理、毒理学研究奠定基础。
关键词:组织工程肾脏脱细胞支架冻融法灌注法
Optimization of preparation of rat kidney decellularized scaffold by combining freeze-thawing with perfusion
Dong Hu, Deying Zhang

 , Bo Liu, Yu Zhou, Yihang Yu, Lianju Shen, Chunlan Long, Xing Liu, Tao Lin, Dawei He, Guanghui Wei
, Bo Liu, Yu Zhou, Yihang Yu, Lianju Shen, Chunlan Long, Xing Liu, Tao Lin, Dawei He, Guanghui Wei

Department of Urology, Children's Hospital of Chongqing Medical University, Chongqing Key Laboratory of Children Urogenital Development and Tissue Engineering, China International Science and Technology Cooperation Base of Child Development and Critical Disorders, Ministry of Education Key Laboratory of Child Development and Disorders, Chongqing Key Laboratory of Pediatrics, Chongqing 400014, China
Received: July 1, 2018; Accepted: September 6, 2018; Published: January 11, 2019
Supported by: National Natural Science Foundation of China (Nos. 81771566, 81800618), Entrepreneurship and Innovation Support Program for Returned Overseas Chinese Scholars, Chongqing (No. cx2017015)
Corresponding author: Deying Zhang. Tel/Fax: +86-23-63633264; E-mail: dzdy199@126.com;
Guanghui Wei. E-mail: u806806@cqmu.edu.cn.
Abstract: We explored the improved method to prepare decellularized kidney scaffold and provide experimental basis for kidney tissue engineering and renal pathology and toxicology in vitro research. We perfused rat kidneys with PBS (group control) and prepared the decellularized kidney scaffolds with sodium dodecyl sulfate (SDS) (group S), Triton X-100 combined with SDS (group TS), and Triton X-100 combined with SDS after repeated freezing and thawing (group FTS) in different flow velocity. Meanwhile we measured their fluid distributions and vascular resistance. We examined the degree of decellularization of acellular scaffolds by HE, DAPI staining and DNA quantification. We examined the retention of main composition and structural integrity of decellularized scaffolds by Masson, PAS and immunohistochemical staining. We also detected the ultrastructure, cytotoxicity and the level of growth factor of the scaffolds by scanning electron microscope, MTT and ELISA, respectively. The results showed that the time of decellularization in group FTS was less than that in group S and TS. The vascular resistance of scaffolds decellularized at 10 mL/min flow velocity was lower. The fluid distribution in groups S, TS and FTS was different from that in control group. No residual cell was detected by HE and DAPI staining. DNA content was less than 50 ng/mg. Masson, PAS and immunohistochemical staining results showed that there was extracellular collagen, polysaccharide, type Ⅰ collagen, type Ⅳ collagen, fibronectin and laminin in the decellularized scaffolds, and the scanning electron microscope result showed the scaffolds had the honeycomb structure. The cytotoxicity level of decellularized scaffolds was between grade 0 to 1. The level of VEGF, EGF, IGF-1 and PDGF-BB in group FTS were significantly higher than those in group S and TS. In concluding, combining freeze-thawing with perfusion can produce more ideal and effective whole organ decellularized scaffold of rat kidney, and make a foundation for the study of kidney tissue engineering and in vitro pathology and toxicology of kidney.
Keywords: tissue engineeringkidneydecellularized scaffoldsfreeze-thawingperfusion
目前我国慢性肾病患者的人数将近1.2亿,其中有近5 000万患者处于终末期肾病[1]。对于慢性肾病乃至终末期肾病,目前的治疗方案仍限于以透析和肾移植为主的肾脏替代治疗[2]。其中,透析治疗仅能部分替代肾脏的滤过功能,而无法替代肾脏的造血和内分泌功能[3];与此同时,肾移植的广泛开展仍受限于供体肾源的稀缺和移植后的排斥反应等问题[4]。随着近年来组织工程的不断发展,以上问题的解决迎来了新的希望。组织工程组织/器官的构建包括种子细胞、支架材料和细胞因子这三个要素[5]。其中,支架材料的选择是影响后期细胞行为的重要环节。目前组织工程应用的支架材料包括天然及其改性修饰材料、人工合成材料和复合支架材料。由于重构的肾脏需要连接至受体的循环系统,肾脏组织工程支架不仅要求其具有良好的生物相容性、低免疫原性等其他支架材料所共有的一般特性[6],还要求其具有相对完整的脉管系统[7-8]。因此,通过去除组织中细胞成分而保留细胞外基质三维结构和生物学活性的肾脏脱细胞支架具有其他支架材料所不可替代的优势。而目前采用的脱细胞方法大都存在着脱细胞剂浓度较高、脱细胞时间较长从而影响支架材料生物学特性的弊端。本研究通过联合冻融和灌注法优化了肾脏脱细胞支架的制备,用低浓度脱细胞剂在更短时间内成功制备保留了细胞外基质主要成分、空间结构和对再细胞化具有重要意义的生长因子的脱细胞支架,为肾脏组织工程重建提供了理想的支架材料来源及更优的制备方法。
1 材料与方法1.1 实验动物及主要仪器、试剂实验动物:12周龄清洁级健康SD大鼠180–220 g,购自重庆医科大学实验动物中心,许可证号SCXK (渝) 2017-0001。
主要仪器和试剂:蠕动泵(保定创锐泵业有限公司),真空冷冻干燥机(Thermo),大鼠VEGF、EGF ELISA试剂盒(欣博盛生物),大鼠IGF-1、PDGF-BB ELISA试剂盒(Elabscience),组织DNA提取试剂盒(OMEGA),Fibronectin抗体(北京博奥森生物),CollagenⅠ抗体、Collagen Ⅳ抗体、Laminin抗体(武汉博士德生物)。
1.2 肾脏脱细胞支架的制备及实验分组SD大鼠麻醉后,无菌术取肾置于冰PBS溶液中,将24 G留置针经腹主动脉插至肾动脉结扎固定后经硅胶管连接至蠕动泵,以4 mL/min的流速灌注肝素化PBS溶液(50 U/mL肝素钠) 30 min作为Control组。之后分别以4 mL/min和10 mL/min流速灌注0.5% SDS溶液作为S4组和S10组;分别以4 mL/min和10 mL/min流速序列灌注0.1% Triton X-100溶液和0.5% SDS溶液作为TS4组和TS10组。将肝素化PBS灌注后的离体肾先后置于–80 ℃中3 h、4 ℃中6 h反复冻融3次后,再次置入留置针并连接蠕动泵,分别以4 mL/min和10 mL/min流速序列灌注0.1% Triton X-100和0.5% SDS溶液作为FTS4组和FTS10组。待各组离体肾脱细胞后灌注抗生素化的PBS溶液(100 U/mL青霉素和100 U/mL链霉素) 12 h洗脱Triton X-100和SDS。记录脱细胞过程中肾脏大体形态变化,测量各组样本干重。
1.3 肾脏脱细胞支架的检测1.3.1 生物力学检测将各组样本以1 mL/min流速经肾动脉灌注PBS溶液,U型压力计检测肾动脉入口处脉管阻力。将各组样本以4 mL/min流速经肾动脉灌注PBS溶液,5 min后测量经静脉和输尿管流出的液体量和经器官壁流出的液体量。
1.3.2 组织形态学观察将各组样本经4%多聚甲醛固定后,常规脱水、包埋并切片,行HE染色、DAPI染色、Masson染色和PAS染色后于光镜下观察。
1.3.3 扫描电镜将各组样本经戊二醛固定后,梯度法丙酮脱水,乙酸异戊酯置换,临界点法干燥,真空喷镀后扫描电镜下观察超微结构。
1.3.4 DNA含量测定将各组样本于真空冷冻干燥机中冷冻干燥12 h,按组织DNA提取试剂盒说明书步骤提取DNA,用紫外分光光度计于260 nm处测定DNA含量。
1.3.5 免疫组织化学染色各组样本的石蜡切片脱蜡并水化后,将切片加入0.01 mmol/L枸橼酸钠缓冲溶液微波热修复抗原12 min,3% H2O2孵育10 min后PBS清洗,0.5 %牛血清白蛋白室温下封闭1 h,加抗CollagenⅠ抗体(1:200)、抗Collagen Ⅳ抗体(1:200)、抗Fibronectin抗体(1:200),抗Laminin抗体(1:200),室温过夜,PBS清洗3遍,加辣根过氧化物酶标记的二抗(1:200)室温孵育1 h,PBS清洗,DAB显色数秒后置于去离子水中终止显色,苏木素染核后于光镜下观察。
1.3.6 MTT体外细胞毒性试验按照GB/T 16886.5-2003将经PBS灌洗和未灌洗的肾脏脱细胞支架以多孔材料1 mg/mL的比例加入无血清DMEM培养基中,于37 ℃浸没24 h后加入10%血清制备浸提液。将大鼠肾小管上皮细胞(NRK-52E)以5×103个/孔接种至96孔板,24 h后弃原培养基,分别加入含10%血清DMEM培养基(阴性对照组)、灌洗后支架的浸提液、未灌洗支架的浸提液、含0.1% Triton X-100的DMEM培养基、含0.5% SDS的DMEM培养基各100 μL,于37 ℃、5% CO2环境中培养。分别于6 h、12 h、24 h、48 h后,每孔加入20 μL 5 mg/mL MTT继续培养4 h。弃孔内液体,加入100 μL DMSO振荡10 min,酶标仪测定492 nm波长下的光密度(OD)值,计算相对增殖率(Relative growth rate,RGR):RGR (%)=(实验组OD值–空白OD值)/(阴性对照组OD值–空白OD值)×100%。
1.3.7 ELISA生长因子检测将各组样品经真空冷冻机冻干称重后,与RAPI裂解液共同在匀浆器中研磨,超声10 min,12 000 r/min离心10 min后取上清,按ELISA检测试剂盒说明书步骤测定VEGF、EGF、IGF-1、PDGF-BB浓度。
1.4 统计学分析采用SPSS 18.0统计软件,计量资料以x±s表达,两组间比较采用t检验,多组间比较采用方差分析。
2 结果与分析2.1 脱细胞过程中肾脏大体形态及质量肝素化PBS灌注后离体肾为棕色,冻融3次后肾脏颜色稍变浅透明,0.1% Triton X-100溶液灌注后肾脏颜色稍变白,0.5% SDS溶液灌注后肾脏颜色逐渐呈分段分叶状变白透明,最终全肾颜色呈均质白色半透明状(图 1A)。FTS组脱细胞时间较S组、TS组少,10 mL/min流速脱细胞时间较4 mL/min少(图 1B)。各组肾脏脱细胞支架质量无明显差异(图 1C)。
 |
| 图 1 肾脏脱细胞过程大体形态及质量(A:肾脏脱细胞过程大体形态变化;B:脱细胞过程用时;C:肾脏脱细胞支架干重) Fig. 1 The gross morphology and weight of kidneys during decellularized process. (A) Gross morphological changes in the decellularization process of the kidney. (B) Time of the decellularization process. (C) Dry weight of the decellularized kidney scaffolds. ** P < 0.01; NS: no significance. |
| 图选项 |
2.2 生物力学检测结果肾动脉入口处脉管阻力测量显示,10 mL/min流速脱细胞后支架脉管阻力较4 mL/min组低,S组、TS组、FTS组之间支架脉管阻力无明显统计学差异(图 2A)。流体分布测量结果显示,各组肾脏脱细胞支架流体经脉管和经肾外壁流出分布无明显统计学差异。与离体肾相比,各组肾脏脱细胞支架经肾外壁溢出比例从12.22%增加至54.98% (图 2B)。
 |
| 图 2 肾脏脱细胞支架生物力学检测结果(A:脉管阻力检测结果;B:流体分布检测结果) Fig. 2 The biodynamics results of decellularized kidney scaffolds. (A) The results of vascular resistance. (B) The results of fluid distribution. * P < 0.05; ** P < 0.01; NS: no significance. |
| 图选项 |
2.3 组织形态学表现HE染色显示各组肾脏脱细胞支架肾皮髓质部位全视野下未见细胞残留,Control组肾皮髓质组织结构完整,细胞清晰可见(图 3)。DAPI染色显示各组肾脏脱细胞支架肾皮髓质部位无DAPI荧光染色,Control组肾皮髓质可见与细胞核结合的DAPI荧光(图 4)。Masson染色显示各组肾脏脱细胞支架肾髓质部位仅见蓝色网状胶原纤维,结构完整,Control组肾皮髓质肾小球、肾小管组织结构清楚,可见细胞外网状胶原成分(图 5)。PAS染色显示各组肾脏脱细胞支架肾皮髓质部位仅见紫红色基底膜,无结构破坏,Control组肾皮髓质可见组织结构完整的肾小球、肾小管及其基底膜(图 6)。
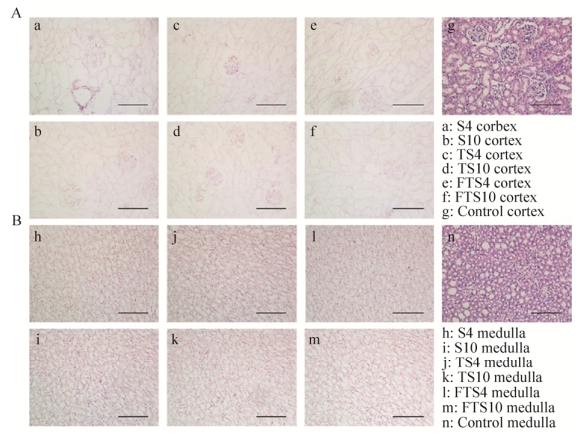 |
| 图 3 离体肾和肾脏脱细胞支架HE染色观察(A:肾皮质部位HE染色观察;B:肾髓质部位HE染色观察) Fig. 3 The HE staining of isolated kidneys and decellularized kidney scaffolds. (A) The HE staining of renal cortex. (B) The HE staining of renal medulla. Scale bar=100 μm. |
| 图选项 |
 |
| 图 4 离体肾和肾脏脱细胞支架DAPI染色观察(A:肾皮质部位DAPI染色观察;B:肾髓质部位DAPI染色观察) Fig. 4 The DAPI staining of isolated kidneys and decellularized kidney scaffolds. (A) The DAPI staining of renal cortex. (B) The DAPI staining of renal medulla. Scale bar=100 μm. |
| 图选项 |
 |
| 图 5 离体肾和肾脏脱细胞支架Masson染色观察(A:肾皮质部位Masson染色观察;B:肾髓质部位Masson染色观察) Fig. 5 The Massion staining of isolated kidneys and decellularized kidney scaffolds. (A) The Masson staining of renal cortex. (B) The Masson staining of renal medulla. Scale bar=100 μm. |
| 图选项 |
 |
| 图 6 离体肾和肾脏脱细胞支架PAS染色观察(A:肾皮质部位PAS染色观察;B:肾髓质部位PAS染色观察) Fig. 6 The PAS staining of isolated kidneys and decellularized kidney scaffolds. (A) The PAS staining of renal cortex. (B) The PAS staining of renal medulla. Scale bar=100 μm. |
| 图选项 |
2.4 超微结构观察扫描电镜观察可见各组肾脏脱细胞支架皮髓质部位细胞外基质表面光滑,呈完整蜂窝状结构,Control组肾脏皮髓质可见正常肾小球和肾小管(图 7)。
 |
| 图 7 离体肾和肾脏脱细胞支架扫描电镜观察(A:肾皮质部位扫描电镜观察;B:肾髓质部位扫描电镜观察) Fig. 7 The scanning electron micrographs of isolated kidneys and decellularized kidney scaffolds. (A) The scanning electron micrographs of renal cortex. (B) The scanning electron micrographs of renal medulla. Scale bar=30 μm. |
| 图选项 |
2.5 DNA含量测定DNA定量结果显示,Control组肾脏DNA含量为(17 453.41±483.59) ng/mg,各组肾脏脱细胞支架DNA含量均 < 50 ng/mg,无明显统计学差异(图 8)。
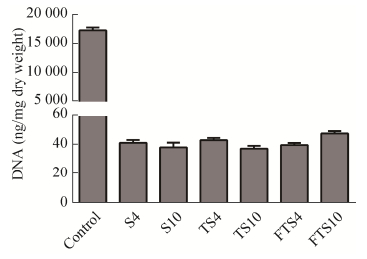 |
| 图 8 离体肾和肾脏脱细胞支架DNA定量 Fig. 8 DNA content of isolated kidneys and decellularized kidney scaffolds. |
| 图选项 |
2.6 肾脏脱细胞支架细胞外基质结构蛋白表达对离体肾和肾脏脱细胞支架皮质及髓质部位的CollagenⅠ、Collagen Ⅳ、Fibronectin和Laminin进行免疫组织化学染色后,可见各组肾脏脱细胞支架和离体肾类似,CollagenⅠ、Collagen Ⅳ、Fibronectin和Laminin在细胞外基质中有不同程度的表达(图 9)。
 |
| 图 9 离体肾和肾脏脱细胞支架细胞外基质主要结构蛋白免疫组织化学染色观察(A:肾皮质部位免疫组织化学染色观察;B:肾髓质部位免疫组织化学染色观察) Fig. 9 The immunohistochemical staining of the main structural protein of extracellular matrix in isolated kidneys and decellularized kidney scaffolds. (A) The immunohistochemical staining of renal cortex. (B) The immunohistochemical staining of renal medulla. Scale bar=100 μm. |
| 图选项 |
2.7 肾脏脱细胞支架体外细胞毒性体外细胞毒性实验发现,S组、TS组、FTS组未经灌洗的肾脏脱细胞支架浸提液对细胞活力有明显抑制作用,表明细胞毒性的Triton X-100和SDS在未灌洗支架中存在残留。随着S组、TS组、FTS组灌洗后肾脏脱细胞支架浸提液作用时间的延长,细胞活力逐渐下降(图 10)。按GB/T 16886.5-2003评价其细胞毒性为1级,可以认为无细胞毒性。
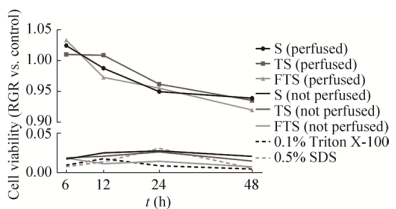 |
| 图 10 体外检测肾脏脱细胞支架细胞毒性结果 Fig. 10 The in vitro cytotoxicity of decellularized kidney scaffolds. |
| 图选项 |
2.8 肾脏脱细胞支架生长因子浓度ELISA检测各组肾脏脱细胞支架的生长因子浓度,在4 mL/min和10 mL/min流速下,FTS组的VEGF、EGF、IGF-1、PDGF-BB浓度均高于S组、TS组,差异具有统计学意义。FTS组内10 mL/min流速脱细胞后支架VEGF、EGF、IGF-1、PDGF-BB浓度高于4 mL/min组(图 11)。
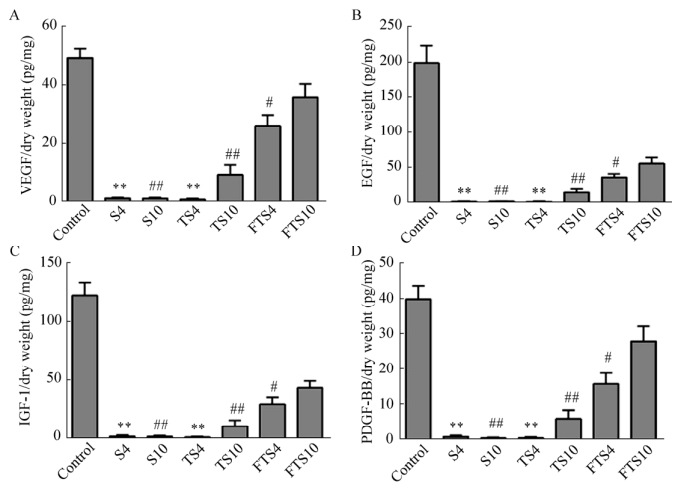 |
| 图 11 离体肾和肾脏脱细胞支架生长因子浓度(A:VEGF浓度;B:EGF浓度;C:IGF-1浓度;D:PDGF-BB浓度) Fig. 11 The growth factors concentration of isolated kidneys and decellularized kidney scaffolds. (A) The concentration of VEGF. (B) The concentration of EGF. (C) The concentration of IGF-1. (D) The concentration of PDGF-BB. ** P < 0.01, compared with group FTS4; # P < 0.05, compared with group FTS10; ## P < 0.01, compared with group FTS10. |
| 图选项 |
3 讨论经过多年的探索,目前组织工程支架材料的种类已十分丰富。其中,天然脱细胞支架材料已成功应用在包括气管[9-10]、心脏[11-12]、肝脏[13]和肺[14]在内的各种组织器官的再生研究中。同时,肾脏脱细胞支架因其良好的理化特性及其在肾脏发育过程中起着调控细胞生长增殖、调节信号转导的作用[15],近年来已成为肾脏组织工程研究的热点之一。
目前肾脏脱细胞支架的获取多采用经脉管系统整器官灌洗脱细胞剂以除去细胞成分。最常用的脱细胞剂包括Triton X-100和SDS。Triton X-100为非离子型洗脱剂,通过打破脂质之间的连接破坏细胞膜。SDS为离子型洗脱剂,与Triton X-100相比,能够更为有效地从致密的组织器官如肾脏中去除细胞核并保留组织结构[15]。然而,浓度超过0.04%的SDS可以使细胞外基质的胶原结构变性,并破坏细胞生长所需的关键组分[16-17]。因此,在制备的脱细胞支架满足其对移植受体低免疫原性要求的前提下,应尽可能优化脱细胞程序,减少脱细胞剂的浓度及灌注洗脱所需要的时间,从而最大化保留细胞外基质主要成分的含量、生理活性和空间结构的完整性,以利于脱细胞支架的再细胞化。
本研究在应用低浓度Triton X-100和SDS脱细胞之前,经过反复冻融,在细胞内形成冰晶破坏细胞膜溶解细胞,而不会影响支架材料的再细胞化[18]。此外,通过不同流速下脱细胞进一步探究脱细胞剂灌注过程中液体流速对肾脏脱细胞支架的影响。在预实验阶段,我们发现在20 mL/min流速下脱细胞会导致肾脏脱细胞支架的破裂,因此设计了4 mL/min和10 mL/min两组流速脱细胞。实验结果显示,与S组、TS组相比,FTS组脱细胞时间明显缩短。10 mL/min流速脱细胞较4 mL/min更快,提示在一定范围内较高的流速能够提高脱细胞剂整器官脱细胞的效率。生物力学检测显示,10 mL/min组支架肾动脉入口处脉管阻力低于4 mL/min组,推测可能与高流速灌洗条件下弹性的肾脏脱细胞支架脉管孔径增大有关。流体分布测量显示,经肾动脉灌注的液体从支架器官外壁溢出增加,提示肾脏脱细胞支架具有一定渗透性,这可能将影响细胞经脉管灌注实现支架再细胞化过程中细胞的传递,而脱细胞方法及流速对流体分布无明显影响。HE染色、DAPI染色和DNA定量提示各组肾脏脱细胞支架无细胞成分残留,且各组制备的支架已经达到脱细胞基质生物相容性的应用标准[19]。肾脏细胞外基质主要由糖胺聚糖、胶原(主要为Ⅰ和Ⅳ型)、Fibronectin和Laminin组成[20]。Masson染色显示各组肾脏脱细胞支架中胶原的保留和结构的完整。PAS染色显示肾脏脱细胞支架中肾小球/管基底膜中多糖成分的保留及膜结构的完整。免疫组织化学染色发现各组肾脏脱细胞支架中仍然存在CollagenⅠ、CollagenⅣ、Fibronectin和Laminin的表达。此外,脱细胞支架的超微结构将影响细胞在材料表面的迁移,干预细胞与支架材料的粘附行为[21]。扫描电镜提示本实验各组肾脏脱细胞支架的细胞外基质表面光滑,呈蜂窝状排列,空间结构相对完整,利于细胞的传递与粘附。体外细胞毒性试验提示灌洗后的肾脏脱细胞支架无明显细胞毒性,符合生物材料体外细胞毒性试验的安全标准。VEGF在肾内皮细胞表达,对维持细胞增殖和肾脏发育至关重要;EGF在近端小管增殖及肾器官发生中具有重要意义[22]。IGF-1通过刺激肾小管上皮细胞Na通道,在调节钠盐平衡中起重要作用[23]。PDGF-BB具有诱导系膜细胞的活化和增殖,增强细胞外基质合成的作用[24]。ELISA检测提示,FTS10组肾脏脱细胞支架VEGF、EGF、IGF-1、PDGF-BB浓度较其他各组高。这可能与FTS10组脱细胞剂,尤其是对细胞外基质影响较大的SDS溶液作用时间明显缩短有关。而同时,这一结果也提示FTS10组脱细胞程序能够更好地保留细胞外基质中的生长因子,从而为肾脏各种细胞提供适宜的生长环境,为后期肾脏脱细胞支架的再细胞化打下了良好基础。
随着组织工程技术的进步和方法的创新,肾脏组织工程研究取得了巨大的进步。但值得注意的是,由于肾脏本身结构的复杂性、细胞表型的多样性和生理功能的复杂性,实现肾脏组织器官的再生是一项巨大的挑战[25]。本研究发现,冻融后联合Triton X-100和SDS灌注可以成功制备肾脏脱细胞支架,该支架无细胞成分,有一定渗透性,无明显细胞毒性,为肾脏组织工程提供了理想的支架材料。与SDS灌注、Triton X-100联合SDS灌注相比,该方法脱细胞效率更高,对支架中的胶原、基底膜、主要结构蛋白及超微结构无明显影响,能更好地保留细胞外基质中的VEGF、EGF、IGF-1、PDGF-BB。10 mL/min流速脱细胞较4 mL/min能明显提高脱细胞效率,且对支架空间结构无明显影响。综上,本研究探索优化了肾脏脱细胞支架制备的有利条件,为组织工程构建再生肾及肾脏体外病理、毒理研究奠定了一定的基础。
参考文献
| [1] | Zhang JS, Wang ZB, Lin KZ, et al. In vivo regeneration of renal vessels post whole decellularized kidneys transplantation.Oncotarget, 2015, 6(38): 40433–40442. |
| [2] | Perico N, Remuzzi G. Chronic kidney disease: a research and public health priority.Nephrol Dial Transplant, 2012, 27(Suppl 3): iii19–iii26. |
| [3] | Madariaga MLL, Ott HC. Bioengineering kidneys for transplantation.Semin Nephrol, 2014, 34(4): 384–393.DOI: 10.1016/j.semnephrol.2014.06.005 |
| [4] | Bonandrini B, Figliuzzi M, Papadimou E, et al. Recellularization of well-preserved acellular kidney scaffold using embryonic stem cells.Tissue Eng Part A, 2014, 20(9/10): 1486–1498. |
| [5] | Sundaram S, Niklason LE. Smooth muscle and other cell sources for human blood vessel engineering.Cells Tissues Organs, 2012, 195(1/2): 15–25. |
| [6] | Gao QD, Zhu XL, Xiang JX, et al. Strategies to choose scaffold materials for tissue engineering.Chin J Biotech, 2016, 32(2): 172–184.(in Chinese). 高庆东, 祝旭龙, 向俊西, 等. 基于组织工程研究的可降解支架材料选择策略.生物工程学报, 2016, 32(2): 172-184. |
| [7] | Peloso A, Ferrario J, Maiga B, et al. Creation and implantation of acellular rat renal ECM-based scaffolds.Organogenesis, 2015, 11(2): 58–74.DOI: 10.1080/15476278.2015.1072661 |
| [8] | Poornejad N, Momtahan N, Salehi ASM, et al. Efficient decellularization of whole porcine kidneys improves reseeded cell behavior.Biomed Mater, 2016, 11(2): 025003.DOI: 10.1088/1748-6041/11/2/025003 |
| [9] | Conconi MT, de Coppi P, Di Liddo R, et al. Tracheal matrices, obtained by a detergent-enzymatic method, support in vitro the adhesion of chondrocytes and tracheal epithelial cells.Transpl Int, 2005, 18(6): 727–734.DOI: 10.1111/tri.2005.18.issue-6 |
| [10] | Baiguera S, Jungebluth P, Burns A, et al. Tissue engineered human tracheas for in vivo implantation.Biomaterials, 2010, 31(34): 8931–8938.DOI: 10.1016/j.biomaterials.2010.08.005 |
| [11] | Ott HC, Matthiesen TS, Goh SK, et al. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart.Nat Med, 2008, 14(2): 213–221.DOI: 10.1038/nm1684 |
| [12] | Hansen KJ, Favreau JT, Guyette JP, et al. Functional effects of delivering human mesenchymal stem cell-seeded biological sutures to an infarcted heart.Biores Open Access, 2016, 5(1): 249–260. |
| [13] | Uygun BE, Soto-Gutierrez A, Yagi H, et al. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix.Nat Med, 2010, 16(7): 814–820.DOI: 10.1038/nm.2170 |
| [14] | Petersen TH, Calle EA, Zhao LP, et al. Tissue-engineered lungs for in vivo implantation.Science, 2010, 329(5991): 538–541.DOI: 10.1126/science.1189345 |
| [15] | Nakayama KH, Batchelder CA, Lee CI, et al. Decellularized rhesus monkey kidney as a three-dimensional scaffold for renal tissue engineering.Tissue Eng Part A, 2010, 16(7): 2207–2216.DOI: 10.1089/ten.tea.2009.0602 |
| [16] | Andersen KK, Oliveira CL, Larsen KL, et al. The role of decorated SDS micelles in sub-CMC protein denaturation and association.J Mol Biol, 2009, 391(1): 207–226. |
| [17] | Michaux C, Pouyez J, Wouters J, et al. Protecting role of cosolvents in protein denaturation by SDS: a structural study.BMC Struct Biol, 2008, 8: 29.DOI: 10.1186/1472-6807-8-29 |
| [18] | Poornejad N, Frost TS, Scott DR, et al. Freezing/thawing without cryoprotectant damages native but not decellularized porcine renal tissue.Organogenesis, 2015, 11(1): 30–45.DOI: 10.1080/15476278.2015.1022009 |
| [19] | Crapo PM, Gilbert TW, Badylak SF. An overview of tissue and whole organ decellularization processes.Biomaterials, 2011, 32(12): 3233–3243.DOI: 10.1016/j.biomaterials.2011.01.057 |
| [20] | Frantz C, Stewart KM, Weaver VM. The extracellular matrix at a glance.J Cell Sci, 2010, 123(Pt 24): 4195–4200. |
| [21] | Brown B, Lindberg K, Reing J, et al. The basement membrane component of biologic scaffolds derived from extracellular matrix.Tiss Eng, 2006, 12(3): 519–526. |
| [22] | Zepeda-Orozco D, Wen HM, Hamilton BA, et al. EGF regulation of proximal tubule cell proliferation and VEGF-A secretion.Physiol Rep, 2017, 5(18): e13453.DOI: 10.14814/phy2.13453 |
| [23] | Gonzalez-Rodriguez E, Gaeggeler HP, Rossier BC. IGF-1 vs insulin: respective roles in modulating sodium transport via the PI-3 kinase/Sgk1 pathway in a cortical collecting duct cell line.Kidney Int, 2007, 71(2): 116–125.DOI: 10.1038/sj.ki.5002018 |
| [24] | Salva E, Turan S?, Akbu?a J. Inhibition of Glomerular Mesangial cell proliferation by siPDGF-B- and siPDGFR-β-containing chitosan nanoplexes.AAPS PharmSciTech, 2017, 18(4): 1031–1042.DOI: 10.1208/s12249-016-0687-8 |
| [25] | Batchelder CA, Martinez ML, Tarantal AF. Natural scaffolds for renal differentiation of human embryonic stem cells for kidney tissue engineering.PLoS ONE, 2015, 10(12): e0143849.DOI: 10.1371/journal.pone.0143849 |
