南开大学 药学院 药物化学生物学国家重点实验室,天津 300350
收稿日期:2018-12-06;接收日期:2019-03-08;网络出版时间:2019-03-20
基金项目:国家自然科学基金(Nos. 31501186,31671538),天津市自然科学基金(No. 31872841)资助
摘要:孤雌胚胎干细胞(Parthenogenetic embryonic stem cells,pESCs)的遗传物质全部来源于母源基因组,因缺失父源基因而不具备四倍体补偿的能力。为了使pESCs也具备发育到个体的能力,呈现与受精卵来源ESCs类似的多能性,文中借助CRISPR/Cas9系统对孤雌来源的pESCs中的2个重要母源印迹基因的差异甲基化区域(Differentially methylated region,DMR)进行单等位基因敲除(H19-DMR,IG-DMR),获得双基因敲除的(DKO) pESCs。结果表明,pESCs虽然来源于母源基因组,但是其形态特征、多能干性标记分子的表达水平、体外神经分化能力与受精卵来源的ESCs基本一致。最后,通过基因修饰的DKO pESCs可以通过四倍体补偿获得发育到期的胎儿,表明经过印迹基因修饰的pESCs也具有发育到一个完整个体的多能性。从而为再生医学研究提供了一类具有主要组织相容性复合基因匹配且多能性良好的资源细胞。
关键词:孤雌胚胎干细胞印迹基因基因编辑四倍体补偿
Imprinting genes modified parthenogenetic embryonic stem cells produce full-term mouse via tetraploid complementation
Xu Li, Keli Peng, Jinxin Zhang, Qian Gao, Wenhao Zhang, Ruotong Hua, Ling Shuai
State Key Laboratory of Medicinal Chemical Biology, College of Pharmacy, Nankai University, Tianjin 300350, China
Received: December 6, 2018; Accepted: March 8, 2019; Published: March 20, 2019
Supported by: National Natural Science Foundation of China (Nos. 31501186, 31671538), Natural Science Foundation of Tianjin (No.31872841)
Abstract: Parthenogenetic embryonic stem cells (pESCs) derived from bi-maternal genomes do not have competency of tetraploid complementation, due to lacking of paternal imprinting genes. To make pESCs possess fully development potentials and similar pluripotency to zygote-derived ESCs, we knocked out one allelic gene of the two essential maternal imprinting genes (H19 and IG) in their differentially methylated regions (DMR) via CRISPR/Cas9 system and obtained double knock out (DKO) pESCs. Maternal pESCs had similar morphology, expression levels of pluripotent makers and in vitro neural differentiation potentials to zygotes-derived ESCs. Besides that, DKO pESCs could contribute to full-term fetuses through tetraploid complementation, proving that they held fully development potentials. Derivation of DKO pESCs provided a type of major histocompatibility complex (MHC) matched pluripotent stem cells, which would benefit research in regenerative medicine.
Keywords: parthenogenetic embryonic stem cellsimprinting genesgene editingtetraploid compensation
孤雌胚胎干细胞(Parthenogenetic embryonic stem cells,pESCs)来源于化学激活的未受精卵母细胞发育来的囊胚中的内细胞团(Inner cell mass,ICM),所以两套基因组均来源于母本。在之前的报道中,pESCs已经在小鼠[1]、兔[2]、灵长类[3]等物种中建立,这些pESCs具备了一定的多能性,可以体外分化为多种体细胞,同时小鼠pESCs也可以贡献到嵌合动物的各种组织和器官中。此外,pESCs的基因组来源于卵母细胞,所以与卵供体具有很好的组织相容性,经移植后不会产生免疫排斥[4],因此,pESCs也是一类进行细胞替代疗法理想的资源细胞。在之前的报道中,pESCs已经应用于包括帕金森综合征[5]、心脏损伤修复[6]和肝脏再生[7]等小鼠动物模型的研究中。所以提高pESCs的多能性对于未来将其更好地应用于临床治疗中有重要意义。
基因组印迹在哺乳动物发育中起到关键作用,当胚胎缺失父源或母源任意一方基因印迹时都将无法发育到期[8]。小鼠的孤雌胚胎由于缺失父源印迹基因最多只能发育到胚胎发育的13.5 d (E13.5)[9]。pESCs由于缺失了父源基因印迹,使得印迹基因表达呈双母源状态,导致其无法像正常的受精卵来源的ESCs一样具有四倍体补偿的能力。此外,印迹基因的表达水平与DNA甲基化的程度也同样会影响pESCs的多能性[10]。为了提高pESCs的多能性,研究者们进行了许多尝试。Hikichi等通过将pESCs细胞核移植到去核卵母细胞的方式改变其DNA的甲基化状态[11],并且最终通过多次连续核移植的方式获得了发育到期的胎儿[12]。H19是位于小鼠7号染色体上的一个母源表达的基因,编码长非编码RNA (Long non-coding RNA,LncRNA),在胚胎发育中起到重要作用[13],其表达由一段基因内部的差异甲基化区域(H19 differentially methylated region,H19-DMR)控制,当敲低H19后,pESCs的多能性将得到显著提高[14]。此外,Kono等将敲除H19-DMR的未成熟卵母细胞核注入正常的卵母细胞,此重构孤雌胚胎经激活可以发育到成年[15]。此外,小鼠12号染色体上有一簇重要的印迹基因群,由位于Dlk1-Gtl2间的差异甲基化区(Intergenic region differentially methylated region,IG-DMR)控制多个印迹基因的表达,该印迹基因群对于胚胎的发育也起到重要作用[16]。在之前的报道中,Kono等同时敲除H19-DMR与IG-DMR的一个等位基因并获得重构胚胎,大幅度提高了孤雌胚胎发育到期的效率[17]。之后,Li等通过将H19-DMR与IG-DMR敲除的孤雌单倍体胚胎干细胞注入卵母细胞获得重构胚胎,也可以大幅度提高孤雌胚胎的发育效率[18]。之前的报道证实,敲除H19-DMR与IG-DMR的一个等位基因并通过半克隆的方式可以提高孤雌胚胎的效率。因此推测将H19-DMR与IG-DMR的一个等位基因敲除也可以大幅度提高pESCs的多能性,而四倍体补偿正是验证干细胞多能性的金标准。文中首次通过敲除pESCs中的H19-DMR与IG-DMR的单等位基因,提高了pESCs的发育潜能,通过四倍体补偿的方式获得了发育到期的小鼠。具备四倍体补偿能力即可证明pESCs可以分化到个体的任一类型细胞,为将来pESCs的应用奠定理论基础。
1 材料与方法1.1 材料实验所需小鼠购自北京维通利华公司,饲养于SPF标准鼠房。所使用细胞培养基DMEM/F12、N2、B27、胰酶、限制性内切酶等均购自Thermo公司。定量PCR试剂购自Roche公司。所使用抗体均购自Abcam公司。引物合成及测序由北京奥科鼎盛生物科技公司完成。
1.2 方法1.2.1 孤雌胚胎干细胞建系在取卵前两天对每只129Sv/Jae谱系的雌鼠进行腹腔注射5–10 U的PMSG激素,48 h后注射5–10 U的HCG激素。注射HCG 14–16 h后。处死雌鼠,划开输卵管膨大部取卵,再将卵母细胞置于50 μL的操作液中(CZB-HEPES)清洗3次,之后在50 μL KSOM (石蜡油覆盖)培养液中,置于37 ℃、5% CO2培养箱中培养30 min,再在含有细胞松弛素和SrCl2的激活液中培养6 h左右,清洗干净后的胚胎在KSOM中继续培养至囊胚。将囊胚置于含R1+2i培养液及饲养层细胞的4孔板中,静置培养3–4 d,可见内细胞团孵出并在饲养层上呈克隆样,每天换液,待克隆长大后,挑克隆消化传代。
1.2.2 细胞培养与转染小鼠胚胎干细胞系ESCs、pESCs、H19-DMR+/- pESCs、DKO-pESCs培养于R1+2i培养液中。R1+2i培养液成分为DMEM/F12 (Gibco)、15%胎牛血清(BI)、1%的NEAA (Millipore)、1 U/mL白血病抑制因子(lif) (Millipore)、40 mmol/L PD0325901、120 mmol/L CHIR99021 (MCE)。每两天用胰酶(Gibco)传一次代,培养于37 ℃、5% CO2培养箱中。为了获得H19-DMR+/- pESCs、DKO-pESCs,大约1×106细胞进行转染,共使用8 μg质粒,sgRNA-cas9:同源重组供体质粒为1:1,根据试剂盒说明书使用Lipofectamine LTX kit (Invitrogen)进行转染,6–8 h换液,36 h分选GFP阳性细胞(Cas9阳性)。分选后的细胞使用G418 (250 μg/mL)筛选7 d获得H19-DMR+/– pESCs,或使用嘌呤霉素(Puromycin) (1 μg/mL)进行抗性筛选3 d获得DKO pESCs。对挑取的亚克隆进行基因型鉴定,各引物序列见表 3。
表 1 sgRNAs序列Table 1 Sequence of sgRNA
| Primer name | Primer sequence (5'–3') |
| H19 DMR sGRNA1 | TGCACGTGCAACCAGTTCGA |
| H19-DMR sGRNA2 | GGCATCCACCATGAGCCGGT |
| H19-DMR sGRNA3 | GTTCGATGGCCTCCCACCCC |
| H19-DMR sGRNA4 | CTACCCGTGGGCGAGGCTCT |
| IG-DMR sGRNA1 | TACGGCAACCAACGCTATAG |
| IG-DMR sGRNA2 | AGGAGAAACCACTATAGCGT |
| IG-DMR sGRNA3 | ACACACGGTCCGTTACAGCC |
| IG-DMR sGRNA4 | TGCTGCACATCCGGTGTACC |
表选项
表 2 qPCR及DNA甲基化引物序列Table 2 Primers for qPCR and detection of DNA methylation
| Primer name | Primer sequence (5'–3') |
| Gapdh F | TCTTCCTGGTCCCCACAGTTT |
| Gapdh R | GCAAGAATAGTTCTCGGGATGAA |
| Oct4 F | GGATGGCATACTGTGGACCTC |
| Oct4 R | TTTCATGTCCTGGGACTCCTCG |
| Nanog F | CCAGGGCTATCTGGTGAACG |
| Nanog R | CCCGAAGTTATGGAGCGGAG |
| H19 F | GAACAGAAGCATTCTAGGCTGG |
| H19 R | TTCTAAGTGAATTACGGTGGGTG |
| H19-DMR BS F1 | TGTAAGGAGATTATGTTTTATTTTTGG |
| H19-DMR BS R1 | CCCTAACCTCATAAAACCCATAACTAT |
| H19-DMR BS F2 | TATGAGTATTTAGGAGGTATAAGAATT |
| H19-DMR BS R2 | TTTTATCAAAAACTAACATAAACCCCT |
| Snrpn BS F1 | AATTTGTGTGATGTTTGTAATTATTTGG |
| Snrpn BS R1 | ATAAAAATACACTTTCACTACTACTAAAAT |
| Snrpn BS F2 | TATGTAATATGATATAGTTTAGAAATTAGT |
| Snrpn BS R2 | AATAAACCCAAATCTAAAATATTTTAATCA |
表选项
表 3 基因鉴定引物序列Table 3 Primers for genotype
| Primer name | Primer sequence (5'–3') |
| H19 F1 | CTCCTTCCCTGCACAGTATTGG |
| H19 R1 | TCTCATGCTGGAGTTCTTCGCC |
| H19 F2 | CTTCTGGAATAGCTCAGAGGCAGAG |
| H19 R2 | GGAGTCTTCTGGATAGGCCAAG |
| H19 F3 | GAGGGGTTTGGGTGTGTGAG |
| H19 R3 | CTCCTCAAGCCACTCCTGTG |
| IG F1 | ATTCAAGTTTCCGCCCACTGC |
| IG R1 | CTTTCCACACCCTAACTGACACA |
| IG F2 | CCGCAACCTCCCCTTCTAC |
| IG R2 | AGAAGATGATGGGGGAGGCA |
| IG F3 | CTGGGTGGTAGTACACGGAC |
| IG R3 | CCTGAATCTGTGCCACGGTAA |
| D1Mit46F | AGTCAGTCAGGGCTACATGATG |
| D1Mit46R | CACGGGTGCTCTATTTGGAA |
| D14Mit5F | CACATGAACAGAGGGGCAG |
| D14Mit5R | GTCATGAAGTGCCCACCTTT |
| D2Mit102F | TATTTCCCTGTCACTCCTCCC |
| D2Mit102R | TGTCTTTATGCTCAGACATACACA |
表选项
1.2.3 免疫荧光染色待细胞长出克隆后,用4%多聚甲醛室温固定10 min,PBS清洗3次,加入0.3% Triton X-100对细胞进行处理(30 min),之后进行3次PBS清洗,再加入含3% BSA的PBS进行封闭,室温处理1 h,加入一抗(1:200) 4 ℃过夜,之后PBS清洗3次,加入二抗(1:200),室温1 h,PBS清洗3次,加入DAPI (1:200),室温孵育10–15 min,PBS清洗后,加防荧光淬灭剂封片。使用激光共聚焦显微镜收集图片。文中所用一抗均购自Abcam公司,二抗购自天津三箭生物有限公司。
1.2.4 质粒构建在MIT CRISPR Design网站上设计基因编辑sgRNAs,sgRNAs单链DNA片段合成后,加磷退火成双链,连入BbsⅠ线性化的PX461 (AddGene)质粒中,测序后进行大提。为了构建同源重组质粒,首先通过PCR的方式获得同源臂DNA片段与抗性片段,之后一步步连接入pEasy-Blunt Simple Vector (TransGene)中,经测序验证成功后大提,准备转染。sgRNA序列见表 1。
1.2.5 定量PCR按照试剂使用说明用Trizol提取细胞中的总RNA。之后取1 μg RNA用cDNA反转录试剂盒(TaKaRa)进行反转录,稀释10倍后进行定量PCR。定量PCR试剂盒购自Roche公司。反应条件为:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 60 s,共40个循环。以GAPDH作为内参,使用定量PCR仪(Thermo)收集数据,以2–ΔΔCt法来表示实验组和对照组中目的基因的表达倍数比。各引物序列见表 2。
1.2.6 亚硫酸氰盐DNA甲基化测序提取细胞基因组,按照亚硫酸氰盐DNA甲基化试剂盒(Qiagen)说明进行DNA的亚硫酸氰盐修饰,回收修饰过后的DNA,进行巢式PCR扩增目的片段,PCR产物连接入pEASY-Blunt Simple Vector中,挑细菌单克隆送测序。获得测序结果后将数据导入http://quma.cdb.riken.jp/进行分析,引物见表 2。
1.2.7 四倍体补偿取见栓第2天的雌鼠输卵管冲出2细胞胚胎,之后将2细胞置于融合液中清洗3次,融合液为0.3 mol/L甘露醇、0.1 mmol/L MgSO4、3 mg/mL BSA和0.1 mg/mL PVA。最后转移至融合槽两极间进行融合。融合后的胚胎继续采用KSOM进行培养,1 h后观察,去除未融合的胚胎。继续培养胚胎至4细胞胚胎,此时注入8–10个胚胎干细胞于卵周隙中。重构胚胎在KSOM培养液中平衡30 min后移植到ICR假孕雌鼠的输卵管中。
2 结果与分析2.1 pESCs的获得为了获得pESCs,对雌鼠进行了超排取卵,经SrCl2激活,经细胞松弛素B (CB)处理后,获得孤雌二倍体胚胎。孤雌二倍体胚胎可以正常发育至囊胚(图 1A),孤雌囊胚形态良好,可以清晰观察到囊胚腔、内细胞团(ICM)、滋养层外胚层细胞(TE)结构(图 1B)。将状态良好的囊胚种植于R1+2i的培养液中,内细胞团孵出,经扩增传代后,可见穹窿状的pESCs克隆(图 1C)。进一步检测了印迹基因H19-DMR和Snrpn在pESCs基因组中的甲基化状态。经检测H19-DMR在ESCs基因组中的甲基化为58.8%,在pESCs基因组中的甲基化水平为8.1% (图 1D),符合父源印迹基因H19-DMR在pESCs中呈现出的低甲基化状态。而Snrpn在ESCs基因组中甲基化水平为32.5%,在pESCs基因组中甲基化水平为86.9% (图 1E),结果也符合母源印迹基因Snrpn在pESCs中呈现出的高甲基化状态。通过以上实验,成功建立了pES细胞系。
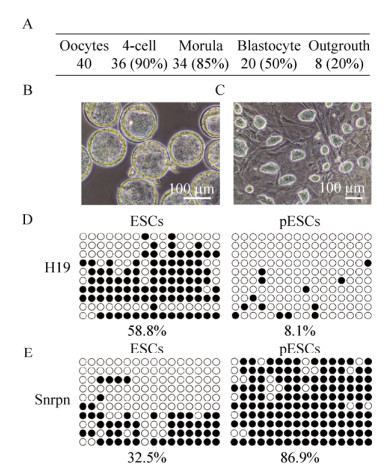 |
| 图 1 通过化学激活卵母细胞获得pESCs并进行相关印迹基因的DNA甲基化检测 Fig. 1 Derivation of pESCs from chemically activated oocytes and detection of relate imprinting genes DNA methylation in pESCs. (A) Development of parthenogenetic embryos. (B) Parthenogenetic blastocysts in bright field (BF). (C) Established parthenogenetic embryonic stem cell lines in BF. (D) Schematic of H19-DMR DNA methylation by bisulfite analysis. (E) Schematic of Snrpn DNA methylation by bisulfite analysis. |
| 图选项 |
2.2 pESCs多能性鉴定为确定pESCs的多能性,对pESCs进行碱性磷酸酶染色,结果显示pESCs具有较强的碱性磷酸酶活性(图 2A)。进一步鉴定其多能性,免疫荧光染色结果证明,pESCs表达Oct4与SSEA1两种胚胎干细胞的标志基因(图 2B)。同时针对RNA水平也进行检测,通过定量PCR结果显示,pESCs在Oct4、Nanog和Rex1这3个胚胎干细胞的标志基因的表达与受精卵来源的ESCs无显著差异。同时pESCs也有良好的神经分化能力。pESCs来源的神经干细胞形态良好(图 2D),表达神经干细胞的标志基因(图 2E)。以上结果证明pESCs具备良好的多能性。
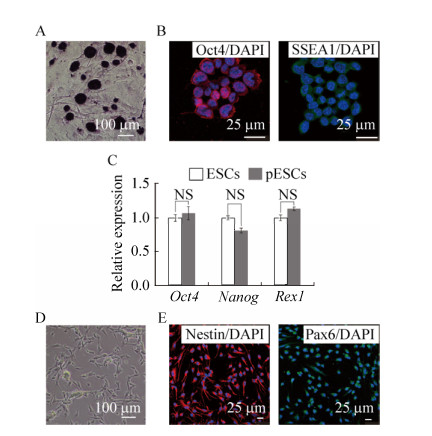 |
| 图 2 pESCs多能性鉴定 Fig. 2 Identify the pluripotency of pESCs. (A) The AP stain of pES cells. (B) Immunofluorescence for SSEA1 and OCT4 in undifferentiated pES cells. (C) qPCR analysis the expression of the pluripotency marker gene (Oct4, Nanog, Rex1). (D) The NSCs differentiated from pES cells. (E) Immunofluorescence for Nestin and Pax6 in NSC derived from pES cells. |
| 图选项 |
2.3 获得H19-DMR+/– pESC与DKO pESCs虽然pESCs在体外分化方面展现了一定的多能性,但是由于缺失父源基因组而导致其不具备发育成一个完整个体的能力。而有文献报道通过修饰父源印迹基因可以提高重构孤雌胚胎的发育能力[15]。因此尝试通过基因编辑技术修饰父源印迹H19-DMR与IG-DMR提高pESCs的多能性。为了通过CRISPR/Cas9敲除H19-DMR,设计敲除方案如图 3A所示。将sgRNA-Cas9 (Cas9携带GFP标记)质粒与供体质粒,共转染到pESCs中,之后分选GFP阳性细胞(图 3B)。将分选回的细胞进行G418抗性筛选7 d,获得抗性细胞(图 3C)。将抗性pESCs亚克隆传代后进行基因型鉴定,测序结果显示为杂合子(图 3D),并命名为H19-DMR+/-pESCs。为进一步提高pESCs的发育潜能,在H19-DMR+/- pESCs进一步敲除IG-DMR。质粒设计图如图 3E所示。经过流式分选与嘌呤霉素抗性筛选后,对抗性亚克隆进行基因型鉴定,测序结果证明,IG-DMR的单等位基因也被敲除(图 3E),获得的细胞系命名为DKO-pESCs。
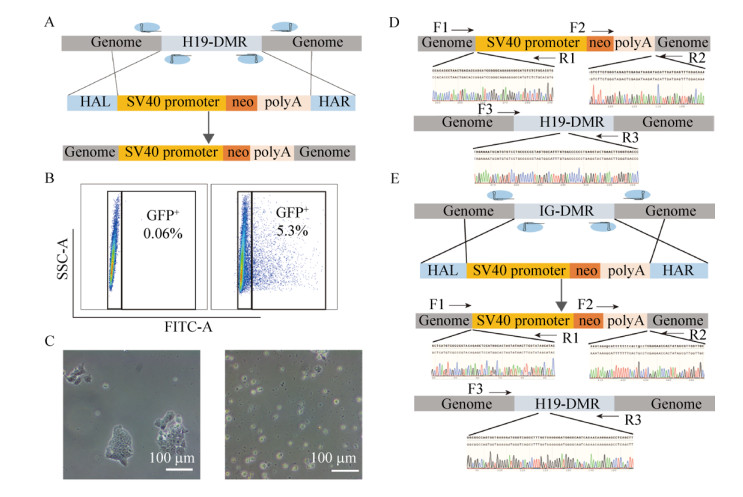 |
| 图 3 通过CRISPR/Cas9介导的同源重组获得H19-DMR+/-与DKO pESCs Fig. 3 Derivation of H19-DMR+/- and DKO pESCs through homologous recombination mediated by CRISPR/Cas9. (A) Schematic overview of H19-DMR knockout. (B) Flow cytometry sorting of eGFP positive cells from transfected pESCs. eGFP positive indicates expression of Cas9. (C) G418 resistant results after 7 days. Right panel is the cells with transfection, left without transfection. (D) DNA sequencing of H19-DMR subclones genotype. The F1/R1, F2/R2 and F3/R3 indicate the sites of the H19-DMR genotype primers. (E) Schematic overview of IG-DMR knockout and DNA sequencing of IG-DMR subclones genotype. The F1/R1, F2/R2 and F3/R3 indicate the sites of the IG-DMR knockout genotype primers. |
| 图选项 |
2.4 DKO pESCs四倍体补偿获得小鼠鉴定获得DKO pESCs后,首先检测了H19-DMR与IG-DMR相关基因的表达,结果表明,父源印迹基因H19与Meg3的表达量显著下降,母源印迹基因Igf2与Dlk1的表达量上升。为了进一步分析基因编辑后的pESCs的多能性,对其进行了四倍体补偿实验。结果显示仅敲除H19-DMR无法获得四倍体补偿动物,但是DKO-pESCs却可以获得四倍体补偿动物,尽管效率极低(0.29%) (图 4B)。所获得四倍体补偿小鼠虽然个体完整,但是出生后即死亡,而且与对照组同一天出生的野生型小鼠对比可以发现,小鼠个体偏小,嘴巴张大,舌头微微外吐(图 4C)。为确定由四倍体补偿获得的小鼠是否来源于DKO-pESCs,分别进行了SSLP鉴定与基因型鉴定(图 4D–E)。结果显示,该小鼠确实为129 DKO-pESCs来源。以上数据说明,在pESCs中同时敲除H19-DMR和IG-DMR的单等位基因可以使pESCs具备四倍体补偿能力。
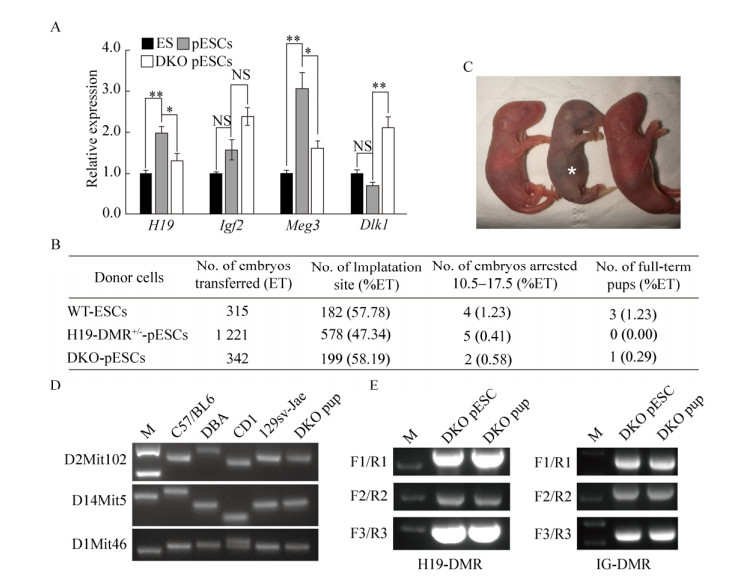 |
| 图 4 四倍体补偿获得DKO pESCs来源的小鼠胎儿 Fig. 4 Derivation of pup from DKO pESCs through tetraploid complementation. (A) qPCR analysis the expression of H19-DMR and IG-DMR related genes (H19, Igf2, Meg3 and Dlk1), t test, *P < 0.05, **P < 0.01. Data are represented as mean x±s. (B) The statistics of development efficiency. (C) The newborn pups. The star indicate the DKO pup from tetraploid complementation. The other two is the normal WT pups as the control. (D) Microsatellite analysis shows the alleles of DKO pup is identical to those of DKO pESC but completely different from the tetraploid blastocysts CD1 and others. (E) Genotype the DKO pup through tetraploid complementation. |
| 图选项 |
3 讨论多能性干细胞既可以自我更新又可以分化为多种体细胞类型,所以是未来细胞替代治疗疗法的重要来源细胞之一。由于免疫排斥作用,可以被应用于临床的多能干细胞只能是来源于病人自身的细胞。目前由于诱导多能干细胞的安全性尚在评估,核移植胚胎干细胞又存在着操作复杂的问题,因此相对安全又容易获得的pESCs是未来替代疗法的重要细胞资源之一。另外,pESCs仅具备卵母细胞基因组,所以可与卵供体MHC匹配[4]。pESCs可以通过囊胚嵌合实验贡献到各种组织器官中。此外pESCs也可以在体外分化为各种体细胞类型,包括神经干细胞、心肌细胞等多种细胞类型,并应用到疾病模型动物的治疗研究中[5-7]。之前的研究表明,孤雌胚胎最多可以发育至E13.5[9],此外,来源于孤雌囊胚的pESCs的多能性也比ESCs要差一些[19]。印迹基因在胚胎发育过程中起到重要作用,根据Yang等的报道,孤雄单倍体胚胎干细胞(Androgenetic haploid ESCs,AG-hESCs)具备类似精子的能力,可以通过半克隆的方式获得动物,敲除H19-DMR、IG-DMR后注射到卵母细胞中可以大幅度提高半克隆效率[20],而将敲除H19-DMR、IG-DMR的孤雌单倍体胚胎干细胞(Parthenogenetic haploid embryonic stem cells,phESCs)注射到卵母细胞中也可以大幅度提高孤雌小鼠的发育率[18]。因此,为进一步提高pESCs的多能性,文中首次对pESCs中的父源印迹基因进行了编辑。结果表明,当印迹基因H19-DMR、IG-DMR的单等位基因被敲除后,pESCs来源的小鼠可以发育到期。pESCs通过四倍体补偿的小鼠可以观察到小鼠个体偏小、舌头外吐,我们推测主要原因是仅仅敲除两个母源表达印迹基因的单等位基因可能并不足以使得pESCs具备使四倍体补偿动物发育到健康个体的能力。由于在pESCs中仍然有许多重要的印迹基因在发育进程中起到关键作用,Li等报道[21],在编辑H19-DMR和IG-DMR的基础上又编辑了Rasgrf1不仅可以提高获得孤雌小鼠的效率还获得了行为正常的成体的孤雌小鼠,因此可能需要编辑更多的关键印迹基因才能使pESCs进一步提高获得四倍体补偿动物的效率,并最终获得正常的孤雌成体动物。为了更好地研究印迹基因在个体发育中的作用和进一步提高pESCs的发育潜能,可以结合印迹基因编辑的孤雌/孤雄单倍体细胞与四倍体补偿实验,获得健康的孤雌或孤雄小鼠,并发现更多相关的关键印迹基因,再针对这些印迹基因在pESCs上进行修饰,进一步提高pESCs的多能性,获得健康的孤雌动物,拓展pESCs的应用。
参考文献
| [1] | Kaufman MH, Robertson EJ, Handyside AH, et al. Establishment of pluripotential cell lines from haploid mouse embryos.J Embryol Exp Morphol, 1983, 73: 249–261. |
| [2] | Fang ZF, Gai H, Huang YZ, et al. Rabbit embryonic stem cell lines derived from fertilized, parthenogenetic or somatic cell nuclear transfer embryos.Exp Cell Res, 2006, 312(18): 3669–3682.DOI: 10.1016/j.yexcr.2006.08.013 |
| [3] | Cibelli JB, Grant KA, Chapman KB, et al. Parthenogenetic stem cells in nonhuman primates.Science, 2002, 295(5556): 819.DOI: 10.1126/science.1065637 |
| [4] | Kim K, Lerou P, Yabuuchi A, et al. Histocompatible embryonic stem cells by parthenogenesis.Science, 2007, 315(5811): 482–486.DOI: 10.1126/science.1133542 |
| [5] | Sanchez-Pernaute R, Lee H, Patterson M, et al. Parthenogenetic dopamine neurons from primate embryonic stem cells restore function in experimental Parkinson's disease.Brain, 2008, 131: 2127–2139.DOI: 10.1093/brain/awn144 |
| [6] | Didié M, Christalla P, Rubart M, et al. Parthenogenetic stem cells for tissue-engineered heart repair.J Clin Invest, 2013, 123(3): 1285–1298.DOI: 10.1172/JCI66854 |
| [7] | Espejel S, Eckardt S, Harbell J, et al. Brief report: Parthenogenetic embryonic stem cells are an effective cell source for therapeutic liver repopulation.Stem Cells, 2014, 32(7): 1983–1988.DOI: 10.1002/stem.1726 |
| [8] | Platonov ES. Genomic imprinting and problem of parthenogenesis in mammals.Ontogenez, 2005, 36(4): 300–309. |
| [9] | Kono T, Obata Y, Yoshimzu T, et al. Epigenetic modifications during oocyte growth correlates with extended parthenogenetic development in the mouse.Nat Genet, 1996, 13(1): 91–94.DOI: 10.1038/ng0596-91 |
| [10] | Li C, Chen ZS, Liu Z, et al. Correlation of expression and methylation of imprinted genes with pluripotency of parthenogenetic embryonic stem cells.Hum Mol Genet, 2009, 18(12): 2177–2187.DOI: 10.1093/hmg/ddp150 |
| [11] | Hikichi T, Kohda T, Wakayama S, et al. Nuclear transfer alters the DNA methylation status of specific genes in fertilized and parthenogenetically activated mouse embryonic stem cells.Stem Cells, 2008, 26(3): 783–788.DOI: 10.1634/stemcells.2007-0907 |
| [12] | Hikichi T, Ohta H, Wakayama S, et al. Functional full-term placentas formed from parthenogenetic embryos using serial nuclear transfer.Development, 2010, 137(17): 2841–2847.DOI: 10.1242/dev.051375 |
| [13] | Bartolomei MS, Zemel S, Tilghman SM. Parental imprinting of the mouse H19 gene.Nature, 1991, 351(6322): 153–155.DOI: 10.1038/351153a0 |
| [14] | Ragina NP, Schlosser K, Knott JG, et al. Downregulation of H19 improves the differentiation potential of mouse parthenogenetic embryonic stem cells.Stem Cells Dev, 2012, 21(7): 1134–1144.DOI: 10.1089/scd.2011.0152 |
| [15] | Kono T, Obata Y, Wu Q, et al. Birth of parthenogenetic mice that can develop to adulthood.Nature, 2004, 428(6985): 860–864.DOI: 10.1038/nature02402 |
| [16] | Lin SP, Youngson N, Takada S, et al. Asymmetric regulation of imprinting on the maternal and paternal chromosomes at the Dlk1-Gtl2 imprinted cluster on mouse chromosome 12.Nat Genet, 2003, 35(1): 97–102.DOI: 10.1038/ng1233 |
| [17] | Kawahara M, Wu Q, Takahashi N, et al. High-frequency generation of viable mice from engineered bi-maternal embryos.Nat Biotechnol, 2007, 25(9): 1045–1050.DOI: 10.1038/nbt1331 |
| [18] | Li ZK, Wan HF, Feng GH, et al. Birth of fertile bimaternal offspring following intracytoplasmic injection of parthenogenetic haploid embryonic stem cells.Cell Res, 2015, 26(1): 135–138. |
| [19] | Thomson JA, Solter D. The developmental fate of androgenetic, parthenogenetic, and gynogenetic cells in chimeric gastrulating mouse embryos.Genes Dev, 1988, 2(10): 1344–1351.DOI: 10.1101/gad.2.10.1344 |
| [20] | Yang H, Shi L, Wang BA, et al. Generation of genetically modified mice by oocyte injection of androgenetic haploid embryonic stem cells.Cell, 2012, 149(3): 605–617.DOI: 10.1016/j.cell.2012.04.002 |
| [21] | Li ZK, Wang LY, Wang LB, et al. Generation of bimaternal and bipaternal mice from hypomethylated haploid ESCs with imprinting region deletions.Cell Stem Cell, 2018, 23(5): 665–676.e4.DOI: 10.1016/j.stem.2018.09.004 |
