
 , 邓锴1
, 邓锴1

1. 湖北医药学院附属人民医院 生殖医学中心,湖北 十堰 442000;
2. 湖北医药学院 基础医学院,湖北 十堰 442000
收稿日期:2018-12-06;接收日期:2019-02-18
基金项目:国家自然科学基金(No.81401200), 湖北省自然科学基金(Nos.2018CFB219, 2013CFB479), 湖北省教育厅科学技术研究项目(Nos.B2015478, B2015493)资助
摘要:PLCζ是PLC家族的一种新型同工酶,在哺乳动物卵母细胞激活中起着极其重要的作用。近年来,体外大量表达和纯化有活性的PLCζ蛋白用于结构生物学研究一直未能获得成功。本研究首次在杆状病毒表达系统中表达和纯化重组人PLCζ蛋白,首先将人PLCζ基因克隆至pFastBac-HTA质粒构建重组载体,转化DH10Bac发生位点特异性转座,经抗性和蓝白斑筛选,获得重组穿梭质粒Bacmid-PLCζ;在脂质体介导下将穿梭质粒转染Sf9昆虫细胞产生重组病毒,扩增病毒感染Sf9昆虫细胞进行蛋白表达;利用Ni2+亲和柱及分子筛来纯化蛋白,并通过考马斯亮蓝染色、Western blotting及飞行时间质谱对蛋白进行鉴定,并进行酶活性测定。结果显示重组蛋白在Sf9昆虫细胞感染杆状病毒后72 h达到峰值并以分泌形式表达在细胞培养基中,Ni2+亲和柱及分子筛纯化后的重组蛋白经Western blotting及电离飞行时间质谱鉴定为PLCζ蛋白,酶活性可达326.8 U/mL。该实验结果为重组人PLCζ蛋白大规模生产和生物医学应用研究提供了可参考利用的技术。
关键词:PLCζ蛋白昆虫细胞杆状病毒表达系统表达纯化鉴定
Expression, purification and characterization of recombinant PLCζ protein in baculovirus-insect cell expression system
Xin Chen1, Yueyue Hu1, Hongyi Xu1, Xiaoyan Wang2

 , Kai Deng1
, Kai Deng1

1. Reproductive Medicine Center, Renmin Hospital, Hubei University of Medicine, Shiyan 442000, Hubei, China;
2. School of Basic Medical Sciences, Hubei University of Medicine, Shiyan 442000, Hubei, China
Received: December 6, 2018; Accepted: February 18, 2019
Supported by: National Natural Science Foundation of China (No.81401200), Natural Science Foundation of Hubei Province of China (Nos.2018CFB219, 2013CFB479), Research Project of Hubei Provincial Department of Education (Nos.B2015478, B2015493)
Corresponding author: Xiaoyan Wang. Tel: +86-719-8875302; E-mail: xywangdk@163.com;
Kai Deng. Tel: +86-719-8637123; E-mail: dkeanig@163.com.
Abstract: PLCζ is a new isoenzyme of the PLC family which plays an important role in activating mammalian oocytes. In recent years, large-scale expression and purification of active PLCζ protein in vitro for structural biology research has not been successful. In this study, the recombinant human PLCζ protein was expressed and purified in the baculovirus expression system. First, the full length of human PLCζ gene was cloned into the pFastBac-HTA plasmid to form the recombinant donor plasmid that was further transformed into DH10Bac Escherichia coli cells to construct the recombined bacmid by the site-specific transposition that was screened by resistance and blue-white spots. Then the bacmid was transfected to Sf9 insect cells via cellfectin to package the recombinant baculovirus. After the amplification of the recombinant baculovirous, the recombinant protein was expressed from the cells transduced by the recombinant baculovirus and was purified by Ni-NTA resin. Purified protein was identified by Western blotting and time-of-flight mass spectrometry and the enzyme activity was determined. The results showed that the recombinant PLCζ protein in the Sf9 cells was achieved at 72 hours after baculovirus infection and expressed in secreted form in cell culture medium. The recombinant protein purified by Ni2+ affinity column was identified as PLCζ by Western blotting and ionization time-of-flight mass spectrometry and the enzyme activity was up to 326.8 U/mL. The experimental results provide a reference for the large-scale production and biological application of recombinant human PLCζ protein.
Keywords: PLCζ proteininsect cellbaculovirus expression systemexpressionpurificationidentification
磷脂酶C-zeta (Phospholipase C-zeta,PLCζ)是磷脂酶C家族的一种新型同工酶,是哺乳动物精子激活卵母细胞重要的生理性刺激因子[1]。在哺乳动物受精过程中,PLCζ蛋白作为“精子因子”被释放入卵母细胞中,水解磷脂酰肌醇-4, 5-二磷酸脂(Phosphatidylinositol 4, 5-bisphosphate,PIP2)产生第二信使1, 4, 5-三磷酸肌醇(Inositol-1, 4, 5- triphosphate,IP3),诱导卵母细胞内Ca2+周期性增加,从而使处于停滞期的卵母细胞恢复第二次减数分裂并启动胚胎发育[2-3]。精子中PLCζ蛋白水平降低或缺失与卵母细胞激活缺陷型男性不育密切相关,人工辅助卵母细胞激活是解决此类男性不育的重要方法[4-5]。目前常用的人工辅助卵母细胞激活方法是机械刺激及化学激活,考虑到这些外界操作影响卵母细胞质量以及化学物质对胚胎的潜在危害,人工辅助卵母细胞激活技术未能广泛开展[6-7]。PLCζ蛋白在辅助卵母细胞激活中有着较大的应用潜能,使用纯化的具有活性的重组人PLCζ蛋白可能是一种更安全有效的治疗卵母细胞激活缺陷型男性不育症的潜在方法[8-10]。
体外表达和纯化有活性的重组人PLCζ蛋白用以生物学应用的研究一直备受关注,国内外****对重组人PLCζ蛋白的体外表达进行了广泛的探索,Nomikos等尝试用含组氨酸标签的质粒载体通过大肠杆菌原核表达系统纯化重组蛋白,发现原核系统表达量极低,将这些蛋白显微注射到小鼠卵母细胞中时不能引起细胞内Ca2+振荡启动胚胎发育[11]。与大肠杆菌等原核表达系统相比,杆状病毒表达系统在增加重组蛋白的可溶性、蛋白质翻译后加工修饰方面具有天然优势,能更好地保持蛋白的生物活性[12]。为了大量表达和纯化出有活性的重组人PLCζ蛋白,进一步探索精卵融合时其蛋白与受体之间相互作用以及其作为辅助卵母细胞激活生物制剂的可行性,本研究从质粒构建开始,利用昆虫杆状病毒表达系统成功地表达并纯化出有活性的重组人PLCζ蛋白,为接下来对PLCζ蛋白质的结构-功能关系及PLCζ生物医学应用研究奠定基础。
1 材料与方法1.1 主要实验材料草地贪夜蛾Spodoptera frugiperda Sf9昆虫细胞、杆状病毒Bac-to-Bac表达系统(重组杆状病毒转移载体pFastBac HTA、DH10Bac感受态大肠杆菌、Cellfectin Ⅱ试剂)、SF-900Ⅱ SFM培养基、Grace’s Insect Medium、ECL显色试剂盒等购自Invitrogen公司;Taq DNA高保真聚合酶、限制性内切酶NcoⅠ、HindⅢ等购自宝生物工程(大连)有限公司;对硝基磷酸胆碱(p-nitrophehylphosphoryl choline,p-NPPC)、十二烷基硫酸钠(SDS)、考马斯亮蓝R-250、甲基纤维素等购自Sigma公司;His GraviTrap亲和层析柱购自GE Healthcare公司;兔源抗人PLCζ蛋白单克隆抗体和HRP标记的山羊抗兔IgG抗体均购自Abcam公司;PureLink HiPure Plasmid Miniprep kit购自QIAGEN公司;其他试剂均为国产分析纯级。
1.2 引物的设计与转移载体构建检索GenBank数据库获取人PLCζ基因(登录号:NM_033123)的mRNA序列,由南京金斯瑞生物科技有限公司合成;合成的全长人PLCζ编码基因为1 841bp,其中5′端插入NcoⅠ酶切位点,3′端插入HindⅢ酶切位点。将合成的PLCζ目的片段克隆至经NcoⅠ、HindⅢ双酶切后的pFastBac HTA载体中,构建重组转移质粒pFastBac-PLCζ。PLCζ特异性引物参照Primer Premier 5扩增全长设计,引物由南京金斯瑞生物科技有限公司合成,引物序列见表 1。
表 1 载体构建及鉴定所用的引物Table 1 Primers used in vector construction and identification
| Primer name | Primer sequence (5′–3′) | Size (bp) |
| PLCζ-for | ATGGAAATGAGATGGTTTTTGTC | 23 |
| PLCζ-rev | TTATCTGACGTACCAAACATAAAC | 24 |
表选项
1.3 重组杆状病毒穿梭载体的制备按照Invitrogen公司的Bac-to-Bac Baculovirus Expression System使用说明将pFastBac-PLCζ构建体转化DH10Bac感受态大肠杆菌细胞,用未插入外源基因的pFastBac HTA质粒转化DH10Bac感受态细胞作为阴性对照[13]。取50 μL菌液涂布含有50 μg/mL卡那霉素、10 μg/mL四环素、7 μg/mL庆大霉素、100 μg/mL X-gal和40 μg/mL IPTG的LB琼脂平板,置于37 ℃培养箱内培养,48 h后进行蓝白斑筛选。随机挑取白色单克隆菌落接种于LB液体培养基37 ℃过夜培养。使用PureLink Hipure Plasmid Miniprep kit提取重组杆粒并用PLCζ特异性引物进行PCR扩增,PCR产物用1%琼脂糖凝胶电泳检测,鉴定正确的重组杆粒命名为Bacmid-PLCζ。
1.4 重组杆状病毒的制备与鉴定按照Invitrogen公司的CellfectinⅡ阳离子脂质体转染试剂操作说明转染对数生长期Sf9昆虫细胞,5 h后更换新鲜的完全培养基,置于27 ℃培养箱培养72?96 h。当细胞出现明显病变时离心收集上清液即为P1代重组病毒,将P1代重组杆状病毒按照感染复数(MOI)为0.1接种对数期生长的Sf9细胞进行重组病毒的增殖与传代,得到P2代重组杆状病毒。按照相同的方法将病毒传至P3代,采用改良的病毒噬斑法即来测定杆状病毒储液的滴度[14],即用甲基纤维素代替传统的琼脂糖覆盖病毒感染后的细胞,之后进行病毒噬斑的检测。
1.5 重组PLCζ蛋白的表达、纯化及鉴定将P3代重组杆状病毒以MOI=3的比例感染处于对数生长中期、密度为2×106/mL的Sf9昆虫细胞,100 r/min、27 ℃培养96 h。收获细胞混合物,3 800 r/min离心40 min,上清液经0.22 μm滤膜过滤后经切向流超滤膜包VIVAFLOW 200浓缩至50 mL,采用Ni-NTA亲和层析柱纯化上清液,以含250 mmol/L咪唑的变性缓冲液进行洗脱,收集洗脱液后经分子筛进一步纯化。纯化的PLCζ蛋白样品经煮沸变性处理后用两块8%分离胶进行SDS-PAGE。其中一块凝胶用考马斯亮蓝快速染色液染色,随后用脱色液进行脱色,以鉴定目的蛋白的分子质量,同时切胶后经基质辅助激光解析电离-飞行时间质谱仪进行质谱鉴定。另一块凝胶经半干法转印PVDF膜,以兔源的抗重组人PLCζ蛋白抗体作为一抗,以HRP标记的山羊抗兔作为二抗进行常规Western blotting鉴定。
1.6 重组人PLCζ蛋白的活性检测PLC可水解p-NPPC生成黄色物质对硝基苯酚,对硝基苯酚在410 nm处有最大吸光度值,故可以通过酶标仪测定反应前后在410 nm处吸光度值的变化,利用标准曲线法定量计算重组人PLCζ蛋白的活性[15]。反应混合物中含0.25 mol/L Tris-HCl (pH 7.2)缓冲液,1 mmol/L的ZnCl2,60%的山梨醇(W/V),10 mmol/L的p-NPPC。取20 μL 0.5 μg/mL的PLCζ蛋白样品溶液加入到200 μL反应混合物中混匀,37 ℃水浴反应30 min,加入0.5 mol/L的NaOH 200 μL终止酶促反应后测定在410 nm波长处的吸收值。酶活单位的定义:pH 7.2、温度为37 ℃条件下,每分钟水解p-NPPC产生1 nmol对硝基苯酚所需要的酶量为1个酶活力单位(U)。
2 结果与分析2.1 pFast-Bac-HTA-PLCζ重组转移质粒的鉴定将重组转移质粒pFast-Bac-HTA-PLCζ用NcoⅠ和Hind Ⅲ双酶切后进行琼脂糖电泳,结果(图 1)显示重组质粒经双酶切后有2条特异性条带,其中一条为PLCζ基因约为1 800 bp,另一条为载体pFast-Bac-HTA片段约为4 700 bp,均与目的基因大小和载体质粒片段相符,表明载体构建成功,结果见图 1。
 |
| 图 1 重组质粒pFast-Bac-HTA-PLCζ双酶切产物 Fig. 1 Double digestion of pFast-Bac-HTA-PLCζ resulting plasmid with NcoⅠ and HindⅢ. M: marker; 1: double digested; 2: undigested. |
| 图选项 |
2.2 Bacmid-PLCζ构建及鉴定提取重组杆粒,以PLCζ-for/PLCζ-rev为引物对重组杆粒进行PCR鉴定,取出5 μL产物经0.8%琼脂糖凝胶电泳后,在约1 840 bp处有一特异性条带,与预期片段大小相符,结果见图 2。插入Bacmid的PLCζ基因经测序表明序列正确,可用于制备重组杆状病毒颗粒。
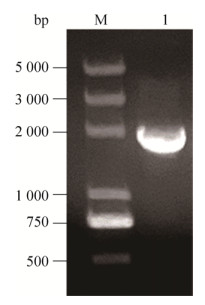 |
| 图 2 重组杆粒Bacmid-PLCζ的PCR鉴定 Fig. 2 Idetification of recombinant Bacmid-PLCζ by PCR. M: marker; 1: PCR products of Bacmid-PLCζ. |
| 图选项 |
2.3 重组Bacmid-PLCζ转染Sf9细胞及病毒扩增将重组杆粒Bacmid-PLCζ用脂质体法转染Sf9昆虫细胞,27 ℃培养72 h后细胞有明显的病毒感染迹象,主要表现为细胞生长停滞,胞体胀大变圆,胞核明显,部分细胞裂解,未转染的细胞未出现此现象。离心收集上清,标记为PLCζ P1代病毒,收获病毒液连续传代后收取P3代杆状病毒,利用甲基纤维素改良的病毒噬斑法测定P3代病毒滴度为5.2×108 PFU/mL (图 3)。
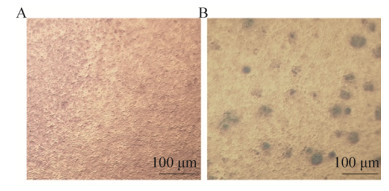 |
| 图 3 甲基纤维素噬斑法测定病毒滴度结果分析 Fig. 3 Determine the baculovirus titration values of the P3 baculovirus stocks. (A) Non-transfected Sf9 cells. (B) Sf9 cells were infected by P3 baculovirus stocks and the number of infected foci can be counted under light microscopy. |
| 图选项 |
2.4 PLCζ重组蛋白的表达及鉴定重组Bacmid-PLCζ病毒感染Sf9昆虫细胞,72 h后离心收集细胞培养基,浓缩亲和层析纯化后的目的蛋白经SDS-PAGE分离,考马斯亮蓝染色显示相对分子质量约为70 kDa的条带,其大小与重组人PLCζ蛋白的理论相对分子质量相符,该条带经飞行时间质谱鉴定为重组人PLCζ蛋白(图 4),其中Mascot得分为151,蛋白序列覆盖率为50%。用抗人PLCζ蛋白单克隆抗体进行Western blotting分析,成像结果显示一条相对分子质量约为70 kDa的特异性条带,与人PLCζ融合蛋白的理论分子质量相符(图 5)。
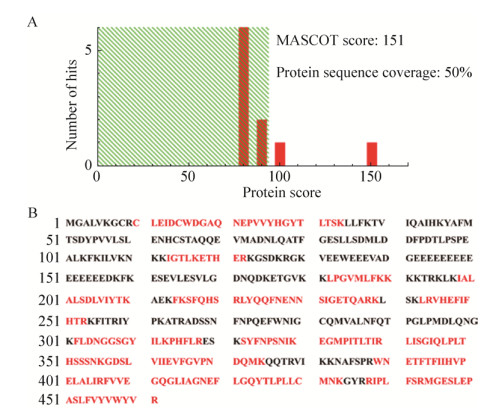 |
| 图 4 重组人PLCζ蛋白的肽指纹图谱鉴定结果 Fig. 4 Identification of recombinant PLCζ by peptide mass fingerprint. (A) Mascot score of the recombinant PLCζ protein. (B) The number of matching peptides of identification result, matched peptides shown in bold red. |
| 图选项 |
2.5 重组人PLCζ蛋白的活性测定重组人PLCζ蛋白可水解p-NPPC生成对硝基苯酚,其在410 nm处有最大吸收峰,此吸光值可反映PLCζ水解p-NPPC产生对硝基苯酚的量。将浓度为0.025 g/L的对硝基苯酚溶液梯度稀释后测定在410 nm处的吸光度值,绘制标准曲线得到的回归方程为:y=94.51x?0.043,R2=0.999 1,y为对硝基苯酚的浓度(nmol/mL),x为不同浓度对硝基苯酚在410 nm处吸光值。酶活力计算公式为:
PLCζ酶活力U (U/mL)=(94.51A?0.053) V总/30·V酶
注:A为反应后OD410,V总为反应体系总体积(mL),V酶为加入重组人PLCζ蛋白体积(mL)。
 |
| 图 5 重组人PLCζ蛋白的SDS-PAGE和Western blotting鉴定 Fig. 5 Expression and purification of recombinant PLCζ and then evaluated by using 8% SDS-PAGE and Western blotting analysis. (A) Coomassie blue stained 8% SDS-PAGE gel of baculovirus infected samples purified using His-select beads and eluted with 250 mmol/L imidazole. M1: molecular marker; 1: purified protein. (B) Western blotting analysis of recombinant PLCζ expressed in Sf9 cells that had been incubated for 72 h at 27 ℃, detected using anti-PLCζ antibody. The size of the expressed recombinant PLCζ was about 68 kDa. M2: EasySee Western molecular marker; 2: purified protein. |
| 图选项 |
经过优化表达、纯化条件,最终获得重组人PLCζ蛋白酶活力可达到326.8 U/mL。
3 讨论PLCζ蛋白在卵母细胞活化中发挥着重要作用,其异常形式或含量减低可能是某些精子激活卵母细胞失败型男性不育的根本原因[16-18]。Kouchi等纯化出有活性的重组小鼠PLCζ蛋白并将其注射入小鼠卵母细胞,可观察到类似于精子显微注射时引发的细胞内Ca2+振荡,启动小鼠胚胎发育[19]。虽然这些研究意味着PLCζ在卵母细胞激活缺陷型男性不育治疗中的应用潜力,但是关于有活性的人PLCζ重组蛋白的体外表达及纯化一直没有取得大的进展。为更好地分析PLCζ的结构及功能,探究其生物医学应用,体外表达和纯化有活性的人PLCζ重组蛋白显得尤为重要。
昆虫杆状病毒表达系统是继大肠杆菌、哺乳动物细胞表达系统后的另一个高效的蛋白表达系统。其系统适当的分子伴侣和翻译后修饰加工体系使其表达的蛋白更加接近体内天然形式同时具有较高的生物学活性[20-21]。为了得到具有生物学活性的PLCζ蛋白,分析其酶学分子特性以及在激活卵母细胞时与其他分子之间的相互作用,进一步探究其作为人工辅助卵母细胞激活生物制剂的可行性,本研究利用杆状病毒/昆虫细胞系统表达并分离纯化重组人PLCζ蛋白。
为了便于蛋白纯化,本研究中我们将人PLCζ基因克隆至含有6×His标签及AcTEVTM白酶剪切位点的pFastBac HTA质粒中,所表达蛋白经亲和层析纯化后,重组PLCζ蛋白纯度高,无杂蛋白污染。扩增杆状病毒颗粒后认MOI=5感染Sf9昆虫细胞,培养72 h后PLCζ蛋白以胞外分泌的形式表达,可以从无血清培养基中分离纯化出靶蛋白。本研究中重组杆状病毒经过3次扩增病毒后滴度经测定为5.2×108 PFU/mL,滴度不够高在一定程度上可能会影响重组蛋白的大批量纯化。考虑到影响病毒感染效率的因素有目的基因片段的大小,重组Bacmid DNA的转染效率、病毒存放时间、保存条件等,本实验中采用新鲜的病毒进行Sf9昆虫细胞的感染,并加入了终浓度2%的胎牛血清避光存放于4 ℃,病毒降解可能不是影响杆状病毒毒力的主要因素,而采用有效的方法提高转染效率是提高病毒滴度的关键。有研究表明通过多次传代可以提高病毒毒力,但应当注意杆状病毒在细胞中多次传代后可能引起基因组的改变,出现多角体表型变化,导致蛋白表达水平降低[22]。为了减少重组杆状病毒在传代后存在突变导致蛋白表达水平降低的可能,通过扩大转染体积、离心浓缩病毒颗粒等方法来获取低代数、高滴度的重组病毒是后续研究中需要实现的目标。影响重组蛋白表达的因素除了表达载体选择和目的基因本身大小、重组病毒感染效率之外还取决于宿主细胞状态及培养条件和蛋白收获时间[23-24]。本实验中发现宿主细胞状态对目的蛋白的产量至关重要,感染前应选择传代次数少、细胞存活率高于95%、无异常形态的健康对数生长期细胞进行重组病毒接种;宿主细胞状态不佳时无论是通过增加病毒接种量、延长细胞培养时间还是增加宿主细胞数量均不能提高蛋白表达量。考虑到表达的重组蛋白会被细胞培养时自身蛋白酶所降解,我们选择在感染72 h作为收获PLCζ蛋白的最佳时间点。为了把目的蛋白从细胞培养基中分离出来,同时还要保持其生物学活性,蛋白纯化过程中尽量在低温环境中进行[25]。收集感染病毒后的昆虫细胞培养基后,可以加入蛋白酶抑制剂以防止目的蛋白降解,利用重组蛋白上所带的His标签与Ni2+亲和层析达到分离纯化目的蛋白与杂蛋白,最后经高浓度咪唑洗脱得到目的蛋白。考马斯亮蓝染色及Western blotting检测蛋白大小为68 kDa左右,与人PLCζ蛋白的理论分子大小一致,该蛋白经电离飞行时间质谱鉴定为PLCζ蛋白,经酶学测定显示有生物学活性,说明本方法可成功获得有活性的重组人PLCζ蛋白。
PLCζ蛋白是PLC家族的最新成员,目前关于人PLCζ蛋白结构及功能的研究鲜见报道。本研究利用杆状病毒/昆虫细胞真核表达系统获得了在结构及功能上都更接近天然蛋白特性的重组人PLCζ蛋白,这为下一步进行人PLCζ蛋白晶体结构解析的生物学研究奠定了坚实的基础,也为加深对PLCζ在卵母细胞激活缺陷型男性不育诊断和治疗上的探索提供了可能。
参考文献
| [1] | Saunders CM, Larman MG, Parrington J, et al. PLC zeta:a sperm-specific trigger of Ca2+ oscillations in eggs and embryo development.Development, 2002, 129(15): 3533–3544. |
| [2] | Swann K, Saunders CM, Rogers NT, et al. PLCζ(zeta):a sperm protein that triggers Ca2+ oscillations and egg activation in mammals.Semin Cell Dev Biol, 2006, 17(2): 264–273. |
| [3] | Xu HY, Deng K, Luo QB, et al. High Serum FSH is associated with brown oocyte formation and a lower pregnacy rate in human IVF parctice.Cell Physiol Biochem, 2016, 39(2): 677–684. |
| [4] | Nomikos M, Elgmati K, Theodoridou M, et al. Male infertility-linked point mutation disrupts the Ca2+ oscillation-inducing and PIP2, hydrolysis activity of sperm PLCζ.Biochem J, 2011, 434(2): 211–217.DOI: 10.1042/BJ20101772 |
| [5] | Heytens E, Parrington J, Coward K, et al. Reduced amounts and abnormal forms of phospholipase C zeta (PLCζ) in spermatozoa from infertile men.Hum Reprod, 2009, 24(10): 2417–2428.DOI: 10.1093/humrep/dep207 |
| [6] | Ramadan WM, Kashir J, Jones C, et al. Oocyte activation and phospholipase C zeta (PLCζ):diagnostic and therapeutic implications for assisted reproductive technology.Cell Commun Signal, 2012, 10(1): 12.DOI: 10.1186/1478-811X-10-12 |
| [7] | Ozil JP, Banrezes B, Tóth S, et al. Ca2+ oscillatory pattern in fertilized mouse eggs affects gene expression and development to term.Dev Biol, 2006, 300(2): 534–544.DOI: 10.1016/j.ydbio.2006.08.041 |
| [8] | Tavalaee M, Nasr-Esfahani MH. Expression profile of PLCζ, PAWP, and TR-KIT in association with fertilization potential, embryo development, and pregnancy outcomes in globozoospermic candidates for intra-cytoplasmic sperm injection and artificial oocyte activation.Andrology, 2016, 4(5): 850–856.DOI: 10.1111/andr.2016.4.issue-5 |
| [9] | Amdani SN, Yeste M, Jones C, et al. Phospholipase C zeta (PLCζ) and male infertility:clinical update and topical developments.Adv Biol Regul, 2016, 61: 58–67.DOI: 10.1016/j.jbior.2015.11.009 |
| [10] | Yoon SY, Eum JH, Lee JE, et al. Recombinant human phospholipase C zeta 1 induces intracellular calcium oscillations and oocyte activation in mouse and human oocytes.Hum Reprod, 2012, 27(6): 1768–1780.DOI: 10.1093/humrep/des092 |
| [11] | Nomikos M, Yu YS, Elgmati K, et al. Phospholipase Cζ rescues failed oocyte activation in a prototype of male factor infertility.Fertil Steril, 2013, 99(1): 76–85.DOI: 10.1016/j.fertnstert.2012.08.035 |
| [12] | Li ZH, Wang QJ. Expression, purification and characterization of catalytic domain of protein kinase D1 in baculovirus-insect cell expression system.Chin J Biotech, 2014, 30(8): 1291–1298.(in Chinese). 李志红, WangQJ. 蛋白激酶D1催化结构域在昆虫细胞/杆状病毒表达系统内的表达、纯化和活性测定.生物工程学报, 2014, 30(8): 1291-1298. |
| [13] | Luckow VA, Lee SC, Barry GF, et al. Efficient generation of infectious recombinant baculoviruses by site-specific transposon-mediated insertion of foreign genes into a baculovirus genome propagated in Escherichia coli.J Virol, 1993, 67(8): 4566–4579. |
| [14] | Baer A, Kehn-Hall K. Viral concentration determination through plaque assays:using traditional and novel overlay systems.J Vis Exp, 2014(93): e52065. |
| [15] | Flieger A, Gong SM, Faigle M, et al. Critical evaluation of p-nitrophenylphosphorylcholine (p-NPPC) as artificial substrate for the detection of phospholipase C.Enzyme Microb Technol, 2000, 26(5/6): 451–458. |
| [16] | Kashir J, Heindryckx B, Jones C, et al. Oocyte activation, phospholipase C zeta and human infertility.Hum Reprod Update, 2010, 16(6): 690–703.DOI: 10.1093/humupd/dmq018 |
| [17] | Parrington J. Does a soluble sperm factor trigger calcium release in the egg at fertilization?.J Androl, 2001, 22(1): 1–11. |
| [18] | Rogers NT, Halet G, Piao Y, et al. The absence of a Ca2+ signal during mouse egg activation can affect parthenogenetic preimplantation development, gene expression patterns, and blastocyst quality.Reproduction, 2006, 132(1): 45–57.DOI: 10.1530/rep.1.01059 |
| [19] | Kouchi Z, Fukami K, Shikano T, et al. Recombinant phospholipase Czeta has high Ca2+ sensitivity and induces Ca2+ oscillations in mouse eggs.J Biol Chem, 2004, 279(11): 10408–10412.DOI: 10.1074/jbc.M313801200 |
| [20] | Lin SY, Chen GY, Hu YC. Recent patents on the baculovirus systems.Recent Pat Biotechnol, 2011, 5(1): 1–11. |
| [21] | Zhang ZG, Jing Y, Barford D. Recombinant expression and reconstitution of multiprotein complexes by the USER cloning method in the insect cell-baculovirus expression system.Methods, 2016, 95: 13–25.DOI: 10.1016/j.ymeth.2015.10.003 |
| [22] | Kool M, Ahrens CH, Vlak JM, et al. Replication of baculovirus DNA.J Gen Virol, 1995, 76(9): 2103–2118.DOI: 10.1099/0022-1317-76-9-2103 |
| [23] | Ren YY, Chen D, Guo YZ, et al. Expression of human retinol-binding protein 4 in insect baculovirus system and preparation of its polyclonal antibody.Chin J Biotech, 2013, 29(7): 974–985.(in Chinese). 任玉莹, 陈丹, 郭玉争, 等. 人视黄醇结合蛋白4在杆状病毒系统中的表达及其多克隆抗体制备.生物工程学报, 2013, 29(7): 974-985. |
| [24] | Jarvis DL. Developing baculovirus-insect cell expression systems for humanized recombinant glycoprotein production.Virology, 2003, 310(1): 1–7. |
| [25] | Wingfield PT. Overview of the purification of recombinant proteins.Curr Protoc Protein Sci, 2015, 80(6): 1–35. |
