
 , 陈峰
, 陈峰 浙江工业大学 生物工程学院,浙江 杭州 310032
收稿日期:2018-07-12;接收日期:2018-10-22
摘要:近年来,随着微流体技术和生物微电子机械系统技术的不断发展,人类中枢神经系统(CNS)的微流体平台及相关疾病的体外模型逐渐得到了广泛的研究。微流体平台可以更好地模拟体内环境,同时能够控制结构、微环境和外来刺激。文中总结了微流控芯片在CNS的基本技术和CNS疾病中的应用。此外,文中对微流控芯片在CNS中的研究进行了展望,强调了通过跨学科的共同努力能够实现更高程度的仿生学挑战。
关键词:微流体技术中枢神经系统疾病模型微流控芯片
Application and prospect of microfluidic chip in central nervous system diseases
Chenyu Zhao

 , Feng Chen
, Feng Chen College of Biotechnology and Bioengineering, Zhejiang University of Technology, Hangzhou 310032, Zhejiang, China
Received: July 12, 2018; Accepted: October 22, 2018
Corresponding author: Chenyu Zhao. Tel: +86-571-88320823; E-mail: Reminiscem@163.com.
Abstract: In recent years, many human central nervous systems (CNS) of microfluidic platforms and related disease models in vitro have been built with the continuous development of the microfluidic technology and biological microelectronics mechanical systems technology. Microplatforms have emerged to provide a better approximation of the in vivo scenario with better control of the structure, microenvironment and stimuli. This review summarized the basic technology of microfluidic chips in CNS and the application in CNS diseases. In addition, the research of microfluidic chip in CNS diseases has been also prospected. We also highlight challenges that can be addressed with interdisciplinary efforts to achieve more biomimicry.
Keywords: microfluidic technologycentral nervous systemdisease modelmicrofluidic chip
中枢神经系统(CNS)是人体神经系统的主要组成部分,其可以接受全身各处的传入信息,这些信息经过CNS加工整合后成传出,或者储存在CNS内成为记忆、学习的基础。CNS包括了轴突和树突连接的各种细胞,具有高度的封闭性和片层结构。在过去的研究中,动物模型通常被用于脑部结构及其相关疾病的模拟,但是这种方法价格昂贵、效率低、实验复杂以及耗时多,严重限制了神经疾病研究的发展。近年来,利用微流控芯片技术已经能够在体外很好地模拟CNS,进而让我们对CNS以及神经疾病的研究有了更深入的了解。
1 微流控芯片技术简介微流控芯片是2011年前后发展起来的只有几个平方厘米大小的有微米级通道和隔室的生物芯片,具有化学和生物实验室的功能,可以进行样品的制备和分离、细胞的培养和检测等,是一种能够快速准确完成分析全过程的新兴技术,其中涉及表面化学、电化学、微加工等多学科领域[1-2]。特别是随着微加工技术的不断进步,加快了微流控芯片内多功能组件(如微阀、微泵、微型混合器、微电极阵列等)的集成,更好地体现了其高效、节约、便于连续操作、仿生特性等特点[3-6],使其在细胞培养研究、样品分析,模拟体内器官的组织结构、微环境和机械力,实现类器官机能方面展现了突出的优势[7-9]。
神经科学包括脑科学、神经病理学、神经生物学等领域,涉及电生理、结构学和行为学等诸多研究。目前主要的研究手段是体外常规细胞培养和动物实验,其中常规细胞培养难以体现神经细胞间的相互联系,而动物实验成本高、耗时长、实验误差大。微流控芯片与传统研究手段相比有着明显的优势[10]:1)支持流体的持续流动和交换,通过层流在微通道或凹槽阵列制造浓度梯度为细胞提供分层刺激,模拟正常体内的动态微环境;2)微流控芯片的小体积使得在制备和检测时只需要很小的用量,大大降低了成本;3)传统方法检测繁琐,微流控芯片可快速反应,提升了实验的效率。因此,自该项技术产生以来受到极大关注,发展迅速。本文主要阐述了微流控芯片在CNS的基本技术和在CNS中的应用,并对微流控芯片在未来的研究进行了展望。
2 微流控芯片在中枢神经系统基本技术CNS内有各种神经元、星形胶质细胞、少突胶质细胞、小胶质细胞以及其它支持细胞,它们通过迁移、分化、突触形成和交联,构建复杂神经网络,实现脑功能。模拟CNS的微流控芯片是依据脑生理结构与机能设计的高通量检测平台,在脑病理学的研究具有以下几个优点:灵活控制微环境、单细胞处理、实时分析、共培养、分室培养、灌注培养和长期培养等。微流控芯片在CNS的基本技术可以分为对细胞的控制、轴突可视化、细胞共培养、定向神经网络、大脑切片技术、微电极阵列(MEA)技术等。
本课题组致力于通过体外图案化培养神经细胞、模拟神经网络以研究神经细胞的功能和行为。研究证明,微图案的优化设计对于构建神经元网络和保持功能特性是必要的,不同的材料,比如尺寸、形状、接触表面的粗糙度等,都会对神经突伸长率和神经元极化产生显著的影响。选择新的聚合物或者开发新的微图案制备方法尤为重要,常用的方法是微流体印刷术,即在软光刻技术制成的微图案化(通常为条纹或网格)芯片上涂布聚合物培养神经细胞构建神经网络,合适的聚合物还有望实现神经元与电子元件的通讯联系,但这种方法受到聚二甲基硅氧烷(PDMS)材料印章的纵横比限制,且很难排除细胞密度变化导致的细胞自身分泌因子浓度变化等因素的干扰。目前更复杂的微图案是通过用于细胞粘附的粘合点互连的条纹构建而成,已被广泛用于产生体外组织的神经网络,还可以对形成的成熟神经元网络进行单通道电流记录,以验证其在数周内的生理特性。
2.1 微平台上中枢神经细胞的控制微流控平台已经成为目前模拟中枢神经内环境的重要手段,其可以通过限制细胞运动和利用通道产生的化学浓度梯度对神经元进行适当的控制[11-12]。控制细胞比例和模仿细胞外基质对模拟不同CNS疾病的体内环境至关重要,不同细胞的比例可以模拟体内正常或异常状态,这可能产生不同的疾病模型。在细胞培养方面,水凝胶的多孔特性使代谢物质能够在其中进行一定程度的扩散和交流,与微流体通道结合可以造成具有化学浓度梯度的局部微环境,诱导细胞发生不同程度的生长与分化。在芯片处理方面,微流控技术通过不同的拓扑结构和化学修饰对细胞进行控制从而模拟细胞外基质和组织结构。拓扑结构的控制包括光刻技术、印章印刷技术、激光烧蚀和3D打印等,化学方法可以使用聚赖氨酸、聚乙二醇、清蛋白等对芯片进行表面修饰控制细胞粘附和生长[13]。
2.2 可视化与量化轴突神经CNS神经元轴突损伤创伤对神经退行性疾病的病因和CNS损伤至关重要。动物模型由于涉及多个参数以至于不能够对轴突的损坏或再生进行实时的监控[14],目前的研究还无法区分正常和损伤后再生神经元的不同生长形式,并且缺乏以精确控制的方式诱导轴突损伤的合适方法。多室神经培养芯片是将微加工和微流控相结合产生的,具有由微通道相互连接的多个独立的细胞培养室,能够可视化引导轴突生长、分离轴突和量化神经元[15-17]。Kilic等[18]构建了一种新型的微流控芯片,该芯片可以重建神经细胞组织,大大减小了体内和体外模拟的差距,在该装置内神经元成功表达了轴突标志物丝原蛋白和微管蛋白,证明了该装置在成熟神经元中具有相当高的兼容性。Park等[19]研制出一种将神经元胞体与其轴突分隔的微流控芯片,该芯片阻止细胞体离开环形中央室,但允许轴突沿微通道生长进入轴突隔室,这种设计使得轴突成功分离,并能继续物理引导轴突直线生长,通过图像处理算法得到轴突的生长情况(图 1A)。
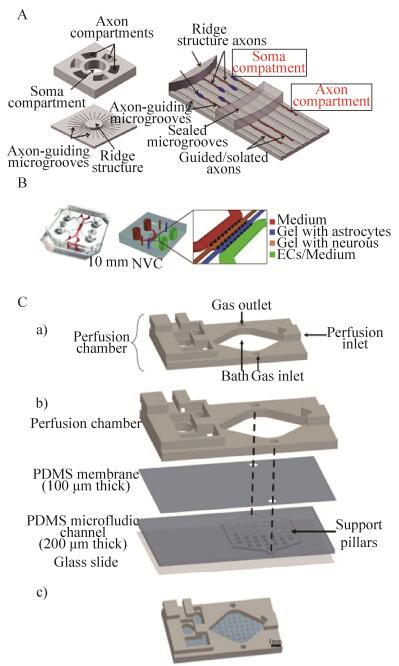 |
| 图 1 关于CNS的微流体平台 Fig. 1 The microfluidic platform of CNS. (A) Schematic illustrations of the quantitative axon growth analysis microchip[19]. (B) Scheme of the neurovascular chip[22]. (C) Schematic illustrations of the microfluidic device that allows oxygen supply[29]. a: standard perfusion chamber; b: exploded view of the microfluidic device; c: picture showing the completed device. |
| 图选项 |
2.3 中枢神经细胞的共培养由于CNS内细胞种类多,细胞间相互作用、相互支持,细胞的共培养技术在更好地模拟体外环境中发挥着重要的作用。传统的共培养方式耗时费力,且不便于后期观察与检测。分室微流体芯片可以进行多种细胞类型的共培养以及在同一平台中使用多种培养基和提供不同的生化刺激。在微流控芯片中,共培养主要有3种方式:在微芯片中的凹槽阵列中接种细胞形成细胞球状体;在多孔膜的正反两面接种不同类型细胞构成细胞插入物;在水凝胶中接种不同类型细胞或交联接种了不同类型细胞的水凝胶[20-22]。
Adriani等[23]利用人脐静脉内皮细胞(HUVEC)与原代大鼠星形胶质细胞,建立了三维共培养系统。该系统包括了完整的血脑屏障和紧密的细胞间连接的内皮单层,运用不同分子量的荧光法测定了血脑屏障的选择性通透性,并通过钙成像显示了神经元的功能,该实验证实了胶质细胞能够提供必要的营养物质进而使神经元存活(图 1B)。Shi等[24]在神经元和胶质细胞共培养实验中,发现了其产物可溶性因子的水平高于单个神经元或胶质细胞培养所分泌的可溶性因子水平,这表明神经元和胶质细胞相互作用可以调节突触细胞的功能。Aebersold等[25]研究发现,星形胶质细胞和神经元共培养可以改善低神经元细胞密度下形成的神经网络的存活率,这个发现可以改善体外测定神经元功能的质量。
2.4 神经网络的方向性神经网络具有一定的方向性,这可以使CNS快速地收集和处理信息。为了更好地理解神经元如何处理信息,保持大脑回路的复杂组织至关重要。近年来,神经网络的方向性通常依靠微图案化和微通道实现。Gladkov等[26]研发的集成MEA的微流控芯片可以诱导神经元定向形成类似于脑中的神经网络,将原代海马神经元接种在由特定形状微通道连接的微室中,通过分析比较通道中神经突的生长情况与形状,最终确定了微通道的最佳几何形状特征,得到的稳定的网络可用于长期研究各种条件下的突触可塑性。Ortega等[27]应用计算神经网络的方向性优化微流控芯片上受体-配体相互作用的荧光信号,验证了神经网络方向的有效性。Peyrin等[28]在微流控芯片上添加了一个轴突二极管,其涉及的不对称微通道可以使神经网络具有方向性,在接种了原代神经元培养物后发现了皮质轴突纹状体的分化和神经系统的同步协作。轴突二极管的应用促进了微流控芯片的神经方向性研究,能够更好地构建体外CNS,为神经性疾病的机理研究提供了基础。
2.5 脑切片微流体体外培养的脑切片长期以来被广泛用于研究脑发育,电生理学,神经变性和神经保护。微流体技术可以精确控制大脑特定区域的微环境,从而提高了脑切片的渗透。Liu等[29]开发了一种新型灌注式液滴微流体装置,该装置可用于大脑切片的长期培养,将海马组织切片放入PDMS膜切成的孔中,控制孔内的液位水平,使得每一层都形成一个液滴,液滴可以通过微通道与培养基相连接,这样的海马切片在体外至少可以维持9 d。Mauleon等[30]开发了一种微流控平台,通过灌注腔将氧气扩散到整个PDMS薄膜,进而扩散到下方的大脑切片中。微通道能够快速有效地控制氧气的进出,使切片的不同区域能够处于不同的氧气条件(图 1C)。使用该设备,可以在整个大脑切片中获得一个稳定的、均匀的氧气环境,同时可以测量不同区域对于氧张力的响应,更加完整地模拟了CNS的结构,为中风疾病的研究提供了借鉴作用。
2.6 微电极阵列上的神经元活动近年来,微电极阵列技术(MEA)逐渐应用于监测神经细胞网络的电路活动。由于MEA不仅能够原位监测细胞电信号,还能够进行电刺激,被看作应用于模拟CNS的微流控芯片的理想工具。Kang等[31]应用MEA技术在微孔中涂抹细胞粘附层,然后用细胞排斥层(琼脂糖水凝胶)对细胞粘附区和神经元微电路隔离,在琼脂糖微孔环境下,以细胞外活动电位为特征培养初级海马神经元,该方法的提出促进了神经生物学功能分析的研究和神经生物传感器领域的发展。Kreir等[32]利用MEA技术在体外培养小鼠神经元细胞,证明了在体外运用MEA技术培养小鼠神经元优于直接监测小鼠体内的神经元细胞,此外,还证明了MEA的技术可以用于检测潜在药物诱发的神经中枢系统疾病。
3 微流控芯片在中枢神经系统疾病中的应用中枢神经疾病不仅是神经元和胶质细胞的功能障碍或破坏,而且受细胞微环境和各种细胞类型(神经元、星形胶质细胞、内皮细胞、周细胞和骨骼肌细胞)之间的相互作用影响[33]。神经退行性疾病的CNS模型一般都包含微通道和微室。微通道通常用于指导神经突生长、提供可控介质和生化刺激,微室通常用于较长时间的细胞培养。利用微流控芯片技术模拟中枢神经性疾病,可以更好地揭示神经退行性疾病的分子机制,提供疾病的解决方案。
3.1 阿尔茨海默病阿尔茨海默病(AD)是CNS小胶质细胞和星形胶质细胞介导的炎症,其致病原因可能是β-淀粉样蛋白(Aβ)斑块的形成、tau蛋白的延长和神经原纤维缠结[34-35]。通过Aβ或tau蛋白在神经网络的传播和轴突间的转移、Aβ和tau蛋白毒性暴露、研究胶质细胞功能和神经突触功能来建立AD模型[36-38]。Park等[39]将神经球装载于带有凹槽的微通道,再以微渗透泵驱动低流速灌流培养液,这种微流控脑芯片模拟了脑内的间质流,可用于分析灌注Aβ对于网状神经球的作用。最近的一些研究还模拟了AD发生过程小胶质细胞在Aβ斑块附近累积的机制,并且证明了Aβ通过神经元的连接传播[40-41]。在含有微通道的微流控装置中,可以观察到对照组tau蛋白在神经细胞间的扩散以及tau蛋白的高磷酸化[42]。Kunze等[43]利用冈田酸的浓度梯度,控制连接的神经元细胞区室之间的两种不同磷酸化状态,创建了一个共培养健康和患病组织的AD模型。
3.2 帕金森病模型帕金森病(PD)的特征在于黑质中多巴胺能神经元的丧失以及细胞内蛋白质比如α-Syn聚集体(路易体)的异常聚集[44-45]。除了传统的分离培养系统,α-Syn的聚集以及其对轴突-神经胶质细胞相互作用的研究也是必需的。Lu等[46]研发的微平台利用平行的微通道阵列实现了轴突与体细胞的流体分离,可以用于监测单个多巴胺能轴突的线粒体运转。通过这种培养系统可以更好地了解轴突变性的机制。Fernandes等[47]发现α-Syn纤维被神经元内化并沿着轴突运输,具有微槽的微流控平台提供了α-Syn原纤维存在下的原代神经元的培养模型,同时允许细胞通过扩散或灌注进行通信,为研究PD和其他神经退行性疾病所涉及的分子机制提供了新的机会。
3.3 多发性硬化多发性硬化(MS)是指持续时间短暂、可被特殊因素诱发的感觉或运动异常,是一种以CNS白质炎症性脱髓鞘病变为主要特点的免疫介导性疾病。周瑜等[48]通过高通量蛋白质芯片技术检测与对照组分析比对,共筛出MS患者血清27种自身抗体,该结果可以较为有效地筛选出MS血清中自身抗体的靶抗原,为进一步验证MS相关自身抗体的功能及作用机制奠定了基础。Hosmane等[49]通过微流控轴突-小胶质细胞共培养平台发现了轴突变性导致小胶质细胞内1型干扰素基因的诱导,证实了Toll样受体在退化轴突的小胶质细胞清除中起重要作用。到目前为止,MS治疗方法只集中于缓和并且效果有限,微流控平台通过实时监控疾病微环境,为该疾病提供更好的解决方案。
3.4 偏头痛皮层扩散性抑制(CSD)被认为是偏头痛发生的重要机制,它是神经元和胶质细胞继于生物电活动抑制后产生的可向邻近区传播的去极化波,该信号主要发生在视皮层。当化学刺激被聚焦时,信号可以更准确地通过神经网络传递给周围的神经元。Tang等[50]研发的新型CSD模型微流体装置可以同时注射和抽出流体,具有通过局部控制以精确刺激脑切片的能力,通过微流控平台局部递送氯化钾溶液进而诱导CSD,可有效进行CSD建模和药物筛选。在先前的研究基础上,Tang等[51]通过改变细胞外钾离子浓度以及暴露于钾离子的区域以确定引发CSD所需的最小条件,这表明了在偏头痛先兆以及脑外伤相关的条件下,CSD可以是诱导型的。
3.5 脑弥漫性轴索损伤脑弥漫性轴索损伤(DAI)是指头部受到外伤作用后以轴索损伤为主要改变的一种原发性脑实质损伤,其特点是轴突肿胀、分离,并且有多个球体出现单个轴突。适当的治疗条件需要精确的模型来模拟实际情况,微流控平台可以通过一些机械方法模拟这种CNS的损伤[50-51]。Siddique等[52]开发了一种支持脊髓和周围神经共培养的微流控平台,用于研究生长因子对机械损伤后轴突再生的影响,同时允许研究人员在仿生3D环境中手动诱导神经损伤并对轴突部分进行分离治疗,这提供了在体外进行神经修复的可能性。
3.6 癫痫病癫痫是一种以过度同步神经活动为特征的疾病。目前可用的抗癫痫药物需要连续给药以抑制癫痫发作,并且临床上没有可用于预防癫痫发作的疗法。微流控芯片的出现为了解癫痫发生中的复杂信号通路和高通量筛选抗癫痫药物铺平了道路。一般来说,MEA由于可以高灵敏度记录,脑切片能够局部诱导或抑制特定区域中神经元的活动,兼容了MEA与脑切片技术的器官型海马切片培养物已越来越多地用做创伤后癫痫的体外模型。为了明确额叶癫痫发作的发生时间,Chang等[55]在丘脑-前扣带皮层(ACC)切片中通过MEA记录了癫痫活动随时间的变化,发现丘脑输入对于调节ACC癫痫活动的持续时间和脑皮层中发作部位的深度有着直接的影响。
4 总结与展望本文总结了微流控芯片在CNS的基本技术和在CNS疾病中的应用。微流控技术是一门交叉技术,需要多学科共同协作。脑是高度复杂的组织器官,现有的微流控芯片对于更为复杂的脑机能还少有研究。芯片缺少对脑组织细胞微环境的精细模拟,也缺少对细胞生理生化指标的高通量快速检测手段。芯片质量的稳定性、可重复性,以及价格因素都还有大量的工作有待完成。考虑到人类和动物模型之间的代谢和生理差异,CNS疾病模型的最终目标是模拟患者来源细胞的特定疾病,并将其作为筛选工具以寻找个性化医疗,最小化生物医学领域中临床前和临床研究之间的差距。
随着3D结构微平台和个性化CNS疾病模型的不断发展,可以通过3D打印、软光刻、光蚀技术等手段来更精确地模拟组织器官[56]。微流控芯片也可以与快速兴起的诱导多能干细胞技术结合,理论上能够重建一个可能与患者遗传特征相匹配的小型多器官芯片,这些将为医学研究提供巨大的贡献。
参考文献
| [1] | Ren L, Liu WM, Wang YL, et al. Investigation of hypoxia-induced myocardial injury dynamics in a tissue interface mimicking microfluidic device.Anal Chem, 2013, 85(1): 235–244. |
| [2] | Tian SS. Research on the construction of neuron networks in vitro based on microfluidic technology [D]. Beijing: Beijing University of Technology, 2017 (in Chinese). 田姗姗.基于微流控技术体外构建神经元网络的相关研究[D].北京: 北京工业大学, 2017.http://cdmd.cnki.com.cn/Article/CDMD-10005-1018704600.htm |
| [3] | MacKerron C, Robertson G, Zagnoni M, et al. A microfluidic platform for the characterisation of CNS active compounds.Sci Rep, 2017, 7: 15692–15702.DOI: 10.1038/s41598-017-15950-0 |
| [4] | Liu WM, Li L, Wang JC, et al. Dynamic trapping and high-throughput patterning of cells using pneumatic microstructures in an integrated microfluidic device.Lab Chip, 2012, 12(9): 1702–1709.DOI: 10.1039/c2lc00034b |
| [5] | Schulze F, Gao XH, Virzonis D, et al. Air quality effects on human health and approaches for its assessment through microfluidic chips.Genes, 2017, 8(10): 244–269.DOI: 10.3390/genes8100244 |
| [6] | Hsieh HY, Camci-Unal G, Huang TW, et al. Gradient static-strain stimulation in a microfluidic chip for 3D cellular alignment.Lab Chip, 2014, 14(3): 482–493.DOI: 10.1039/C3LC50884F |
| [7] | Eduati F, Utharala R, Madhavan D, et al. A microfluidics platform for combinatorial drug screening on cancer biopsies.Nat Commun, 2018, 9: 2434–2446.DOI: 10.1038/s41467-018-04919-w |
| [8] | Aziz AUR, Geng CY, Fu MJ, et al. The role of microfluidics for organ on chip simulations.Bioengineering (Basel), 2017, 4(2): 39–52. |
| [9] | Cho CF, Wolfe JM, Fadzen CM, et al. Blood-brain-barrier spheroids as an in vitro screening platform for brain-penetrating agents.Nat Commun, 2017, 8: 15623–15636.DOI: 10.1038/ncomms15623 |
| [10] | Li M. The effects of PQQ and bFGF on proliferation of Schwann cells on microfluidic chips[D]. Dalian: Dalian Medical University, 2014 (in Chinese). 李明.应用"微流控芯片"技术探讨PQQ与bFGF促进雪旺细胞增殖的实验研究[D].大连: 大连医科大学, 2014.http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2587131 |
| [11] | Wheeler BC, Brewer GJ. Designing neural networks in culture: experiments are described for controlled growth, of nerve cells taken from rats, in predesigned geometrical patterns on laboratory culture dishes.Proc IEEE Inst Electr Electron Eng, 2010, 98(3): 398–406.DOI: 10.1109/JPROC.2009.2039029 |
| [12] | Nam Y, Brewer GJ, Wheeler BC. Development of astroglial cells in patterned neuronal cultures.J Biomater Sci Polym Ed, 2007, 18(8): 1091–1100.DOI: 10.1163/156856207781494430 |
| [13] | Haring AP, Sontheimer H, Johnson BN. Microphysiological human brain and neural systems-on-a-chip: potential alternatives to small animal models and emerging platforms for drug discovery and personalized medicine.Stem Cell Rev, 2017, 13(3): 381–406.DOI: 10.1007/s12015-017-9738-0 |
| [14] | Siddique R, Thakor N. Investigation of nerve injury through microfluidic devices.J R Soc Interface, 2014, 11(90): 20130676–20130688. |
| [15] | Soitu C, Feuerborn A, Tan AN, et al. Microfluidic chambers using fluid walls for cell biology.Proc Natl Acad Sci USA, 2018, 115(26): E5926–E5933.DOI: 10.1073/pnas.1805449115 |
| [16] | Park J, Koito H, Li JR, et al. Multi-compartment neuron-glia co-culture platform for localized CNS axon-glia interaction study.Lab Chip, 2012, 12(18): 3296–3304.DOI: 10.1039/c2lc40303j |
| [17] | Kim HS, Jeong S, Koo C, et al. A microchip for high-throughput axon growth drug screening.Micromachines (Basel), 2016, 7(7): 114–132.DOI: 10.3390/mi7070114 |
| [18] | Kilic O, Pamies D, Lavell E, et al. Brain-on-a-chip model enables analysis of human neuronal differentiation and chemotaxis.Lab Chip, 2016, 16(21): 4152–4162.DOI: 10.1039/C6LC00946H |
| [19] | Park J, Kim S, Park SI, et al. A microchip for quantitative analysis of CNS axon growth under localized biomolecular treatments.J Neurosci Methods, 2014, 221: 166–174.DOI: 10.1016/j.jneumeth.2013.09.018 |
| [20] | Choi YJ, Park J, Lee SH. Size-controllable networked neurospheres as a 3D neuronal tissue model for Alzheimer's disease studies.Biomaterials, 2013, 34(12): 2938–2946.DOI: 10.1016/j.biomaterials.2013.01.038 |
| [21] | Adriani G, Ma D, Pavesi A, et al. Modeling the Blood-Brain Barrier in a 3D triple co-culture microfluidic system.Conf Proc IEEE Eng Med Biol Soc, 2015, 2015: 338–341. |
| [22] | Brown JA, Pensabene V, Markov DA, et al. Recreating blood-brain barrier physiology and structure on chip: A novel neurovascular microfluidic bioreactor.Biomicrofluidics, 2015, 9(5): 054124–054138.DOI: 10.1063/1.4934713 |
| [23] | Adriani G, Ma DL, Pavesi A, et al. A 3D neurovascular microfluidic model consisting of neurons, astrocytes and cerebral endothelial cells as a blood-brain barrier.Lab Chip, 2017, 17(3): 448–459.DOI: 10.1039/C6LC00638H |
| [24] | Shi MJ, Majumdar D, Gao YD, et al. Glia co-culture with neurons in microfluidic platforms promotes the formation and stabilization of synaptic contacts.Lab Chip, 2013, 13(15): 3008–3021.DOI: 10.1039/c3lc50249j |
| [25] | Aebersold MJ, Thompson-Steckel G, Joutang A, et al. Simple and inexpensive paper-based astrocyte co-culture to improve survival of low-density neuronal networks.Front Neurosci, 2018, 12: 94–107.DOI: 10.3389/fnins.2018.00094 |
| [26] | Gladkov A, Pigareva Y, Kutyina D, et al. Design of Cultured Neuron Networks in vitro with Predefined Connectivity Using Asymmetric Microfluidic Channels.Sci Rep, 2017, 7(1): 15625–15638.DOI: 10.1038/s41598-017-15506-2 |
| [27] | Ortega M, Hanrahan G, Arceo M, et al. Application of a computational neural network to optimize the fluorescence signal from a receptor-ligand interaction on a microfluidic chip.Electrophoresis, 2015, 36(3): 393–397.DOI: 10.1002/elps.201400288 |
| [28] | Peyrin JM, Deleglise B, Saias L, et al. Axon diodes for the reconstruction of oriented neuronal networks in microfluidic chambers.Lab Chip, 2011, 11(21): 3663–3673.DOI: 10.1039/c1lc20014c |
| [29] | Liu J, Pan LP, Cheng XH, et al. Perfused drop microfluidic device for brain slice culture-based drug discovery.Biomed Microdevices, 2016, 18(3): 46–62.DOI: 10.1007/s10544-016-0073-z |
| [30] | Mauleon G, Fall CP, Eddington DT. Precise spatial and temporal control of oxygen within in vitro brain slices via microfluidic gas channels.PLoS ONE, 2012, 7(8): e43309–e43317.DOI: 10.1371/journal.pone.0043309 |
| [31] | Kang G, Lee JH, Lee CS, et al. Agarose microwell based neuronal micro-circuit arrays on microelectrode arrays for high throughput drug testing.Lab Chip, 2009, 9(22): 3236–3242.DOI: 10.1039/b910738j |
| [32] | Kreir M, Van Deuren B, Versweyveld S, et al. Do in vitro assays in rat primary neurons predict drug-induced seizure liability in humans?.Toxicol Appl Pharmacol, 2018, 346: 45–57.DOI: 10.1016/j.taap.2018.03.028 |
| [33] | Yi YY, Park J, Lim J, et al. Central nervous system and its disease models on a chip.Trends Biotechnol, 2015, 33(12): 762–776.DOI: 10.1016/j.tibtech.2015.09.007 |
| [34] | Birch AM, Katsouri L, Sastre M. Modulation of inflammation in transgenic models of Alzheimer's disease.J Neuroinflammation, 2014, 11: 25–37.DOI: 10.1186/1742-2094-11-25 |
| [35] | Liu RF, Liu YC, Meng JW, et al. A microfluidics-based mobility shift assay to identify new inhibitors of β-secretase for Alzheimer's disease.Anal Bioanal Chem, 2017, 409(28): 6635–6642.DOI: 10.1007/s00216-017-0617-y |
| [36] | Lonskaya I, Hebron M, Chen WQ, et al. Tau deletion impairs intracellular β-amyloid-42 clearance and leads to more extracellular plaque deposition in gene transfer models.Mol Neurodegener, 2014, 9: 46–61.DOI: 10.1186/1750-1326-9-46 |
| [37] | Pérez-Ruiz E, Decrop D, Ven K, et al. Digital ELISA for the quantification of attomolar concentrations of Alzheimer's disease biomarker protein Tau in biological samples.Anal Chim Acta, 2018, 1015: 74–81.DOI: 10.1016/j.aca.2018.02.011 |
| [38] | Courtney M, Chen XM, Chan S, et al. Droplet microfluidic system with on-demand trapping and releasing of droplet for drug screening applications.Anal Chem, 2017, 89(1): 910–915.DOI: 10.1021/acs.analchem.6b04039 |
| [39] | Park J, Lee BK, Jeong GS, et al. Three-dimensional brain-on-a-chip with an interstitial level of flow and its application as an in vitro model of Alzheimer's disease.Lab Chip, 2014, 15(1): 141–150. |
| [40] | Blake AJ, Pearce TM, Rao NS, et al. Multilayer PDMS microfluidic chamber for controlling brain slice microenvironment.Lab Chip, 2007, 7(7): 842–849.DOI: 10.1039/b704754a |
| [41] | Cho H, Hashimoto T, Wong E, et al. Microfluidic chemotaxis platform for differentiating the roles of soluble and bound amyloid-β on microglial accumulation.Sci Rep, 2013, 3: 1823–1829.DOI: 10.1038/srep01823 |
| [42] | Stoothoff W, Jones PB, Spires-Jones TL, et al. Differential effect of three-repeat and four-repeat tau on mitochondrial axonal transport.J Neurochem, 2009, 111(2): 417–427.DOI: 10.1111/jnc.2009.111.issue-2 |
| [43] | Kunze A, Meissner R, Brando S, et al. Co-pathological connected primary neurons in a microfluidic device for Alzheimer studies.Biotechnol Bioeng, 2011, 108(9): 2241–2245.DOI: 10.1002/bit.v108.9 |
| [44] | The HD iPSC Consortium. Induced pluripotent stem cells from patients with Huntington's disease show CAG-repeat-expansion-associated phenotypes.Cell Stem Cell, 2012, 11(2): 264–278.DOI: 10.1016/j.stem.2012.04.027 |
| [45] | Lees AJ. The Parkinson chimera.Neurology, 2009, 72(7S2): S2–S11. |
| [46] | Lu X, Kim-Han JS, O'Malley KL, et al. A microdevice platform for visualizing mitochondrial transport in aligned dopaminergic axons.J Neurosci Methods, 2012, 209(1): 35–39.DOI: 10.1016/j.jneumeth.2012.05.021 |
| [47] | Fernandes JTS, Chutna O, Chu V, et al. A novel microfluidic cell co-culture platform for the study of the molecular mechanisms of Parkinson's disease and other synucleinopathies.Front Neurosci, 2016, 10: 511–521. |
| [48] | Zhou Y, Cai MH, He W, et al. Identification of serological autoantibody for screening of multiple sclerosis using proteome array.Basic Clin Med, 2016, 36(7): 941–945.(in Chinese). 周瑜, 蔡孟华, 何维, 等. 利用蛋白质芯片技术筛查多发性硬化患者的自身抗体.基础医学与临床, 2016, 36(7): 941-945. |
| [49] | Hosmane S, Tegenge MA, Rajbhandari L, et al. Toll/interleukin-1 receptor domain-containing adapter inducing interferon-β mediates microglial phagocytosis of degenerating axons.J Neurosci, 2012, 32(22): 7745–7757.DOI: 10.1523/JNEUROSCI.0203-12.2012 |
| [50] | Tang YT, Kim J, López-Valdés HE, et al. Development and characterization of a microfluidic chamber incorporating fluid ports with active suction for localized chemical stimulation of brain slices.Lab Chip, 2011, 11(13): 2247–2254.DOI: 10.1039/c1lc20197b |
| [51] | Tang YT, Mendez JM, Theriot JJ, et al. Minimum conditions for the induction of cortical spreading depression in brain slices.J Neurophysiol, 2014, 112(10): 2572–2579.DOI: 10.1152/jn.00205.2014 |
| [52] | Yap YC, King AE, Guijt RM, et al. Mild and repetitive very mild axonal stretch injury triggers cystoskeletal mislocalization and growth cone collapse.PLoS ONE, 2017, 12(5): e0176997–e0177015.DOI: 10.1371/journal.pone.0176997 |
| [53] | Dollé JP, Morrison III B, Schloss RS, et al. An organotypic uniaxial strain model using microfluidics.Lab Chip, 2013, 13(3): 432–442.DOI: 10.1039/C2LC41063J |
| [54] | Siddique R, Vyas A, Thakor N, et al. A two-compartment organotypic model of mammalian peripheral nerve repair.J Neurosci Methods, 2014, 232: 84–92.DOI: 10.1016/j.jneumeth.2014.05.005 |
| [55] | Chang WP, Wu JS, Lee CM, et al. Spatiotemporal organization and thalamic modulation of seizures in the mouse medial thalamic-anterior cingulate slice.Epilepsia, 2011, 52(12): 2344–2355.DOI: 10.1111/j.1528-1167.2011.03312.x |
| [56] | Ahadian S, Civitarese R, Bannerman D, et al. Or gan-on-a-chip platforms: a convergence of advanced materials, cells, and microscale technologies.Adv Healthc Mater, 2018, 7(2): 1700506–1700558.DOI: 10.1002/adhm.v7.2 |
