

温州医科大学 检验医学院 生命科学学院,浙江 温州 325035
收稿日期:2019-04-07;接收日期:2019-06-14;网络出版时间:2019-06-24
基金项目:国家自然科学基金(Nos. 81573110, 91729101)资助
摘要:基因治疗是一个快速发展的领域,其中关于慢病毒介导的外源基因导入研究得最为广泛。随着研发技术的不断发展,在安全性方面慢病毒已经从第一代发展至第三代,而如何工程化获得高滴度慢病毒仍是当今技术一大瓶颈。运用Fibra-Cel片状载体作为HEK293T细胞载体基质,联合多个无菌细胞转瓶在滚瓶机上培养,对贴壁细胞进行规模放大化生产。通过对第三代慢病毒包装过程中影响慢病毒滴度的因素进行逐一筛选,使病毒滴度达到最优。研究结果成功运用Fibra-Cel片状载体作为HEK293T细胞粘附载体基质,作为一种贴壁细胞规模放大的方法,筛选出了利用滚瓶机制备第三代慢病毒的最优条件,规模化生产了3批慢病毒。在时间上,将慢病毒的生产时间从质粒转染到病毒收集的120 h缩短至54 h;在成本上,利用滚瓶机代替生物反应器实现了无需反复灭菌、全程一次性产品的安全有效低成本的运行,为慢病毒的规模化制备提供了技术上的支持,为临床应用奠定了坚实的基础。
关键词:慢病毒规模化制备Fibra-Cel基因治疗CAR-T
Pilot-scale preparation of clinical-grade third generation lentivirus
Deming Duan, Yongpiao Ji, Mengjie Zhou, Jimin Gao


School of Laboratory Medicine and Life Sciences, Wenzhou Medical University, Wenzhou 325035, Zhejiang, China
Received: April 7, 2019; Accepted: June 14, 2019; Published: June 24, 2019
Supported by: National Natural Science Foundation of China (Nos. 81573110, 91729101)
Corresponding author: Jimin Gao. Tel: +86-577-86699341; E-mail: jimingao64@yahoo.com.
Abstract: Gene therapy is a rapidly developing field. The most widely used technique for foreign gene transfer is lentiviral-mediated gene therapy. Lentiviral vector has been developed from the first generation to the third generation in terms of safety. The preparation of lentiviruses with high titer remains difficult. In this study, a Fibra-Cel sheet carrier was used as an HEK293T cell carrier matrix, and several sterile cell culture spinners were combined and cultured on a roller bottle machine to scale up the adherent cells. The virus titer was maximized by screening the factors to optimize the lentivirus titer in the third-generation lentivirus packaging process one by one. Fibra-Cel sheet vector was successfully used as the matrix of HEK293T cell adhesion to culture adherent cells at large scale. The optimal conditions for large-scale preparation of the third-generation lentivirus by bottle roller were screened and three batches of lentiviruses were produced on pilot scale. The production time of lentivirus was shortened from 120 hours to 54 hours from plasmid transfection to virus collection; in terms of cost, a rolling bottle machine was used instead of a bioreactor, leading to lower cost and no need for repeated sterilization during the whole process. The safe, effective and low-cost operation of successful production will provide a technical base for the large-scale preparation of lentivirus and thus lay a firm foundation for its clinical application.
Keywords: lentiviruslarge-scale preparationFibra-Celgene therapyCAR-T
20世纪90年代,慢病毒载体作为一种安全替代品开始渐渐取代γ-逆转录病毒载体,由于慢病毒载体既能将基因插入到分裂细胞也能插入到非分裂细胞[1-2]中,且目的基因在宿主细胞中长期而稳定的表达,使其迅速成为基因修饰和细胞治疗中的重要工具。
随着对慢病毒的不断研究和开发,慢病毒从第一代开展至第三代,第一个改进是该载体系统病毒只有HIV-1 Gag、Pol、Rev和VSV-G蛋白,没有活性LTR、Tat或辅助蛋白,可以显著增加其生物安全性。第二个改进就是从表达质粒中的3′ LTR中删除了U3区域内的TATA盒、Sp1和NF-kB转录因子结合位点[3-6],这些载体称为自灭活载体(Self-inactivating vector,SIN),其长末端重复序列的增强子或启动子被删除,从理论上降低了附近基因被激活的风险。在逆转录之后,U3区域内的3′ LTR缺失被转移到原病毒DNA的5′ LTR的U3区域,引起LTR启动子的转录失活,阻止了全长载体的RNA的表达,这种改进降低了野生型HIV病毒感染后载体活化的可能性[7-9]。第3个改进就是在慢病毒载体骨架上加入了土拨鼠肝炎病毒转录后调控元件(Wood chuck hepatitis virus post-transcriptional regulatory element, WPRE),它可增强mRNA转录的稳定性,提高第三代载体的表达[10-12]。Salk的报道中指出,在慢病毒载体中添加WPRE后,转导效率提高了5倍[13-15]。
慢病毒载体的运用十分广泛,在转向临床实验时会需要大量的慢病毒载体,而将生产工艺放大则显得极为重要。可以通过扩展方法(增加生产单元)即单纯的扩大“2D”培养方法,也可以通过采用悬浮培养系统实现,后者比贴壁细胞更容易放大规模,而悬浮化贴壁依赖型细胞会降低细胞的体积/密度比,对于商品制造者来说,载体基质培养具有诸多优点。在简单的悬浮培养、流化床或填充床系统中使用载体基质,每1 mL可能得到2×108个细胞。选择正确的载体基质取决于培养细胞的类型和培养的目的。本研究在已经成熟的“2D”培养方法基础上,纵向扩展——“3D”悬浮细胞培养,对悬浮培养系统体系如细胞密度、载体基质浓度、转瓶速度、聚醚酰亚胺(Polyetherimide):DNA比例、总质粒浓度、丁酸钠浓度以及培养时间进行优化,获得最佳的慢病毒规模化制备条件,为临床应用奠定了坚定的基础。
1 材料与方法1.1 试剂与材料细胞基础培养基DMEM-MEM、RPMI1640及细胞培养其他成分HEPES、D-PBS,购自美国Gibco公司;去内毒素质粒大提试剂盒购自美国Axygen公司;Fibra-Cel购自Eppendorf公司;Cytodex1、Cytodex3购自GE Healthcare公司;polybrene、PEI购自Sigma公司;内毒素检测试剂盒购自厦门鲎试剂生物科技公司;双链DNA定量试剂盒购自上海联迈生物。
1.2 仪器与设备流式细胞分析系统(BD FACS Aria),细胞培养箱(Thermo),超速离心机(Beckman Coulter),荧光显微镜,冷冻真空干燥机、超低温冰箱和核酸蛋白电泳系统,台式高速离心机(Eppendorf 5415D),凝胶成像系统为Bio-Rad公司。
1.3 方法1.3.1 质粒提取质粒加到感受态Stbl3里,依次冰上放置5 min,42 ℃水浴锅热激90 s,冰上放置5 min后,三区划线的方法涂布于氨苄平板上。37 ℃培养12–16 h后取出平板后挑取单个菌落接种至含0.1%氨苄的LB液体培养基,37 ℃、250 r/min转速的摇床中培养14–16 h。
收获细菌,6 000×g、4 ℃离心15 min,然后依次加入10 mL Buffer P1、P2、P3,剧烈晃动离心管4–6次后室温过滤,加2.5 mL缓冲液ER至溶菌液,冰上孵育30 min,10 mL QBT润洗QIAGEN-tip 500柱子,用15 mL缓冲液QN洗脱DNA,加入10.5 mL异丙醇使DNA沉淀下来,混匀,15 000×g、4 ℃离心30 min,弃上清,5 mL 70%乙醇,15 000×g、4 ℃离心10 min,弃上清后烘干质粒。检测质粒DNA的浓度并记录,保存于-20 ℃。
1.3.2 Fibra-Cel的处理和回收用电子天平称取一定量的Fibra-Cel载体,1 g载体加入5 mL的PBS,混匀密封,4 ℃过夜后,121 ℃高压灭菌30 min,4 ℃保存。
将用过的载体基质移至玻璃器皿,用清水洗涤3次。向洗涤后的载体基质中加入0.1 mol/L醋酸浸泡4–6 h,再用清水洗涤3–5次,烘干灭菌后备用。
1.3.3 细胞铺板于Fibra-Cel载体基质配制DMEM完全培养基,从4 ℃取出PBS、已水化高压的Fibra-Cel载体基质常温复温。提前将滚瓶机打开,紫外照射30 min,温度调至37 ℃,CO2浓度调至5%。取1 L的未处理细胞培养转瓶,放入6 g Fibra-Cel载体基质。取3×108细胞,300 mL完全培养基于已加Fibra-Cel的细胞培养转瓶。将细胞培养瓶放至滚瓶机上,8 r/min旋转2 h。
1.3.4 慢病毒包装准备a、b两个无菌的离心管,分别加入5 mL的PBS,在a管中加入一定比例的PEI,在b管中加入目的质粒和包装质粒静置5 min后将a管中试剂加入b管中,轻轻混合均匀。室温孵育20 min后,将混合物移至细胞培养转瓶中,37 ℃、5% CO2培养箱孵育。
1.3.5 慢病毒滴度检测96孔板每孔铺0.2×106–0.5×106 Jurkat细胞,200 μL/孔,以1:10的比例将病毒转导入细胞,32 ℃、1 200×g离心90 min。4 h后用DPBS将细胞洗一次后铺于12孔板,转导48 h后用流式细胞术检测。将阳性细胞群圈出后,计算病毒滴度。病毒滴度T=(P*N)/(D*V)[T=病毒滴度(TU/mL),P=流式细胞术检测的阳性细胞比例(如P=0.2即阳性细胞占20%),N=转导的细胞数,D=转导时病毒稀释倍数,V=转导时的体积]。
1.3.6 双链DNA (dsDNA)定量检测向一次性微量比色皿中依次加入梯度性Tris-EDTA缓冲液和2 μg/mL小牛胸腺DNA标准浓缩液,随后加入1 mL PicoGreen定量试剂,混匀后,于室温避光孵育2–5 min,并以1×TE缓冲液为空白对照,以此结果作标准曲线,向96孔板中加入TE和2 μg/mL小牛胸腺DNA标准浓缩液,随后加入100 μL PicoGreen定量试剂,混匀,于室温避光孵育2–5 min,荧光酶标仪中检测各浓度荧光值,Ex/Em=480 nm/520 nm。
1.3.7 BSA残留检测在酶标板上设标准品浓度分别为90、60、30、15、7.5 μg/L。封板膜封板后置37 ℃温育30 min后小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干。然后显色,先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻振荡混匀,37 ℃避光显色15 min,每孔加终止液50 μL,终止反应。以空白孔调零,450 nm波长依序测量各孔的吸光度(OD450)。根据标准曲线计算BSA残留量。
1.3.8 统计学分析结果代表至少3次独立实验。实验数据用x ± s来表示,统计学分析使用非配对t检验,数据统计分析和图表制作均采用Graphpad prim 5.0,差异在P < 0.05时被认为具有统计学意义。(*P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.000 1)。
2 结果与分析2.1 质粒构建包装质粒为本实验室的第三代慢病毒质粒,如图 1所示,载体质粒含有报告基因Zsgreen。慢病毒包装后成功转染细胞,表达绿色荧光蛋白,这使得它们易于检测。
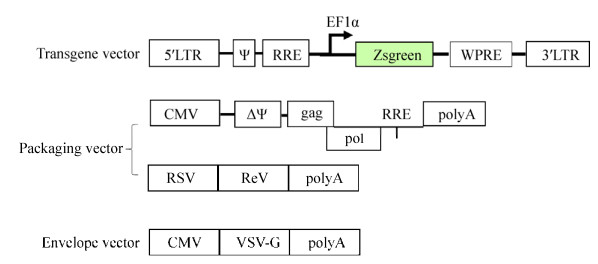 |
| 图 1 载体质粒及第三代慢病毒包装质粒系统 Fig. 1 Transgene vector and third generation lentivirus system |
| 图选项 |
2.2 细胞培养载体的选择为使细胞在转瓶内能悬浮化生长,我们评估了细胞的培养载体类型。固定接种5×105个/mL细胞,分别考察微载体Cytodex l、Cytodex3和Fibra-Cel对细胞增殖的影响。每组考察实验设3个平行实验。经过48 h的微载体培养,细胞密度均有所增加,显微镜下观察细胞在载体上的生长情况(图 2A)。利用微载体Cytodex 1培养HEK293T细胞,细胞增殖不显著;Cytodex 3细胞密度均增加为最初接种时的近4–5倍,而利用片状载体Fibra-Cel近7–9倍,且稳定转染导致的慢病毒载体滴度最高(图 2B)。因此,本实验确定使用片状载体Fibra-Cel进行HEK293T细胞规模化培养的细胞载体基质。
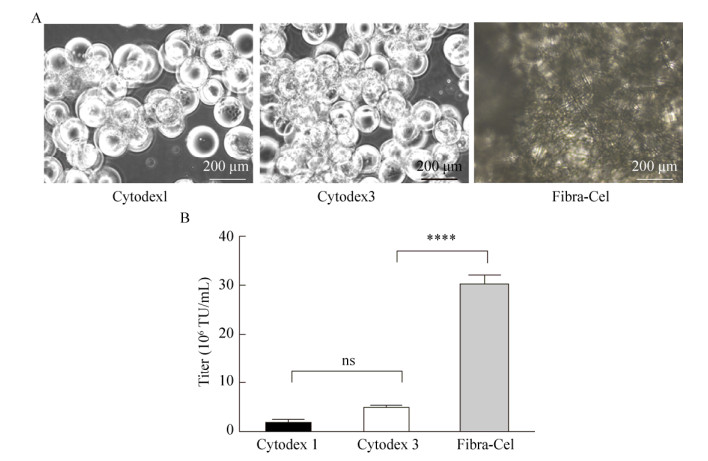 |
| 图 2 载体基质的优化 Fig. 2 Optimization of vectors and transfection methods. (A) Microscopic analysis in which three vectors are co-cultured with cells, separately. (B) Comparison of packaging the lentivirus titer of three kinds of vectors. (****P < 0.000 1) |
| 图选项 |
2.3 细胞培养条件的优化细胞的生长状态直接影响了慢病毒的生产滴度,故大规模生产慢病毒载体需要高产量的HEK293T细胞[16]。为了优化出HEK293T细胞在Fibra-Cel载体基质上富集程度,我们以20 g/L片状载体Fibra-Cel,在2 r/min、4 r/min、6 r/min、8 r/min、10 r/min转速下,使细胞与载体基质充分接触着床后,消化载体基质,计算细胞数量并统计细胞富集率(图 3A),通过显微镜下观察细胞在载体上的生长情况(图 3B)。结果显示,在8 r/min转速的转瓶中旋转2 h,可保证HEK293T细胞高效率的着床于载体基质上,且细胞密度在106/mL和2×106/mL时有相近的富集率。
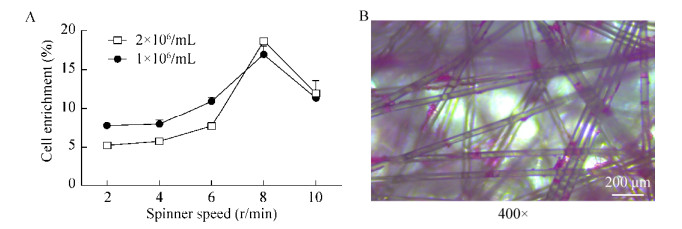 |
| 图 3 细胞培养条件的优化 Fig. 3 Optimization of cell culture conditions. (A) Effect of different spinner speeds on cell enrichment at 1×106/mL, 2×106/mL cell plating density. (B) Microscopic image of 293T cells on a Fibra-Cel disk (400×). Disks had been rinsed with phosphate-buffered saline, treated with trypsin and rinsed in DMEM to remove the bulk of the cells. Cells were fixed with 70% isopropanol and stained with Hematoxylin |
| 图选项 |
2.4 病毒包装条件优化为了进一步开发无菌细胞培养转瓶作为生产慢病毒载体的平台,我们优化了包装病毒的条件,包括丁酸钠的浓度、PEI与DNA的质量比、总质粒(μg/mL)的浓度,并且以此条件成功包装出高滴度并具有生物学功能的慢病毒。
2.4.1 生产培养基中丁酸钠浓度对慢病毒包装滴度的影响丁酸钠是一种有效的组蛋白去乙酰化抑制剂,使组蛋白高度乙酰化,从而可以引起染色质的解聚,使转染的DNA的转录和表达更高[17-19]。在细胞铺板载体基质48 h后,我们更换DMEM培养基,单一变量变化,使用丁酸钠0 mmol/L、3 mmol/L、6 mmol/L、9 mmol/L、12 mmol/L的培养基包装病毒,收集48 h的上清液,流式细胞术确定慢病毒的功能滴度。结果显示(图 4A),培养基中丁酸钠浓度为3 mmol/L时慢病毒滴度最高,但与未添加丁酸钠的培养基相比未有统计学差异。为减少慢病毒生产后下游处理,未选择丁酸钠作为增加慢病毒包装条件。
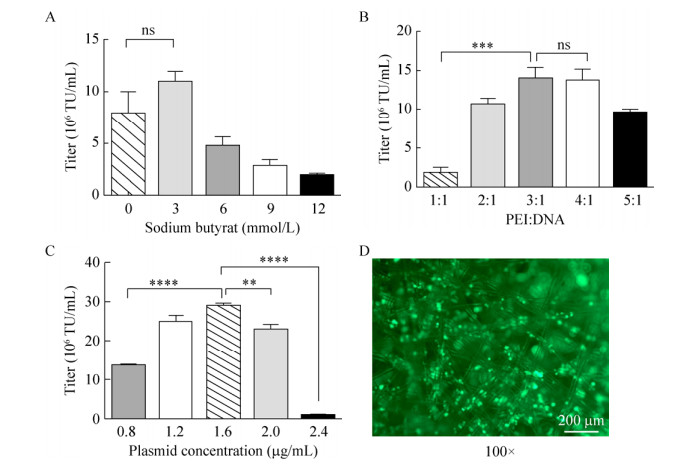 |
| 图 4 病毒包装条件的优化 Fig. 4 Optimization of virus packaging condition. (A) Effect of different concentrations of sodium butyrate on lentivirus titer. (B) Effect of different PEI: DNA ratios on lentiviral packaging. (C) Effect of different total plasmids on lentiviral packaging. (D) Light-emitting condition under a fluorescent microscope after packaging green light plasmid at 48 h. (**P < 0.01, ***P < 0.001, **** P < 0.000 1, ns: not significant) |
| 图选项 |
2.4.2 PEI对慢病毒包装滴度的影响传统质粒转染方法有磷酸钙质粒转染、PEI、LIP2000和POLYJET等,其中PEI兼具成本低、转染效率高、影响转染效率因素少等优点,故本研究选用PEI为规模化生产的转染阳离子聚合物。PEI可与DNA的磷酸酯键形成离子相互作用,形成浓缩的PEI-DNA复合物。在一定量的DNA的情况下,我们推测不同的PEI/DNA比例对病毒滴度有影响。细胞在载体基质上培养48 h后,分别以PEI:总质粒质量比为1:1、2:1、3:1、4:1、5:1包装慢病毒。结果显示(图 4B),在PEI:总质粒质量比为3:1、4:1时,可获得107 TU/mL的慢病毒,统计学分析两者无明显差异。由于PEI具有一定的细胞毒性,在生产或纯化慢病毒时缺少检测及定量PEI的方法来判定PEI是否会和慢病毒共纯化,以及共纯化的水平是否会破坏慢病毒的感染能力和稳定性,因此选择PEI:总质粒质量比为3:1作为规模化包装所用的比值。
2.4.3 总质粒量对慢病毒包装滴度的影响有研究表明,当从培养皿扩大到细胞工厂时,质粒总浓度可以按比例放大[20],利用悬浮细胞瞬时转染大规模生产慢病毒是可行的,且拥有良好的产量。但在转移到中试生产之前,该技术还需要进一步完善。优化的主要瓶颈是转染过程本身,PEI无法沉降到细胞转瓶中Fibra-Cel载体基质的细胞层上,而细胞培养转瓶中定义的最佳质粒浓度是有限的,故需要对总质粒的量进行优化。
实验结果表明,将总质粒浓度从0.8 mg/mL增加到1.6 mg/mL,可以将Fibra-Cel上产生的慢病毒的滴度提高大约两倍(图 4C)。随着总质粒浓度的继续增加,慢病毒包装的生物功能滴度呈下降趋势。
2.5 关键时间点的探索2.5.1 细胞铺板不同时间后转染接下来,我们优化了两个关键的时间变量:转染混合物的加入时间和慢病毒包装后的收集时间。
为了探索细胞形态对慢病毒生产的影响,我们以1×106/mL细胞密度接种于Firba-Cel载体基质,在细胞培养转瓶中以8 r/min的转速旋转混匀2 h后,置于37 ℃、5% CO2培养箱培养0 h、2 h、48 h、72 h后将质粒加入细胞培养基中,进行慢病毒生产。结果显示(图 5A),在HEK293T细胞落在载体基质并培养2 h后即刻进行慢病毒包装,慢病毒原液滴度可达18×106 TU/mL。一般情况下,我们认为当细胞粘附于载体基质上,细胞骨架完全伸开密度达80%时可获得较优的滴度。实验结果表明,细胞在贴壁的早期阶段所产生的慢病毒滴度最高,这可能和细胞的细胞膜通透性有关。
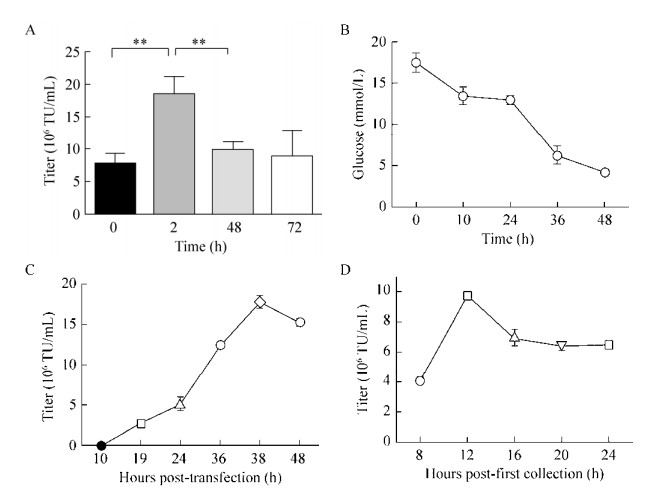 |
| 图 5 在Fibra-Cel上扩增和转染HEK293T细胞 Fig. 5 Expansion and transfection of HEK293T cells on Fibra-Cel. (A) Plasmid transfection after cells inoculation with Fibra-Cel at different times. (B) Glucose levels. (C) The supernatant is first collected at different times. (D) The supernatant was collected for the second time. **P < 0.01 |
| 图选项 |
2.5.2 第一次收取病毒时间HEK293T细胞表面广泛表达LDL-R,当细胞上清内的病毒VSV-G可以识别并结合HEK293T细胞表面LDL-R,HEK293T细胞通过胞吞的形式再次使病毒进入细胞,从而使上清中的病毒数量减少。当上清中的实际病毒数量(生产的病毒总数-进入细胞的病毒数)最大时,即可获最大慢病毒滴度。
我们分别于质粒转染后的10 h、19 h、24 h、36 h、38 h、48 h收取上清。结果显示,在38 h时,上清中的实际病毒数量达到最大值(图 5C),随着时间增加,细胞所产病毒减少,进入细胞的病毒数增加,上清病毒反而降低。HEK293T细胞以300 mL规模接种到细胞培养转瓶中的Fibra-Cel上,葡萄糖48 h内水平降低更多,表明代谢活跃细胞随着时间的推移而增多(图 5B)。
2.5.3 第二次收取病毒时间在某些情况下,可通过增加收集次数来提高最终慢病毒的质量。我们在收集第一次病毒原液后,更换10% FBS的DMEM,再次放入培养箱产毒,分别于8 h、12 h、16 h、20 h、24 h后收集第二次上清。结果显示(图 5D),在换液12 h后,获得病毒原液的生物学功能滴度最高。
2.6 GMP生产GMP (Good manufacture practices),即药品生产质量管理规范,用上述优化条件作为规模化慢病毒生产的标准工作程序(图 6),并生产3批高滴度GMP级GFP慢病毒载体产物(表 1)。这3批慢病毒进行浓缩后检测支原体、真菌、细菌、内毒素、残留DNA、BSA残留均符合欧盟国际标准(表 2),病毒浓缩后保存于-80 ℃。
 |
| 图 6 临床制造流程图 Fig. 6 Clinical manufacturing flow chart |
| 图选项 |
表 1 滚瓶机中生产慢病毒Table 1 Production of lentivirus vector in the cellroll
| Batch number | Total culture volume (mL) | Total plasmid (μg/mL) | Titer H1×106 (TU/mL) | Titer H2×106 (TU/mL) | Total volume harvested (mL) | Average titer (TU/mL) |
| GFP01 | 1 200 | 1.6 | 7.84 | 4.09 | 2 400 | 5.90 |
| GFP02 | 1 200 | 1.6 | 9.90 | 3.67 | 2 400 | 6.78 |
| GFP03 | 1 200 | 1.6 | 10.12 | 5.64 | 2 400 | 7.88 |
表选项
表 2 主要质控指标Table 2 Main quality control indicators
| Batch number | pH | Fungus | Bacterial | Mycoplasma | Endotoxin (EU/2×108 TU) | Residual BSA (ng/2×108 TU) | The total residual DNA (ng/2×108 TU) |
| GFP01 | 7.5 | (–) | (–) | (–) | 1.9 | 0.5 | 308 |
| GFP02 | 7.5 | (–) | (–) | (–) | 2.5 | 1.1 | 297 |
| GFP03 | 7.5 | (–) | (–) | (–) | 2.2 | 0.8 | 261 |
| EU reference value | 7.0–8.0 | (–) | (–) | (–) | < 25 | < 1 500 | < 4 000 |
表选项
3 讨论近年来,慢病毒载体的发展非常迅速,从第一代到第三代的四质粒系统[21-23],随着科学家对于载体质粒的不断优化,慢病毒的安全性也得到了很大程度的提高[12, 24-26]。但是,在临床试验开展的整体过程中,不仅要求慢病毒要有十分高的安全性,还要求慢病毒有足够多的具有生物学功能的病毒颗粒,因此对慢病毒生产时的滴度和生产后的下游加工提出了更高的要求。
我们在此描述了使用PEI瞬时转染生产高安全性第三代慢病毒载体的可扩展制造平台开发。基于滚瓶机联合多个透气表面未处理的无菌细胞培养转瓶封闭系统处理技术,一台滚瓶机亦可产0.3–500 L病毒原液,且无需在每批运行之间进行灭菌或必要的清洁。
转染的规模化生产需要仔细分析和优化处理步骤,转染过程和载体收集都是有时间依赖性的,并且受到本研究中所证明的许多变量的影响。有报告指出,若未能在最佳“感受”条件下生产慢病毒,最高可导致生产力降低10倍以上[27-28],此外培养时间也对转染具有很大程度的影响。在测试的变量中,我们发现几个关键的影响因素,其中包括在细胞收获前用于转染细胞的密度。我们确定转染前培养的HEK293T细胞的最佳细胞接种密度为106/mL。然而,细胞密度对病毒滴度的影响是否适用于其他载体类型以及这是否对慢病毒载体具有特异性仍有待研究。其他变量发现影响病毒滴度的因素包括转染后培养基更换的时间和转染过程中使用的质粒浓度。我们的实验结果显示,第一次收取的最佳时间为38 h,第二次收取的最佳时间为12 h。同时,1.6 μg/mL是规模化制备中转染的最佳质粒浓度。其中通过转染HEK293T细胞产生慢病毒载体的结果显示,质粒的量从每瓶1.6 μg/mL增加至2.0或2.4 μg/mL时,实际上却大大降低了病毒滴度。最后,我们总结了使用瞬时转染大规模生产慢病毒载体的新型制造平台的优化参数并生产3批慢病毒载体。
病毒的质量控制主要包括外观、可见异物、目的载体鉴别、pH、纯度、病毒滴度、无菌检查、工艺相关杂质(如DNA残留、牛血清白蛋白残留,核酸残留等)及细菌内毒素等。生产的3批慢病毒的各项质控均符合欧盟的标准值,而针对每一个特定的病毒载体,需根据病毒载体及其生产工艺的特点建立特定的质量控制检测及要求,建立相应的病毒载体参比品。
工艺开发需要严谨的条件摸索和优化,基于瞬态转染的平台一旦开发成功,就可以发挥其最大的灵活性,以节省成本和时间。本实验的探索实现了慢病毒的规模化制备,利用滚瓶机实现了无需反复灭菌、全程一次性产品的安全有效低成本的运行,在快速发展的基因治疗领域中,可用于慢病毒载体的大规模临床生产。
参考文献
| [1] | Brown PO. Integration of retroviral DNA//Swanstrom R, Vogt PK, eds. Retroviruses. Berlin: Springer, 1990, 157: 19-48 |
| [2] | Céfa? D, Simeoni E, Ludunge KM, et al. Multiply attenuated, self-inactivating lentiviral vectors efficiently transduce human coronary artery cells in vitro and rat arteries in vivo.J Mol Cell Cardiol, 2005, 38(2): 333–344.DOI: 10.1016/j.yjmcc.2004.11.031 |
| [3] | Zufferey R, Nagy D, Mandel RJ, et al. Multiply attenuated lentiviral vector achieves efficient gene delivery in vivo.Nat Biotechnol, 1997, 15(9): 871–875.DOI: 10.1038/nbt0997-871 |
| [4] | Naldini L, Bl?mer U, Gage FH, et al. Efficient transfer, integration, and sustained long-term expression of the transgene in adult rat brains injected with a lentiviral vector.Proc Natl Acad Sci USA, 1996, 93(21): 11382–11388.DOI: 10.1073/pnas.93.21.11382 |
| [5] | Dull T, Zufferey R, Kelly M, et al. A third-generation lentivirus vector with a conditional packaging system.J Virol, 1998, 72(11): 8463–8471. |
| [6] | Zufferey R, Dull T, Mandel RJ, et al. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery.J Virol, 1998, 72(12): 9873–9880. |
| [7] | Gait MJ, Karn J. RNA recognition by the human immuno-deficiency virus Tat and Rev proteins.Trends Biochem Sci, 1993, 18(7): 255–259.DOI: 10.1016/0968-0004(93)90176-N |
| [8] | Cockrell AS, Kafri T. Gene delivery by lentivirus vectors.Mol Biotechnol, 2007, 36(3): 184–204.DOI: 10.1007/s12033-007-0010-8 |
| [9] | Delenda C. Lentiviral vectors: optimization of packaging, transduction and gene expression.J Gene Med, 2004, 6: S125–S38.DOI: 10.1002/(ISSN)1521-2254 |
| [10] | Zufferey R, Donello JE, Trono D, et al. Woodchuck hepatitis virus posttranscriptional regulatory element enhances expression of transgenes delivered by retroviral vectors.J Virol, 1999, 73(4): 2886–2892. |
| [11] | Espinoza DA, Fan X, Yang D, et al. Aberrant clonal hematopoiesis following lentiviral transduction of HSPC in a rhesus macaque.Mol Ther, 2019.DOI: 10.1101/525691 |
| [12] | Engelman AN, Singh PK. Cellular and molecular mechanisms of HIV-1 integration targeting.Cell Mol Life Sci, 2018, 75(14): 2491–2507.DOI: 10.1007/s00018-018-2772-5 |
| [13] | Popa I, Harris ME, Donello JE, et al. CRM1-dependent function of a cis-acting RNA export element.Mol Cell Biol, 2002, 22(7): 2057–2067.DOI: 10.1128/MCB.22.7.2057-2067.2002 |
| [14] | Hope TJ, Romain Z, Didier T, et al. RNA export element: US19970936476, 2000-10-24. |
| [15] | Thomas J, Hope RZ. RNA export element and methods of use: US6287814, 2001. |
| [16] | Yon CS, Won PS. Recombinant expression vector system for variants of coagulation factor Ⅷ and von Willebrand factor: US20080200928. 2010-08-28. |
| [17] | Sena-Esteves M, Tebbets JC, Steffens S, et al. Optimized large-scale production of high titer lentivirus vector pseudotypes.J Virol Methods, 2004, 122(2): 131–139.DOI: 10.1016/j.jviromet.2004.08.017 |
| [18] | Joglekar AV, Sandoval S. Pseudotyped lentiviral vectors: one vector, many guises.Hum Gene Ther Methods, 2017, 28(6): 291–301.DOI: 10.1089/hgtb.2017.084 |
| [19] | Sakuma T, Barry M, Ikeda Y. Lentiviral vectors: basic to translational.Biochemical J, 2012, 443(3): 603–618.DOI: 10.1042/BJ20120146 |
| [20] | Geraerts M, Michiels M, Baekelandt V, et al. Upscaling of lentiviral vector production by tangential flow filtration.J Gene Med, 2010, 7(10): 1299–1310. |
| [21] | Kjems J, Askjaer P. Rev protein and its cellular partners.Adv Pharmacol, 2000, 48: 251–298.DOI: 10.1016/S1054-3589(00)48009-9 |
| [22] | Milone MC, O'Doherty U. Clinical use of lentiviral vectors.Leukemia, 2018, 32(7): 1529–1541.DOI: 10.1038/s41375-018-0106-0 |
| [23] | Sakuma T, Barry M, Ikeda Y, et al. Lentiviral vectors: basic to translational.Biochemical J, 2012, 443(3): 603–618. |
| [24] | Jamali A, Kapitza L, Schaser T, et al. Highly efficient and selective CAR-gene transfer using CD4- and CD8-targeted lentiviral vectors.Mol Ther Methods Clin Dev, 2019, 13: 371–379.DOI: 10.1016/j.omtm.2019.03.003 |
| [25] | Persons DA. Lentiviral vector gene therapy: effective and safe?.Mol Therapy, 2010, 18(5): 861–862.DOI: 10.1038/mt.2010.70 |
| [26] | Chen RJ, Folarin N, Ho VHB, et al. Affinity recovery of lentivirus by diaminopelargonic acid mediated desthiobiotin labelling.J Chromatogr B, 2010, 878(22): 1939–1945.DOI: 10.1016/j.jchromb.2010.05.019 |
| [27] | Strobel B, Zuckschwerdt K, Zimmermann G, et al. Standardized, scalable, and timely flexible adeno-associated virus vector production using frozen high-density HEK-293 cell stocks and CELLdiscs.Hum Gene Ther Methods, 2019, 30(1): 23–33.DOI: 10.1089/hgtb.2018.228 |
| [28] | Miyake K, Miyake N, Shimada T. Development of targeted gene transfer into human primary T lymphocytes and macrophages using high-titer recombinant HIV vectors.J Biotechnol, 2007, 129(3): 532–538.DOI: 10.1016/j.jbiotec.2007.01.004 |
