朱婉瑜1,2, 侍浏洋1, 赵维1, 黄志勇1, 王兴彪1


1. 中国科学院天津工业生物技术研究所, 工业生物系统与过程工程重点实验室, 天津 300308;
2. 天津科技大学生物工程学院, 天津 300457
收稿日期:2020-07-07;修回日期:2020-08-24;网络出版日期:2020-09-17
基金项目:天津市科技支撑计划(18ZXSZSF00100,19YFZCSF00750);国家自然科学基金(41977200);中国科学院环境生物技术重点实验室开放课题(kf2019005)
*通信作者:王兴彪, Tel: +86-22-84861930;E-mail: wang_xb@tib.cas.cn.
摘要:好氧反硝化是在好氧条件下将NO3–-N最终转化为N2的过程。好氧反硝化菌不仅表现出优秀的脱氮性能,可在许多极端条件下生存,还拥有多种重金属耐受性。本文总结了不同重金属Cr(Ⅵ)、Cu(Ⅱ)和Cd(Ⅱ)对好氧反硝化菌脱氮效率的影响,同时整理了好氧反硝化菌对不同重金属的耐受或去除机制。分析了好氧反硝化菌在工业废水处理中的应用潜力,最后对好氧反硝化菌的未来研究方向进行了简要的展望,期望为工业废水中氮污染和重金属污染处理提供更加全面的理论认识和技术支持。
关键词:好氧反硝化菌重金属硝酸盐降解耐受机理
Metabolic characteristics of aerobic denitrifiers and their interactions with heavy metals
Wanyu Zhu1,2, Liuyang Shi1, Wei Zhao1, Zhiyong Huang1, Xingbiao Wang1


1. Tianjin Key Laboratory of Industrial Biology System and Process Engineering, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China;
2. College of Biotechnology, Tianjin University of Science & Technology, Tianjin 300457, China
Received: 7 July 2020; Revised: 24 August 2020; Published online: 17 September 2020
*Corresponding author: Xingbiao Wang, Tel: +86-22-84861930;E-mail: wang_xb@tib.cas.cn.
Foundation item: Supported by the Key Technologies R & D Program of Tianjin (18ZXSZSF00100, 19YFZCSF00750), by the National Natural Science Foundation of China (41977200) and by the Open Fund of Ministry of Key Experiment of Environmental Biotechnology, Chinese Academy of Sciences (kf2019005)
Abstract: Aerobic denitrification is an aerobic process to convert NO3--N into N2. Aerobic denitrifiers not only denitrify well, but also survive under extreme conditions such as to tolerate a variety of heavy metals. This paper summarizes the effects of Cr(Ⅵ), Cu(Ⅱ), Cd(Ⅱ) on the denitrification efficiency of aerobic denitrifiers. At the same time, the mechanisms of aerobic denitrifiers to tolerate or remove different heavy metals are summarized. The application potential of aerobic denitrifiers in industrial wastewater is analyzed, and the future research direction of aerobic denitrifiers is proposed, to provide comprehensive theoretical understanding and technical support for the treatment of nitrogen and heavy metals pollution in industrial water.
Keywords: aerobic denitrifiersheavy metalsdegradation of nitratetolerance mechanism
随着我国工业和经济的发展,水资源污染问题愈发严重,仅2017年一年中国污水排放总量就达700亿m3,硝酸盐作为重点污染源,2017年总氮排放量为216万t,是水污染治理的重头[1]。2020年年初,新型冠状肺炎疫情的爆发,使得国家对医疗废水以及环境水污染的处理更加重视,医疗废水含氮量大,水质混浊,气味难闻,目前其常用的处理方法为氯消毒法,但当氮的浓度较高时,它可与氯反应生成有毒的消毒副产物(disinfection by-products,DBPs)[2]。除此之外,硝酸盐还会造成水体富营养化[3],饮用水中含硝酸盐,会对人和动物的健康造成危害,6个月以内的婴儿极易患蓝婴综合症[4-5]。常用的去除硝酸盐的方法有离子交换法、化学还原法(如Zn可以促进硝酸盐还原)[6]、使用纳米材料去除硝酸盐(如纳米颗粒,纳米管,纳米壳层等[7])以及活性炭吸附法[8]。生物脱氮的方法在污水处理厂中也被广泛使用[9],具有处理效率高、成本低、对环境污染小等优点[10-11]。好氧反硝化菌的发现更是解决了传统生物脱氮法需要进行好氧和厌氧严格分离的情况,进一步简化了工艺与操作[10]。但针对硝酸盐废水成分复杂的现状,还需要更深入的研究。
1983年,Robertson和Kuenen等[12]在研究脱硫、反硝化废水处理系统时,首次分离出好氧反硝化菌Thiosphaera pantotropha,这是一种能够在有氧条件下利用好氧反硝化酶系进行反硝化脱氮反应的异养型微生物[13]。其后,不断有研究者分离出新的好氧反硝化菌,包括Pseudomonas putida[14]、Bacillus cereus[11]、Acinetobacter junii[15]、Arthrobacter nicotianae[16]、Enterobacter cloacae[17]等。随着研究的深入,研究者们发现好氧反硝化菌具有很强的环境适应性,在低温、高盐等极端环境中不仅可以生长,还可以有效地去除水中的NO3–-N[18-19]。
高硝酸盐工业废水中常常含有Cd(Ⅱ)、Zn(Ⅱ)、Cr(Ⅵ)、Cu(Ⅱ)等重金属离子,重金属与硝酸盐的共存对生态和人体健康的危害都很大[20]。城市生活污水是典型的高氮废水,而工业废水在初步处理后会纳入城市污水处理系统,这种联合处理增加了污水处理系统中重金属离子的浓度[21]。重金属离子的有毒性、稳定性和不可生物降解性对生物脱氮法有很大的副作用[22],水体中重金属的存在对微生物细胞有着极高的毒害作用,严重抑制微生物的代谢[23],这导致重金属-硝酸盐复合污染处理困难。当Cd(Ⅱ)≥0.5 mg/L,Cu(Ⅱ)≥0.5 mg/L,Zn(Ⅱ)≥20 mg/L时,会抑制好氧反硝化菌的活性和基因表达,导致菌体细胞自身的生长繁殖受到损害[24]。所以研究废水中重金属污染对好氧反硝化的影响很有必要。随着研究不断深入,很多研究者分离出的好氧反硝化菌,不仅可以承受较高浓度的重金属离子,还可以在除去NO3–-N的同时去除水中的重金属。以往的研究中,在菌株分离和活性测试、重金属耐受能力以及相关酶类和基因表达的应激反应方面,有关数据较多,理论研究比较全面,但关于好氧反硝化菌和重金属相互作用过程及代谢机理并不全面,而研究不同好氧反硝化菌耐受重金属的机理可以进一步推进其在工艺上的应用,所以在反硝化菌同重金属离子相互作用的代谢机理和技术进步仍然有很长的路要走。综上,本文总结了近年来国内外在不同重金属条件下好氧反硝化菌的脱氮效果以及重金属对于好氧反硝化菌影响的研究,同时分析了相关的酶和功能基因表达方面的代谢机理,以期为处理含重金属硝态氮废水在脱氮和重金属拮抗的研究方面提供一定的数据支持。
1 好氧反硝化菌的脱氮效果及代谢机制 好氧反硝化菌广泛存在于自然界中,自20世纪80年代,研究者们从各种环境中分离出来约20多个属的好氧反硝化菌[25],表 1总结了近些年分离的好氧反硝化菌株的来源、NO3–-N去除效率及可以耐受的重金属离子。
表 1. 一些好氧反硝化菌及其脱氮特性 Table 1. Some aerobic denitrifiers and their denitrification characteristics
| Genus | Strains | Sources | Carbon sources | C/N | NO3–-N removal/% | Tolerated heavy metals | Time | References |
| Pseudomonas | LZ-4 | Petrochemical sewage | Sodium succinate | 10 | 95.00 | Cr(Ⅵ) | 2016 | [26] |
| ZN1 | Coking wastewater | Sodium citrate | 16 | 86.08 | Zn(Ⅱ), Cu(Ⅱ), Cr(Ⅵ), Ni(Ⅱ) | 2016 | [27] | |
| PCN-2 | Landfill leachate | Glucose | – | 100.00 | Cr(Ⅵ) | 2015 | [28] | |
| YG-24 | Taihu sediments | Sodium citrate | 8 | 70.83 | – | 2015 | [29] | |
| LX | Activated sludge | Sodium succinate | 12 | 93.22 | Cr(Ⅵ) | 2020 | [30] | |
| TJPU04 | Activated sludge | Sodium citrate | – | 93.00 | – | 2019 | [31] | |
| G12 | Sewage treatment plant | Sodium citrate | 10 | 98.00 | Cr(Ⅵ) | 2019 | [32] | |
| Acinetobacter | ND7 | Activated sludge | Sodium citrate | 8 | 97.18 | – | 2019 | [33] |
| YB | Sequential batch reactor | Sodium succinate | 15 | 99.05 | – | 2014 | [15] | |
| HA2 | Secondary sedimentation tank | Sodium acetate | – | 80.00 | – | 2013 | [34] | |
| Cupriavidus | H29 | Soil | Sodium acetate | 6 | 98.89 | Cd(Ⅱ) | 2020 | [35] |
| S1 | Coking plant | Sodium pyruvate | 14 | 98.03 | Zn(Ⅱ), Cu(Ⅱ), Cr(Ⅵ) | 2016 | [23] | |
| Rhodococcus | CPZ24 | Swine wastewater | Sodium succinate | – | 67.00 | – | 2012 | [36] |
| Agrobacterium | LAD9 | Landfill leachate | Sodium succinate | 8.28 | 100.00 | – | 2012 | [37] |
| Aeromonas | HN-02 | Activated sludge | Sodium succinate | – | 56.80 | Zn(Ⅱ), Cu(Ⅱ) | 2016 | [38] |
| Bacillus | N31 | Shrimp pond | Sodium acetate | 5–20 | 89.40 | – | 2017 | [39] |
| Alcaligenes | C16 | Coking plant | Sodium citrate | 14 | 94.70 | Fe(Ⅱ) | 2014 | [40] |
| Halomonas | B01 | Salt pond sediment | Sodium succinate | 5 | 96.00 | – | 2017 | [41] |
| Enterobacter | F2 | Activated sludge | Sodium citrate | 10 | 95.00 | Cu(Ⅱ) | 2015 | [42] |
| Arthrobacter | D51 | Paddy soil | Sodium acetate | – | 78.32 | Cu(Ⅱ) | 2019 | [16] |
| Y-10 | Laboratory | Sodium acetate | – | 100.00 | Zn(Ⅱ), Ni(Ⅱ) | 2019 | [43] | |
| –: no result. | ||||||||
表选项
碳源可提供反硝化过程中所需的还原力,显著影响脱氮效果[44]。不同碳源会导致反硝化速率差异很大。分析表 1中的碳源,大部分好氧反硝化菌可以利用醋酸钠、琥珀酸钠和柠檬酸钠进行生长,只有少数菌株可以利用葡萄糖等糖类碳源生长。C/N对好氧反硝化过程有显著影响,一些研究者认为高C/N可以保证反硝化进行得更为彻底[45],但过高的C/N也会导致最终出水的COD过高。不同好氧反硝化菌的最适C/N不一样,大多为5–20。
除了脱氮性能,研究者还进一步探究了好氧反硝化菌的关键酶。主要涉及的酶包括周质硝酸盐还原酶(periplasmic nitrate reductase,Nap)、亚硝酸盐还原酶(nitrite reductases,Nir)、一氧化氮还原酶(nitric oxide reductas,Nor)和一氧化二氮还原酶(nitrous oxide reductases,Nos)[44]。如图 1所示,好氧反硝化过程是硝酸盐还原酶将NO3–-N还原为NO2–-N,然后再通过亚硝酸盐还原酶转化为NO,NO被一氧化氮还原酶还原成N2O,最终被一氧化二氮还原酶转变为N2的过程[46]。好氧反硝化过程中所涉及的硝酸盐还原酶几乎都为周质硝酸盐还原酶(Nap,催化好氧反硝化的第一步,将NO3–-N还原为NO2–-N),而非膜质硝酸盐还原酶(membrane-bound nitrate reductase,Nar)主要作用于厌氧反硝化过程[47]。因为在好氧条件下,膜质硝酸盐还原酶被抑制,而周质硝酸盐还原酶对氧分子不敏感,仍具有活性[45]。反硝化过程中的亚硝酸盐还原酶(Nir)有两种类型,一种是细胞色素cd,另一种是含铜酶[46]。纯化后的细胞色素cd的催化产物是NO和N2O混合物,而纯化后的含铜酶则将亚硝酸盐转化为NO[48]。一氧化氮还原酶是一种膜结合还原酶,含有2个血红素b和1个血红素c,在细胞膜外催化一氧化氮的还原[46]。一氧化二氮是反硝化不完全而产生的产物,一般会由一氧化二氮还原酶进行还原,最终转变为氮气[49]。一氧化二氮还原酶(Nos)是一种位于细胞周质的含铜蛋白,通过nos z基因编码[50]。
 |
| 图 1 好氧反硝化菌的反硝化过程[46] Figure 1 Denitrification process of aerobic denitrifiers[46]. |
| 图选项 |
2 重金属对好氧反硝化菌的影响 重金属在环境中分布广泛,对细胞的危害主要在于生物毒性,对细胞的损坏以及对其代谢过程的干扰和抑制。随着近年来研究的不断深入,****们也发现了许多对不同类型重金属具有耐受或抗性的好氧反硝化菌,如Sun等[23]分离出的Cupriavidus sp. S1,可在耐受20.0 mg/L Zn2+,或8.0 mg/L Cu2+,或5.0 mg/L Cr6+的同时,维持90%以上的氮去除率;He等发现,当Zn(Ⅱ)浓度为30 mg/L时,Arthrobacter arilaitensis Y-10仍可去除NH4+-N、NO3–-N和NO2–-N [43]。这些菌株经过了长期的环境选择压力,细胞和代谢功能都产生了相应的耐受能力以抵抗这些重金属离子的冲击和毒害,细胞的代谢流程应对不同重金属的机制也各不相同。
2.1 铬Cr(Ⅵ) Cr(Ⅵ)在工业中应用广泛,含Cr(Ⅵ)废水的来源包括冶金、电镀、制革、油漆、颜料、印染、制药等行业[51],这其中很多废水又同时是高硝酸盐废水。微生物处理含氮废水以性价比高、二次污染少引起了广泛关注[11]。但Cr(Ⅵ)对很多微生物都有很强的毒性,会产生自由基来破坏DNA[30],抑制微生物生长。所以筛选能耐受Cr(Ⅵ)或者能同时将其去除的脱氮微生物成为硝酸盐废水处理中的热点。
研究人员在探究好氧反硝化菌时,发现其中许多具有耐受Cr(Ⅵ)的性能,如铜绿假单胞菌(Pseudomonas aeruginosa) G12[32]最高可以同时去除500 mg/L的NO3–-N和20 mg/L的Cr(Ⅵ),去除效率极高,均可达95%以上,且结果表明Cr(Ⅵ)的初始浓度对菌株G12的生长影响不明显,NO3–-N浓度的提高还可以促进Cr(Ⅵ)的去除;He等[28]发现铜绿假单胞菌P. aeruginosa PCN-2最高可耐受5 mg/L的Cr(Ⅵ),可在21 h内去除全部的Cr(Ⅵ),在33 h内去除近200 mg/L的NO3–-N,当Cr(Ⅵ)浓度提升至7.5 mg/L时,NO3–-N去除效率迅速下降,只有8.99%;P. brassicacearum LZ-4[26]在Cr(Ⅵ)浓度为50 mg/L,NO3–-N为700 mg/L时依然可生长,OD值达到0.8以上,50 mg/L的Cr(Ⅵ)对去除100 mg/L NO3–-N没有明显抑制作用,LZ-4能在84 h内去除80.2%的NO3–-N,反硝化速率为7.09 mg/(L·h),并且同时在61 h内完全还原Cr(Ⅵ),最大去除速率为0.236 mg/(L·h)[26];Yang等[52]分离出1株恶臭假单胞菌P. putida NP5,发现Cr(Ⅵ)对其生物毒性并不显著,当Cr(Ⅵ)浓度为50 mg/L时,对氮和磷的去除也只有部分抑制,并且在菌株异养硝化过程中,检测到Cr(Ⅵ)浓度的降低。
这些好氧反硝化菌表现出的对Cr(Ⅵ)的抗性,是由于具有独特的自解毒能力,其耐受机制主要涉及3类。一是通过产生不同的代谢产物来抵抗重金属的毒性。Chovanec等[53]通过研究Geobacter metallireducens,Desulfovibrio desulfuricans和Sulfurospirillum barnesii发现,每株菌的Cr(Ⅵ)抗性机制都不一样,G. metallireducens通过产生Fe(Ⅱ)来还原Cr(Ⅵ),间接地减少Cr(Ⅵ);D. desulfuricans能够还原Cr(Ⅵ)则是由一种分泌到培养基中的具有热稳定性和氧化还原活性的次级代谢物导致的,但此化合物如何还原Cr(Ⅵ)还有待进一步研究;S. barnesii对Cr(Ⅵ)的抗性是因为同时具有一种还原酶和一种具有氧化还原活性的代谢物。二是重金属离子对关键酶类的活性及基因表达有一定的促进作用。Yu等[26]通过研究菌株的基因发现,Cr(Ⅵ)可以促进反硝化基因的表达,加入30 mg/L的Cr(Ⅵ)之后,亚硝酸盐还原酶基因nirK、一氧化氮还原酶基因norB和一氧化二氮还原酶基因nosZ的表达水平上调了85–97倍,这可能是因为铬的氧化态可能会诱导反硝化过程中的氧化还原酶。第三则涉及氧化还原电势,此类菌能够还原Cr(Ⅵ)的主要原因是硝酸盐还原酶对电子的竞争能力弱于Cr(Ⅵ)还原酶,图 2总结了此类好氧反硝化菌对Cr(Ⅵ)进行还原的可能机制,Pseudomonas sp. LZ-4[26]的好氧反硝化过程和Cr(Ⅵ)还原过程分别使用醌/细胞色素c和NAD(P)H作为电子供体,说明两个过程之间的电子竞争是间接的,为同时去除Cr(Ⅵ)和NO3–-N提供了可能。He等[28]通过电子顺磁共振法研究了P. aeruginosa PCN-2对Cr(Ⅵ)的还原过程,在ChrR的催化作用下,Cr(Ⅵ)从NADH接收1个电子,生成中间产物Cr(V),并将其还原为最终稳定产物Cr(Ⅲ),并且在反应过程中,Cr(Ⅵ)较NO3–-N优先接受电子,所以增加Cr(Ⅵ)浓度会加强对好氧反硝化的抑制。Pseudomonas aeruginosa G12[32]的表面存在-OH,-NH,-CHO,-CONH,可为Cr(Ⅵ)还原提供电子,使Cr(Ⅵ)可在细菌表面被还原为Cr(Ⅲ)并与Cl–合成CrCl3晶体。上述菌株对Cr(Ⅵ)的抗性机制,是将毒性价态的六价铬还原成为没有毒性的三价铬状态。深入好氧反硝化菌分子水平和基因水平解毒机制的研究,有助于更好地指导实际应用。
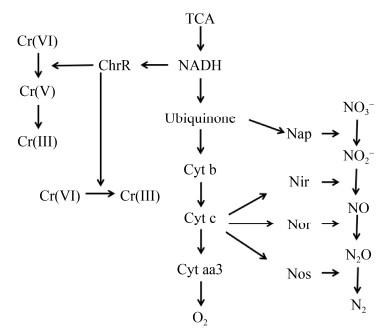 |
| 图 2 好氧反硝化和Cr(Ⅵ)还原的可能机制[26, 28] Figure 2 Possible mechanism of aerobic denitrification and Cr(Ⅵ) reduction. Collated from [26, 28]. Nap: periplasmic nitrate reductase; Nir: nitrite reductases; Nor: nitric oxide reductas; Nos: nitrous oxide reductases; Cyt: cytochrome; ChrR: chromate reductase. |
| 图选项 |
2.2 铜Cu(Ⅱ) 铜的化合物(如硫酸铜、氯化铜等)极易溶于水[54],造成其在环境中的流动性很高。冶金、电子、颜料和化工合成等多种含硝酸盐工业废水中,都含有Cu(Ⅱ)[55],传统微生物方法在处理此类废水时,仍面临着巨大的压力,处理效率不高,主要包括Cu(Ⅱ)对细胞本身的毒害以及对反硝化基因表达的抑制,所以优化提高含Cu(Ⅱ)硝酸盐废水的反硝化菌剂处理效率是当前重点研究方向,同时也是未来技术发展的主要内容之一。
关于好氧反硝化菌的细胞对Cu(Ⅱ)的耐受性能,NO3–-N去除活性的研究较多。当Cu(Ⅱ)浓度为0.01 mmol/L时,Paracoccus sp. YF1对NO3–-N去除率为98.0%,浓度为0.05 mmol/L时,NO3–-N去除率为68.7%,但当Cu(Ⅱ)浓度超过0.1 mmol/L时,就会对菌株产生较强的抑制[56];Alcaligenes faecalis WY-01在Cu(Ⅱ)浓度为3 mmol/L的情况下,氮去除率为98.19%±2.83%,Cu(Ⅱ)浓度升高至8 mmol/L时,依然可去除68.72%±5.34%的氮[57];阴沟肠杆菌Enterobacter cloacae F2在Cu(Ⅱ)浓度达到80 mg/L的情况下,对NO3–-N的去除率仍高达80%以上,并能在反应过程中除去部分的Cu(Ⅱ)[42];Pseudomonas putida ZN1对Cu(Ⅱ)很不敏感,当Cu(Ⅱ)浓度低于80 mg/L时,氮的去除不受任何影响,Cu(Ⅱ)浓度为400 mg/L时,ZN1能有效去除96.58%的氮,当Cu(Ⅱ)浓度提升至800 mg/L时,氮去除率仍能维持在62.10%[27]。上述研究说明,不同的微生物种类,或者同样科属的微生物不同菌株之间对Cu(Ⅱ)的耐受能力存在很大差异,耐受程度和原因也各不相同。
整体上说,较低浓度的Cu(Ⅱ)可以有效促进菌株的反硝化作用,但高浓度的Cu(Ⅱ)却对菌株生长有很强的抑制作用[16]。张进等[42]对添加含Cu(Ⅱ)浓度在80 mg/L污水处理前后的菌株E. cloacae F2进行了扫描电镜比对,发现菌株形态并无明显差别,可认为该浓度的Cu(Ⅱ)对于菌株脱氮过程中的细胞无明显影响,但发现活性反应过程中可溶性代谢产物增多,这些可溶性产物中存在一些基团与铜离子发生络合后使其沉淀,减轻Cu(Ⅱ)对菌体产生的生物毒性[42]。Lu等[56]在研究Paracoccus sp. YF1时发现,Cu(Ⅱ)通过影响还原酶(硝酸盐还原酶和亚硝酸盐还原酶)的活性来抑制反硝化作用,并通过傅氏转换红外线光谱等方法确定了酰胺基、羧基和醚基的孤对电子可以提供Cu(Ⅱ)的结合位点,使Cu(Ⅱ)吸附在细胞表面,从而对好氧反硝化产生影响。Zhang等[27]认为菌株ZN1对Cu(Ⅱ)的高耐受性可能是因为具有相关的铜抗性基因,并成功扩增出一条copB-I片段,该片段使得菌株ZN1可以编码相应的铜抗性蛋白,对ZN1菌株的高铜耐性起着不可或缺的作用。好氧反硝化菌对铜的耐受机制主要分为2类,一是好氧反硝化菌可通过表面官能团来吸附Cu(Ⅱ),降低Cu(Ⅱ)对细胞内部的毒性,二是细胞本身含有抗铜基因,在含NO3–-N废水处理过程中,这些基因在Cu(Ⅱ)的诱导下表达,使得细胞能够耐受高浓度的Cu(Ⅱ)[27]。
同时研究发现,Cu(Ⅱ)耐受和Cr(Ⅵ)耐受最大的区别是出现了低剂量促进的效果,这可能是因为Cu(Ⅱ)是微生物生长所必需的微量元素,在低浓度下可以促进细胞代谢以及提高微生物生长所需酶或辅酶的合成[58]。Cu(Ⅱ)好氧反硝化菌的发现,给含铜高硝酸盐废水的治理提供了新的思路,在冶金、电子等废水处理方面有广泛的应用前景。
2.3 镉Cd(Ⅱ) 水中镉污染的主要来源是电镀、冶炼、染料、电池和化学合成等工业废水的排放[59]。由于同时具有除氮除镉能力的微生物在环境中的种类、数量较少[60],镉-硝酸盐废水处理的生物技术需求更加迫切,所以发展处理此类废水的微生物对应的工程应用技术,成为了研究人员的当务之急。
有关含镉废水反硝化的处理相关研究报道不多,同时环境中存在的可以耐受或去除Cd(Ⅱ)的微生物不多,从而导致Cd(Ⅱ)条件下硝酸盐降解的菌剂资源相对较少。Cupriavidus sp. H29[35]可同时去除NO3–-N、Cd(Ⅱ)和P,初始浓度分别为55.2、30.0、50.0 mg/L时,去除率可达98.89%、85.01%及75.23%,并且Cd(Ⅱ)和P还可在生物作用下共沉淀;Gui等[24]在研究Cd(Ⅱ)对Pseudomonas stutzeri PCN-1的影响时发现,随着Cd(Ⅱ)浓度的逐渐升高,虽然NO3–-N最终可被完全消耗,但菌株反硝化速率逐渐降低,当Cd(Ⅱ)浓度为2.5 mg/L时,去除速率降低至1.7 mg/(L·h)。
在代谢产物和分子机制方面,涉及镉的研究集中在Cd(Ⅱ)去除途径、基因表达、以及Cd(Ⅱ)和氮去除的共代谢方面。Cd(Ⅱ)对好氧反硝化菌的影响主要有两类,一是细菌通过产生特定的机制,如在细胞内聚集络合重金属离子[61],或者通过产生代谢产物使重金属离子在细胞外部发生沉淀等方式,耐受Cd(Ⅱ)。Cupriavidus sp. H29[35]去除Cd(Ⅱ)主要通过两种途径,一是细胞通过生物作用将有机碳转化为二氧化碳,二氧化碳与液体介质中的镉离子反应生成碳酸镉沉淀,二是在细胞的生物作用下,镉离子与磷酸基反应形成磷酸镉沉淀。并且研究者通过研究膜组分和细胞质组分对Cd(Ⅱ)的去除率发现细胞对Cd(Ⅱ)的去除主要是由于膜相关蛋白的作用。二是通过影响好氧反硝化菌的基因表达水平,间接影响硝酸盐的去除[62]。Gui等[24]认为Cd(Ⅱ)对好氧反硝化的影响与基因表达水平密切相关,他们通过实验发现因为硝酸盐还原酶基因napA在所有实验组中的表达水平相当,所以在较高浓度的Cd(Ⅱ)条件下,NO3–-N才可被活性细胞完全去除,而大量的NO2–-N的产生,则是由于硝酸盐还原酶基因napA和亚硝酸盐还原酶基因nirS的表达水平之间存在时滞,当Cd(Ⅱ)浓度为2.5 mg/L时,NO2–-N成为反硝化过程的最终产物,说明Cd(Ⅱ)对nirS基因的抑制作用比对napA基因的抑制更严重。可以看出,Cd(Ⅱ)在好氧反硝化过程中可以通过与其他的物质形成沉淀或是被吸附的方式来去除,这在厌氧反硝化的过程中也有报道,Su等[63]在研究厌氧反硝化菌Pseudomonas sp. H117时发现该菌可以同时除去NO3–-N、Mn和Cd,H117可通过生物矿化的方式来氧化Mn(Ⅱ),形成MnO2,而MnO2则可进一步吸附Cd(Ⅱ),研究者还对厌氧及好氧条件下去除率做了对比,发现只有NO3–-N的去除率显著降低,而Cd(Ⅱ)和Mn(Ⅱ)的去除无显著差别。这为我们提供了新的思路,在去除其他重金属离子时,也可以尝试通过添加其他物质的方法,使两者进行共代谢,从而达到富集进而去除重金属污染物的目的。
2.4 其他重金属 除了Cr(Ⅵ)、Cu(Ⅱ)和Cd(Ⅱ)外,研究者发现好氧反硝化菌还能耐受锌(Zn)、镍(Ni)、铁(Fe)等其他重金属离子。Chen等[64]在探究ZnO纳米材料对Pseudomonas stutzeri PCN-1的影响时发现,ZnO的存在会导致反硝化反应的延迟,在8 h时,对照组中NO3–-N去除率为100%,而在ZnO浓度为1、4、16、64、128 mg/L的实验组中,NO3–-N去除率仅为61.9%、42.5%、38.1%、19.4%和10.9%,在32 h之后,各实验组中的NO3–-N均可完全去除,说明活性细胞对ZnO纳米材料的耐受度较高。ZnO纳米材料对细胞产生毒性,主要有两个原因,一是由于静电力,ZnO吸附在细胞表面,对细胞产生毒性;二是因为活性氧的产生极大抑制了关键反硝化酶的基因表达和催化活性[64]。Zn(Ⅱ)不仅是一种重要的微量元素,还是氮循环过程中许多酶类(氨单加氧酶、一氧化二氮还原酶和亚硝酸盐还原酶)的重要辅因子[66]。Zhang等[65]的研究表明较低浓度的Zn(Ⅱ) (< 10 mg/L)对脱氮过程并无明显抑制,甚至有利于提高菌群的活性,但高浓度的Zn(Ⅱ)会与微生物体内酶发生化学结合,从而破坏微生物的酶结构和活性,最终对脱氮过程产生抑制[66]。同时,也有研究发现,长期存在于含Zn(Ⅱ)的环境中,可提高微生物对Zn(Ⅱ)的抗性[67]。Aeromonas sp. HN-02[38]对Zn(Ⅱ)不敏感,Zn(Ⅱ) 浓度为8 mg/L时,N去除率仍能维持在94.59%。P. putida ZN1[27]可耐受较高浓度的Zn(Ⅱ) (80 mg/L),N去除率为97.79%,与对照组相同。
研究同时发现,同Zn相比,微生物对Ni(Ⅱ)的敏感度较高,Ni(Ⅱ)浓度从20 mg/L增加到80 mg/L,N的去除率从71.29%下降到31.52%[27]。Ma等[68]认为,Ni(Ⅱ)的存在会影响反硝化酶的活性,但同时细菌也会分泌更多的胞外聚合物,通过其中的官能团与Ni(Ⅱ)进行络合,来保护自己。王瑶等[40]发现,在24 h时,Fe(Ⅱ)浓度增加,可以促进Alcaligenes faecalis C16的生长和N的去除;而Fe(Ⅱ)与Mg(Ⅱ)和Mn(Ⅱ)共同存在时,也有利于菌株C16的生长和氮的去除,这可能是因为不同金属离子间的协同作用和代谢产物之间的共代谢作用。而Li等[69]在研究组合重金属离子及单一重金属离子对好氧反硝化的影响时发现,20 mg/L Cu(Ⅱ)+10 mg/L Cr(Ⅵ)无论是对反硝化速率还是对好氧反硝化关键酶的活性的抑制,都只略高于单独添加20 mg/L Cu(Ⅱ),这说明Cu(Ⅱ)和Cr(Ⅵ)共存时,对微生物酶活性并没有协同抑制作用。这些发现证明了好氧反硝化菌在含重金属的废水中也能有效脱氮,进一步地拓宽了其技术应用范围,也为今后处理此类废水增加了一些其他的可选方案。
3 总结和展望 从好氧反硝化菌被发现至今,取得了丰硕的研究成果,研究的深度和广度也在不断扩大。从最初关于菌株筛选、最适生长条件、最佳脱氮效果及关键酶研究,到之后发掘好氧反硝化菌能同时脱氮除磷,耐受低温、高盐、贫营养等极端环境,这使得好氧反硝化菌在废水处理中具有广泛应用前景。能耐受过量重金属甚至同时去除重金属的好氧反硝化菌的发现,再一次拓宽了人类对这类具有重要工业应用前景的菌株的认知和其应用范围。不同的重金属对于好氧反硝化菌的影响不同,研究重金属对于好氧反硝化的影响以及两者之间的相互作用和代谢流程,对处理冶金、染料等工业废水,都具有重要的意义。
但是,好氧反硝化菌的研究仍面临着一些挑战:(1)深入研究耐重金属好氧反硝化菌在重金属/好氧反硝化活性同环境条件之间的相互影响,提高环境普适性和鲁棒性,提高技术应用范围。(2) 重金属的存在可能会导致好氧反硝化的副产物(NO2–-N、N2O)增多,如何通过生物强化或其他方法减少这些有害副产物的产生,降低其环境潜在影响,也是一个理论研发和技术开发的难点。(3) 许多好氧反硝化菌能同时耐受多种重金属,也有部分菌株可以使两种污染物协同去除,其共代谢的机制需要更深入的研究。(4) COD也是废水处理的一个重点,如何提高好氧反硝化菌同COD去除之间的兼容性,也是重金属污染废水处理中另一个急需解决的问题。
References
| [1] | 张珏. 硝酸废水的高效生物脱氮技术研究. 上海师范大学硕士学位论文, 2019. |
| [2] | Xue RM, Donovan A, Zhang HT, Ma YF, Adams C, Yang J, Hua B, Inniss E, Eichholz T, Shi HL. Simultaneous removal of ammonia and N-nitrosamine precursors from high ammonia water by zeolite and powdered activated carbon. Journal of Environmental Sciences, 2018(64): 82-91. |
| [3] | Pawe?czyk A. Assessment of health hazard associated with nitrogen compounds in water. Water Science & Technology, 2012, 66(3): 666-672. |
| [4] | Bi JJ, Peng CS, Xu HZ. Review of research on groundwater nitrate pollution and its removal. Underground Water, 2010, 32(1): 97-102. (in Chinese) 毕晶晶, 彭昌盛, 胥慧真. 地下水硝酸盐污染与治理研究进展综述. 地下水, 2010, 32(1): 97-102. DOI:10.3969/j.issn.1004-1184.2010.01.042 |
| [5] | Zhai YZ, Lei Y, Wu J, Teng YG, Wang JS, Zhao XB, Pan XD. Does the groundwater nitrate pollution in China pose a risk to human health? A critical review of published data. Environmental Science and Pollution Research, 2017, 24(4): 3640-3653. DOI:10.1007/s11356-016-8088-9 |
| [6] | Capodaglio AG, Hlavinek P, Raboni M. Physico-chemical technologies for nitrogen removal from wastewaters: a review. Revista Ambiente & água, 2015, 10(3): 481-498. |
| [7] | Tyagi S, Rawtani D, Khatri N, Tharmavaram M. Strategies for nitrate removal from aqueous environment using nanotechnology: a review. Journal of Water Process Engineering, 2018(21): 84-95. |
| [8] | Mazarji M, Aminzadeh B, Baghdadi M, Bhatnagar A. Removal of nitrate from aqueous solution using modified granular activated carbon. Journal of Molecular Liquids, 2017(233): 139-148. |
| [9] | Cecconet D, Devecseri M, Callegari A, Capodaglio AG. Effects of process operating conditions on the autotrophic denitrification of nitrate-contaminated groundwater using bioelectrochemical systems. Science of the Total Environment, 2018(613/614): 663-671. |
| [10] | Xia L, Li XM, Fan WH, Wang JL. Heterotrophic nitrification and aerobic denitrification by a novel Acinetobacter sp. ND7 isolated from municipal activated sludge. Bioresource Technology, 2020(301): 122749. |
| [11] | Rout PR, Bhunia P, Dash RR. Simultaneous removal of nitrogen and phosphorous from domestic wastewater using Bacillus cereus GS-5 strain exhibiting heterotrophic nitrification, aerobic denitrification and denitrifying phosphorous removal. Bioresource Technology, 2017(244): 484-495. |
| [12] | Robertson LA, Kuenen JG. Thiosphaera pantotropha gen. nov. sp. nov., a facultatively anaerobic, facultatively autotrophic sulphur bacterium. Microbiology, 1983, 129(9): 2847-2855. DOI:10.1099/00221287-129-9-2847 |
| [13] | Wang ZY, Chen GY, Jiang K, Xu PY. Identification and denitrification characteristics of a psychrotolerant facultative basophilic aerobic denitrifier. Environmental Science, 2014, 35(6): 2341-2348. (in Chinese) 王兆阳, 陈国耀, 姜珂, 许培雅. 1株耐冷兼性嗜碱好氧反硝化菌的分离鉴定及反硝化特性. 环境科学, 2014, 35(6): 2341-2348. |
| [14] | Kim M, Jeong SY, Yoon SJ, Cho SJ, Kim YH, Kim MJ, Ryu EY, Lee SJ. Aerobic denitrification of Pseudomonas putida AD-21 at different C/N ratios. Journal of Bioscience and Bioengineering, 2008, 106(5): 498-502. DOI:10.1263/jbb.106.498 |
| [15] | Ren YX, Yang L, Liang X. The characteristics of a novel heterotrophic nitrifying and aerobic denitrifying bacterium, Acinetobacter junii YB. Bioresource Technology, 2014, 171: 1-9. DOI:10.1016/j.biortech.2014.08.058 |
| [16] | Cai X, Li KL, He TX, Wang YX, Zhang X, Xie EY, Ding NN, Li ZL. Characteristics of heterotrophic nitrifying and aerobic denitrifying Arthrobacter nicotianae D51 strain in the presence of copper. Water, 2019, 11(3): 434. DOI:10.3390/w11030434 |
| [17] | Guo LJ, Zhao B, An Q, Tian M. Characteristics of a novel aerobic denitrifying bacterium, Enterobacter cloacae strain HNR. Applied Biochemistry and Biotechnology, 2016, 178(5): 947-959. DOI:10.1007/s12010-015-1920-8 |
| [18] | Zhang JB, Wu PX, Hao B, Yu ZN. Heterotrophic nitrification and aerobic denitrification by the bacterium Pseudomonas stutzeri YZN-001. Bioresource Technology, 2011, 102(21): 9866-9869. DOI:10.1016/j.biortech.2011.07.118 |
| [19] | Jin RF, Liu TQ, Liu GF, Zhou JT, Huang JY, Wang AJ. Simultaneous heterotrophic nitrification and aerobic denitrification by the marine origin bacterium Pseudomonas sp. ADN-42. Applied Biochemistry and Biotechnology, 2015, 175(4): 2000-2011. DOI:10.1007/s12010-014-1406-0 |
| [20] | Su JF, Fan YY, Huang TL, Wei L, Gao CY. Modified PVA (polyvinyl alcohol) biomaterials as carriers for simultaneous removal of nitrate, Cd(Ⅱ), and Mn(Ⅱ): performance and microbial community. Environmental Science and Pollution Research, 2020, 27(22): 28348-28359. DOI:10.1007/s11356-020-09114-3 |
| [21] | Yu X, Shi JJ, Khan A, Yun H, Zhang PY, Zhang P, Kakade A, Tian YR, Pei YX, Jiang YM, Huang HY, Wu KJ, Li XK. Immobilized-microbial bioaugmentation protects aerobic denitrification from heavy metal shock in an activated-sludge reactor. Bioresource Technology, 2020(307): 123185. |
| [22] | Jiang Y, Liu Y, Zhang HN, Yang K, Li JY, Shao SL. Aerobic granular sludge shows enhanced resistances to the long-term toxicity of Cu(Ⅱ). Chemosphere, 2020(253): 126664. |
| [23] | Sun ZY, Lv YK, Liu YX, Ren RP. Removal of nitrogen by heterotrophic nitrification-aerobic denitrification of a novel metal resistant bacterium Cupriavidus sp. S1. Bioresource Technology, 2016(220): 142-150. |
| [24] | Gui MY, Chen Q, Ma T, Zheng MS, Ni JR. Effects of heavy metals on aerobic denitrification by strain Pseudomonas stutzeri PCN-1. Applied Microbiology and Biotechnology, 2017, 101(4): 1717-1727. DOI:10.1007/s00253-016-7984-8 |
| [25] | Yuan JH, Zhao TT, Peng XY. Advances in heterotrophic nitrification-aerobic denitrifying bacteria for nitrogen removal under extreme conditions. Chinese Journal of Biotechnology, 2019, 35(6): 942-955. (in Chinese) 袁建华, 赵天涛, 彭绪亚. 极端条件下异养硝化-好氧反硝化菌脱氮的研究进展. 生物工程学报, 2019, 35(6): 942-955. |
| [26] | Yu X, Jiang YM, Huang HY, Shi JJ, Wu KJ, Zhang PY, Lv JG, Li HL, He H, Liu P, Li XK. Simultaneous aerobic denitrification and Cr(Ⅵ) reduction by Pseudomonas brassicacearum LZ-4 in wastewater. Bioresource Technology, 2016(221): 121-129. |
| [27] | Zhang N, Chen H, Lyu YK, Wang Y. Nitrogen removal by a metal-resistant bacterium, Pseudomonas putida ZN1, capable of heterotrophic nitrification-aerobic denitrification. Journal of Chemical Technology and Biotechnology, 2019, 94(4): 1165-1175. DOI:10.1002/jctb.5863 |
| [28] | He D, Zheng MS, Ma T, Li C, Ni JR. Interaction of Cr(Ⅵ) reduction and denitrification by strain Pseudomonas aeruginosa PCN-2 under aerobic conditions. Bioresource Technology, 2015(185): 346-352. |
| [29] | Li CN, Yang JS, Wang X, Wang ET, Li BZ, He RX, Yuan HL. Removal of nitrogen by heterotrophic nitrification-aerobic denitrification of a phosphate accumulating bacterium Pseudomonas stutzeri YG-24. Bioresource Technology, 2015(182): 18-25. |
| [30] | Zhang X, Yan JW, Luo XT, Zhu YF, Xia L, Luo LX. Simultaneous ammonia and Cr(Ⅵ) removal by Pseudomonas aeruginosa LX in wastewater. Biochemical Engineering Journal, 2020(157): 107551. |
| [31] | He XL, Sun Q, Xu TY, Dai M, Wei DS. Removal of nitrogen by heterotrophic nitrification-aerobic denitrification of a novel halotolerant bacterium Pseudomonas mendocina TJPU04. Bioprocess and Biosystems Engineering, 2019, 42(5): 853-866. DOI:10.1007/s00449-019-02088-8 |
| [32] | An Q, Deng SM, Xu J, Nan HY, Li Z, Song JL. Simultaneous reduction of nitrate and Cr(Ⅵ) by Pseudomonas aeruginosa strain G12 in wastewater. Ecotoxicology and Environmental Safety, 2020(191): 110001. |
| [33] | Chen Q, Ni JR. Ammonium removal by Agrobacterium sp. LAD9 capable of heterotrophic nitrification-aerobic denitrification. Journal of Bioscience and Bioengineering, 2012, 113(5): 619-623. DOI:10.1016/j.jbiosc.2011.12.012 |
| [34] | Yao S, Ni JR, Ma T, Li C. Heterotrophic nitrification and aerobic denitrification at low temperature by a newly isolated bacterium, Acinetobacter sp. HA2. Bioresource Technology, 2013(139): 80-86. |
| [35] | Su JF, Zhang H, Xue L, Zhang YM. Characterization of simultaneous aerobic denitrification and dephosphorization strain Cupriavidus sp. H29 and its application on cadmium-removing. Geomicrobiology Journal, 2020, 37(5): 426-436. DOI:10.1080/01490451.2019.1711466 |
| [36] | Chen PZ, Li J, Li QX, Wang YC, Li SP, Ren TZ, Wang LG. Simultaneous heterotrophic nitrification and aerobic denitrification by bacterium Rhodococcus sp. CPZ24. Bioresource Technology, 2012(116): 266-270. |
| [37] | Xia L, Li XM, Fan WH, Wang JL. Heterotrophic nitrification and aerobic denitrification by a novel Acinetobacter sp. ND7 isolated from municipal activated sludge. Bioresource Technology, 2020(301): 122749. |
| [38] | Chen MX, Wang WC, Feng Y, Zhu XH, Zhou HZ, Tan ZL, Li XD. Impact resistance of different factors on ammonia removal by heterotrophic nitrification-aerobic denitrification bacterium Aeromonas sp. HN-02. Bioresource Technology, 2014(167): 456-461. |
| [39] | Huang F, Pan LQ, Lv N, Tang XM. Characterization of novel Bacillus strain N31 from mariculture water capable of halophilic heterotrophic nitrification-aerobic denitrification. Journal of Bioscience and Bioengineering, 2017, 124(5): 564-571. DOI:10.1016/j.jbiosc.2017.06.008 |
| [40] | Wang Y, Liu YX, An H, Zhang H. Influence of metal ions on nitrogen removal and NO2--N accumulation by Alcaligenes faecalis C16. Microbiology China, 2014, 41(11): 2254-2263. (in Chinese) 王瑶, 刘玉香, 安华, 张浩. 金属离子对粪产碱杆菌C16的脱氮和亚硝酸盐积累的影响. 微生物学通报, 2014, 41(11): 2254-2263. |
| [41] | Wang T, Li J, Zhang LH, Yu Y, Zhu YM. Simultaneous heterotrophic nitrification and aerobic denitrification at high concentrations of NaCl and ammonia nitrogen by Halomonas bacteria. Water Science & Technology, 2017, 76(2): 386-395. |
| [42] | Zhang J, Ye J, Peng HL, Li D, Xu L, Zhang YG, Xu HX, Liang YM, Liu W. Cu2+ tolerance and hunger characteristics of an aerobic denitrifying bacterium. Environmental Science & Technology, 2018, 41(S2): 43-50. (in Chinese) 张进, 叶坚, 彭焕龙, 李达, 徐梁, 张煜光, 徐海星, 梁咏梅, 刘伟. 1株耐受Cu2+好氧反硝化菌及其饥饿特性. 环境科学与技术, 2018, 41(S2): 43-50. |
| [43] | He TX, Xie DT, Ni JP, Li ZL. Ca(Ⅱ) and Mg(Ⅱ) significantly enhanced the nitrogen removal capacity of Arthrobacter arilaitensis relative to Zn(Ⅱ) and Ni(Ⅱ). Journal of Hazardous Materials, 2019(368): 594-601. |
| [44] | Yang T, Yang Y, Liu YX. Research progress and challenges of heterotrophic nitrification-aerobic denitrification. Microbiology China, 2017, 44(9): 2213-2222. (in Chinese) 杨婷, 杨娅, 刘玉香. 异养硝化-好氧反硝化的研究进展. 微生物学通报, 2017, 44(9): 2213-2222. |
| [45] | Wang W, Cai ZC, Zhong WH, Wang GX. Research advances in aerobic denitrifiers. Chinese Journal of Applied Ecology, 2007, 18(11): 2618-2625. (in Chinese) 王薇, 蔡祖聪, 钟文辉, 王国祥. 好氧反硝化菌的研究进展. 应用生态学报, 2007, 18(11): 2618-2625. |
| [46] | Ji B, Yang K, Zhu L, Jiang Y, Wang HY, Zhou J, Zhang HN. Aerobic denitrification: a review of important advances of the last 30 years. Biotechnology and Bioprocess Engineering, 2015, 20(4): 643-651. DOI:10.1007/s12257-015-0009-0 |
| [47] | Bell LC, Richardson DJ, Ferguson SJ. Periplasmic and membrane-bound respiratory nitrate reductases in Thiosphaera pantotropha: the periplasmic enzyme catalyzes the first step in aerobic denitrification. FEBS Letters, 1990, 265(1/2): 85-87. |
| [48] | Robertson LA, Kuenen JG. Combined heterotrophic nitrification and aerobic denitrification in Thiosphaera pantotropha and other bacteria. Antonie van Leeuwenhoek, 1990, 57(3): 139-152. DOI:10.1007/BF00403948 |
| [49] | Orellana LH, Rodriguez-R LM, Higgins S, Chee-Sanford JC, Sanford RA, Ritalahti KM, L?ffler FE, Konstantinidis KT. Detecting nitrous oxide reductase (NosZ) genes in soil metagenomes: method development and implications for the nitrogen cycle. mBio, 2014, 5(3): e01193-14. |
| [50] | Chon K, Chang JS, Lee E, Lee J, Ryu J, Cho J. Abundance of denitrifying genes coding for nitrate (narG), nitrite (nirS), and nitrous oxide (nosZ) reductases in estuarine versus wastewater effluent-fed constructed wetlands. Ecological Engineering, 2011, 37(1): 64-69. DOI:10.1016/j.ecoleng.2009.04.005 |
| [51] | Liu W, Li ZQ. Progress on research of treating Cr containing wastewater. Guangdong Trace Elements Science, 2007, 14(9): 5-9. (in Chinese) 刘婉, 李泽琴. 水中铬污染治理的研究进展. 广东微量元素科学, 2007, 14(9): 5-9. DOI:10.3969/j.issn.1006-446X.2007.09.002 |
| [52] | Yang L, Wang XH, Cui S, Ren YX, Yu J, Chen N, Xiao Q, Guo LK, Wang RH. Simultaneous removal of nitrogen and phosphorous by heterotrophic nitrification-aerobic denitrification of a metal resistant bacterium Pseudomonas putida strain NP5. Bioresource Technology, 2019(285): 121360. |
| [53] | Chovanec P, Sparacino-Watkins C, Zhang N, Basu P, Stolz JF. Microbial reduction of chromate in the presence of nitrate by three nitrate respiring organisms. Frontiers in Microbiology, 2012(3): 416. |
| [54] | Liang ZL, Nie ZY. Perplexity on copper contamination in waste water of PCB industry. Printed Circuit Information, 2007(12): 10-14, 37. (in Chinese) 梁志立, 聂忠源. 印制板行业水污染中铜的困扰. 印制电路信息, 2007(12): 10-14, 37. DOI:10.3969/j.issn.1009-0096.2007.12.004 |
| [55] | Li B, Liu SP. The technologies for treating wastewater containing copper and research progress. Multipurpose Utilization of Mineral Resources, 2008(5): 33-38. (in Chinese) 李博, 刘述平. 含铜废水的处理技术及研究进展. 矿产综合利用, 2008(5): 33-38. DOI:10.3969/j.issn.1000-6532.2008.05.010 |
| [56] | Lu ZY, Gan L, Lin JJ, Chen ZL. Aerobic denitrification by Paracoccus sp. YF1 in the presence of Cu(Ⅱ). Science of the Total Environment, 2019(658): 80-86. |
| [57] | Wang Y, Chen H, Liu YX, Ren RP, Lv YK. Effect of temperature, salinity, heavy metals, ammonium concentration, pH and dissolved oxygen on ammonium removal by an aerobic nitrifier. RSC Advances, 2015, 5(97): 79988-79996. DOI:10.1039/C5RA13318A |
| [58] | Chen H, Chen QQ, Jiang XY, Hu HY, Shi ML, Jin RC. Insight into the short- and long-term effects of Cu(Ⅱ) on denitrifying biogranules. Journal of Hazardous Materials, 2016(304): 448-456. |
| [59] | 黄志平, 王韶宾, 周蕾, 任丽君, 徐彩霞. 田兴涛. 含镉废水处理方法研究//中国化学会. 第五届全国"公共安全领域中的化学问题"暨第三届危险物质与安全应急技术研讨会论文集. 银川: 中国化学会, 2015: 141-145. |
| [60] | Wang P, Min XB, Chai LY. The status of treatment technology on wastewater containing cadmium and the development of its bio-treatment technology. Industrial Safety and Environmental Protection, 2006, 32(8): 14-17. (in Chinese) 王璞, 闵小波, 柴立元. 含镉废水处理现状及其生物处理技术的进展. 工业安全与环保, 2006, 32(8): 14-17. DOI:10.3969/j.issn.1001-425X.2006.08.006 |
| [61] | Kiskira K, Papirio S, Fourdrin C, van Hullebusch ED, Esposito G. Effect of Cu, Ni and Zn on Fe(Ⅱ)-driven autotrophic denitrification. Journal of Environmental Management, 2018(218): 209-219. |
| [62] | Liu NH, Liao P, Zhang JC, Zhou YY, Luo L, Huang HL, Zhang LH. Characteristics of denitrification genes and relevant enzyme activities in heavy-metal polluted soils remediated by biochar and compost. Science of the Total Environment, 2020(739): 139987. |
| [63] | Su JF, Gao CY, Huang TL, Gao YC, Bai XC, He L. Characterization and mechanism of the Cd(Ⅱ) removal by anaerobic denitrification bacterium Pseudomonas sp. H117. Chemosphere, 2019(222): 970-979. |
| [64] | Chen Q, Li TT, Gui MY, Liu SF, Zheng MS, Ni JR. Effects of ZnO nanoparticles on aerobic denitrification by strain Pseudomonas stutzeri PCN-1. Bioresource Technology, 2017(239): 21-27. |
| [65] | Zhang XJ, Chen Z, Ma YP, Zhou Y, Zhao SY, Wang LN, Zhai HF. Influence of elevated Zn(Ⅱ) on anammox system: microbial variation and zinc tolerance. Bioresource Technology, 2018(251): 108-113. |
| [66] | Cheng YF, Li GF, Liu YY, Zhu BQ, Zhang Q, Xue Y, Zhang ZZ, Jin RC. Evaluating the effects of Zn(Ⅱ) on high-rate biogranule-based denitrification: performance, microbial community and sludge characteristics. Bioresource Technology, 2019(279): 393-397. |
| [67] | Daverey A, Chen YC, Sung S, Lin JG. Effect of zinc on anammox activity and performance of simultaneous partial nitrification, anammox and denitrification (SNAD) process. Bioresource Technology, 2014(165): 105-110. |
| [68] | Ma BR, Li ZW, Wang S, Liu ZZ, Li SS, She ZL, Yu NL, Zhao CK, Jin CJ, Zhao YG, Guo L, Gao MC. Insights into the effect of nickel (Ni(Ⅱ)) on the performance, microbial enzymatic activity and extracellular polymeric substances of activated sludge. Environmental Pollution, 2019(251): 81-89. |
| [69] | Li SS, Wu SY, Ma BR, Gao MC, Wu YY, She ZL, Zhao YG, Guo Liang, Jin CJ, Ji JY. Single and combined effects of divalent copper and hexavalent chromium on the performance, microbial community and enzymatic activity of sequencing batch reactor. Science of the Total Environment, 2020(719): 137289. |
