刘昭曦, 王禄山, 陈敏


山东大学微生物技术国家重点实验室, 微生物技术研究院, 山东 青岛 266237
收稿日期:2020-07-22;修回日期:2020-09-25;网络出版日期:2020-11-05
基金项目:国家自然科学基金(31770997,31500648,31770054);青岛市博士后应用研究项目
*通信作者:陈敏, Tel/Fax: +86-531-88366078;E-mail: chenmin@sdu.edu.cn.
摘要:宿主与肠道共生菌之间存在一种互利共生的关系。肠道共生菌可以代谢宿主自身不能消化的多糖。进入肠道内的多糖是影响肠道共生菌生理状态和组成的重要因素,这些多糖主要来自饮食和宿主的粘膜分泌物。人类饮食中含有几十种不同的膳食多糖,其中大多数不能被人类基因组中编码的酶降解,并进入大肠,供肠道共生菌利用。肠道共生菌将这些不易消化的多糖转化为短链脂肪酸,作为大肠细胞和其他肠道上皮细胞的营养物质。除此之外,短链脂肪酸对人体健康有着重要的影响。不同的肠道共生菌对进入肠道内的多糖具有不同的偏好性,表明摄入膳食多糖是一种可以直接影响肠道内共生菌物种平衡的策略。因此,研究肠道菌群的多糖代谢机制具有重要的意义。本文从肠道共生菌的组成、利用进入肠道内多糖的机制,以及产生的代谢产物可能对人体健康存在的潜在影响等方面进行了综述,并介绍了代表性的肠道共生菌如拟杆菌和双歧杆菌利用多糖的途径及特征。
关键词:肠道菌群多糖膳食纤维短链脂肪酸
Glycan utilization and metabolism by gut microbiota
Zhaoxi Liu, Lushan Wang, Min Chen


State Key Laboratory of Microbial Technology, Microbial Biotechnology Institute, Shandong University, Qingdao 266237, Shandong Province, China
Received: 22 July 2020; Revised: 25 September 2020; Published online: 5 November 2020
*Corresponding author: Min Chen, Tel/Fax: +86-531-88366078;E-mail: chenmin@sdu.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31770997, 31500648, 31770054) and by the Qingdao Post-Doctoral Applied Research Program
Abstract: The gut microbiota is a changing ecosystem, containing trillions of bacteria, continuously shaped by many factors, such as dietary habits, seasonality, lifestyle, stress, antibiotics use, or diseases. Diet is the key determinant of the microbiota configuration, through modulation of the abundance of specific species and their individual or collective functions. Most complex plant polysaccharides from diet are not digested by humans and enter the colon as a potential nutrient source for the microbiota. Gut microbiota can convert these undigestible polysaccharides into short-chain fatty acids (SCFAs). Besides, SCFAs are likely to have broad impacts on various aspects of host physiology. Dietary fibers interact directly with gut microbes and lead to the production of key metabolites such as short-chain fatty acids. Dietary fibers can be considered key ancestral compounds that preserve gut ecology, especially regulating macronutrients and host physiology. Here we summarize the composition of intestinal symbiotic bacteria, the utilization of polysaccharides entering the intestinal tract, and the potential impact of metabolites on human health.
Keywords: gut microbiotapolysaccharidedietary fibershort-chain fatty acid
人类肠道中的共生菌组成了一个复杂的群落。肠道菌群对人体炎症反应、免疫系统功能以及肠道内环境稳态等方面都产生重要影响。随着过去几十年某些肠道疾病发病率的增加,肠道菌群对宿主健康的影响越来越受到关注。健康人体内的肠道共生菌可以增强肠道上皮屏障功能,减轻炎症反应,调节免疫反应,抑制肿瘤发生,抑制致病菌群的生长,从而预防炎症性肠病(IBD)、肠易激综合征(IBS)以及结直肠癌(CRC)等疾病[1]。因此,许多研究者认为通过调节肠道菌群可以促进肠道健康。饮食被认为是最容易控制和塑造肠道共生菌群的因素。这一观点得到了许多研究的支持;例如,在一项研究中发现坦桑尼亚人在雨季更频繁地食用浆果及蜂蜜,会导致拟杆菌门的丰度明显低于旱季时期[2]。此外,还有研究证明,饮食的改变可以在24 h内引起肠道微生物群组成发生变化[3]。人类饮食中含有多种膳食多糖,那些不能被宿主自身降解的膳食多糖会到达大肠被肠道共生菌降解并为肠道菌群提供能量来源[4]。膳食多糖的发酵产物短链脂肪酸(short-chain fatty acids,SCFA)既会影响其他共生菌的代谢也会影响宿主健康[5]。由于肠道菌群对多糖的利用很大程度上影响着肠道共生菌组成结构以及肠道健康,因此研究肠道菌群多糖利用的机制至关重要。基于这些原因,下文对肠道菌群的组成结构、多糖的利用机制及其代谢产物进行了介绍。
1 人体肠道菌群概况 在人类胃肠道中定殖的微生物菌群数量庞大且种类丰富。成人体内微生物菌群由约4×1013个细菌组成,并且由它们编码的基因总数超过300万个,约为人体基因总数的100多倍,微生物种类超过了1000种[6]。在健康人体的胃肠道细菌中,绝大部分为厌氧菌,主要分布在以下9个菌门中:厚壁菌门、拟杆菌门、放线菌门、变形菌门、螺旋体门、疣微菌门、梭杆菌门、蓝藻菌门以及黏胶球形菌门,其中厚壁菌门和拟杆菌门的总数多于90%(图 1)[7]。
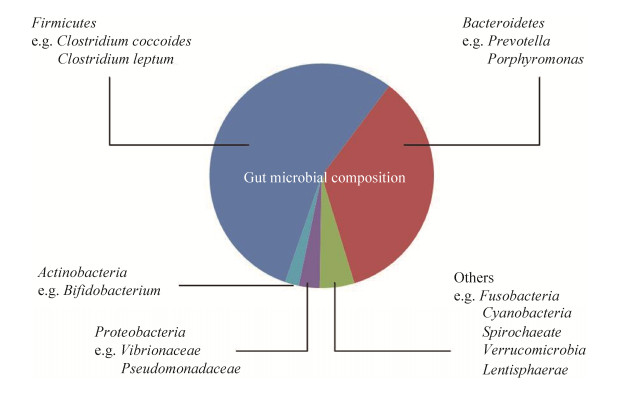 |
| 图 1 人体内肠道菌群的组成及比例 Figure 1 The gut microbiota composition. |
| 图选项 |
厚壁菌门是人体及高等哺乳动物肠道内最丰富的一大类细菌。厚壁菌门中大多数细菌是产丁酸细菌,丁酸是肠道菌发酵宿主无法吸收的多糖后的最终代谢产物之一,它在为宿主供应能量和促进肠上皮细胞的发育方面起重要作用[5]。人体肠道内第二大优势类群拟杆菌门能够降解碳水化合物,为宿主提供来自食物10%–15%的能量。据报道,拟杆菌还能通过定殖在肠粘膜表面抵御肠侵入性病原菌的粘附[8]。有大量证据表明,拟杆菌门和厚壁菌门的比例变化会导致肥胖的发展,但有的观点认为,肠道微生物对肥胖的影响很可能比这两种菌门比例的不平衡要复杂得多[9]。变形菌门细菌在人体胃肠道内的比例常低于1%,大多数的变形菌门细菌为兼性厌氧菌。由于其难以适应肠道内严格厌氧的环境,因此在正常的健康状态下,肠道内变形菌门细菌的含量较少[5]。变形菌门细菌具有多种可能与胃肠道致病性相关的毒力因子,且具有获得抗生素耐药性的能力。许多胃肠道疾病包括胃肠炎(自发性和食源性)、真菌感染、阑尾炎、克罗恩病等都与变形菌门细菌关系密切,因此吸引了很多研究者对胃肠道中变形菌门细菌进行进一步研究[5, 10]。放线菌门中的双歧杆菌属(Bifidobacterium)是人体肠道内较为常见且对人体健康起着重要作用的益生菌[11]。双岐杆菌能够酸化肠道内环境,抑制腐败菌和病原菌的生长;产生维生素和氨基酸,为人体提供必需的营养;刺激免疫应答;减少结肠癌的发生,是哺乳期肠道内关键的菌种之一[12-13]。最近的一项研究表明,婴儿肠道内存在多种双歧杆菌属细菌且菌株的基因组内容存在差异,这与它们能够利用人乳低聚糖(human milk oligosaccharides,HMOs)等不同的母乳成分生长繁殖有关[14]。这些结果进一步强调了双歧杆菌在降解饮食中母乳成分的突出能力。双歧杆菌作为一种有益健康的菌种已经被广泛应用于食品和药物中[15]。近年来,对疣微菌门的研究正不断增多,因为疣微菌门中的阿克曼粘细菌(Akkermansia muciniphila)被发现与一系列的代谢性疾病存在一定的关系[16],例如,口服阿克曼粘细菌可缓解由于饮酒导致的肠道内阿克曼粘细菌丰度的降低,这一特点可能对改善酒精性肝病有益[17]。除此之外,还有研究证明灭活的阿克曼粘细菌使小鼠粪便中的能量排泄增加,碳水化合物的吸收减少,这表现了阿克曼粘细菌在缓解肥胖方面的巨大潜力[18]。
2 肠道菌群的多糖来源 食物中,不会被人类消化的复杂多糖是肠道菌群的主要碳源,除人类自身可降解的淀粉、乳糖和蔗糖外,其余多糖逃脱了宿主小肠葡萄糖淀粉酶的消化,通过结肠,最终在许多肠道细菌的共同作用下被降解(图 2)[19],产生气体和热量以及生成短链脂肪酸。这些多糖被称为发酵多糖,可分为3类:非淀粉性多糖(nonstarch polysaccharides,NPS)、抗性淀粉(resistant starch,RS)和膳食纤维。膳食纤维中不溶性纤维具有高发酵的能力,因此在结肠中产生更多的SCFAs,而可溶性膳食纤维具有较低的发酵能力,会增加粪便的体积并降低通过结肠的时间[20]。因此,饮食中膳食纤维的数量和类型会对肠道细菌的比例和相关的代谢功能产生重要影响。Holscher等[21]证明龙舌兰菊粉改变了健康成人胃肠道微生物菌群的组成和活性,显著提高了肠道中短双歧杆菌(Bifidobacteria breve)、长双歧杆菌(Bifidobacteria longum)、Bifidobacteria adolescentis和Bifidobacteria pseudolongum的组成比例。除此之外,Benus等[22]利用荧光原位杂交技术证明食用不含纤维的饮食会导致普拉梭菌(Faecalibacterium prausnitzii)和罗斯氏菌(Roseburia)的显著减少,且这些菌群的减少与粪便中丁酸浓度的降低有关,而食用豌豆膳食纤维和低聚果糖可明显提高肠道丁酸产生菌的数目。Li等[23]的16S rDNA焦磷酸测序结果表明麦麸中的可溶性膳食纤维能显著提高肠道中拟杆菌(Bacteroides)、阿克曼氏菌(Akkermansia)和瘤胃球菌(Ruminococcus)的丰度且能降低肠道中厚壁菌门与拟杆菌门的比例。
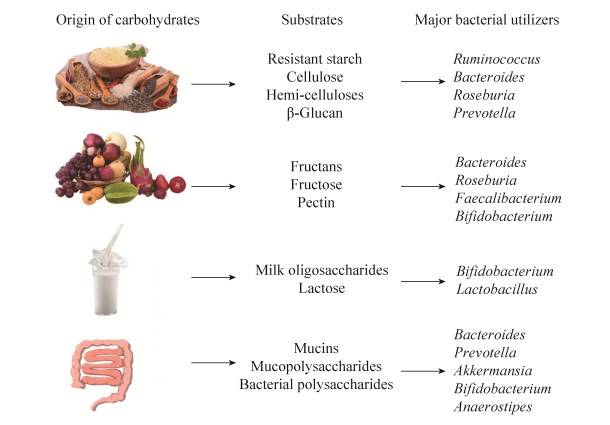 |
| 图 2 宿主以及肠道菌群代谢的多糖来源以及去路[19] Figure 2 The origin of carbohydrates and the major bacterial utilizers[19]. |
| 图选项 |
除了来自食物中不同种类以及不同数量的多糖外,从肠上皮细胞脱落的的多糖也是一种重要的多糖来源。这些内源性多糖在宿主的饮食发生剧烈变化后,可为微生物菌群提供了稳定的营养来源[24-25]。
3 肠道菌群的多糖转运模式 膳食多糖到达结肠后,肠道菌群会通过不同的降解系统和转运系统将从饮食或宿主来源的多糖降解成单糖或低聚糖,再将这些单糖或低聚糖转运至胞内进一步降解和发酵[26]。由于拟杆菌(Bacteroidetes)的高效多糖降解系统以及其能大量产短链脂肪酸的性质,使之成为在肠道菌群的多糖转运利用方面研究最多的菌种,它们的基因组中约有20%的基因被用来完成糖的分解,这也是其成为优势菌种的可能原因[27]。
在人体肠道拟杆菌中首次发现多糖利用位点,多糖利用位点已确定可以分解不同底物[28],对人类肠道中少数拟杆菌的研究发现,除了纤维素外,所有可能进入肠道的多糖都有对应的多糖转运系统。这些负责多糖运输、分解并对此过程进行调控的功能蛋白组成的体系统一称为淀粉利用系统(starch utilization system,Sus),当SusR检测到多糖分解时,外膜蛋白表达水平会显著升高,即SusA-SusG基因的表达受SusR基因的调控[29]。以拟杆菌为例,多糖分解过程一般是:多糖由SusE,SusF蛋白在表面结合,经外膜表面糖苷水解酶(GH)将原始多糖分解为多个低聚糖后由SusD蛋白结合绑定,由TonB依赖性转运蛋白提供运输低聚糖所需的能量,通过SusC蛋白从外膜转运进周质空间[30]。这些低聚糖通过壁膜间隙的GH或多糖水解酶(PL)进一步分解为更小的低聚糖。再通过内膜的转运蛋白将酶解产物转运至细胞内(图 3)[27]。
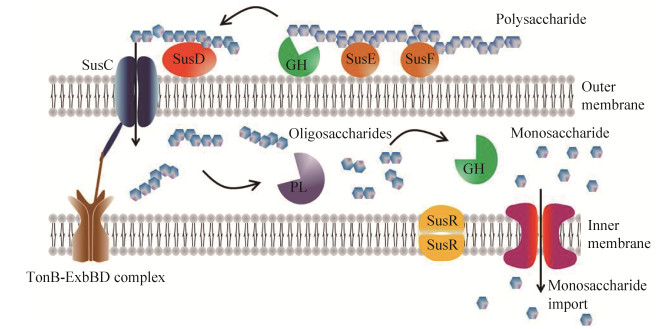 |
| 图 3 拟杆菌降解多糖模型[27] Figure 3 Model of polysaccharide utilisation system in the Bacteroides[27]. |
| 图选项 |
除革兰氏阴性菌外,一些革兰氏阳性菌的糖链获取策略在微生物菌群中也很突出。测序结果表明,厚壁菌门编码了较少的碳水化合物降解酶,但编码了更多的ABC转运蛋白(ATP结合的转运蛋白)来运输碳水化合物[31]。在放线菌中也发现了类似的ABC转运系统,其中最具代表性的是双歧杆菌。与拟杆菌不同的是,革兰氏阳性菌没有周质空间,复杂多糖被双歧杆菌产生的胞外糖苷水解酶(GHs)在细胞外被消化为低聚糖[24],然后产生的低聚糖可运输进双歧杆菌细胞内进一步降解,或供其他肠道菌群成员作为营养来源共享[24]。
通过比较基因组和转录组学分析,单糖或低聚糖可通过4种不同的通透酶家族进入双歧杆菌细胞质。这些系统包括ATP结合盒(ABC)型转运系统、磷酸烯醇丙酮酸-磷酸转移酶转运系统(PEP-PTS)、主要促进因子超家族(MFS)超家族和其糖苷-戊糖苷-己二酸酯(GPH)阳离子转运蛋白家族。其中最主要的碳水化合物转运系统是ATP结合盒(ABC)型转运系统(图 4)[32]。
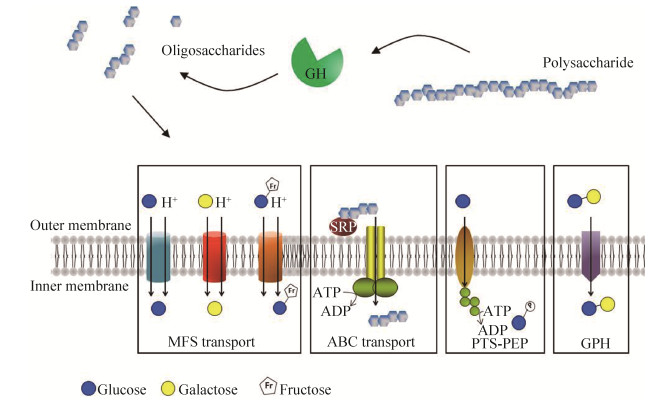 |
| 图 4 双歧杆菌的多糖利用系统[32] Figure 4 Major glycan utilisation strategy in the Bifidobacteria[32]. |
| 图选项 |
最近的几项研究调查了双歧杆菌交叉喂养碳水化合物对肠道菌群的影响。各种研究表明,双歧杆菌群落中的一些成员可以相互合作,将大而复杂的多糖降解成更多的单糖,这些单糖随后被肠道菌群中的其他成员吸收利用[32]。例如,双歧杆菌不能直接利用木聚糖,而当双歧杆菌与拥有胞外木聚糖降解活性的卵形拟杆菌共同培养时,双歧杆菌可以有效摄取木糖寡糖,然后再由双歧杆菌编码的专用ABC转运蛋白将低聚木糖转运至胞内[33]。研究表明,两个或两个以上的双歧杆菌菌株的加入,可导致这些菌株在小鼠体内定殖的持久性水平提高[32, 34]。肠道微生物进化出的交叉喂养策略使其扩展了多糖获取能力,从而提高了整个肠道菌群的生态适应性。也正是因为这种依赖性,导致在实验室条件下分离或培养细菌时遇到较多的困难,从而解释了为什么许多肠道细菌仍然被认为是“不可培养的”[32]。
另一种被广泛研究的革兰氏阳性菌多糖获取模式是通过纤维素酶体,纤维素酶体是一种多酶复合体, 能够高效降解纤维素,一些厌氧菌能够利用降解产物,使之发酵生成乙醇。纤维素酶体存在于牛瘤胃和生活在土壤中的碳水化合物降解微生物中[29]。但迄今为止在人类肠道微生物方面的研究中明显缺乏[35]。然而,一项对人类肠道菌群的宏基因组的研究揭示了纤维素酶体特征蛋白质成分(dockerins和黏连蛋白)的存在;这些功能与厚壁菌门的基因组对比后,表明粪杆菌属、真杆菌属和瘤胃球菌属可能是它们的基因组来源[36]。这一发现意味着,微生物群中至少有一些厚壁菌已经进化到可以在人类肠道中利用纤维素。
4 肠道菌群多糖发酵后产物 多糖被降解成单糖或低聚糖后会进入细菌的不同代谢途径,经过继续酵解产生一类最终产物为1–6个碳原子的短链脂肪酸,最主要的包括乙酸、丙酸和丁酸。琥珀酸和乳酸也是肠道中共生菌产生的,但由于其量较少且其他微生物会将其转化为SCFA,因此它们通常被视为中间产物[37]。
越来越多的研究表明,SCFAs对结直肠癌(CRC)的发病有重要影响。细胞内丁酸和丙酸抑制结肠细胞和免疫细胞中组蛋白脱乙酰基酶(HDACs)的活性,导致组蛋白高乙酰化,继而对基因表达和细胞分化产生影响[38]。已有多项研究证明SCFAs具有重要的抗炎作用。例如,SCFA能够下调结肠巨噬细胞中促炎细胞因子如白细胞介素6 (IL-6)和IL-12[39],还可以调节小鼠结肠调节性T细胞(cTReg细胞)[40]。还有证据表明,丁酸和丙酸可以诱导调节性T细胞的分化,调节性T细胞会表达转录因子FOXP3,而FOXP3在控制肠道炎症中起着至关重要的作用[41]。有研究证明,丁酸增加了组蛋白H3在FOXP3基因座启动子和增强子区域的乙酰化,从而导致FOXP3的表达增加[40]。丙酸的作用机制可能与丁酸的作用机制是相同的,但这一推论需要更多研究来证明[41]。除此之外,丁酸和丙酸被证明能够激活上皮细胞中的AP-1信号通路,在控制结肠癌细胞增殖和诱导细胞凋亡中起着重要作用[42]。
目前,SCFAs对宿主免疫系统的影响方面研究较为全面。除此之外,肠道菌群发酵多糖之后产生的SCFAs具有多样的生物活性。肠道内乙酸、丙酸、丁酸的比例通常是3︰1︰1,丁酸是肠道上皮细胞首选的能量来源,丙酸主要在肝脏参与代谢,只有乙酸会在肠道内达到相对较高的浓度[43]。不同SCFAs的分布、去向以及对宿主细胞代谢的影响各不相同。
乙酸是肠道内含量最丰富的SCFA,是大多数肠道细菌的净发酵产物。乙酸是由单糖降解为丙酮酸后经乙酰辅酶A和Wood-Ljungdahl途径产生的。乙酸是胆固醇和脂肪酸合成的重要底物,并在肌肉中被代谢,大部分乙酸被吸收入血液。Antunes等[44]的研究发现高纤维饮食的小鼠由于肠道内乙酸的含量增多而不易被呼吸道合胞病毒感染,乙酸可通过增加干扰素刺激基因在肺中的表达来介导干扰素β(IFN-β)的应答反应。Ganesh[45]的研究中确定了乙酸在阻塞性睡眠呼吸暂停综合征(OSA)诱发的高血压中具有重要影响,增加肠道中乙酸浓度的各种方法都能延缓OSA对微生物菌群、肠道、大脑和血压产生的不良影响。
丁酸是由乙酸、乳酸、氨基酸和各种碳水化合物通过两种不同途径的糖酵解产生的。丁酸是肠上皮细胞的主要能源,其通过线粒体中的β-氧化途径被氧化,丁酸的一部分转化为酮体,结肠细胞按丁酸、酮体、氨基酸、葡萄糖的优先顺序利用底物。丁酸有提高胰岛素敏感性、抑制结肠癌细胞的生长、诱导分化肠上皮细胞、刺激细胞骨架形成及改变基因表达等作用[46]。Szentirmai等[47]验证了丁酸可能作为细菌源性睡眠促进信号的假设,研究者将丁酸合成前体药物灌胃给小鼠,将丁酸注射给大鼠,结果发现它们的非快速眼动睡眠(NREMS)分别增加了50%与70%,且体温显著降低。患有代谢性疾病和炎症性疾病的人,肠道中产生丁酸的细菌水平往往较低。Kasahara等[48]对83种品系的小鼠的肠道菌群进行了分析,发现肠道中产丁酸菌属的丰度,尤其是罗斯拜瑞氏菌(Roseburia hominis),与动脉粥样硬化斑块大小呈显著负相关,且给小鼠肠道注射丁酸后内毒素血症和动脉粥样硬化的症状得到了缓解,说明丁酸会对心血管疾病的发病产生影响。Hong等[49]最近的一项研究表明,丁酸能缓解饮食引起的小鼠肥胖和胰岛素抵抗,另一项对小鼠的研究也表明,在膳食中添加丁酸可以通过下调PPAR-h的表达和活性促进脂肪生成向脂质氧化的转变,从而预防和逆转高脂饮食诱导的肥胖[50]。但也有人提出丁酸在肥胖中的作用存在两面性,即缓解肥胖,又促进能量的吸收,机理可能与丁酸通过肠-脑轴调控糖脂代谢有关[51]。
丙酸可由PEP通过琥珀酸途径或丙烯酸酯途径生成,其中乳酸还会被还原为丙酸(图 5)[52]。而丙酸是肝脏中葡萄糖合成的前体。丙酸主要是由肠道菌群中的优势菌群拟杆菌门参与代谢生成的,丙酸经结肠吸收以后由肝脏代谢参与糖异生作用并用作能源。Church团队[53]的研究中发现马拉松运动员的肠道菌群里存在着一种能利用乳酸通过代谢乳酸产生丙酸的韦荣球菌属菌群,将这些菌群移植到小鼠肠道后的小鼠比对照组小鼠拥有了更好的运动耐力。Huang[54]的研究显示肠道菌群来源的丙酸有助于缓解雷公藤甲素(TP)治疗时产生的肝毒性,其表现为改善炎症水平(Tnfa、Il6和Cox2)、ATP、丙二醛和肝脏组织学,通过食物、益生元和益生菌对肠道菌群的干预或补充丙酸可能是未来缓解TP毒性的一种临床策略。
 |
| 图 5 短链脂肪酸的生成途径[52] Figure 5 Pathways for biosynthesis of SCFAs from carbohydrate fermentation[52]. |
| 图选项 |
靶向改变SCFAs的比例将改变肠道菌群与人类宿主之间的生理、代谢和免疫关系[55]。尽管现在,还不能精准地利用膳食纤维进行肠道微生物代谢活性的调控,但最近的一项研究已经证明,Ⅳ型抗性淀粉(RS4s)的晶体结构使一些产酸肠道菌可以很好的粘附并利用这些膳食纤维,使少数细菌类群如瘤胃球菌(Ruminococcus)、青春双岐杆菌(B. adolescentis)选择性富集,并针对性地增加丁酸和丙酸的产量,同时抑制有害的蛋白质发酵[56]。但目前还需要解决的问题是这种调节途径存在剂量依赖性,尚不清楚能产生显著变化所需的确切的膳食纤维剂量,以及人类是否能接受这种程度的膳食纤维补充[55]。这些研究提示了我们可以针对不同的疾病情况设计碳水化合物,最终达到个性化调节肠道菌代谢产物的目的。
5 展望 近年来,由于肠道菌群与各种疾病之间千丝万缕的联系逐渐浮现,导致越来越多的研究者将目光转移到肠道菌群的研究上。微生物菌群影响人类健康和疾病的机制之一就是通过糖代谢产生与疾病发展有关的有害代谢物或可预防疾病的有益代谢物[57]。许多复杂的多糖被人体大肠中的肠道共生菌降解和发酵。由于肠道共生菌代谢多糖的能力不同而导致的菌群组成及其代谢的变化对我们理解肠道菌群在人类体内如何维持生存以及短期的群落变化如何影响人类健康具有深远的意义。因此,我们必须深入了解肠道菌群的组成结构及其多糖代谢机制,以便未来可以通过某些特定多糖或益生元来精准调控肠道菌群,以达到让肠道共生菌发挥更多对宿主有益的潜力的目的。
利用饮食中的膳食多糖来干预肠道共生菌是目前最有力和可行的方法。其中最受研究者关注的就是利用不同的膳食纤维来调节人体的健康状态。已经有大量的研究证明食用膳食纤维有抑制肥胖[58]、降低血糖[59]、降低胆固醇的吸收[60]和预防心血管疾病[20, 61]的作用。除此之外,还有研究调查了1575例Ⅰ期至Ⅲ期的结直肠癌患者,在摄入大量纤维—尤其是谷类食物后,整体死亡率出现下降,诊断后即刻增加纤维摄入量的患者表现出更好的生存率[62]。Joanna团队[63]证明了从谷物、水果和蔬菜中摄取的膳食纤维还可通过其抗炎特性预防慢性阻塞性肺病(COPD),实验结果显示,在已戒烟的男性中,高纤维摄入量与慢性阻塞性肺病的发病率呈负相关。还有研究者研究了膳食纤维在病毒感染中的作用,发现可发酵膳食纤维通过两种互补机制提高流感感染小鼠的存活率,证明了短链脂肪酸通过提高代谢而增强了CD8+效应T细胞的功能且短链脂肪酸可通过促进Ly6c-巡逻单核细胞(巨噬细胞的前体细胞)的产生而改善造血作用[64]。据报道,膳食纤维摄入过少会导致肠道菌在近端结肠区域的代谢受到影响,可能导致多糖运输的时间缩短、有毒代谢物的产生增加或保护性代谢物如丁酸的产生减少,从而导致疾病的发生。
深入了解肠道微生物降解多糖的机制一方面可以更好地阐明糖类物质对宿主健康的影响,另一方面可以更准确地利用膳食多糖来调节肠道微生物生态,以促进健康。在未来的研究中可根据不同肠道共生菌的不同多糖代谢能力,从食物中提取和纯化对宿主有益的膳食纤维,也可将经过选择性修饰或合成的新型纤维作为新一代益生元,旨在为肠道补充对宿主有益的肠道共生菌并调节肠道中特定的代谢物的含量。这些策略将成为肠道菌群对相关疾病治疗与预防领域产生重大影响的一项挑战。
References
| [1] | Tanaka M, Nakayama J. Development of the gut microbiota in infancy and its impact on health in later life. Allergology International, 2017, 66(4): 515-522. DOI:10.1016/j.alit.2017.07.010 |
| [2] | Fan Y, Pedersen O. Gut microbiota in human metabolic health and disease. Nature Reviews Microbiology, 2020. DOI:10.1038/s41579-020-0433-9 |
| [3] | David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, Ling AV, Devlin AS, Varma Y, Fischbach MA, Biddinger SB, Dutton RJ, Turnbaugh PJ. Diet rapidly and reproducibly alters the human gut microbiome. Nature, 2014, 505(7484): 559-563. DOI:10.1038/nature12820 |
| [4] | Jha R, Berrocoso JD. Review: dietary fiber utilization and its effects on physiological functions and gut health of swine. Animal: an International Journal of Animal Bioscience, 2015, 9(9): 1441-1452. DOI:10.1017/S1751731115000919 |
| [5] | 李旻. 人体肠道菌群结构与宿主代谢的相关性研究. 上海交通大学博士学位论文, 2009. |
| [6] | Menni C, Jackson MA, Pallister T, Steves CJ, Spector TD, Valdes AM. Gut microbiome diversity and high-fibre intake are related to lower long-term weight gain. International Journal of Obesity, 2017, 41(7): 1099-1105. DOI:10.1038/ijo.2017.66 |
| [7] | Qin JJ, Li RQ, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T, Pons N, Levenez F, Yamada T, Mende DR, Li JH, Xu JM, Li SC, Li DF, Cao JJ, Wang B, Liang HQ, Zheng HS, Xie YL, Tap J, Lepage P, Bertalan M, Batto JM, Hansen T, Le Paslier D, Linneberg A, Nielsen HB, Pelletier E, Renault P, Sicheritz-Ponten T, Turner K, Zhu HM, Yu C, Li ST, Jian M, Zhou Y, Li YR, Zhang XQ, Li SG, Qin N, Yang HM, Wang J, Brunak S, Doré J, Guarner F, Kristiansen K, Pedersen O, Parkhill J, Weissenbach J, Consortium M, Bork P, Ehrlich SD, Wang J. A human gut microbial gene catalogue established by metagenomic sequencing. Nature, 2010, 464(7285): 59-65. DOI:10.1038/nature08821 |
| [8] | Marcobal A, Barboza M, Sonnenburg ED, Pudlo N, Martens EC, Desai P, Lebrilla CB, Weimer BC, Mills DA, German JB, Sonnenburg JL. Bacteroides in the infant gut consume milk oligosaccharides via mucus-utilization pathways. Cell Host & Microbe, 2011, 10(5): 507-514. |
| [9] | John GK, Mullin GE. The gut microbiome and obesity. Current Oncology Reports, 2016, 18(7): 45. DOI:10.1007/s11912-016-0528-7 |
| [10] | Hamilton AL, Kamm MA, Ng SC, Morrison M. Proteus spp. as putative gastrointestinal pathogens. Clinical Microbiology Reviews, 2018, 3: e00085-17. |
| [11] | Cani PD, Neyrinck AM, Fava F, Knauf C, Burcelin RG, Tuohy KM, Gibson GR, Delzenne NM. Selective increases of bifidobacteria in gut microflora improve high-fat-diet-induced diabetes in mice through a mechanism associated with endotoxaemia. Diabetologia, 2007, 50(11): 2374-2383. DOI:10.1007/s00125-007-0791-0 |
| [12] | Ninonuevo MR, Park Y, Yin HF, Zhang JH, Ward RE, Clowers BH, German JB, Freeman SL, Killeen K, Grimm R, Lebrilla CB. A strategy for annotating the human milk glycome. Journal of Agricultural and Food Chemistry, 2006, 54(20): 7471-7480. DOI:10.1021/jf0615810 |
| [13] | Dominguez-Bello MG, De Jesus-Laboy KM, Shen N, Cox LM, Amir A, Gonzalez A, Bokulich NA, Song SJ, Hoashi M, Rivera-Vinas JI, Mendez K, Knight R, Clemente JC. Partial restoration of the microbiota of cesarean-born infants via vaginal microbial transfer. Nature Medicine, 2016, 22(3): 250-253. DOI:10.1038/nm.4039 |
| [14] | Lawson MAE, O'Neill IJ, Kujawska M, Javvadi SJ, Wijeyesekera A, Flegg Z, Chalklen L, Hall LJ. Breast milk-derived human milk oligosaccharides promote Bifidobacterium interactions within a single ecosystem. The ISME Journal, 2020, 14(2): 635-648. DOI:10.1038/s41396-019-0553-2 |
| [15] | Eckburg PB, Bik EM, Bernstein CN, Purdom E, Dethlefsen L, Sargent M, Gill SR, Nelson KE, Relman DA. Diversity of the human intestinal microbial flora. Science, 2005, 308(5728): 1635-1638. DOI:10.1126/science.1110591 |
| [16] | Ti PP, Pang XY, Lv JP. Research progress of Akkermansia muciniphila. Science and Technology of Food Industry, 2018, 39(13): 311-314, 324. (in Chinese) 提盼盼, 逄晓阳, 吕加平. 阿克曼粘细菌研究进展. 食品工业科技, 2018, 39(13): 311-314, 324. |
| [17] | Grander C, Adolph TE, Wieser V, Lowe P, Wrzosek L, Gyongyosi B, Ward DV, Grabherr F, Gerner RR, Pfister A, Enrich B, Ciocan D, Macheiner S, Mayr L, Drach M, Moser P, Moschen AR, Perlemuter G, Szabo G, Cassard AM, Tilg H. Recovery of ethanol-induced Akkermansia muciniphila depletion ameliorates alcoholic liver disease. Gut, 2018, 67(5): 891-901. DOI:10.1136/gutjnl-2016-313432 |
| [18] | Depommier C, Van Hul M, Everard A, Delzenne NM, De Vos WM, Cani PD. Pasteurized Akkermansia muciniphila increases whole-body energy expenditure and fecal energy excretion in diet-induced obese mice. Gut Microbes, 2020, 11(5): 1231-1245. DOI:10.1080/19490976.2020.1737307 |
| [19] | B?ckhed F, Ley RE, Sonnenburg JL, Peterson DA, Gordon JI. Host-bacterial mutualism in the human intestine. Science, 2005, 307(5717): 1915-1920. DOI:10.1126/science.1104816 |
| [20] | Wang J, Liu S, Zou Y, Ma H, Wang S. Research advances in the aassociations of dietary fiber with gut microbiota and related. Food Research and Development, 2020, 41(11): 201-207. (in Chinese) 王津, 刘爽, 邹妍, 马慧, 王硕. 膳食纤维和肠道微生物及相关疾病的研究进展. 食品研究与开发, 2020, 41(11): 201-207. |
| [21] | Holscher HD, Bauer LL, Gourineni V, Pelkman CL, Fahey GC Jr, Swanson KS. Agave inulin supplementation affects the fecal microbiota of healthy adults participating in a randomized, double-blind, placebo-controlled, crossover trial. The Journal of Nutrition, 2015, 145(9): 2025-2032. DOI:10.3945/jn.115.217331 |
| [22] | Benus RFJ, Van Der Werf TS, Welling GW, Judd PA, Taylor MA, Harmsen HJM, Whelan K. Association between Faecalibacterium prausnitzii and dietary fibre in colonic fermentation in healthy human subjects. The British Journal of Nutrition, 2010, 104(5): 693-700. DOI:10.1017/S0007114510001030 |
| [23] | Li Q, Wu T, Liu R, Zhang M, Wang RJ. Soluble dietary fiber reduces trimethylamine metabolism via gut microbiota and co-regulates host AMPK pathways. Molecular Nutrition & Food Research, 2017, 61(12): 1700473. |
| [24] | Koropatkin NM, Cameron EA, Martens EC. How glycan metabolism shapes the human gut microbiota. Nature Reviews. Microbiology, 2012, 10(5): 323-335. DOI:10.1038/nrmicro2746 |
| [25] | Larsson JM, Karlsson H, Sj?vall H, Hansson GC. A complex, but uniform O-glycosylation of the human MUC2 mucin from colonic biopsies analyzed by nanoLC/MSn. Glycobiology, 2009, 19(7): 756-766. DOI:10.1093/glycob/cwp048 |
| [26] | Dalile B, Van Oudenhove L, Vervliet B, Verbeke K. The role of short-chain fatty acids in microbiota-gut-brain communication. Nature Reviews. Gastroenterology & Hepatology, 2019, 16(8): 461-478. |
| [27] | Singh RP. Glycan utilisation system in Bacteroides and Bifidobacteria and their roles in gut stability and health. Applied Microbiology and Biotechnology, 2019, 103(18): 7287-7315. DOI:10.1007/s00253-019-10012-z |
| [28] | Reichardt N, Vollmer M, Holtrop G, Farquharson FM, Wefers D, Bunzel M, Duncan SH, Drew JE, Williams LM, Milligan G, Preston T, Morrison D, Flint HJ, Louis P. Specific substrate-driven changes in human faecal microbiota composition contrast with functional redundancy in short-chain fatty acid production. The ISME Journal, 2018, 12(2): 610-622. DOI:10.1038/ismej.2017.196 |
| [29] | Tancula E, Feldhaus MJ, Bedzyk LA, Salyers AA. Location and characterization of genes involved in binding of starch to the surface of Bacteroides thetaiotaomicron. Journal of Bacteriology, 1992, 174(17): 5609-5616. DOI:10.1128/jb.174.17.5609-5616.1992 |
| [30] | Foley MH, Cockburn DW, Koropatkin NM. The Sus operon: a model system for starch uptake by the human gut Bacteroidetes. Cellular and Molecular Life Sciences, 2016, 73(14): 2603-2617. DOI:10.1007/s00018-016-2242-x |
| [31] | Mahowald MA, Rey FE, Seedorf H, Turnbaugh PJ, Fulton RS, Wollam A, Shah N, Wang C, Magrini V, Wilson RK, Cantarel BL, Coutinho PM, Henrissat B, Crock LW, Russell A, Verberkmoes NC, Hettich RL, Gordon JI. Characterizing a model human gut microbiota composed of members of its two dominant bacterial phyla. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(14): 5859-5864. DOI:10.1073/pnas.0901529106 |
| [32] | Turroni F, Milani C, Duranti S, Mahony J, Van Sinderen D, Ventura M. Glycan utilization and cross-feeding activities by Bifidobacteria. Trends in Microbiology, 2018, 26(4): 339-350. DOI:10.1016/j.tim.2017.10.001 |
| [33] | Rogowski A, Briggs JA, Mortimer JC, Tryfona T, Terrapon N, Lowe EC, Baslé A, Morland C, Day AM, Zheng HJ, Rogers TE, Thompson P, Hawkins AR, Yadav MP, Henrissat B, Martens EC, Dupree P, Gilbert HJ, Bolam DN. Corrigendum: glycan complexity dictates microbial resource allocation in the large intestine. Nature Communications, 2016, 7: 10705. DOI:10.1038/ncomms10705 |
| [34] | 王琳琳. 双歧杆菌对便秘的影响及其作用机理研究. 江南大学博士学位论文, 2017. |
| [35] | Sonnenburg ED, Zheng HJ, Joglekar P, Higginbottom SK, Firbank SJ, Bolam DN, Sonnenburg JL. Specificity of polysaccharide use in intestinal Bacteroides species determines diet-induced microbiota alterations. Cell, 2010, 141(7): 1241-1252. DOI:10.1016/j.cell.2010.05.005 |
| [36] | Artzi L, Bayer EA, Mora?s S. Cellulosomes: bacterial nanomachines for dismantling plant polysaccharides. Nature Reviews. Microbiology, 2017, 15(2): 83-95. DOI:10.1038/nrmicro.2016.164 |
| [37] | Koh A, De Vadder F, Kovatcheva-Datchary P, B?ckhed F. From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites. Cell, 2016, 165(6): 1332-1345. DOI:10.1016/j.cell.2016.05.041 |
| [38] | Fung KYC, Cosgrove L, Lockett T, Head R, Topping DL. A review of the potential mechanisms for the lowering of colorectal oncogenesis by butyrate. The British Journal of Nutrition, 2012, 108(5): 820-831. DOI:10.1017/S0007114512001948 |
| [39] | Chang PV, Hao L, Offermanns S, Medzhitov R. The microbial metabolite butyrate regulates intestinal macrophage function via histone deacetylase inhibition. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(6): 2247-2252. DOI:10.1073/pnas.1322269111 |
| [40] | Furusawa Y, Obata Y, Fukuda S, Endo TA, Nakato G, Takahashi D, Nakanishi Y, Uetake C, Kato K, Kato T, Takahashi M, Fukuda NN, Murakami S, Miyauchi E, Hino S, Atarashi K, Onawa S, Fujimura Y, Lockett T, Clarke JM, Topping DL, Tomita M, Hori S, Ohara O, Morita T, Koseki H, Kikuchi J, Honda K, Hase K, Ohno H. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature, 2013, 504(7480): 446-450. DOI:10.1038/nature12721 |
| [41] | Arpaia N, Campbell C, Fan XY, Dikiy S, Van Der Veeken J, Deroos P, Liu H, Cross JR, Pfeffer K, Coffer PJ, Rudensky AY. Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation. Nature, 2013, 504(7480): 451-455. DOI:10.1038/nature12726 |
| [42] | Nepelska M, Cultrone A, Béguet-Crespel F, Le Roux K, Doré J, Arulampalam V, Blottière HM. Butyrate produced by commensal bacteria potentiates phorbol esters induced AP-1 response in human intestinal epithelial cells. PLoS ONE, 2012, 7(12): e52869. DOI:10.1371/journal.pone.0052869 |
| [43] | Sleeth ML, Thompson EL, Ford HE, Zac-Varghese SEK, Frost G. Free fatty acid receptor 2 and nutrient sensing: a proposed role for fibre, fermentable carbohydrates and short-chain fatty acids in appetite regulation. Nutrition Research Reviews, 2010, 23(1): 135-145. DOI:10.1017/S0954422410000089 |
| [44] | Antunes KH, Fachi JL, De Paula R, Da Silva EF, Pral LP, Dos Santos Aá, Dias GBM, Vargas JE, Puga R, Mayer FQ, Maito F, Zarate-Blades CR, Ajami NJ, Sant'Ana MR, Candreva T, Rodrigues HG, Schmiele M, Clerici MTPS, Proen?a-Modena GL, Vieira AT, Mackay CR, Mansur D, Caballero MT, Marzec J, Li JY, Wang XT, Bell D, Polack FP, Kleeberger SR, Stein RT, Vinolo MAR, De Souza AP. Microbiota-derived acetate protects against respiratory syncytial virus infection through a GPR43-type 1 interferon response. Nature Communications, 2019, 10(1): 3273. DOI:10.1038/s41467-019-11152-6 |
| [45] | Ganesh BP, Nelson JW, Eskew JR, Ganesan A, Ajami NJ, Petrosino JF, Bryan RM Jr, Durgan DJ. Prebiotics, probiotics, and acetate supplementation prevent hypertension in a model of obstructive sleep apnea. Hypertension, 2018, 72(5): 1141-1150. DOI:10.1161/HYPERTENSIONAHA.118.11695 |
| [46] | Meng DL. Physiological function of short-chain fatty acids in the intestine. Chinese Journal of New Clinical Medicine, 2018, 11(2): 198-202. (in Chinese) 蒙丹丽. 短链脂肪酸在肠道中的生理作用. 中国临床新医学, 2018, 11(2): 198-202. DOI:10.3969/j.issn.1674-3806.2018.02.29 |
| [47] | Szentirmai é, Millican NS, Massie AR, Kapás L. Butyrate, a metabolite of intestinal bacteria, enhances sleep. Scientific Reports, 2019, 9(1): 7035. DOI:10.1038/s41598-019-43502-1 |
| [48] | Kasahara K, Krautkramer KA, Org E, Romano KA, Kerby RL, Vivas EI, Mehrabian M, Denu JM, B?ckhed F, Lusis AJ, Rey FE. Interactions between Roseburia intestinalis and diet modulate atherogenesis in a murine model. Nature Microbiology, 2018, 3(12): 1461-1471. DOI:10.1038/s41564-018-0272-x |
| [49] | Hong J, Jia YM, Pan SF, Jia LF, Li HF, Han ZQ, Cai DM, Zhao RQ. Butyrate alleviates high fat diet-induced obesity through activation of adiponectin-mediated pathway and stimulation of mitochondrial function in the skeletal muscle of mice. Oncotarget, 2016, 7(35): 56071-56082. DOI:10.18632/oncotarget.11267 |
| [50] | Den Besten G, Bleeker A, Gerding A, Van Eunen K, Havinga R, Van Dijk TH, Oosterveer MH, Jonker JW, Groen AK, Reijngoud DJ, Bakker BM. Short-chain fatty acids protect against high-fat diet-induced obesity via a PPARγ-dependent switch from lipogenesis to fat oxidation. Diabetes, 2015, 64(7): 2398-2408. DOI:10.2337/db14-1213 |
| [51] | Liu H, Wang J, He T, Becker S, Zhang GL, Li DF, Ma X. Butyrate: a double-edged sword for health?. Advances in Nutrition, 2018, 9(1): 21-29. DOI:10.1093/advances/nmx009 |
| [52] | Louis P, Hold GL, Flint HJ. The gut microbiota, bacterial metabolites and colorectal cancer. Nature Reviews. Microbiology, 2014, 12(10): 661-672. DOI:10.1038/nrmicro3344 |
| [53] | Scheiman J, Luber JM, Chavkin TA, Macdonald T, Tung A, Pham LD, Wibowo MC, Wurth RC, Punthambaker S, Tierney BT, Yang Z, Hattab MW, Avila-Pacheco J, Clish CB, Lessard S, Church GM, Kostic AD. Meta-omics analysis of elite athletes identifies a performance-enhancing microbe that functions via lactate metabolism. Nature Medicine, 2019, 25(7): 1104-1109. DOI:10.1038/s41591-019-0485-4 |
| [54] | Huang JF, Zhao Q, Dai MY, Xiao XR, Zhang T, Zhu WF, Li F. Gut microbiota protects from triptolide-induced hepatotoxicity: key role of propionate and its downstream signalling events. Pharmacological Research, 2020, 155: 104752. DOI:10.1016/j.phrs.2020.104752 |
| [55] | Tannock GW, Liu YF. Guided dietary fibre intake as a means of directing short-chain fatty acid production by the gut microbiota. Journal of the Royal Society of New Zealand, 2020, 50(3): 435-455. |
| [56] | Deehan EC, Yang C, Perez-Mu?oz ME, Nguyen NK, Cheng CC, Triador L, Zhang ZX, Bakal JA, Walter J. Precision microbiome modulation with discrete dietary fiber structures directs short-chain fatty acid production. Cell Host & Microbe, 2020, 27(3): 389-404. |
| [57] | Sonnenburg ED, Smits SA, Tikhonov M, Higginbottom SK, Wingreen NS, Sonnenburg JL. Diet-induced extinctions in the gut microbiota compound over generations. Nature, 2016, 529(7585): 212-215. DOI:10.1038/nature16504 |
| [58] | Li XF, Guo J, Ji KL, Zhang P. Bamboo shoot fiber prevents obesity in mice by modulating the gut microbiota. Scientific Reports, 2016, 6: 32953. DOI:10.1038/srep32953 |
| [59] | Ferrario C, Statello R, Carnevali L, Mancabelli L, Milani C, Mangifesta M, Duranti S, Lugli GA, Jimenez B, Lodge S, Viappiani A, Alessandri G, Dall'Asta M, Del Rio D, Sgoifo A, Van Sinderen D, Ventura M, Turroni F. How to feed the mammalian gut microbiota: bacterial and metabolic modulation by dietary fibers. Frontiers in Microbiology, 2017, 8: 1749. DOI:10.3389/fmicb.2017.01749 |
| [60] | Huang WC, Lin CL, Hsu YJ, Chiu YS, Chen YM, Wu MF, Huang CC, Wang MF. Inulin and fibersol-2 combined have hypolipidemic effects on high cholesterol diet-induced hyperlipidemia in hamsters. Molecules, 2016, 21(3): 313. DOI:10.3390/molecules21030313 |
| [61] | Estruch R, Ros E, Salas-SalvadóJ, Covas MI, Corella D, Arós F, Gómez-Gracia E, Ruiz-Gutiérrez V, Fiol M, Lapetra J, Lamuela-Raventos RM, Serra-Majem L, Pintó X, Basora J, Mu?oz MA, Sorlí JV, Martínez JA, Fitó M, Gea A, Hernán MA, Martínez-González MA. Primary prevention of cardiovascular disease with a mediterranean diet supplemented with extra-virgin olive oil or nuts. The New England Journal of Medicine, 2018, 378(25): e34. DOI:10.1056/NEJMoa1800389 |
| [62] | Song MY, Wu KN, Meyerhardt JA, Ogino S, Wang ML, Fuchs CS, Giovannucci EL, Chan AT. Fiber intake and survival after colorectal cancer diagnosis. JAMA Oncology, 2018, 4(1): 71-79. DOI:10.1001/jamaoncol.2017.3684 |
| [63] | Kaluza J, Harris H, Wallin A, Linden A, Wolk A. Dietary fiber intake and risk of chronic obstructive pulmonary disease: a prospective cohort study of men. Epidemiology, 2018, 29(2): 254-260. DOI:10.1097/EDE.0000000000000750 |
| [64] | Trompette A, Gollwitzer ES, Pattaroni C, Lopez-Mejia IC, Riva E, Pernot J, Ubags N, Fajas L, Nicod LP, Marsland BJ. Dietary fiber confers protection against flu by shaping Ly6c- patrolling monocyte hematopoiesis and CD8+ T cell metabolism. Immunity, 2018, 48(5): 992-1005. DOI:10.1016/j.immuni.2018.04.022 |
