杜艳娇, 田瑶, 袁志霄, 杨明耀


四川农业大学动物遗传育种研究所, 四川 成都 611130
收稿日期:2020-08-25;修回日期:2020-11-13;网络出版日期:2021-02-10
基金项目:国家自然科学基金(31771338)
*通信作者:杨明耀, Tel/Fax: +86-28-86290991;E-mail: yangmingyao@sicau.edu.cn.
摘要:肠道共生菌是动物体内的重要组成部分,在宿主的生长发育和健康等方面发挥着重要作用,近年来已成为国内外的研究热点。果蝇作为研究肠道微生物菌群功能的优秀模型,在肠道共生菌与宿主关系研究方面已取得许多重要进展。在本文中,我们首先对果蝇肠道微生物的组成和特征作了总结,然后对果蝇肠道共生菌在其生长发育、营养与代谢、行为反应、寿命以及免疫与疾病方面的作用进行了综述,以期为研究人类肠道共生菌功能和肠道健康提供一定理论依据和新的思路。
关键词:肠道共生菌果蝇发育营养行为寿命免疫
Research progress on the effect of symbiotic bacteria in Drosophila gut on its host
Yanjiao Du, Yao Tian, Zhixiao Yuan, Mingyao Yang


Institute of Animal Genetics and Breeding, Sichuan Agricultural University, Chengdu 611130, Sichuan Province, China
Received: 25 August 2020; Revised: 13 November 2020; Published online: 10 February 2021
*Corresponding author: Yang Mingyao, Tel/Fax: +86-28-86290991;E-mail: yangmingyao@sicau.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31771338)
Abstract: It is believed that symbiotic bacteria in the gut form an important part of animals, which play a significant role in the growth, development and health of the host. In recent years, it has attracted more attention on a national and international level. Drosophila melanogaster is an excellent model for studying the function of intestinal flora and has made important progress in the relationship between symbiotic gut bacteria and their host. In this paper, we first summarized the composition and characteristics of intestinal microbes in Drosophila, we then reviewed the roles of symbiotic fly gut bacteria on the host growth and development, nutrition and metabolism, behavioral response, longevity, immunity and disease. This will provide some theoretical rationales and new ideas for the study of the function of the gut symbiotic bacteria and the gut health in human.
Keywords: symbiotic gut bacteriaDrosophila melanogasterdevelopmentnutritionbehaviorlongevityimmunity
近年来,肠道微生物对宿主的影响和作用已成为国内外研究的热点,它们在塑造包括人类在内的动物的生理和健康方面发挥着重要作用[1]。自20世纪60年代以来,黑腹果蝇(Drosophila melanogaster)已被用作一种研究肠道微生物功能的理想模式生物,因为它能提供多种遗传资源和工具。与脊椎动物相比,其肠道微生物群种类少,培养无菌果蝇相对简单,科学研究较为方便和容易[2]。在近十几年里,我们对果蝇肠道微生物的性质和影响有了更清晰的认识。研究发现果蝇肠道的一些功能与许多良性或有益的共生菌有关,这些共生菌能影响果蝇的生长发育和多种生理功能。本文主要对果蝇共生菌在宿主各方面的影响和作用进行了总结(图 1),进一步增加了我们对共生菌群如何影响宿主特性的理解,并为微生物对人类健康的影响提供了参考。
1 果蝇肠道微生物的组成和特征 果蝇肠道是一个复杂的器官,由多种不同发育来源的细胞组成。与哺乳动物一样,果蝇的肠道分为前肠、中肠和后肠,其中中肠是消化和吸收的主要部位[3]。果蝇肠道是绝大多数微生物的栖息地,微生物通常通过食物获得,具有不稳定性的特点。对果蝇肠道微生物多样性的研究表明,黑腹果蝇的肠道是一个细菌多样性很低的环境,通常只含有5–20个细菌物种,最常见的4种优势细菌科是:乳酸杆菌科(Lactobacillaceae)、醋酸杆菌科(Acetobacteraceae)、肠球菌科(Enterococcaceae)和肠杆菌科(Enterobacteriaceae),其中乳酸杆菌(Lactobacillus)和醋酸杆菌(Acetobacter)占主要部分。实验室饲养的果蝇通常只携带4–8种菌株,两种优势物种是短乳杆菌(Lactobacillus brevis)和植物乳杆菌(Lactobacillus plantarum);野生果蝇的微生物群则更为复杂,但它们通常由醋酸杆菌科和乳酸杆菌科的成员所组成[4–8]。不同菌株在肠道的空间定殖不同,这可能有助于保持多样性[9]。果蝇的外表面也有微生物,其成分通常与肠道微生物群相似,但含量要低10倍[10]。
 |
| 图 1 果蝇共生菌对宿主各方面的影响 Figure 1 Effects of Drosophila symbiotic bacteria on the host. |
| 图选项 |
果蝇肠道微生物群受到遗传和环境因素的共同作用,而且具有很强的随机可变性[11]。即使单一果蝇品系在严格一致的条件下保持相同的饮食,其细菌群落的组成可以随时间在同一实验室内以及遵循相同饲养方案的不同实验室之间有所变化[12]。另外,有大量研究证明果蝇肠道微生物的种类随着年龄而改变。在门的水平上,以乳酸杆菌科和肠球菌科为代表的厚壁菌门(Firmicutes)和以醋酸杆菌科和肠杆菌科为代表的变形菌门(Proteobacteria)构成了黑腹果蝇中99%的微生物群;在种的水平上,幼年果蝇以波斯醋酸杆菌(Acetobacter persicae)和短乳杆菌为主,老年果蝇以苹果醋酸杆菌(Acetobacter pomorum)和植物乳杆菌为主[13]。肠道微生物的丰度也随着年龄而改变。卵发育期,卵的表面遗传了大量的醋酸杆菌和乳酸杆菌,尤其是甲醛醋酸杆菌(Acetobacter formaldehyde)和植物乳杆菌,这些细菌在整个发育阶段都存在[14]。在种群水平上,乳酸杆菌的丰度一般在卵中较高,在发育早期有所下降,而醋酸杆菌的丰度随着果蝇年龄的增长而增加[15];在个体水平上,乳酸杆菌和醋酸杆菌的相对丰度在果蝇中变化很大,并且容易受到环境条件的干扰,例如饮食和种群密度[8]。总的来说,果蝇肠道微生物菌群组成的年龄相关变化为蛋白菌门丰度的增加和厚壁菌门含量的降低,随后α蛋白细菌的扩张被认为会导致宿主进一步的免疫激活并缩短寿命(图 2)。而且,与人类一样,果蝇肠道菌群中微生物数量和物种组成的变化与动物健康状况的关系比它们与年龄变化的关系更密切[16]。
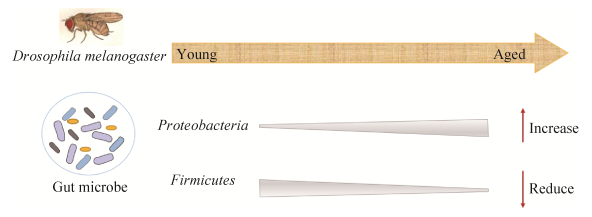 |
| 图 2 果蝇肠道微生物群组成的年龄相关变化 Figure 2 Age-related changes of gut microbes in Drosophila melanogaster. |
| 图选项 |
果蝇和它的微生物菌群之间的联系可以被定义为“开放的”,因为肠道内的微生物群落和外部环境之间存在联系,外部微生物寄生在宿主体内,肠道微生物作为排泄物的一部分被释放到外部环境中,释放的微生物反过来可以改变生态位,又有利于果蝇肠道微生物的定殖[17]。一些动物的肠道微生物菌群通常包括一个核心微生物区系,这些微生物区系在生态学上是独一无二的,可能与宿主共同进化,但果蝇没有核心微生物菌群,且微生物菌群在细菌特性和定位方面具有高度的个体变异性[8]。然而,肠道微生物,特别是共生菌仍然对果蝇的生理和健康有着深远的影响。
2 肠道共生菌影响果蝇的生长发育 在果蝇的整个生命周期中,肠道共生菌都扮演着重要的角色。肠道共生菌能加快幼虫的生长和发育速度,还能控制果蝇的能量代谢和肠道干细胞(intestinal stem cells,ISC)活性。若消除共生菌则会延长幼虫的发育时间、扰乱代谢稳态和降低ISC有丝分裂活性。肠道共生菌对果蝇卵子的发生也有一定的影响。
2.1 影响幼虫的发育和能量代谢 肠道共生菌对果蝇幼虫的生长发育有一定影响。与常规带菌果蝇相比,无菌果蝇幼虫的孵化率降低,且无菌果蝇的代谢率显著降低,碳水化合物分配发生改变,葡萄糖水平升高[18]。说明消除常驻共生菌群会延长幼虫的发育时间,扰乱果蝇的能量平衡和碳水化合物的分配模式。共生菌群可以通过影响果蝇生长速度和体型而影响它们的系统发育,但促进生长并不一定是由多个共生物种的协同作用产生的,也可以通过单个优势细菌物种的活动来模拟。甲醛醋酸杆菌通过调节果蝇体内胰岛素生长因子信号来调节宿主的稳态机制,从而控制果蝇的发育速度、体型、能量代谢和ISC活性,缺失这种细菌的果蝇表现出发育和代谢稳态的严重失调[19]。植物乳杆菌是黑腹果蝇的一种益生菌,它可以激活胰岛素信号通路,并能在果蝇体内维持较高的活性,保持果蝇体内生理内环境稳态,促进果蝇的生长发育[20]。
2.2 影响ISC活性 为了维持体内平衡,ISC的分裂和分化使肠道上皮在机体的整个生命周期中不断更新,而ISC的过度增殖和异常分化可能会导致与年龄相关的肠上皮退化[21]。肠道共生菌在其中发挥着重要作用,它们可以通过多种途径影响果蝇ISC活性。与常规饲养的果蝇相比,无菌果蝇ISC的有丝分裂数量和上皮细胞更新速度均显著降低,原生细菌的重新引入增强了ISC的有丝分裂活性,它们通过增加Janus激酶(Janus-family tyrosine kinase,JAK)和Jun N-末端激酶(Jun N-terminal kinase,JNK)的活性来调节上皮细胞更新的基础水平[22]。
2.3 促进卵子的发生 肠道共生菌对果蝇生殖系统也有影响。Elgart等[23]研究了醋酸杆菌对果蝇成虫生理的作用,揭示了这种细菌能促进卵子的发生。但这一结果与以往的研究有所不同,之前并没有发现肠道共生菌对宿主生殖能力有任何增强作用[18]。不一致的原因可能是由于不同的实验环境造成的,这些实验环境是基于不同的细菌群落和营养介质的使用,而这些细菌群落和营养介质反过来又影响共生菌和宿主的生理活动。肠道共生菌对果蝇生殖系统的作用,有待进一步验证。
3 肠道共生菌影响果蝇营养与代谢 肠道共生菌在果蝇营养中起着关键作用,这些共生菌以多种方式参与机体的营养获取和分配。它们可以消耗吸收的营养物质或向宿主补充营养物质;可以通过调节宿主的营养传感信号通路来改变宿主的营养分配模式,在营养不良的情况下改善果蝇的营养获取;还可以通过共生菌间的相互作用提高共生菌群落的生产力,改变宿主可用的营养物质。
3.1 影响果蝇对营养的需求和代谢反应 果蝇是研究肠道共生菌群对宿主营养和代谢影响的优良模型,迄今为止的研究主要集中在三类营养素上:维生素B、能量储存分子(尤其是脂类)和蛋白质营养。肠道共生菌群能减少果蝇对饮食中B族维生素的需求,特别是硫胺素(维生素B1)和叶酸(维生素B9)。在动物体内,硫胺素是能量代谢和正常细胞功能所必需的,在低硫胺素环境中,黑腹果蝇中的甲醛醋酸杆菌具有向宿主提供硫胺素的功能[24]。虽然硫胺素浓度和共生菌群的相互作用并不影响成年果蝇的寿命,对产卵量也没有影响,但硫胺素的有效性对后代的发育有很大的影响,因为无菌后代不能在无硫胺素的饮食中发育,只有当甲醛醋酸杆菌存在或重新添加时,后代才能存活下来,这表明甲醛醋酸杆菌负责硫胺素的供应,能够挽救在不含硫胺素食物中生长的幼虫的发育。此外,黑腹果蝇可能含有未知的细菌共生体,当食物中叶酸稀缺时,这些共生体为宿主提供必需的叶酸,使果蝇保持生长和发育[25]。肠道共生菌群还能影响果蝇的能量储存。与相同饮食饲养的传统果蝇相比,无菌果蝇的脂质和糖原水平都有所提高[26]。肠道微生物菌群中的各种细菌,包括共生菌和酵母菌,还能促进果蝇的蛋白质营养,尤其是在雌性果蝇和低蛋白饮食中。在营养不良期间,共生菌通常作为富含蛋白质的食物来增强宿主蛋白质营养,调节宿主的生命活动,为寄主提供获得必需营养素的途径[27]。果蝇体内的肠道共生菌群还能在营养缺乏的食物中发挥作用,使它们能够利用低营养或不平衡的饮食,减少对饮食中维生素B的需求,促进蛋白质营养,并抑制能量的储存[28]。
3.2 促进营养缺乏时幼年果蝇的生长和发育 营养与肠道共生菌群的相互作用决定了幼年期的生长轨迹,营养缺乏会导致发育迟缓,而不成熟的肠道共生菌群与幼年期营养不良有关。在果蝇生命周期的幼年阶段,幼虫不断地进食并增加体重约200倍,直到进入变态阶段[29]。然而,幼虫生长的速度和持续时间可以被营养环境和宿主相关的共生菌所改变[30]。在营养不良的条件下生长的无菌幼虫出现发育延迟的现象,与单一细菌株的结合可以加速果蝇的发育速度,在营养缺乏的情况下,这些细菌的生长促进作用是显著的[31]。许多肠道共生菌已被证明对宿主健康具有物种或菌株特异性影响,醋酸杆菌和植物乳杆菌以其独特的方式缓解了环境中的营养限制,以加速宿主在缺乏必需营养的饮食中的生长和成熟。其中,醋酸杆菌通过胰岛素样生长因子信号调节生长速率和最终体型[19];植物乳杆菌能有效地定殖于幼虫的整个生态位,通过雷帕霉素靶标(target of rapamycin,TOR)信号通路提高幼虫生长速度和缩短生长期来促进营养缺乏时幼虫的生长和成熟[32]。果蝇的营养信号传感通路,尤其是胰岛素信号通路和TOR信号通路对共生菌群比较敏感。
3.3 共生菌的相互作用影响宿主的营养与代谢 虽然在特定情况下,单一细菌可以被确定为影响宿主的唯一因素,但在大多数情况下,肠道共生菌间存在相互作用,它们是作为一个群体而不是作为孤立的个体作用于宿主的。在动物肠道菌群中,共生菌间代谢产物的交叉摄食可以促进定殖并影响宿主生理[33–35]。果蝇肠道共生菌之间也存在互惠作用,且对宿主营养与代谢有影响[26, 36]。果蝇的典型微生物菌群是至少具有两种互补代谢类型的微生物菌群,即一级糖解酵母菌(酵母菌和乳酸杆菌)和二级乙酰氧化菌(乙酰菌和其他醋酸杆菌等酸性细菌),后者能利用前者的产物[37]。通过体外共培养发现,醋酸杆菌能够利用短乳杆菌的多种发酵产物,比如,利用糖异生作用吸收乳酸杆菌发酵产物作为体内碳源。与只有醋酸杆菌的果蝇相比,醋酸杆菌和短乳杆菌之间的互利共生显著降低了共培养果蝇的甘油三酯水平,这两种微生物消耗更多葡萄糖,从而降低宿主的可用浓度[37]。组合实验设计表明,3–5种微生物组之间的高阶相互作用还能影响果蝇的生活史策略[38],共生体与病原菌之间的相互作用也能影响宿主的健康[39]。
4 肠道共生菌影响果蝇的行为反应 肠道共生菌对果蝇的行为反应方面有多种影响。在偏好行为上,肠道共生菌参与了果蝇适宜的取食和产卵地点的确定,某些微生物组挥发物对果蝇具有引诱作用;在交配行为上,某些肠道共生菌可以改变果蝇的交配模式;在运动行为上,肠道共生菌可以调节果蝇的运动活跃度,无菌果蝇的运动行为异常活跃。
4.1 影响果蝇的营养偏好 Qiao等[40]研究表明,肠道共生菌参与了果蝇适宜的取食和产卵地点的确定。他们发现酿酒酵母和植物乳杆菌的挥发性物质对成虫和幼虫都有引诱作用,但果蝇对苹果酸醋酸杆菌却有排斥作用,表明这些偏好行为与嗅觉机制有关。此外,将果蝇幼虫暴露于所有3种微生物中可促进果蝇的发育,而在产卵试验中,仅暴露于酿酒酵母和苹果酸乙酰杆菌可促进卵巢的发育并增加卵子数量。Venu等[41]也发现肠道共生菌群能介导社会吸引力,微生物组挥发物作为公共提示信息,将果蝇引向潜在的优势取食点。他们发现无菌幼虫所食用的无菌食品对幼虫和成虫都没有吸引力,但它们都表现出了对含有完整共生菌群的幼虫所食用的标准食品有兴趣。因此,果蝇表现出对有益细菌的偏好,但这些偏好取决于宿主共生菌的历史和特性,肠道共生菌群的成员也会影响果蝇的营养偏好,并在觅食过程中推动行为权衡,因为果蝇必须同时适应共生菌的获取和营养平衡[42]。
4.2 影响果蝇的交配模式 果蝇肠道共生菌群对交配模式有影响,尽管这一结论存在争议。Sharon等[43–44]研究发现,肠道共生菌在果蝇的交配中起着重要作用,果蝇在不同的饮食条件下表现出不同的交配偏好,这种偏好在成年果蝇抗生素治疗后被废除,并通过细菌替换实验重建,特别是通过添加植物乳杆菌。Najarro等[45]也用不同品系的果蝇重复了上述实验,报道了饮食引起的同系交配偏好。但最近Leftwich等[46]的研究却和上述结果不一致,他们发现果蝇没有通过饮食或肠道共生菌群进行配型交配,抗生素处理也没有改变随机交配的模式,植物乳杆菌添加回无菌果蝇后,交配模式仍然是随机的,表明肠道共生菌在推动该物种生殖隔离和进化方面没有普遍作用。因此,共生菌在驱动生殖隔离中所起的作用是一个未解之谜,仍需进一步研究。
4.3 调节果蝇的运动行为 肠道是暴露于影响宿主生理环境信号的主要通道,通过神经元和体液途径与大脑相连,肠道微生物调节神经系统的发育和功能特征[47]。有趣的是,肠道共生菌还能影响果蝇的运动行为。最近,Schretter等[48]发现了一种肠道细菌可以调节黑腹果蝇的运动行为,这种影响是由糖的水平和产生分子章鱼胺的神经元的活动介导的。他们比较了携带天然肠道共生菌群的果蝇和经过肠道细菌清除处理的果蝇的行走活动,观察到无菌状态或抗生素治疗导致果蝇的运动行为异常活跃,这些极度活跃的果蝇比其他果蝇走得更快、更久,但它们的日常活动和睡眠节律没有受到干扰。这种情况可以通过特定细菌的单一定殖得到挽救,其中包括短乳杆菌。
5 肠道共生菌影响果蝇寿命 越来越多的证据表明肠道共生菌直接或间接地影响宿主的寿命,并在不同的动物模型上得到了验证。例如,在无菌培养条件下,线虫的寿命增加了2倍[49];用幼鱼的粪便进行移植处理,可提高老龄鳉鱼的寿命[50]。与这些动物模型研究相似,肠道共生菌对果蝇的寿命也有影响。然而,它对果蝇寿命的影响却不尽相同。
Brummel等[51]观察到经卵漂白或抗生素处理后的果蝇,在成年后的第1周,即使食物摄入量没有改变,细菌的存在也能延长寿命,在生命后期,细菌的存在会缩短寿命。相比之下,Ren等[10]发现无菌条件下果蝇的寿命没有发生改变,而Tefit等[52]和Obata等[53]发现,共生菌的缺失延长了果蝇的寿命。为了解释这些不一致的现象,后来Lee等[13]使用高度精细的控制方法产生了无菌果蝇,并观察到在无有害副作用的情况下消除共生菌可延长宿主寿命,还发现共生菌的丰度可能是影响宿主寿命的一个关键因素,与年龄相关的细菌负荷的增加显著缩短了宿主的寿命,并且细菌负荷的变化比与年龄相关的细菌组成的变化具有更为关键的影响。此外,菌群多样性的增加与细菌负荷的增加有关,从而导致寿命缩短[38]。不同研究者所报道的肠道共生菌对宿主寿命不一致的影响可能是由于不同实验室的果蝇共生菌种类不同,也可能是消除共生菌的方法不同而导致的。
另外,微生物对果蝇寿命的贡献似乎高度依赖于营养状况,肠道相关微生物的存在对宿主的寿命是否有利,这取决于营养环境。肠道微生物在由蛋白质特异性营养不良等原因导致的营养失调中起着重要作用。在营养不足的情况下,伊萨酵母(Issatchenkia orientalis,一种从野外捕获的果蝇中分离出来的真菌微生物)可以挽救果蝇的寿命,直接从营养不良的食物中提取氨基酸,并增强对果蝇的营养传递[54]。然而,在营养不良的饮食中延长果蝇寿命的微生物又可以缩短果蝇在营养丰富饮食中的寿命[55]。因此,微生物影响宿主寿命的机制可能在低营养或高营养饮食上有所不同。微生物对果蝇寿命的最终影响可能是它们对营养和免疫等过程的影响之和,这些参数将受到相互作用的环境因素的影响。由于果蝇的寿命受到诸多遗传因素以及环境因素的影响,研究人员在肠道共生菌对寿命影响的研究上得出不一致的结果,缩短寿命、延长寿命和不改变寿命均有报道。因此,研究肠道共生菌对寿命的影响是个复杂的工程,需要考虑诸多因素的影响,并严格控制实验条件。
随着全球老龄化的加剧,抗衰老和延长健康寿命已经成为老年医学研究的重要组成部分,大量的研究投入到了寻找抗衰老药物中。我们实验室在这方面也开展了大量研究,发现2, 5-二甲基塞来昔布、二氢杨梅素等能有效延长果蝇寿命,它们诱导的延寿机制之一是减缓肠道屏障功能障碍,改善肠道完整性,同时还显著减少了老年果蝇肠道菌群的数量,结果表明在药物抗衰老中肠道共生菌扮演着重要角色[56–57]。二甲双胍是一种抗衰老和改善健康状况的双胍类药物,最近研究表明,二甲双胍的部分治疗作用与肠道菌群的变化有关[58–61]。另外,雷帕霉素可以延长不同物种的寿命,并延缓哺乳动物中与年龄有关的疾病的发生。据报道,雷帕霉素治疗会改变果蝇和小鼠肠道菌群的数量与结构[62–64]。虽然药物的疗效与肠道菌群间的关系尚存在争议,但是以上结果给了我们启示,即肠道菌群可能在药物抗衰老治疗中发挥一定作用。
6 肠道共生菌影响果蝇免疫与疾病 近几十年里,果蝇已被广泛用于破译宿主微生物在先天免疫和致病性关联方面的相互作用机制,肠道共生菌直接影响宿主免疫功能和肠道稳态的观点已得到广泛认可。除此之外,肠道共生菌还与大脑的免疫功能有关,从而影响精神健康。
6.1 影响果蝇的免疫功能 为了适应肠道中这些高度多样化的微生物种群,宿主通过平衡对潜在致病性外来细菌的有效免疫反应和对原生细菌的免疫耐受性来实现肠道微生物的内稳态[65]。肠道共生菌群对果蝇免疫功能有重要影响。果蝇的免疫系统包括一种体液反应,其特征是释放抗菌肽(antimicrobial peptides,AMPs)、活性氧(reactive oxygen species,ROS)和活性氯(reactive chlorine species,RCS),以及一种细胞反应,包括吞噬细胞和无脊椎动物特有的黑色素反应,以抵抗细菌的侵入[66]。这些免疫途径是在有益微生物和致病微生物的共同作用下产生的,最初始和最迅速诱导的宿主反应之一是ROS和RCS的产生。细胞内ROS水平与衰老有关,而共生或病原微生物诱导ROS的生成,作为一种防御反应,已被认为会影响宿主寿命[67]。在整个动物界,AMPs是由肠道产生的,以控制感染。事实上,ROS和AMPs是互补的,因为AMPs对控制ROS耐药菌至关重要[68]。肠道共生菌群是果蝇晶体细胞的重要调节因子,果蝇晶体细胞是一类免疫细胞,在病原体包裹和伤口愈合过程中介导黑色素合成[69]。肠上皮细胞中生长因子Pvf2的表达通过肠道内共生菌诱导免疫缺陷信号通路而增强,这种相互作用在果蝇肠道抗病毒免疫的激活中起着必要的作用[70]。此外,没有共生菌的果蝇幼虫比野生型幼虫更容易感染白色念珠菌,这表明共生菌在宿主防御中起着重要作用[71]。
6.2 影响肠道功能与稳态 尽管一些肠道共生菌群通常有益于宿主生理学,但一个或多个正常菌种的过度生长会导致肠道功能障碍和疾病,在这种情况下,其他肠道共生菌群也会致病。微生物菌群的这种异常与许多疾病有关,包括炎症性肠病,炎症性肠病由寄居微生物与肠道免疫系统相互作用的改变引起的[72]。成功的肠道微生物稳态被认为是不同微生物和肠道免疫之间微妙的相互作用的结果。Lee等[73]研究发现,细菌衍生的尿嘧啶在果蝇肠道中作为依赖双氧化酶的ROS产生的配体,一些病理生物,即具有条件致病特性的本地细菌,释放尿嘧啶会慢性激活十二指肠依赖性肠道免疫,导致病理学上类似的炎症性肠道疾病。与致病菌相比,共生体中不存在尿嘧啶的产生,从而可以在没有双氧化酶激活的情况下和谐地定殖。这些结果表明,主要肠道共生菌缺乏尿嘧啶的特性是非常有益的,使肠道能够在没有免疫激活的情况下容纳有益的微生物。
肠道共生菌群的组成变化与老年期的衰老和虚弱有关。肠道共生菌的组成和数量可以随着年龄的增长而改变,这些变化与肠道屏障功能下降、非典型区域微生物的存在以及全身炎症增加有关。在中年时出现肠屏障功能障碍的果蝇,其体内细菌负荷相比于年龄相仿的对照果蝇有所增加,不管年龄长短,肠屏障功能障碍都预示着个体果蝇即将死亡[74]。而无论在哪个年龄阶段,果蝇肠屏障功能的丧失都与共生菌的变化密切相关。Clark等[16]的研究表明,肠道共生菌的存在会影响衰老期间肠道屏障衰竭的发生,且喂食老年果蝇匀浆与喂食幼年果蝇匀浆的果蝇相比,其寿命显著缩短,肠屏障功能障碍发生率增加。事实上,肠道共生菌群的失调先于年龄相关的肠道屏障功能障碍的发生,所以在肠屏障功能障碍之前发生的共生菌组成的变化会导致肠道排泄功能的改变和免疫系统激活,甚至导致组织死亡。在脊椎动物(包括人类)中,年龄和肠道共生菌群之间也存在着密切的关系。我们研究发现,从长寿人群中移植肠道共生菌群的小鼠有更多有益的细菌和较低的与衰老有关的代谢产物,乳酸杆菌和双歧杆菌的丰度显著增加,脂褐素和β-半乳糖苷酶的水平显著降低[75]。这表明了长寿人群的肠道共生菌群在抗衰老和促进健康衰老方面有潜在的用途。
6.3 影响神经疾病 肠道共生菌群失调在功能上也与大脑的免疫功能失调有关,从而导致精神健康受损[76]。阿尔茨海默病(Alzheimer disease,AD)是一种常见的神经退行性疾病,主要的病理特征是细胞外淀粉样斑块和细胞内神经纤维缠结水平升高[77]。最近的研究表明,在AD患者和动物模型中,肠道共生菌群的组成和多样性发生了改变,菌群失调和细菌感染可能与AD的病因有关[78–81]。在果蝇AD模型中,Wu等[82]研究发现,肠道细菌感染通过促进免疫血细胞向大脑的募集而加剧AD的进展,从而引发神经变性。Liu等[83]研究发现,乳酸菌喂养能逆转黑腹果蝇AD模型的畸形眼结构和改善肠道微生物区系,表明乳酸菌在预防和减轻神经退行性疾病(如AD)的发病机制方面具有一定潜力。这些结果强调了肠道菌群的研究可能为开发AD的诊断生物标志物和治疗靶点提供新的途径,但肠道菌群与AD的关系仍待进一步的研究和验证。
7 结语和展望 肠道共生菌与果蝇个体之间相互作用的研究表明,肠道共生菌与其宿主有共生关系,是果蝇体内必不可少的微生物菌群,在宿主果蝇的生长发育、营养与代谢、行为反应、寿命以及免疫与疾病等方面发挥着重要作用。这些共生菌与宿主互利互惠,建立了双赢的关系,对于维持体内平衡和促进机体健康具有重要意义。果蝇可以提供有价值的替代哺乳动物研究共生菌与宿主关系的模型,利于人们发现共生菌的功能,提高研究成本效益和动物福利效益。第一,果蝇是肠道共生菌研究的优良模型,拥有丰富的分子和遗传学研究系统。用简单、标准化的方法生产大量无菌果蝇和正常果蝇,从而促进实验的可重复性。第二,果蝇的生命周期较短,平均2–3个月,维持成本低。在研究衰老过程中宿主与共生菌相互作用上具有独特优势,有助于更好地理解抗衰老干预措施是否受到共生菌群的影响,为深入了解衰老的生物学机制奠定基础。第三,果蝇能减少用于共生菌研究的哺乳动物数量,并不涉及动物福利问题。同时,在药物与共生菌相互作用的因果关系和机制研究上具有较大潜力,促进了药物与共生菌相互作用的结果向人类疾病治疗的快速转化。
本文主要探讨了果蝇肠道共生菌对宿主各方面的作用,但肠道共生菌领域关键问题之一是确定共生菌动态和宿主健康之间的因果关系,其中的重点不仅是共生菌群给宿主带来哪些益处以及如何带来益处,还包括宿主如何塑造有益的共生菌群。即使果蝇是研究宿主与共生菌群相互作用的优良模型,但果蝇与哺乳动物模型结合使用,结果可以相互验证。例如,果蝇可以识别共生菌群对宿主表型的影响模式以及潜在的分子机制,哺乳动物模型可以评估果蝇的研究成果如何转化并运用于哺乳动物系统。然而,在果蝇模型中,共生菌群在疾病治疗和抗衰老干预中的相关性才刚刚开始探索。更好地理解疾病治疗和抗衰老干预措施是否受共生菌群的影响,对于评估这些干预措施是否能有效促进人类身体健康至关重要。总之,共生菌群与宿主间的相互作用是极其复杂的,仍需要进一步探索。
References
| [1] | Leulier F, MacNeil LT, Lee WJ, Rawls JF, Cani PD, Schwarzer M, Zhao LP, Simpson SJ. Integrative physiology: at the crossroads of nutrition, microbiota, animal physiology, and human health. Cell Metabolism, 2017, 25(3): 522-534. DOI:10.1016/j.cmet.2017.02.001 |
| [2] | Ma DL, Storelli G, Mitchell M, Leulier F. Studying host-microbiota mutualism in Drosophila: harnessing the power of gnotobiotic flies. Biomedical Journal, 2015, 38(4): 285-293. DOI:10.4103/2319-4170.158620 |
| [3] | Miguel-Aliaga I, Jasper H, Lemaitre B. Anatomy and physiology of the digestive tract of Drosophila melanogaster. Genetics, 2018, 210(2): 357-396. |
| [4] | Ryu JH, Kim SH, Lee HY, Bai JY, Nam YD, Bae JW, Lee DG, Shin SC, Ha EM, Lee WJ. Innate immune homeostasis by the homeobox gene caudal and commensal-gut mutualism in Drosophila. Science, 2008, 319(5864): 777-782. DOI:10.1126/science.1149357 |
| [5] | Cox CR, Gilmore MS. Native microbial colonization of Drosophila melanogaster and its use as a model of Enterococcus faecalis pathogenesis. Infection and Immunity, 2007, 75(4): 1565-1576. DOI:10.1128/IAI.01496-06 |
| [6] | Corby-Harris V, Pontaroli AC, Shimkets LJ, Bennetzen JL, Habel KE, Promislow DEL. Geographical distribution and diversity of bacteria associated with natural populations of Drosophila melanogaster. Applied and Environmental Microbiology, 2007, 73(11): 3470-3479. DOI:10.1128/AEM.02120-06 |
| [7] | Erkosar B, Storelli G, Defaye A, Leulier F. Host-intestinal microbiota mutualism: "learning on the fly". Cell Host & Microbe, 2013, 13(1): 8-14. |
| [8] | Wong ACN, Chaston JM, Douglas AE. The inconstant gut microbiota of Drosophila species revealed by 16S rRNA gene analysis. The ISME Journal, 2013, 7(10): 1922-1932. DOI:10.1038/ismej.2013.86 |
| [9] | Obadia B, Güvener ZT, Zhang V, Ceja-Navarro JA, Brodie EL, Ja WW, Ludington WB. Probabilistic invasion underlies natural gut microbiome stability. Current Biology, 2017, 27(13): 1999-2006. DOI:10.1016/j.cub.2017.05.034 |
| [10] | Ren CL, Webster P, Finkel SE, Tower J. Increased internal and external bacterial load during Drosophila aging without life-span trade-off. Cell Metabolism, 2007, 6(2): 144-152. DOI:10.1016/j.cmet.2007.06.006 |
| [11] | Broderick NA, Buchon N, Lemaitre B. Microbiota-induced changes in Drosophila melanogaster host gene expression and gut morphology. mBio, 2014, 5(3): e01117-e01114. |
| [12] | Chandler JA, Lang JM, Bhatnagar S, Eisen JA, Kopp A. Bacterial communities of diverse Drosophila species: ecological context of a host-microbe model system. PLoS Genetics, 2011, 7(9): e1002272. DOI:10.1371/journal.pgen.1002272 |
| [13] | Lee HY, Lee SH, Lee JH, Lee WJ, Min KJ. The role of commensal microbes in the lifespan of Drosophila melanogaster. Aging, 2019, 11(13): 4611-4640. DOI:10.18632/aging.102073 |
| [14] | Broderick NA, Lemaitre B. Gut-associated microbes of Drosophila melanogaster. Gut Microbes, 2012, 3(4): 307-321. DOI:10.4161/gmic.19896 |
| [15] | Wong CNA, Ng P, Douglas AE. Low-diversity bacterial community in the gut of the fruitfly Drosophila melanogaster. Environmental Microbiology, 2011, 13(7): 1889-1900. DOI:10.1111/j.1462-2920.2011.02511.x |
| [16] | Clark RI, Salazar A, Yamada R, Fitz-Gibbon S, Morselli M, Alcaraz J, Rana A, Rera M, Pellegrini M, Ja WW, Walker DW. Distinct shifts in microbiota composition during Drosophila aging impair intestinal function and drive mortality. Cell Reports, 2015, 12(10): 1656-1667. DOI:10.1016/j.celrep.2015.08.004 |
| [17] | Winans NJ, Walter A, Chouaia B, Chaston JM, Douglas AE, Newell PD. A genomic investigation of ecological differentiation between free-living and Drosophila-associated bacteria. Molecular Ecology, 2017, 26(17): 4536-4550. DOI:10.1111/mec.14232 |
| [18] | Ridley EV, Wong AC, Westmiller S, Douglas AE. Impact of the resident microbiota on the nutritional phenotype of Drosophila melanogaster. PLoS ONE, 2012, 7(5): e36765. DOI:10.1371/journal.pone.0036765 |
| [19] | Shin SC, Kim SH, You H, Kim B, Kim AC, Lee KA, Yoon JH, Ryu JH, Lee WJ. Drosophila microbiome modulates host developmental and metabolic homeostasis via insulin signaling. Science, 2011, 334(6056): 670-674. DOI:10.1126/science.1212782 |
| [20] | Li YJ, Su WZ, Hu KK, Li PC, Liu W, Yao H. Lactobacillus plantarum promotes the growth and development of Drosophila melanogaster. Acta Entomologica Sinica, 2017, 60(5): 544-552. (in Chinese) 李玉娟, 苏琬真, 胡坤坤, 李鹏程, 刘威, 姚红. 植物乳杆菌促进黑腹果蝇生长发育. 昆虫学报, 2017, 60(5): 544-552. |
| [21] | Biteau B, Hochmuth CE, Jasper H. JNK activity in somatic stem cells causes loss of tissue homeostasis in the aging Drosophila gut. Cell Stem Cell, 2008, 3(4): 442-455. DOI:10.1016/j.stem.2008.07.024 |
| [22] | Buchon N, Broderick NA, Chakrabarti S, Lemaitre B. Invasive and indigenous microbiota impact intestinal stem cell activity through multiple pathways in Drosophila. Genes & Development, 2009, 23(19): 2333-2344. |
| [23] | Elgart M, Stern S, Salton O, Gnainsky Y, Heifetz Y, Soen Y. Impact of gut microbiota on the fly's germ line. Nature Communications, 2016(7): 11280. |
| [24] | Sannino DR, Dobson AJ, Edwards K, Angert ER, Buchon N. The Drosophila melanogaster gut microbiota provisions thiamine to its host. mBio, 2018, 9(2): e00155-e00118. |
| [25] | Blatch S, Meyer KW, Harrison JF. Effects of dietary folic acid level and symbiotic folate production on fitness and development in the fruit fly Drosophila melanogaster. Fly, 2010, 4(4): 312-319. DOI:10.4161/fly.4.4.13258 |
| [26] | Newell PD, Douglas AE. Interspecies interactions determine the impact of the gut microbiota on nutrient allocation in Drosophila melanogaster. Applied and Environmental Microbiology, 2014, 80(2): 788-796. DOI:10.1128/AEM.02742-13 |
| [27] | Keebaugh ES, Yamada R, Obadia B, Ludington WB, Ja WW. Microbial quantity impacts Drosophila nutrition, development, and lifespan. iScience, 2018, 4: 247-259. DOI:10.1016/j.isci.2018.06.004 |
| [28] | Wong AC, Dobson AJ, Douglas AE. Gut microbiota dictates the metabolic response of Drosophila to diet. The Journal of Experimental Biology, 2014, 217(Pt 11)): 18894-1901. |
| [29] | Tennessen JM, Thummel CS. Coordinating growth and maturation-insights from Drosophila. Current Biology, 2011, 21(18): R750-R757. DOI:10.1016/j.cub.2011.06.033 |
| [30] | Douglas AE. The Drosophila model for microbiome research. Lab Animal, 2018, 47(6): 157-164. DOI:10.1038/s41684-018-0065-0 |
| [31] | Consuegra J, Grenier T, Baa-Puyoulet P, Rahioui I, Akherraz H, Gervais H, Parisot N, da Silva P, Charles H, Calevro F, Leulier F. Drosophila-associated bacteria differentially shape the nutritional requirements of their host during juvenile growth. PLoS Biology, 2020, 18(3): e3000681. DOI:10.1371/journal.pbio.3000681 |
| [32] | Storelli G, Defaye A, Erkosar B, Hols P, Royet J, Leulier F. Lactobacillus plantarum promotes Drosophila systemic growth by modulating hormonal signals through TOR-dependent nutrient sensing. Cell Metabolism, 2011, 14(3): 403-414. DOI:10.1016/j.cmet.2011.07.012 |
| [33] | Sonnenburg ED, Zheng HJ, Joglekar P, Higginbottom SK, Firbank SJ, Bolam DN, Sonnenburg JL. Specificity of polysaccharide use in intestinal Bacteroides species determines diet-induced microbiota alterations. Cell, 2010, 141(7): 1241-1252. DOI:10.1016/j.cell.2010.05.005 |
| [34] | Rakoff-Nahoum S, Coyne MJ, Comstock LE. An ecological network of polysaccharide utilization among human intestinal symbionts. Current Biology, 2014, 24(1): 40-49. DOI:10.1016/j.cub.2013.10.077 |
| [35] | Rakoff-Nahoum S, Foster KR, Comstock LE. The evolution of cooperation within the gut microbiota. Nature, 2016, 533(7602): 255-259. DOI:10.1038/nature17626 |
| [36] | Leit?o-Gon?alves R, Carvalho-Santos Z, Francisco AP, Fioreze GT, Anjos M, Baltazar C, Elias AP, Itskov PM, Piper MDW, Ribeiro C. Commensal bacteria and essential amino acids control food choice behavior and reproduction. PLoS Biology, 2017, 15(4): e2000862. DOI:10.1371/journal.pbio.2000862 |
| [37] | Sommer AJ, Newell PD. Metabolic basis for mutualism between gut bacteria and its impact on the Drosophila melanogaster host. Applied and Environmental Microbiology, 2019, 85(2): e01882-01818. |
| [38] | Gould AL, Zhang V, Lamberti L, Jones EW, Obadia B, Korasidis N, Gavryushkin A, Carlson JM, Beerenwinkel N, Ludington WB. Microbiome interactions shape host fitness. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(51): e11951-11960. DOI:10.1073/pnas.1809349115 |
| [39] | Fast D, Kostiuk B, Foley E, Pukatzki S. Commensal pathogen competition impacts host viability. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(27): 7099-7104. DOI:10.1073/pnas.1802165115 |
| [40] | Qiao HL, Keesey IW, Hansson BS, Knaden M. Gut microbiota affects development and olfactory behavior in Drosophila melanogaster. The Journal of Experimental Biology, 2019, 222(Pt 5): jeb192500. |
| [41] | Venu I, Durisko Z, Xu JP, Dukas R. Social attraction mediated by fruit flies' microbiome. The Journal of Experimental Biology, 2014, 217(Pt 8): 1346-1352. |
| [42] | Wong ACN, Wang QP, Morimoto J, Senior AM, Lihoreau M, Neely GG, Simpson SJ, Ponton F. Gut microbiota modifies olfactory-guided microbial preferences and foraging decisions in Drosophila. Current Biology, 2017, 27(15): 2397-2404. DOI:10.1016/j.cub.2017.07.022 |
| [43] | Sharon G, Segal D, Ringo JM, Hefetz A, Zilber-Rosenberg I, Rosenberg E. Commensal bacteria play a role in mating preference of Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(46): 20051-20056. DOI:10.1073/pnas.1009906107 |
| [44] | Sharon G, Segal D, Zilber-Rosenberg I, Rosenberg E. Symbiotic bacteria are responsible for diet-induced mating preference in Drosophila melanogaster, providing support for the hologenome concept of evolution. Gut Microbes, 2011, 2(3): 190-192. DOI:10.4161/gmic.2.3.16103 |
| [45] | Najarro MA, Sumethasorn M, Lamoureux A, Turner TL. Choosing mates based on the diet of your ancestors: replication of non-genetic assortative mating in Drosophila melanogaster. PeerJ, 2015, 3: e1173. DOI:10.7717/peerj.1173 |
| [46] | Leftwich PT, Clarke NVE, Hutchings MI, Chapman T. Gut microbiomes and reproductive isolation in Drosophila. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(48): 12767-12772. DOI:10.1073/pnas.1708345114 |
| [47] | Diaz Heijtz R, Wang S, Anuar F, Qian Y, Bjorkholm B, Samuelsson A, Hibberd ML, Forssberg H, Pettersson S. Normal gut microbiota modulates brain development and behavior. Proceedings of the National Academy of Sciences of the United States of America,, 2011, 108(7): 3047-3052. DOI:10.1073/pnas.1010529108 |
| [48] | Schretter CE, Vielmetter J, Bartos I, Marka Z, Marka S, Argade S, Mazmanian SK. A gut microbial factor modulates locomotor behaviour in Drosophila. Nature, 2018, 563(7731): 402-406. DOI:10.1038/s41586-018-0634-9 |
| [49] | Houthoofd K, Braeckman BP, Lenaerts I, Brys K, De Vreese A, van Eygen S, Vanfleteren JR. Axenic growth up-regulates mass-specific metabolic rate, stress resistance, and extends life span in Caenorhabditis elegans. Experimental Gerontology, 2002, 37(12): 1371-1378. DOI:10.1016/S0531-5565(02)00173-0 |
| [50] | Smith P, Willemsen D, Popkes M, Metge F, Gandiwa E, Reichard M, Valenzano DR. Regulation of life span by the gut microbiota in the short-lived African turquoise killifish. eLife, 2017, 6: e27014. DOI:10.7554/eLife.27014 |
| [51] | Brummel T, Ching A, Seroude L, Simon AF, Benzer S. Drosophila lifespan enhancement by exogenous bacteria. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(35): 12974-12979. DOI:10.1073/pnas.0405207101 |
| [52] | Téfit MA, Leulier F. Lactobacillus plantarum favors the early emergence of fit and fertile adult Drosophila upon chronic undernutrition. The Journal of Experimental Biology, 2017, 220(Pt 5): 900-907. |
| [53] | Obata F, Fons CO, Gould AP. Early-life exposure to low-dose oxidants can increase longevity via microbiome remodelling in Drosophila. Nature Communications, 2018, 9(1): 975. DOI:10.1038/s41467-018-03070-w |
| [54] | Yamada R, Deshpande SA, Bruce KD, Mak EM, Ja WW. Microbes promote amino acid harvest to rescue undernutrition in Drosophila. Cell Reports, 2015, 10(6): 865-872. DOI:10.1016/j.celrep.2015.01.018 |
| [55] | Keebaugh ES, Yamada R, Ja WW. The nutritional environment influences the impact of microbes on Drosophila melanogaster life span. mBio, 2019, 10(4): e00885-00819. |
| [56] | Wu Q, Lian T, Fan XL, Song CC, Gaur U, Mao XP, Yang DY, Piper MDW, Yang MY. 2, 5-dimethyl-celecoxib extends Drosophila life span via a mechanism that requires insulin and target of rapamycin signaling. The Journals of Gerontology: Series A, 2017, 72(10): 1334-1341. |
| [57] | Fan XL, Zeng Y, Fan ZQ, Cui L, Song WH, Wu Q, Gao Y, Yang DY, Mao XP, Zeng B, Zhang MW, Ni QY, Li Y, Wang T, Li DY, Yang MY. Dihydromyricetin promotes longevity and activates the transcription factor FOXO and AOP in Drosophila. Aging (Albany NY), 2020, 13(1): 460-476. |
| [58] | Bauer PV, Duca FA, Waise TMZ, Rasmussen BA, Abraham MA, Dranse HJ, Puri A, O'Brien CA, Lam TKT. Metformin alters upper small intestinal microbiota that impact a glucose-SGLT1-sensing glucoregulatory pathway. Cell Metabolism, 2018, 27(1): 101-117. DOI:10.1016/j.cmet.2017.09.019 |
| [59] | Wu H, Esteve E, Tremaroli V, Khan MT, Caesar R, Manner?s-Holm L, St?hlman M, Olsson LM, Serino M, Planas-Fèlix M, Xifra G, Mercader JM, Torrents D, Burcelin R, Ricart W, Perkins R, Fernàndez-Real JM, B?ckhed F. Metformin alters the gut microbiome of individuals with treatment-naive type 2 diabetes, contributing to the therapeutic effects of the drug. Nature Medicine, 2017, 23(7): 850-858. DOI:10.1038/nm.4345 |
| [60] | de la Cuesta-Zuluaga J, Mueller NT, Corrales-Agudelo V, Velásquez-Mejía EP, Carmona JA, Abad JM, Escobar JS. Metformin is associated with higher relative abundance of mucin-degrading Akkermansia muciniphila and several short-chain fatty acid-producing microbiota in the gut. Diabetes Care, 2017, 40(1): 54-62. DOI:10.2337/dc16-1324 |
| [61] | Huang XW, Hong XL, Wang JL, Sun TT, Yu T, Yu YN, Fang JY, Xiong H. Metformin elicits antitumour effect by modulation of the gut microbiota and rescues Fusobacterium nucleatum-induced colorectal tumourigenesis. EBioMedicine, 2020(61): 103037. |
| [62] | Fan XL, Liang Q, Lian T, Wu Q, Gaur U, Li DY, Yang DY, Mao XP, Jin ZH, Li Y, Yang MY. Rapamycin preserves gut homeostasis during Drosophila aging. Oncotarget, 2015, 6(34): 35274-35283. DOI:10.18632/oncotarget.5895 |
| [63] | Bitto A, Ito TK, Pineda VV, LeTexier NJ, Huang HZ, Sutlief E, Tung H, Vizzini N, Chen B, Smith K, Meza D, Yajima M, Beyer RP, Kerr KF, Davis DJ, Gillespie CH, Snyder JM, Treuting PM, Kaeberlein M. Transient rapamycin treatment can increase lifespan and healthspan in middle-aged mice. eLife, 2016(5): e16351. |
| [64] | Schinaman JM, Rana A, Ja WW, Clark RI, Walker DW. Rapamycin modulates tissue aging and lifespan independently of the gut microbiota in Drosophila. Scientific Reports, 2019(9): 7824. |
| [65] | Artis D. Epithelial-cell recognition of commensal bacteria and maintenance of immune homeostasis in the gut. Nature Reviews Immunology, 2008, 8(6): 411-420. |
| [66] | Buchon N, Silverman N, Cherry S. Immunity in Drosophila melanogaster-from microbial recognition to whole-organism physiology. Nature Reviews Immunology, 2014, 14(12): 796-810. |
| [67] | Jones RM, Desai C, Darby TM, Luo LP, Wolfarth AA, Scharer CD, Ardita CS, Reedy AR, Keebaugh ES, Neish AS. Lactobacilli modulate epithelial cytoprotection through the Nrf2 pathway. Cell Reports, 2015, 12(8): 1217-1225. DOI:10.1016/j.celrep.2015.07.042 |
| [68] | Ryu JH, Ha EM, Oh CT, Seol J H, Brey PT, Jin I, Lee DG, Kim J, Lee D, Lee WJ. An essential complementary role of NF-kappaB pathway to microbicidal oxidants in Drosophila gut immunity. The EMBO Journal, 2006, 25(15): 3693-3701. DOI:10.1038/sj.emboj.7601233 |
| [69] | Benoit JB, Vigneron A, Broderick NA, Wu Y, Sun JS, Carlson JR, Aksoy S, Weiss BL. Symbiont-induced odorant binding proteins mediate insect host hematopoiesis. eLife, 2017(6): e19535. |
| [70] | Sansone CL, Cohen J, Yasunaga A, Xu J, Osborn G, Subramanian H, Gold B, Buchon N, Cherry S. Microbiota-dependent priming of antiviral intestinal immunity in Drosophila. Cell Host & Microbe, 2015, 18(5): 571-581. |
| [71] | Glittenberg MT, Kounatidis I, Christensen D, Kostov M, Kimber S, Roberts I, Ligoxygakis P. Pathogen and host factors are needed to provoke a systemic host response to gastrointestinal infection of Drosophila larvae by Candida albicans. Disease Models & Mechanisms, 2011, 4(4): 515-525. |
| [72] | Sokol H, Seksik P. The intestinal microbiota in inflammatory bowel diseases: time to connect with the host. Current Opinion in Gastroenterology, 2010, 26(4): 327-331. |
| [73] | Lee KA, Kim SH, Kim EK, Ha EM, You H, Kim B, Kim MJ, Kwon Y, Ryu JH, Lee WJ. Bacterial-derived uracil as a modulator of mucosal immunity and gut-microbe homeostasis in Drosophila. Cell, 2013, 153(4): 797-811. |
| [74] | Rera M, Clark RI, Walker DW. Intestinal barrier dysfunction links metabolic and inflammatory markers of aging to death in Drosophila. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(52): 21528-21533. |
| [75] | Chen YF, Zhang SY, Zeng B, Zhao JC, Yang MY, Zhang MW, Li Y, Ni QY, Wu D, Li Y. Transplant of microbiota from long-living people to mice reduces aging-related indices and transfers beneficial bacteria. Aging (Albany NY), 2020, 12(6): 4778-4793. |
| [76] | Sampson TR, Mazmanian SK. Control of brain development, function, and behavior by the microbiome. Cell Host & Microbe, 2015, 17(5): 565-576. |
| [77] | Reitz C, Brayne C, Mayeux R. Epidemiology of Alzheimer disease. Nature Reviews Neurology, 2011, 7(3): 137-152. |
| [78] | Emery DC, Shoemark DK, Batstone TE, Waterfall CM, Coghill JA, Cerajewska TL, Davies M, West NX, Allen SJ. 16S rRNA next generation sequencing analysis shows bacteria in Alzheimer's post-mortem brain. Frontiers in Aging Neuroscience, 2017(9): 195. |
| [79] | Zhuang ZQ, Shen LL, Li WW, Fu X, Zeng F, Gui L, Lü Y, Cai M, Zhu C, Tan YL, Zheng P, Li HY, Zhu J, Zhou HD, Bu XL, Wang YJ. Gut microbiota is altered in patients with Alzheimer's disease. Journal of Alzheimer's Disease, 2018, 63(4): 1337-1346. |
| [80] | Fulop T, Witkowski JM, Bourgade K, Khalil A, Zerif E, Larbi A, Hirokawa K, Pawelec G, Bocti C, Lacombe G, Dupuis G, Frost EH. Can an infection hypothesis explain the beta amyloid hypothesis of Alzheimer's disease?. Frontiers in Aging Neuroscience, 2018(10): 224. |
| [81] | Chen YJ, Fang LH, Chen S, Zhou HK, Fan YY, Lin L, Li J, Xu JY, Chen YW, Ma YF, Chen Y. Gut microbiome alterations precede cerebral amyloidosis and microglial pathology in a mouse model of Alzheimer's disease. BioMed Research International, 2020(2020): 8456596. |
| [82] | Wu SC, Cao ZS, Chang KM, Juang JL. Intestinal microbial dysbiosis aggravates the progression of Alzheimer's disease in Drosophila. Nature Communications, 2017, 8(1): 24. |
| [83] | Liu G, Tan FH, Lau SA, Jaafar MH, Chung FY, Azzam G, Liong MT, Li Y. Lactic acid bacteria feeding reversed the malformed eye structures and ameliorated gut microbiota profiles of Drosophila melanogaster Alzheimer's Disease model. Journal of Applied Microbiology, 2020. DOI:10.1111/jam.14773 |
