丁允章, 倪峰, 赵鑫, 张奕嘉, 蒋冬花


浙江师范大学化学与生命科学学院, 浙江 金华 321004
收稿日期:2020-07-21;修回日期:2020-10-13;网络出版日期:2020-01-28
基金项目:国家自然科学基金(31570013)
*通信作者:蒋冬花, E-mail: jdh@zjnu.cn.
摘要:[目的] 紫色红曲霉(Monascus purpureus) Mp-21胞内次级代谢产物的分离纯化与活性研究。[方法] 通过综合运用多种色谱分离方法对次级代谢产物进行分离纯化,最后通过多种图谱数据对化合物进行结构的解析与鉴定。对分离纯化得到的单体化合物进行抗氧化与降血糖相关酶抑制活性的测定。[结果] 从紫色红曲霉Mp-21胞内分离纯化并鉴定出3个活性化合物baicalein (1)、genistein (2)、glycitein (3),其中化合物1为首次从红曲菌科中发现,化合物2和3为首次从紫色红曲霉中发现。在体外抗氧化和抑制酶活性试验中,化合物1对1,1-二苯基-2-三硝基苯肼(DPPH)、O2–、OH–自由基具有较强的清除能力,对α-葡萄糖苷酶和α-淀粉酶也具有较强的抑制作用,IC50分别为5.67、17.46、36.40、30.94、430.93 μg/mL。[结论] 紫色红曲霉Mp-21具有开发成抗氧化、降血糖等功能性食品的潜力。
关键词:紫色红曲霉次级代谢产物黄酮类化合物抗氧化降血糖
Separation, purification and bioactivity analysis of intracellular secondary metabolites from Monascus purpureus Mp-21
Yunzhang Ding, Feng Ni, Xin Zhao, Yijia Zhang, Donghua Jiang


College of Chemistry and Life Sciences, Zhejiang Normal University, Jinhua 321004, Zhejiang Province, China
Received: 21 July 2020; Revised: 13 October 2020; Published online: 28 January 2020
*Corresponding author: Donghua Jiang, E-mail: jdh@zjnu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31570013)
Abstract: [Objective] The active components of intracellular secondary metabolites from Monascus purpureus Mp-21 were studied. [Methods] The intracellular secondary metabolites were separated and purified by a variety of chromatographic separation methods, and the structure of the compounds was analyzed and identified using a variety of chromatographic data. Monomeric compounds were tested for antioxidant activity and hypoglycemia-related enzyme inhibitory activity. [Results] Three active compounds, namely baicalein, genistein and glycitein were isolated and identified. Baicalein was first discovered from Monascaceae whereas genistein and glycitein were first discovered from Monascus purpureus. In vitro antioxidant activity test and hypoglycemic- related enzyme activity test, baicalein had strong scavenging ability on 1, 1-diphenyl-2-picrylhydrazyl (DPPH), O2- and OH- radical, and strong inhibitory effect on α-glucosidase and α-amylase, with IC50 of 5.67, 36.40, 17.46, 30.94, 430.93 μg/mL, respectively. [Conclusion] Secondary metabolites from Monascus purpureus Mp-21 have the potential to be developed into functional food such as antioxidant and hypoglycemic agents.
Keywords: Monascus purpureussecondary metabolitesflavonoidsantioxidanthypoglycemic
红曲霉(Monascus)是一类小型的丝状真菌,作为民间传统的食用菌,在东南亚国家(中国、日本、韩国、泰国、印度尼西亚、菲律宾等)有着1000多年的悠久历史[1]。而在中国其不仅作为食用菌,也作为一种药用菌供人们使用[2]。根据Ainsworth真菌分类系统以及SRAP和ISSR等分子生物学鉴定方法的研究表明,红曲霉属于真菌界(Eumycetes)、真菌门(Eumycophyta)、子囊菌亚门(Ascomycotina)、不整囊菌纲(Plectomycetes)、散囊菌目(Eurotiales)、红曲菌科(Monascaceae)、红曲霉属(Monascus)[3]。而目前研究最多的主要有:紫色红曲霉(M. purpureus)、红色红曲霉(M. ruber)、烟色红曲霉(M. fuliginosus)、安卡红曲霉(M. anka)和从毛红曲霉(M. pilosus)等[4]。红曲霉作为药食同源性真菌,其自身可以产生多种有益的次级代谢产物,如红曲色素(monascus pigments,MPs)[5]、莫纳克林K (monacolin K)[6]、γ-氨基丁酸(GABA)[7]、二聚酸(dimerumic acid)[8]和麦角甾醇[9]等,具有抗氧化[10]、消炎[11]、降血脂[12]、抗肿瘤[13]和抑菌[14]等活性。
总结分析已发表的研究报道可知,红曲霉目前的研究主要集中在MPs的结构成分及其功效、高产monacolin K和GABA的菌株筛选和发酵工艺条件的优化、功能基因的敲除和鉴定、菌株的筛选和发酵液生物活性的测定等方面。而对于研究红曲霉菌体内的次级代谢产物的报道却很少。随着分子生物学、生物信息学和基因组学等学科的快速发展极大地推动了真菌次级代谢产物的研究与发展。近年来,已批准和即将上市的药物中,约60%是来源于次级代谢产物[15]。进入21世纪以来,已有超过一半的微生物源新结构化合物与新活性化合物来源于丝状真菌[16]。真菌次级代谢产物作为临床药物的重要来源一直以来受到广泛的关注,同时也是研究的热点[17]。本研究以自主筛选的野生型紫色红曲霉Mp-21为研究对象,对其胞内次级代谢产物进行分离纯化,以期获得特殊的以红曲霉为来源的化学成分,丰富红曲霉中药用活性化学成分的类别,发现更多的可供药用的活性成分及潜在的药用先导化合物,为深层次全方位地了解红曲霉及其开发与应用提供科学的理论依据。
1 材料和方法 1.1 材料
1.1.1 菌株: 为本实验室自主筛选保藏的野生型紫色红曲霉(M. purpureus) Mp-21菌株。
1.1.2 培养基: 马铃薯葡萄糖琼脂培养基(PDA培养基):称取马铃薯浸出粉6 g、葡萄糖20 g和琼脂粉20 g加热溶解于1 L去离子水中,分装,121 ℃高压灭菌15 min,备用;马铃薯葡萄糖液体培养基(PD液体培养基):称取马铃薯浸出粉6 g和葡萄糖20 g加热溶解于1 L去离子水中,用乳酸将pH调至4.5左右,分装,121 ℃高压灭菌15 min,备用。
1.1.3 主要仪器: BSA-224S电子天平(赛多利斯科学仪器有限公司)、D-1高压蒸汽灭菌锅(北京发恩科贸有限公司)、SW-CJ-1B超净工作台(苏州净化设备有限公司)、Blue pard生化培养箱(上海一恒科学仪器有限公司)、BUCHI Rotavapor R-300旋转蒸发仪(BUCHI公司)、DHG-9101-2SA电热恒温鼓风干燥箱(山东邺城科源仪器设备厂)、WD-9403C紫外仪(北京六一生物科技有限公司)、液-质联用仪UPLC/ZQ400 (美国Waters公司)、核磁共振波谱仪(NMR)AV-600 (Bruker公司)、紫外分光光度计UV-2550 (日本岛津)、酶标仪1510-Z0024 C (Thermo Fisher)。
1.1.4 主要试剂: 95%乙醇、乙酸乙酯、甲醇、二氯甲烷、过氧化氢(H2O2)、硫酸铁(FeSO4)、水杨酸、维生素C (Vc)、碳酸钠等分析纯试剂均购于国药集团化学试剂有限公司;还原型β-烟酰胺腺嘌呤二核苷酸二钠盐(NADH)、吩嗪硫酸甲酯(PMS)、氯化硝基四氮唑蓝(NBT)、1, 1-二苯基-2-三硝基苯肼(DPPH)、阿卡波糖(Acarbose)、4-硝基苯基-α-D吡喃葡萄糖苷(pNPG)、3, 5-二硝基水杨酸(DNS)等分析纯试剂均购于上海阿拉丁生化科技有限公司;α-葡萄糖苷酶、α-淀粉酶等购于Sigma-Aldrich公司;Sephadex LH-20凝胶购于美国GE公司。
1.2 紫色红曲霉Mp-21的发酵培养 将实验室冷冻保藏的紫色红曲霉Mp-21菌株取出至室温解冻,解冻后的菌株在超净工作台上用PDA培养基平板接种进行活化培养,30 ℃培养7 d。将活化好的菌株转接到装有75 mL PD液体培养液的250 mL三角锥形瓶中,30 ℃、180 r/min培养4 d得到种子液。将培养得到的种子液转接到装有1 L PD液体培养液的3 L三角锥形瓶中,30 ℃、180 r/min培养7 d即得培养好的红曲霉发酵液。
1.3 紫色红曲霉Mp-21胞内次级代谢产物的提取 将红曲霉发酵液用2-3层纱布过滤,弃去滤液,再将红曲霉菌体置于50 ℃恒温干燥箱中干燥。干燥好的红曲霉菌体用打粉机粉碎,粉碎后的菌粉用80%的乙醇反复浸提3次,浸提液经减压旋蒸浓缩获得乙醇粗浸膏。乙醇粗浸膏加适量去离子水溶解成混悬液,混悬液用乙酸乙酯萃取3次,所得萃取液进行减压浓缩获得乙酸乙酯粗浸膏。
1.4 紫色红曲霉Mp-21胞内次级代谢产物的分离纯化与鉴定 将乙酸乙酯粗浸膏26 g用甲醇溶解后与硅胶(200-300目)等比例混匀拌样,然后用硅胶(520 g,200-300目)柱层析分离,以石油醚-乙酸乙酯(20:1-0:100)、乙酸乙酯-甲醇(20:1-20:5)梯度洗脱,通过薄层层析进行组分分析,共获得4个组分Fr.1 (3.9 g)、Fr.2 (1.7 g)、Fr.3 (1.2 g)和Fr.4 (2.1 g)。由于Fr.1主要是油状物,故未继续分离此组分。将Fr.2继续用硅胶(170 g,300-400目)柱层析分离,用石油醚︰乙酸乙酯(10:1-0:1)分离得到了化合物2,再用重结晶的方法提纯最终获得化合物2 (28.2 mg)。Fr.3继续用硅胶(120 g,300-400目)柱层析分离,用石油醚︰乙酸乙酯(10:1-0:1),获得组分Fr.3.1-3,将Fr.3.3组分继续用Sephadex LH-20凝胶柱以甲醇进行洗脱分离得到化合物3 (23.7 mg)。Fr.4继续用硅胶(210 g,300-400目)柱层析分离,用石油醚︰乙酸乙酯(5:1-0:1)、乙酸乙酯︰甲醇(20:1-0:1)梯度洗脱,获得组分Fr.4.1-5,将Fr.4.1组分继续用Sephadex LH-20凝胶柱以甲醇进行洗脱分离获得组分Fr.4.1.1-6,将组分Fr.4.1.4继续用Sephadex LH-20凝胶柱以甲醇进行洗脱分离得到化合物1 (19.6 mg)。最后通过对化合物的波谱数据(1H-NMR、13C-NMR、HR-ESI-MS等谱图)进行分析,参考相应文献对单体化合物的结构进行解析鉴定。
1.5 体外抗氧化活性试验
1.5.1 1, 1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力测定: 参照文献[18]的方法并稍作修改。取1 mL的DPPH溶液(0.15 mmol/L,溶于95%乙醇中),加入1 mL稀释适当浓度的单体化合物溶液,涡旋混合均匀,在避光室温的条件下反应30 min,用紫外分光光度计在517 nm波长处测定吸光度值,每个浓度的溶液均做3次平行重复。同时用Vc作为阳性对照。DPPH自由基清除能力(%)按公式(1)计算;结果以IC50值来表示,IC50值表示抑制50%的自由基所需要的样品浓度(μg/mL)。
 | 公式(1) |
1.5.2 超氧阴离子(O2-)自由基清除能力测定: 参考文献[19]的方法并稍作修改。利用NADH-PMS-NBT为超氧阴离子(O2-)生成系统,超氧阴离子清除剂能减少NBT的蓝色。在反应中加入2 mL的Tris-HCl缓冲液(16 mmol/L,pH 8.0),1 mL的NADH (78 μmol/L),1 mL的NBT (50 μmol/L),1 mL稀释适当浓度的单体化合物溶液,1 mL的PMS (10 μmol/L),混合均匀,在室温避光的条件下反应5 min,用紫外分光光度计在560 nm波长处测定吸光度值,每个浓度的溶液均做3次平行重复。同时用Vc作为阳性对照。超氧阴离子自由基清除能力(%)按公式(2)计算;结果以IC50值来表示,IC50值表示抑制50%的自由基所需要的样品浓度(μg/mL)。
 | 公式(2) |
1.5.3 羟基(OH-)自由基清除能力测定: 参照文献[20]的方法并稍作修改。在反应体系中加入2 mL稀释适当浓度的单体化合物溶液、2 mL的6 mmol/L FeSO4溶液和2 mL的6 mmol/L水杨酸溶液,最后加入2 mL的6 mmol/L H2O2溶液,混合均匀,在37 ℃条件下反应30 min,用紫外分光光度计在510 nm波长处测定吸光度值,每个浓度的溶液均做3次平行重复。同时用Vc作为阳性对照。羟基自由基清除能力(%)按公式(3)计算;结果以IC50值来表示,IC50值表示抑制50%的自由基所需要的样品浓度(μg/mL)。
 | 公式(3) |
1.6 体外抑制降血糖相关酶活性试验
1.6.1 α-葡萄糖苷酶抑制活性的测定: 参考文献[21]的方法并稍作修改。用磷酸盐缓冲液(0.1 mol/L,pH 6.8)将α-葡萄糖苷酶和4-硝基苯基-α-D吡喃葡萄糖苷(pNPG)分别配制成5 U/mL的α-葡萄糖苷酶溶液和1 mg/mL的pNPG溶液。在反应中加入50 μL的磷酸盐缓冲液,50 μL的α-葡萄糖苷酶溶液和50 μL的稀释适当浓度的单体化合物溶液于96孔板中,混合均匀,在37 ℃条件下孵育10 min,再加入50 μL的pNPG溶液,充分混合,37 ℃条件下反应30 min。最后加入100 μL的碳酸钠溶液(2 mol/L)终止反应,在酶标仪405 nm波长下测定吸光度值,每个浓度的溶液均做3次平行重复。同时用阿卡波糖作阳性对照。对α-葡萄糖苷酶抑制能力(%)按公式(4)计算;结果以IC50值来表示,IC50值表示抑制50%的酶活力所需要的样品浓度(μg/mL)。
 | 公式(4) |
1.6.2 α-淀粉酶抑制活性的测定: 参考文献[22]的方法并稍作修改。用磷酸钠缓冲液(0.02 mol/L,pH 6.8)将α-淀粉酶和可溶性淀粉配制成7 U/mL的α-淀粉酶溶液和1% (W/V)的可溶性淀粉溶液。将0.2 mL α-淀粉酶溶液和0.2 mL稀释适当浓度的单体化合物溶液混合均匀后用磷酸钠缓冲液稀释至1 mL,于37 ℃水浴10 min后,加入1%可溶性淀粉溶液,精确反应5 min后,加入1 mL DNS试剂终止反应,并置于沸水浴中10 min后迅速置于冰水浴中冷却,最后加入20 mL去离子水,混合均匀后于540 nm波长下测定吸光度值,每个浓度的溶液均做3次平行重复。同时用阿卡波糖作阳性对照。对α-淀粉酶酶抑制能力(%)按公式(5)计算;结果以IC50值来表示,IC50值表示抑制50%的酶活力所需要的样品浓度(μg/mL)。
 | 公式(5) |
1.7 数据分析 实验结果以平均值±标准差(mean±SD)来表示。用Microsoft Office Excel 2010进行数据处理,用SPSS 21.0计算IC50值。
2 结果和分析 2.1 活性代谢产物的结构鉴定 运用多种色谱方法,从紫色红曲霉Mp-21乙酸乙酯的粗提物中分离纯化得到3个次级代谢产物。通过对波谱数据的分析与查阅相关的文献报道,将分离纯化得到的3个次级代谢产物确定为baicalein (1)、genistein (2)、glycitein (3)(图 1)。
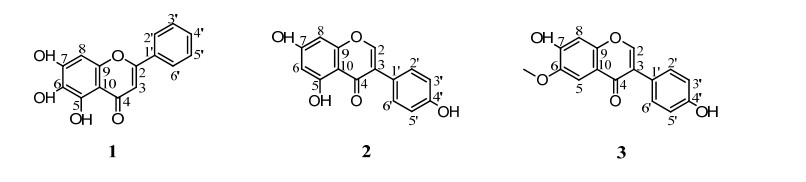 |
| 图 1 化合物1-3的结构图 Figure 1 Structures of compounds 1-3. |
| 图选项 |
化合物1 (19.6 mg):黄色针状晶体,溶于甲醇和乙醇。经HR-ESI-MS分析可知:m/z[M+H]+ 271.0606,分子式为C15H11O5,计算值为271.0601。因此推测该化合物分子式为C15H10O5。1H NMR (600 MHz, DMSO-d6) δ 12.66 (s,1H, C5-OH),10.60 (s,1H, C7-OH),8.83 (s,1H,C6-OH),8.06 (m,2H,C2’, 6’-H),7.59 (m,3H,C3’, 4’, 5’-H),6.93 (s,1H,C3-H),6.64 (s,1H,C8-H);13C NMR (151 MHz,DMSO-d6) δ 182.59 (C-4),163.39 (C-2),154.10 (C-7),150.31 (C-9),147.44 (C-5),132.30 (C-4’),131.43 (C-1’),129.80 (C-6),129.59 (C-3’),129.59 (C-5’),126.77 (C-2’),126.77 (C-6’),104.95 (C-3),104.75 (C-10),94.48 (C-8)。该结构的图谱数据与文献[23-24]报道的相一致,据此将该化合物最终鉴定为baicalein。
化合物2 (28.2 mg):金黄色针状晶体,溶于乙醇和DMSO。经HR-ESI-MS分析可知:m/z[M+H]+ 271.0628,分子式为C15H11O5,计算值为271.0601。因此推测该化合物分子式为C15H10O5。1H NMR (600 MHz,MeOD) δ 8.04 (s,1H, C2-H),7.38 (d,J=7.8 Hz,2H,C2’, 6’-H),6.86 (d,J=7.9 Hz,2H,C3’, 5’-H),6.34 (s,1H,C8-H),6.22 (s,1H,C6-H);13C NMR (151 MHz,MeOD) δ 180.83 (C-4),164.61 (C-7),162.44 (C-5),158.30 (C-9),157.41 (C-4’),153.35 (C-2),129.98 (C-2’),129.98 (C-6’),123.31 (C-3),121.92 (C-1’),114.86 (C-3’),104.86 (C-5’),98.74 (C-6),93.40 (C-8)。该结构的图谱数据与文献[25]报道的相一致,据此将该化合物最终鉴定为genistein。
化合物3 (23.7 mg):黄色粉末,溶于DMSO。经HR-ESI-MS分析可知:m/z[M+H]+ 285.0759分子式为C16H13O5,计算值为285.0757。因此推测该化合物分子式为C16H12O5。1H NMR (600 MHz,DMSO-d6) δ 10.57 (s,C4’-OH),9.52 (s,C7-OH),δ 8.27 (s,1H, C2-H), 7.44 (s,1H,C5-H),7.39 (d,J= 8.5 Hz,2H,C2’, 6’-H),6.94 (s,1H,C8-H),6.82 (d,J= 8.5 Hz,2H,C3’, 5’-H),3.88 (s,3H,C6-OCH3);13C NMR (151 MHz,DMSO-d6) δ 174.79 (C-4),157.58 (C-4’),153.31 (C-7),152.94 (C-2),152.18 (C-9),147.37 (C-6),130.53 (C-2’),130.53 (C-6’),123.43 (C-3),123.26 (C-1’),116.72 (C-10),115.42 (C-3’),115.42 (C-5’),105.19 (C-5),103.30 (C-8),56.28 (6-OMe)。该结构的图谱数据与文献[26-27]报道的相一致,据此将该化合物最终鉴定为glycitein。
2.2 单体化合物的抗氧化活性 3种单体化合物的抗氧化活性如表 1所示。由表中结果可知,化合物1表现出较好的抗氧化能力,对DPPH、OH-自由基都具有较强的清除能力,IC50值分别为5.67±0.02 μg/mL和36.40±0.15 μg/mL,Vc的IC50值分别为6.72±0.02 μg/mL和37.43±0.13 μg/mL,较优于对照Vc的效果;对O2-自由基的清除能力要低于对照Vc的效果,IC50值为17.46±0.05 μg/mL,Vc的IC50值为5.65±0.05 μg/mL,但也表现出了较好的对O2-自由基的清除能力。化合物2和3也对DPPH、OH-和O2-自由基表现出一定的清除能力。
表 1. 紫色红曲霉Mp-21次级代谢产物对自由基的清除和抗氧化活性的结果 Table 1. Effects of Monascus purpureus Mp-21 secondary metabolites on free radical scavenging and antioxidant activities
| In vitro antioxidant activity | Compounds | |||
| 1 | 2 | 3 | Vc | |
| DPPH scavenging activity (IC50,μg/mL) | 5.67±0.02 | 1596.33±8.18 | 3417.33±14.44 | 6.72±0.02 |
| O2- scavenging activity (IC50,μg/mL) | 17.46±0.05 | 99.55±0.21 | 177.24±0.41 | 5.65±0.05 |
| OH- scavenging activity (IC50,μg/mL) | 36.40±0.15 | 546.98±0.40 | 74.52±0.20 | 37.43±0.13 |
| Data derived from three independent experiments were statistically analyzed, and the results are presented as mean±SD (n=3). | ||||
表选项
2.3 单体化合物的酶抑制作用 3种单体化合物的酶抑制作用如表 2所示。由表中结果可知,化合物1对α-葡萄糖苷酶和α-淀粉酶的抑制作用都是3种化合物中表现最好的,IC50分别为30.94±0.28 μg/mL和430.93±2.83 μg/mL。对照Acarbose的IC50分别为18.72±0.02 μg/mL和17.46±0.07 μg/mL。化合物2和3也表现出对α-葡萄糖苷酶和α-淀粉酶一定的酶抑制作用,对α-葡萄糖苷酶的抑制作用要优于α-淀粉酶。
表 2. 紫色红曲霉Mp-21次生代谢产物对α-葡萄糖苷酶和α-淀粉酶的抑制作用结果 Table 2. Effects of Monascus purpureus Mp-21 secondary metabolites on α-glucosidase and α-amylase inhibition
| In vitro enzyme inhibition assay | Compounds | |||
| 1 | 2 | 3 | Acarbose | |
| α-glucosidase inhibition (IC50, μg/mL) | 30.94±0.28 | 464.05±1.30 | 684.41±0.75 | 18.72±0.02 |
| α-amylase inhibition (IC50, μg/mL) | 430.93±2.83 | 729.46±2.24 | 935.51±0.70 | 17.46±0.07 |
| Data derived from three independent experiments were statistically analyzed, and the results are presented as mean±SD (n=3). | ||||
表选项
3 讨论和结论 首次以紫色红曲霉Mp-21菌体为研究对象,对胞内次级代谢产物分离纯化并鉴定出3个活性化合物,分别是baicalein (1)、genistein (2)和glycitein (3),均为黄酮类化合物(flavonoids)。其中化合物1为首次从红曲菌科中发现,化合物2和3为首次从紫色红曲霉中发现。黄酮类化合物是指2个芳香环通过三碳链相互连接而成的一系列化合物,有共同的C6-C3-C6的骨架(1)[28](图 2),具有抗氧化、抗肿瘤、抗炎症、抗病毒和降血糖[29-30]等功能。根据其三碳链的氧化程度及是否成环、B环的位置差异和取代模式,划分出不同类型的黄酮类化合物[31](图 2)。据此可知,化合物1属于黄酮化合物,化合物2和3属于异黄酮化合物。化合物1主要存在于唇形科植物黄芩中[32];化合物2和3主要存在于豆科植物大豆中[33-34]。
 |
| 图 2 黄酮类化合物的基本分类 Figure 2 The basic classifications of flavonoids. |
| 图选项 |
在抗氧化活性实验结果中可知:对DPPH自由基的清除能力1 > 2 > 3;对O2-自由基的清除能力1 > 2 > 3;对OH-自由基的清除能力1 > 3 > 2。Seyoum等[35]探究了黄酮类化合物的抗氧化活性与结构间的构效关系。研究结果表明,在黄酮类化合物结构中,A环和B环的相邻位点有2个或3个羟基取代比单羟基取代或间位羟基取代时抗氧化活性更强。对DPPH自由基和O2-自由基的清除能力的测定结果符合上述研究结果。A环具有3个相邻羟基取代的结构比单羟基取代或间位羟基取代的结构表现出更强的抗氧化活性。在清除Fenton反应产生的羟基自由基方面却表现出1 > 3 > 2,这可能是由于不同反应系统的抑制机理不同所致。在Fenton反应中应更加注意金属的螯合作用,有研究认为有些化合物可能通过金属的螯合或改变铁的氧化还原化学反应来发挥保护作用[36]。
在降血糖相关酶抑制实验结果中可知:对α-葡萄糖苷酶的抑制能力1 > 2 > 3;对α-淀粉酶的抑制能力1 > 2 > 3。Li等[37]研究了黄酮类化合物对α-葡萄糖苷酶和α-淀粉酶的抑制活性与结构之间的构效关系,研究结果表明,A环上C-6和C-7上的相邻的羟基能够增强对α-葡萄糖苷酶和α-淀粉酶的抑制活性。Gao等[38]研究发现黄酮类化合物A环上C-6位上的羟基是发挥效应的必需基团,A环上C-5、6、7上的羟基取代对有效抑制α-葡萄糖苷酶和α-淀粉酶的活性是至关重要的。对α-葡萄糖苷酶和α-淀粉酶的酶抑制活性测定结果符合上述研究结果。A环上具有C-5、6、7上的羟基取代表现出更强的酶抑制活性。
本实验从紫色红曲霉Mp-21的胞内发现的3种黄酮类化合物,经文献查阅发现均无明显的细胞毒性[39-41]。并从构效关系上对其抗氧化活性和降血糖相关酶抑制活性上进行了简单的分析。由于受到所分离得到的化合物的含量限制,未能进一步测试化合物的抗氧化活性和酶抑制作用机理及其他活性作用。但从研究结果表明,紫色红曲霉Mp-21是潜在的抗氧化剂和降血糖抑制剂来源,具有开发成功能性食品的潜力。
References
| [1] | Kim D, Ku S. Beneficial effects of Monascus sp. KCCM 10093 pigments and derivatives: a mini review. Molecules, 2018, 23(1): 98. DOI:10.3390/molecules23010098 |
| [2] | Lin YL, Wang TH, Lee MH, Su NW. Biologically active components and nutraceuticals in the Monascus-fermented rice: a review. Applied Microbiology and Biotechnology, 2008, 77(5): 965-973. DOI:10.1007/s00253-007-1256-6 |
| [3] | Shao YC, Xu L, Chen FS. Genetic diversity analysis of Monascus strains using SRAP and ISSR markers. Mycoscience, 2011, 52(4): 224-233. DOI:10.1007/S10267-010-0087-Y |
| [4] | Patakova P. Monascus secondary metabolites: production and biological activity. Journal of Industrial Microbiology & Biotechnology, 2013, 40(2): 169-181. DOI:10.1007/s10295-012-1216-8 |
| [5] | Feng YL, Shao YC, Chen FS. Monascus pigments. Applied Microbiology and Biotechnology, 2012, 96(6): 1421-1440. DOI:10.1007/s00253-012-4504-3 |
| [6] | Huang CH, Shiu SM, Wu MT, Chen WL, Wang SG, Lee HM. Monacolin K affects lipid metabolism through SIRT1/AMPK pathway in HepG2 cells. Archives of Pharmacal Research, 2013, 36(12): 1541-1551. DOI:10.1007/s12272-013-0150-2 |
| [7] | Dhakal R, Bajpai VK, Baek KH. Production of GABA (γ-aminobutyric acid) by microorganisms: a review. Brazilian Journal of Microbiology, 2012, 43(4): 1230-1241. DOI:10.1590/S1517-83822012000400001 |
| [8] | Aniya Y, Ohtani Ⅱ, Higa T, Miyagi C, Gibo H, Shimabukuro M, Nakanishi H, Taira J. Dimerumic acid as an antioxidant of the mold, Monascus anka. Free Radical Biology and Medicine, 2000, 28(6): 999-1004. DOI:10.1016/S0891-5849(00)00188-X |
| [9] | Liang JX, Zhang QQ, Huang YF, Pang HQ, Liu XG, Gao W, Li P, Yang H. Comprehensive chemical profiling of Monascus-fermented rice product and screening of lipid-lowering compounds other than monacolins. Journal of Ethnopharmacology, 2019(238): 111879. |
| [10] | Dhale MA, Javagal M, Puttananjaiah MKH. Protective and antioxidative effect of rubropunctatin against oxidative protein damage induced by metal catalyzed reaction. International Journal of Biological Macromolecules, 2018(116): 409-416. |
| [11] | Hsu LC, Hsu YW, Liang YH, Kuo YH, Pan TM. Anti-tumor and anti-inflammatory properties of ankaflavin and monaphilone a from Monascus purpureus NTU 568. Journal of Agricultural and Food Chemistry, 2011, 59(4): 1124-1130. DOI:10.1021/jf103652n |
| [12] | Lee CL, Wen JY, Hsu YW, Pan TM. The blood lipid regulation of Monascus-produced monascin and ankaflavin via the suppression of low-density lipoprotein cholesterol assembly and stimulation of apolipoprotein A1 expression in the liver. Journal of Microbiology, Immunology and Infection, 2018, 51(1): 27-37. DOI:10.1016/j.jmii.2016.06.003 |
| [13] | Zheng YQ, Zhang Y, Chen DS, Chen HJ, Lin L, Zheng CZ, Guo YH. Monascus pigment rubropunctatin: a potential dual agent for cancer chemotherapy and phototherapy. Journal of Agricultural and Food Chemistry, 2016, 64(12): 2541-2548. DOI:10.1021/acs.jafc.5b05343 |
| [14] | Nozaki H, Date S, Kondo H, Kiyohara H, Takaoka D, Tada T, Nakayama M. Ankalactone, a new α, β-unsaturated γ-lactone from Monascus anka. Agricultural and Biological Chemistry, 1991, 55(3): 899-900. |
| [15] | Lei HM, Zhao PJ. Advances in research on mining fungal secondary metabolites. Scientia Sinica Vitae, 2019, 49(7): 865-873. (in Chinese) 雷红梅, 赵沛基. 真菌次生代谢产物挖掘策略研究进展. 中国科学(生命科学), 2019, 49(7): 865-873. |
| [16] | Patridge E, Gareiss P, Kinch MS, Hoyer D. An analysis of FDA-approved drugs: natural products and their derivatives. Drug Discovery Today, 2016, 21(2): 204-207. DOI:10.1016/j.drudis.2015.01.009 |
| [17] | Wang SH, Liu Y. A new era of fungal secondary metabolism. Mycosystema, 2020, 39(3): 471-476. (in Chinese) 汪世华, 刘阳. 真菌次级代谢的新时代. 菌物学报, 2020, 39(3): 471-476. |
| [18] | Ser HL, Palanisamy UD, Yin WF, Abd Malek SN, Chan KG, Goh BH, Lee LH. Presence of antioxidative agent, pyrrolo[1, 2-a]pyrazine-1, 4-dione, hexahydro-in newly isolated Streptomyces mangrovisoli sp. nov.. Frontiers in Microbiology, 2015, 6: 854. |
| [19] | Gül?in I. Antioxidant activity of caffeic acid (3, 4-dihydroxycinnamic acid). Toxicology, 2006, 217(2/3): 213-220. |
| [20] | Chen F, Huang GL, Yang ZY, Hou YP. Antioxidant activity of Momordica charantia polysaccharide and its derivatives. International Journal of Biological Macromolecules, 2019(138): 673-680. |
| [21] | Siddharth S, Vittal RR. Evaluation of antimicrobial, enzyme inhibitory, antioxidant and cytotoxic activities of partially purified volatile metabolites of Marine Streptomyces sp. S2A. Microorganisms, 2018, 6(3): 72. DOI:10.3390/microorganisms6030072 |
| [22] | Taha M, Tariq Javid M, Imran S, Selvaraj M, Chigurupati S, Ullah H, Rahim F, Khan F, Islam Mohammad J, Mohammed Khan K. Synthesis and study of the α-amylase inhibitory potential of thiadiazole quinoline derivatives. Bioorganic Chemistry, 2017(74): 179-186. |
| [23] | Wolniak M, Oszmianski J, Wawer I. Solid-state NMR studies and DFT calculations of flavonoids: baicalein, baicalin and wogonoside. Magnetic Resonance in Chemistry, 2008, 46(3): 215-225. DOI:10.1002/mrc.2165 |
| [24] | Xiao LH, Wang HY, Song SJ, Zhang GP, Song HX, Xu SX. Isolation and identification of the chemical constituents of roots of Scutellaria amoena C. H. Wright. Journal of Shenyang Pharmaceutical University, 2003, 20(3): 181-183, 193. (in Chinese) 肖丽和, 王红燕, 宋少江, 张广平, 宋海秀, 徐绥绪. 滇黄芩化学成分的分离与鉴定. 沈阳药科大学学报, 2003, 20(3): 181-183, 193. DOI:10.3969/j.issn.1006-2858.2003.03.008 |
| [25] | Selepe MA, Drewes SE, van Heerden FR. Total synthesis of the pyranoisoflavone kraussianone 1 and related isoflavones. Journal of Natural Products, 2010, 73(10): 1680-1685. DOI:10.1021/np100407n |
| [26] | Park HJ, Park JH, Moon JO, Lee KT, Jung WT, Oh SR, Lee HK. Isoflavone glycosides from the flowers of Pueraria thunbergiana. Phytochemistry, 1999, 51(1): 147-151. DOI:10.1016/S0031-9422(98)00729-8 |
| [27] | Soidinsalo O, W?h?l? K. Synthesis of phytoestrogenic isoflavonoid disulfates. Steroids, 2004, 69(10): 613-616. DOI:10.1016/j.steroids.2004.03.015 |
| [28] | Santos-Buelga C, Feliciano AS. Flavonoids: from structure to health issues. Molecules, 2017, 22(3): 477. DOI:10.3390/molecules22030477 |
| [29] | Zhang BW, Li X, Sun WL, Xing Y, Xiu ZL, Zhuang CL, Dong YS. Dietary flavonoids and acarbose synergistically inhibit α-glucosidase and lower postprandial blood glucose. Journal of Agricultural and Food Chemistry, 2017, 65(38): 8319-8330. DOI:10.1021/acs.jafc.7b02531 |
| [30] | Zakaryan H, Arabyan E, Oo A, Zandi K. Flavonoids: promising natural compounds against viral infections. Archives of Virology, 2017, 162(9): 2539-2551. |
| [31] | Das S, Rosazza JPN. Microbial and enzymatic transformations of flavonoids. Journal of Natural Products, 2006, 69(3): 499-508. DOI:10.1021/np0504659 |
| [32] | Sowndhararajan K, Deepa P, Kim M, Park SJ, Kim S. Baicalein as a potent neuroprotective agent: a review. Biomedicine & Pharmacotherapy, 2017(95): 1021-1032. |
| [33] | Devi KP, Shanmuganathan B, Manayi A, Nabavi SF, Nabavi SM. Molecular and therapeutic targets of genistein in alzheimer's disease. Molecular Neurobiology, 2017, 54(9): 7028-7041. |
| [34] | Dixon RA, Sumner LW. Legume natural products: understanding and manipulating complex pathways for human and animal health. Plant Physiology, 2003, 131(3): 878-885. DOI:10.1104/pp.102.017319 |
| [35] | Seyoum A, Asres K, El-Fiky FK. Structure-radical scavenging activity relationships of flavonoids. Phytochemistry, 2006, 67(18): 2058-2070. DOI:10.1016/j.phytochem.2006.07.002 |
| [36] | Ruiz-Larrea B, Leal AM, Martín C, Martínez R, Lacort M. Effects of estrogens on the redox chemistry of iron: a possible mechanism of the antioxidant action of estrogens. Steroids, 1995, 60(11): 780-783. DOI:10.1016/0039-128X(95)00119-B |
| [37] | Li K, Yao F, Xue Q, Fan H, Yang LG, Li X, Sun LW, Liu YJ. Inhibitory effects against α-glucosidase and α-amylase of the flavonoids-rich extract from Scutellaria baicalensis shoots and interpretation of structure-activity relationship of its eight flavonoids by a refined assign-score method. Chemistry Central Journal, 2018, 12(1): 82. DOI:10.1186/s13065-018-0445-y |
| [38] | Gao H, Nishioka T, Kawabata J, Kasai T. Structure-activity relationships for α-glucosidase inhibition of baicalein, 5, 6, 7-trihydroxyflavone: the effect of a-ring substitution. Bioscience, Biotechnology, and Biochemistry, 2004, 68(2): 369-375. DOI:10.1271/bbb.68.369 |
| [39] | Burnett BP, Silva S, Mesches MH, Wilson S, Jia Q. Safety evaluation of a combination, defined extract of Scutellaria baicalensis and Acacia catechu. Journal of Food Biochemistry, 2007, 31(6): 797-825. DOI:10.1111/j.1745-4514.2007.00142.x |
| [40] | Spagnuolo C, Russo GL, Orhan IE, Habtemariam S, Daglia M, Sureda A, Nabavi SF, Devi KP, Loizzo MR, Tundis R, Nabavi SM. Genistein and cancer: current status, challenges, and future directions. Advances in Nutrition, 2015, 6(4): 408-419. |
| [41] | Anderson JJB, Anthony MS, Cline JM, Washburn SA, Garner SC. Health potential of soy isoflavones for menopausal women. Public Health Nutrition, 1999, 2(4): 489-504. |
