严嘉慧1,2,3, 周岐海1, 胡林安2,3, 钟菊新2,3, 李强2,3


1. 广西师范大学珍稀濒危动植物生态与环境保护教育部重点实验室, 广西珍稀濒危动物生态学重点实验室, 广西 桂林 541006;
2. 中国地质科学院岩溶地质研究所, 自然资源部广西岩溶动力学重点实验室, 广西 桂林 541004;
3. 联合国教科文组织国际岩溶研究中心, 广西 桂林 541004
收稿日期:2021-02-08;修回日期:2021-03-24;网络出版日期:2021-04-02
基金项目:中央引导地方科技发展专项(桂科ZY20198009)
作者简介:李强,中国地质科学院岩溶地质研究所研究员,研究方向为微生物驱动的岩溶碳循环。2007年毕业于华中科技大学生命科学与技术学院生物化学与分子生物学专业,获博士学位。2011年受玛丽居里****计划资助赴德国美因茨大学开展合作研究。获广西自然科学基金****基金和第十四届广西青年科技奖,入选自然资源部自然资源高层次创新人才,任中国地质调查局“地质环境创新工程”副首席专家、中国水土保持学会科技协作工作委员会委员、中国微生物学会地质微生物学专业委员会委员。主持国家重点研发计划课题、国家自然科学基 金、广西自然科学基金、中国地质调查局、中国博士后基金等各类项目11项。已在Catena、Frontiers in Microbiology、FEMS Microbiology Ecology等学术期刊发表SCI论文20余篇。.
*通信作者:李强, E-mail: glqiangli@163.com.
摘要:[目的] 了解可培养细菌群落对岩溶石灰土演替过程的响应,可为岩溶石漠化治理、生态恢复和重建等提供理论依据。[方法] 以黑色石灰土、棕色石灰土、黄色石灰土和红色石灰土为研究对象,对土壤SOC、TN和TP含量以及可培养细菌群落进行测定。[结果] 土壤SOC和TN含量表现为:黑色石灰土>棕色石灰土>黄色石灰土>红色石灰土,TP含量在黑色石灰土中最高,在红色石灰土中最低。本研究共分离纯化得到144株细菌,其中R2A培养基分离纯化出的细菌最多。细菌主要来自Actinobacteria、Bacteroidetes、Firmicutes和Proteobacteria门,Pseudomonas、Cupriavidus和Bacillus等是可培养菌中的优势属。在属水平上,黑色石灰土中分离得到的菌株最多并以Arenimonas、Thermomonas、Achromobacter、Brevibacillus等作为优势特有属。具有固碳、固氮和解磷功能的细菌主要分布在岩溶石灰土演替的早期。[结论] 基于母质碳酸盐岩特性,富含有机质的黑色石灰土在参与碳氮磷循环细菌的作用下形成。随着石灰土淋溶程度的增加,岩溶石灰土理化性质和可培养细菌多样性呈现降低的趋势。
关键词:岩溶石灰土土壤演替可培养细菌
Community characteristics of culturable bacteria in calcareous soil at different succession stages
Jiahui Yan1,2,3, Qihai Zhou1, Lin'an Hu2,3, Juxin Zhong2,3, Qiang Li2,3


1. Key Laboratory of Ecology of Rare and Endangered Species and Environmental Protection, Ministry of Education, Guangxi Key Laboratory of Rare and Endangered Animal Ecology, Guangxi Normal University, Guilin 541006, Guangxi Zhuang Autonomous Region, China;
2. Institute of Karst Geology, Chinese Academy of Geological Sciences, Key Laboratory of Karst Dynamics, Ministry of Natural Resources, Guilin 541004, Guangxi Zhuang Autonomous Region, China;
3. International Research Center on Karst under the Auspices of United Nations Educational, Scientific and Cultural Organization, Guilin 541004, Guangxi Zhuang Autonomous Region, China
Received: 8 February 2021; Revised: 24 March 2021; Published online: 2 April 2021
*Corresponding author: Qiang Li, E-mail: glqiangli@163.com.
Foundation item: Supported by the Special Funds for Local Science and Technology Development Guided by the Central Government, China (GuikeZY20198009)
Abstract: [Objective] To better understand the response of soil bacterial community to calcareous soil at different succession stages, which can provide the basic references for rocky desertification control and soil erosion control in karst area. [Methods] The contents of SOC, TN and TP, and the abundance and diversity of culturable bacteria in calcareous soils (black, brown, yellow and red) were determined. [Results] The contents of soil SOC and TN at different succession stages were in the order of black calcareous soil > brown calcareous soil > yellow calcareous soil > red calcareous soil. The content of TP was highest in black calcareous soil and lowest in red calcareous soil. A total of 144 strains of bacteria were isolated and purified, and R2A medium was the suitable medium. Then, the bacterial strains were classified into Actinobacteria, Bacteroidetes, Firmicutes and Proteobacteria. Pseudomonas, Cupriavidus and Bacillus were the dominant genera of culturable bacteria. At the genus level, the most strains were isolated from the black calcareous soil, and the dominant genera such as Arenimonas, Thermomonas, Achromobacter and Brevibacillus appeared. In the early succession stages, a large number of bacteria involved in carbon, nitrogen and phosphorus cycling appeared. [Conclusion] Based on the characteristics of parent material carbonate rock, black calcareous soil rich in organic matter is formed under the action of bacteria participating in carbon, nitrogen and phosphorus cycle. The physicochemical properties and culturable bacterial diversity of karst limestone soil decreased with the increase of leaching degree of limestone soil.
Keywords: karstcalcareous soilsoil successionculturable bacteria
岩溶是指水对可溶性岩石的溶蚀作用,及其所形成的地表和地下的各种景观与现象。我国岩溶地貌主要分布在贵州、广西和云南等八省,是全球重要的岩溶分布区[1]。岩溶土壤作为岩溶生态系统的重要组成部分,其母质碳酸盐岩在气候、地形、时间及生物等因素的综合作用下可依次演替出黑色石灰土、棕色石灰土、黄色石灰土和红色石灰土,其中黑色石灰土处于石灰土演替的初级阶段[2]。不同演替阶段岩溶石灰土颜色、粘土矿物组成、盐基饱和度和淋溶程度等各不相同[3]。由于我国南方岩溶生态系统基底环境的脆弱性以及长期不合理的人为因素影响[4],目前正面临着水土流失、石漠化、土地退化和生态系统功能衰退等问题[5]。开展岩溶地区生态恢复和重建工作需要了解岩溶石灰土演替特征。
土壤细菌群落多样性占陆地生物多样性的很大比例,对于调节陆地生物地球化学循环和生态系统功能至关重要[6]。土壤细菌是各营养物质形成与分解、养分循环与转化以及能量流动等活动的重要推动者和参与者,同时土壤细菌对环境变化敏感,反馈迅速。朱美娜等[7]研究表明细菌丰度较真菌丰度更适合表征土壤质量,因此研究不同演替阶段土壤细菌群落特征的变化是很有必要的,而通过培养获得的微生物往往是环境微生物群落中最能反映生态环境特征的类群[8],然而目前关于不同演替阶段岩溶石灰土可培养细菌群落特征鲜有研究。本文通过研究不同演替阶段岩溶石灰土可培养细菌群落特征,探讨可培养细菌与石灰土碳氮磷循环的关系,可为岩溶石漠化治理、生态恢复和重建等提供理论依据。
1 材料和方法 1.1 试验材料 供试土壤采自广西弄岗国家级自然保护区。该区位于桂西南龙州县城北面,地跨龙州、宁明两县,是我国具有国际意义的陆地生物多样性14个关键地区之一,也是世界上罕见保存最完好的岩溶地区热带季雨林。该区年均气温22 ℃,年平均降雨量1150-1550 mm,年蒸发量为1344-1748 mm,母岩以泥盆系、石炭系和二叠系碳酸盐为主,因此在气候、地形、地貌和母岩的共同作用下演替出黑色石灰土(BKC)、棕色石灰土(BWC)、黄色石灰土(YWC)及红色石灰土(RDC)等完整的石灰土类型。
1.2 主要试剂和仪器 PCR所用引物(27F/1492R)、核酸染色剂、PCR反应体系混合试剂,生工生物工程(上海)股份有限公司;Chelex 100,西格玛奥德里奇(上海)贸易有限公司;培养基使用R2A、LB与ISP2培养基;紫外可见分光光度计,北京普析通用仪器有限责任公司;原子吸收分光光度计,北京普析通用仪器有限责任公司;PCR仪,Bio-Rad公司。
1.3 土壤理化性质的测定 土壤pH值采用电位计法(土: 水=1:5,质量体积比)测定;土壤有机碳(soil organic carbon,SOC)的测定采用重铬酸钾容量法-稀释热法;全氮(total nitrogen,TN)的测定采用硫酸钾、硫酸铜和硒粉作催化剂,加入浓硫酸消煮,定氮仪自动分析法;全磷(total phosphorus,TP)的测定采用酸溶-钼锑抗比色法。具体分析方法步骤见土壤农业化学分析手册[9]。
1.4 可培养细菌的纯化培养 采用R2A、LB和ISP2三种培养基。研究表明R2A培养基适合大部分细菌生长,而且可培养出某些特有细菌,用ISP2培养基可以观察是否能培养出难培养菌种。根据培养结果进一步选择合适的培养基进行后续培养。
1.4.1 样品预处理: 使用烘干法对样品进行含水率的测定,具体为称取5 g样品土壤放到105 ℃烘箱中烘干,烘干后失去的重量即为土壤的水分含量,土壤含水率计算公式为:土壤水分含量/烘干前土壤重量×100%。得到含水率后,在无菌条件下称取相当于干土2 g的湿土于25 mL锥形瓶,置于28 ℃培养箱中风干后,向锥形瓶加入20 mL无菌水,适当振速振荡1 h后,无菌环境用无菌水进行样品梯度稀释液制备(10-1、10-2、10-3和10-4)。
1.4.2 细菌的培养及纯化: 使用移液枪分别吸取100 μL稀释梯度为10-3、10-4样液涂布于3种培养基上,每种培养基每个梯度设3个平行,28 ℃平板倒置培养10-14 d。期间观察平板菌生长状况、菌落大小、颜色和形态等特征进行描述,挑取形态差异较大的菌落进行划线纯化、编号。
无菌环境下使用尖头竹签挑取单菌落,将挑选的菌落采用平板划线法转接至新的无菌培养基上,倒置于28 ℃培养箱培养,并观察菌种生长情况、纯化程度,若非纯菌则对其继续进行纯化,直到得到纯种菌落,并收集部分至20%甘油管中,置于-80 ℃冰箱保存备用。
1.5 细菌DNA提取及PCR扩增 无菌环境下向装有菌体的PCR管中加入Chelex 100溶液后在PCR仪上进行Chelex程序裂解,Chelex程序参数:99 ℃,25 min。随后室温下使用微型离心机离心至分层,离心条件为:10000 r/min,1 min;上清液即为所提取的DNA。获取到的菌株DNA进行16S rRNA基因序列扩增、测序。扩增使用正向引物27F (5′-AGAGTTT GATCCTGGCT-3′)和反向引物1492R (5′-GGTTA CCTTGTTACGACTT-3′)。PCR反应体系(25 μL):反应体系混合液12.5 μL,正、反向引物浓度为0.4 μmol/L,样品DNA提取液1 μL,双蒸水补足。PCR反应条件:95 ℃ 5 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 1.5 min,35个循环;72 ℃ 10 min;12 ℃保存。
PCR扩增结束后用0.8% (质量体积比)琼脂糖凝胶对PCR产物进行凝胶电泳检测,预计目的条带为1500 bp左右,将PCR产物送至生工生物工程(上海)股份有限公司进行测序,选择测序引物27F/1492R,单向测通。测序结果提交至NCBI数据库。
1.6 数据处理 使用Mothur软件将测序得到的16S rRNA基因序列在97%水平下进行OTU聚类,从每个OTU中选择一条作为代表序列,在NCBI中进行BLAST比对。使用MEGA5.0将序列剪齐后(约900 bp),构建NJ系统发育进化树,将建树参数中的No. of Bootstrap Replications值改为1000,其余参数默认。利用Excel进行数据处理,基于OTU聚类分析结果,使用Pearson相关系数方法对土壤理化性质与丰度大于1%的优势OTU结合进行相关性分析。使用R语言Vegan包计算得到菌株16S rRNA基因序列97%水平下细菌群落的α多样性,并绘制相关性热图和交集UpSet图,对土壤不同发育过程下可培养细菌群落结构进行分析。
2 结果和分析 2.1 土壤理化性质 不同演替阶段岩溶石灰土理化性质如图 1所示。红色石灰土pH为8.36。黑色石灰土SOC含量为56.248 g/kg,TN含量为3.584 g/kg,TP含量为1637.500 mg/kg,均高于其他演替阶段的石灰土。SOC、TN含量随土壤的演替呈现出减少的趋势,依次为:黑色石灰土 > 棕色石灰土 > 黄色石灰土 > 红色石灰土;TP含量在黑色石灰土中最高,在红色石灰土中最低。
 |
| 图 1 不同演替阶段岩溶石灰土理化性质 Figure 1 Physical and chemical properties of calcareous soil at different succession stages. A: pH; B: SOC; C: TN; D: TP. BKC: black calcareous soil; BWC: brown calcareous soil; YWC: yellow calcareous soil; RDC: red calcareous soil; SOC: soil organic carbon; TN: total nitrogen; TN: total nitrogen. |
| 图选项 |
2.2 石灰土不同发育阶段可培养细菌培养情况 采用3种分离培养基共得到144株可培养细菌,各个演替时期得到的各水平分布情况如表 1所示。BKC获得的可培养细菌最多,为74株,分属4门6纲10目15科;BWC共培养出17株菌,分属3门4纲9目11科;YWC共培养出25株菌,分属3门5纲7目9科;RDC共培养出28株菌,分属3门5纲8目9科。
表 1. 石灰土不同发育时期可培养细菌分类水平信息表 Table 1. Classification information table of culturable bacteria of calcareous soil at different development stages
| Soil | Number of bacteria | Phylum | Class | Order | Family |
| BKC | 74 | Bacteroidetes Proteobacteria Firmicutes Actinobacteria | Bacilli Actinomycetia Flavobacteriia Betaproteobacteria Alphaproteobacteria Gammaproteobacteria | Bacillales Rhizobiales Burkholderiales Aeromonadales Lysobacterales Caulobacterales Mycobacteriales Flavobacteriales Pseudomonadales Propionibacteriales | Boseaceae Bacillaceae Rhizobiaceae Nocardiaceae Alcaligenaceae Mycobacteriaceae Nocardioidaceae Aeromonadaceae Lysobacteraceae Paenibacillaceae Flavobacteriaceae Comamonadaceae Caulobacteraceae Phyllobacteriaceae Pseudomonadaceae |
| BWC | 17 | Firmicutes Actinobacteria Proteobacteria | Bacilli Actinomycetia Betaproteobacteria Alphaproteobacteria | Bacillales Rhizobiales Rhizobiales Burkholderiales Microbacteriales Caulobacterales Streptomycetales Sphingomonadales Propionibacteriales | Boseaceae Bacillaceae Planococcaceae Nocardioidaceae Nitrobacteraceae Burkholderiaceae Microbacteriaceae Streptomycetaceae Comamonadaceae Caulobacteraceae Sphingomonadaceae |
| YWC | 25 | Firmicutes Proteobacteria Actinobacteria | Bacilli Actinomycetia Betaproteobacteria Alphaproteobacteria Gammaproteobacteria | Bacillales Rhizobiales Burkholderiales Xanthomonadales Pseudomonadales Sphingomonadales Propionibacteriales | Bacillaceae Rhizobiaceae Nitrobacteraceae Burkholderiaceae Nocardioidaceae Xanthomonadaceae Pseudomonadaceae Sphingomonadaceae Comamonadaceae |
| RDC | 28 | Firmicutes Proteobacteria Actinobacteria | Bacilli Actinomycetia Betaproteobacteria Alphaproteobacteria Gammaproteobacteria | Bacillales Rhizobiales Burkholderiales Caulobacterales Microbacteriales Xanthomonadales Pseudomonadales Sphingomonadales | Boseaceae Bacillaceae Devosiaceae Caulobacteraceae Oxalobacteraceae Microbacteriaceae Xanthomonadaceae Pseudomonadaceae Sphingomonadaceae |
| BKC: black calcareous soil; BWC: brown calcareous soil; YWC: yellow calcareous soil; RDC: red calcareous soil. | |||||
表选项
2.3 可培养细菌系统发育 对培养出的菌株进行扩增测序,使用mothur对测序结果进行OTU聚类后,在Excel中整理所得不同演替阶段岩溶石灰土可培养细菌。本试验培养出的144株菌株,分属Firmicutes、Bacteroidetes、Actinobacteria和Proteobacteria 4门36属,共被划分为52个OTU (表 2),其中黑色石灰土可培养菌株数及分属OTU最高,共得到74株,占总培养菌株数的51.39%,分属31个OTU,占总OTU个数的59.62%。使用培养法最大值计算得到可培养细菌丰度。不同演替阶段岩溶石灰土可培养细菌所得最大值都来自R2A培养基,其中BKC最大值为3.45×104 CFU/g (表 3)。由图 2总可培养细菌属水平分布情况图可看出Pseudomonas在总可培养菌株数中占比最大,为15%,该菌属在系统发育树显示与Pseudomonas chlororaphis (GenBank登录号MT540543)聚集(图 3),Cupriavidus、Flavobacterium和Arenimonas等菌属在总培养菌株数中占比亦达6%-8%,在系统发育树上显示分别与Cupriavidus sp. (GenBank登录号MH795632)、Flavobacterium sp. (GenBank登录号MH989596)、Arenimonas sp. (GenBank登录号JF180336)聚集。
表 2. 不同演替阶段岩溶石灰土细菌培养情况 Table 2. The culturable bacteria in calcareous soil at different succession stages
| Sample | Total | BKC | BWC | YWC | RDC |
| Total strain | 144 | 74 | 17 | 25 | 28 |
| Number of OTUs | 52 | 31 | 11 | 12 | 12 |
| BKC: black calcareous soil; BWC: brown calcareous soil; YWC: yellow calcareous soil; RDC: red calcareous soil. | |||||
表选项
表 3. 不同演替阶段岩溶石灰土可培养细菌丰度 Table 3. Abundance of culturable bacteria (CFU/g) in calcareous soil at different succession stages
| Culture medium | BKC | BWC | YWC | RDC |
| R2A | 3.45×104 | 0.70×104 | 0.90×104 | 1.30×104 |
| LB | 0.20×104 | 0.10×104 | 0.20×104 | 0.50×103 |
| ISP2 | 0.10×104 | 0.50×103 | 0.10×104 | 0.10×104 |
| Maximum | 3.45×104 | 0.70×104 | 0.90×104 | 1.30×104 |
| BKC: black calcareous soil; BWC: brown calcareous soil; YWC: yellow calcareous soil; RDC: red calcareous soil. | ||||
表选项
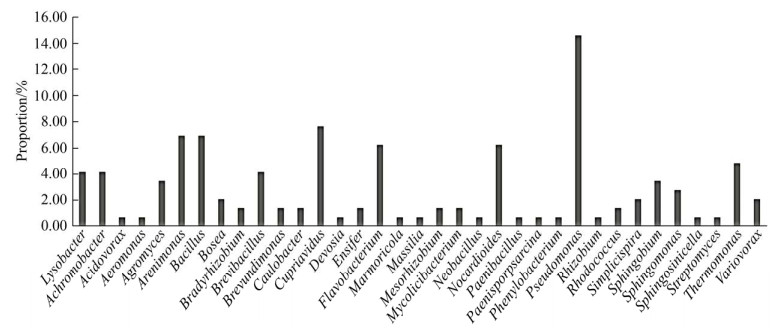 |
| 图 2 获得总可培养细菌属水平分布情况 Figure 2 Distribution of total culturable bacteria. |
| 图选项 |
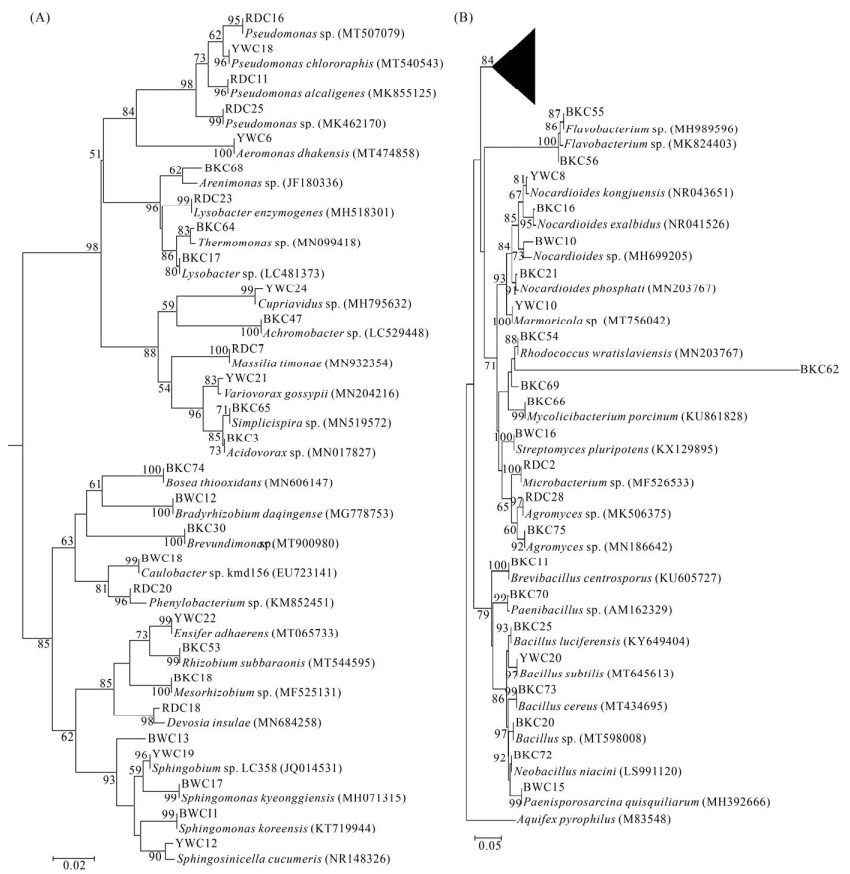 |
| 图 3 不同演替阶段岩溶石灰土可培养细菌种群发育进化树 Figure 3 Evolutionary tree of culturable bacteria population in calcareous soil at different succession stages. The letters and numbers in the first bracket indicate the NCBI registration number. The number of branching points indicates bootstrap values based on 1000 replications are listed as percentages at the branching points. The ruler in Figure A indicates 0.02 substitutions per nucleotide position, the ruler in Figure B indicates 0.05 substitutions per nucleotide position. Figure A is the folded part of the black triangle in Figure B. |
| 图选项 |
2.4 可培养细菌群落结构及α多样性分析 不同演替阶段岩溶石灰土可培养细菌菌株16S rRNA基因在97% OTU水平下的α多样性指数通过R语言Vegan包计算得出,结果如表 4所示。黑色石灰土Shannon、Simpson和Equitability指数分别为2.02、0.84和0.92,红色石灰土3个多样性指数最低,依次为2.1、0.77和0.91。
表 4. 不同演替阶段岩溶石灰土可培养细菌菌株α多样性指数 Table 4. α diversity index of culturable bacteria in Karst calcareous soil at different succession stages
| Succession stage | Number of OTUs | Shannon index | Simpson index | Equitability index |
| BKC | 31 | 2.02 | 0.84 | 0.92 |
| BWC | 11 | 2.12 | 0.83 | 0.88 |
| YWC | 12 | 2.10 | 0.85 | 0.91 |
| RDC | 12 | 1.76 | 0.77 | 0.84 |
| BKC: black calcareous soil; BWC: brown calcareous soil; YWC: yellow calcareous soil; RDC: stands for red calcareous soil. | ||||
表选项
比较不同演替阶段岩溶石灰土可培养细菌属水平组成图(图 4),黑色石灰土分离得到菌株分属22属,优势类群为Arenimonas、Flavobacterium和Thermomonas;红色石灰土分离得到菌株属最少,共10属,Pseudomonas是该类石灰土的优势菌属,达50%,同时Pseudomonas亦是黄色石灰土中占比最大的优势类群。Cupriavidus是棕色石灰土和黄色石灰土可培养菌属中的优势菌属。Arenimonas、Achromobacter、Simplicispira、Mycolicibacterium、Acidovorax和Neobacillus等共14个属是黑色石灰土可培养特有菌属,Devosia和Massilia等5个属是红色石灰土可培养特有菌属。
 |
| 图 4 不同演替阶段岩溶石灰土可培养细菌属水平组成图 Figure 4 Horizontal abundance of culturable bacteria in calcareous soil at different succession stages. BKC: black calcareous soil; BWC: brown calcareous soil; YWC: yellow calcareous soil; RDC: red calcareous soil. |
| 图选项 |
不同演替阶段岩溶石灰土OTU的UpSet图(图 5)显示:不同演替阶段岩溶石灰土共有的OTU数量为3个,占OTU总数5.8%,BKC、YWC共有OTU数量为2个,BKC、RDC共有OTU数量1个,YWC、RDC共有OTU数量1个,YWC、BWC共有OTU数量1个。
 |
| 图 5 不同演替阶段岩溶石灰土OTU的UpSet图分析 Figure 5 Analysis of OTU in calcareous soil at different succession stages by using the upset map. BKC: black calcareous soil; BWC: brown calcareous soil; YWC: yellow calcareous soil; RDC: red calcareous soil. |
| 图选项 |
不同演替阶段石灰土潜在碳氮磷功能菌群丰度如图 6所示。潜在固碳功能菌菌株数大小依次为:BKC > BWC > YWC > RDC;潜在固氮功能菌菌株数大小依次为:BKC > RDC > YWC > BWC;潜在溶磷功能菌菌株数大小依次为:BKC > BWC > RDC > YWC。
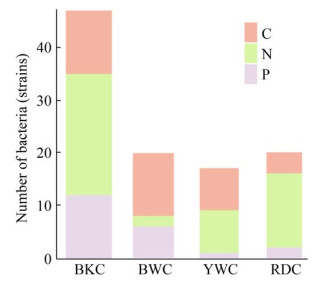 |
| 图 6 不同演替阶段石灰土潜在碳氮磷功能菌群数量图 Figure 6 Abundance of potential C, N and P functional bacteria in calcareous soil at different succession stages. BKC: black calcareous soil; BWC: brown calcareous soil; YWC: yellow calcareous soil; RDC: red calcareous soil. |
| 图选项 |
2.5 土壤理化性质与优势OTU的关系 土壤理化性质与丰度大于1%的优势OTU基于Pearson相关系数方法进行相关性分析的结果如图 7所示。大部分优势菌属主要和SOC、TN和TP正相关,与pH负相关。OTU (4、5、3、28、17、23等与pH负相关,与SOC、TN和TP正相关,其中与TP显著正相关;OTU (10、1和25)与pH正相关,与SOC、TN和TP负相关;OTU (7和12)与pH、SOC、TN和TP均负相关。
 |
| 图 7 理化性质与优势OTU基于Pearson相关系数方法的相关性热图 Figure 7 Correlation heat map of environmental factors and dominant OTUs based on Pearson correlation coefficient method. Significance levels are denoted as follows: P < 0.05 (*) and P < 0.01(**). |
| 图选项 |
3 讨论 土壤演替过程中存在着有机碳、磷等营养元素变化,不同演替阶段的土壤理化性质均呈现一定的差异性。本研究结果显示黑色石灰土SOC、TN、TP最高,这与母质碳酸盐岩风化产物和腐殖质结合有关。Vladimir等[10]研究结果显示石灰土腐殖质中的类胡敏酸能与钙结合生成不易分解的胡敏酸钙,因此石灰土具有高的腐殖质积累。土壤营养物质含量随着石灰土淋溶程度的增加而降低[11]。潘复静等[12]研究表明红色石灰土有机碳、全氮和全磷含量最低,养分供给能力较差,与本研究结果一致,这说明红色石灰土淋溶强度要高于其他演替时期土壤。
细菌群落结构是其整体功能的基础。本研究结果表明,随着土壤演替的进行,参与碳氮磷循环的可培养细菌菌株呈现出与土壤SOC、TN、TP基本一致的变化规律,从而说明功能微生物是不同演替阶段石灰土碳氮磷循环的驱动者。
土壤有机碳是土壤的重要组分和陆地生态系统最大的有机碳库,其微小变化将引起大气二氧化碳浓度的较大波动,进而影响温室效应和全球气候变化[13]。土壤细菌群落是土壤有机碳活性库的重要组成部分,已有研究表明土壤中的有机碳的变化与外界营养物质无关,而是与土壤中的细菌有关[14]。本研究结果显示,黑色石灰土细菌多样性指数较红色石灰土高,且出现的特有菌属最多(图 2),其中Mesorhizobium中有菌株被报道具有核酮糖-1, 5-二磷酸羧化酶/加氧酶(RubisCO),通过卡尔文循环固定CO2[15],在碳循环中起关键作用;Rhizobium和Bacillus中的部分菌株通过对纤维素降解参与到土壤碳循环中[16-17],Rhizobium是BKC特有菌属,Bacillus在4个发育时期土壤均有培养出,在BKC中丰度最高,在RDC中丰度最低(图 4);Microbacterium是RDC特有菌属,Cupriavidus是BWC和YWC的优势菌属,此两个菌属有降解复杂有机质的潜力[18-19],对土壤有机碳含量的增加起一定促进作用。可见土壤与碳循环相关的功能菌通过不同方式参与到碳循环中进而影响了土壤有机碳含量的变化。Chen等[20]的研究结果进一步表明碳循环功能菌丰度和多样性的降低是加速土壤有机碳损失的重要原因。这类与碳循环相关的功能菌较多地出现在石灰土演替初期,同时该时期土壤SOC含量最高,这与黑色石灰土富含腐殖质有关,土壤腐殖质能够提供维持土壤细菌所必需的能量和底物[21],提高了细菌活性,因此富含有机质的黑色石灰土主要是在碳功能菌的作用下形成,可见土壤有机碳与土壤细菌之间存在明显的相关性。
氮循环是土壤生态系统生物地球化学循环中的核心过程之一,细菌在土壤氮素循环及维持生态系统稳定中发挥着重要作用,驱动不同形态氮素转化[22]。本次培养的菌株来自Proteobacteria、Actinobacteria、Firmicutes和Bacteroidetes共4个门(表 1),Proteobacteria为主要类群,Pseudomonas、Variovorax、Arenimonas和Bradyrhizobium是该门的优势菌属。分别有研究表明Arenimonas和Bradyrhizobium中有个别菌株含有反硝化作用的关键酶[23-24],在土壤氧气不足的条件下,将硝酸盐还原成亚硝酸盐,并进一步把亚硝酸盐还原为氨及游离氮,即该两菌属在氮循环中的主要作用是将固定氮返回大气并结束氮循环,这是土壤中NO和N2O排放的主要途径;Variovorax、Pseudomonas和Bradyrhizobium中有菌株被报道带有异二聚酶复合物固氮酶(nif基因)[25-27],nif基因是所有固氮微生物含有的最保守的功能基因,可通过nifH基因的多样性来探讨固氮菌多样性,由nif基因催化的固氮作用可将空气中的分子氮转化为有机氮,这在很大程度上增加了土壤的氮素营养;此外,Bacteroidetes中的Flavobacterium则是参与氨化作用,将有机氮分解成为氨与氨化合物从而参与到氮循环中[28]。上述可能参与氮循环的功能菌属主要来自Proteobacteria,且作为该门下的优势类群,其中RDC仅培养出Pseudomonas,是培养出潜在固氮菌种类最少的一组,土壤TN含量在该时期最低,说明Proteobacteria尤其是该门下的优势菌属可能与土壤氮循环之间作用关系密切,与前人研究结果一致[29]。
由于母质碳酸盐岩高钙的特性,石灰土中磷易与钙结合成难溶性磷酸钙盐,因此磷的有效性低[30]。解磷微生物包括解磷细菌、真菌以及蓝藻等,能够将磷从不可用形式转化为可用形式(HPO42-或H2PO4-),其中解磷细菌占微生物总量的1%-50%,而解磷真菌仅占0.1%-0.5%[31]。梁建宏等[32]研究表明,随着土壤发育,岩溶石灰土磷及其有效性缺乏越发突出。因此在石灰土演替过程中,溶磷细菌(PSB)占据着重要地位。本研究中,多数优势OTU与TP显著正相关,说明这些优势菌属可能直接或间接地参与解磷过程,与TP含量关系密切。溶磷菌通过酸化、螯合、交换反应和聚合物形成等途径将难溶性磷转化为可溶性磷,本研究中各演替阶段的石灰土均培养出具解磷潜力的溶磷菌,BKC和BWC出现的溶磷菌类群较丰富,Streptomyces和Agromyces是BWC特有类群,Achromobacter是BKC的特有类群,上述3个菌属某些菌种正是通过分泌有机酸,如醋酸和柠檬酸等[33-34],土壤中与磷酸盐结合的阳离子(主要是Ca2+)被有机酸的羟基和羧基螯合,或有机酸离子与Pi在土壤中竞争(直接物理竞争或静电竞争)相同的吸附位点,从而提高了无机磷酸盐的溶解性和有效性;优势菌属Bacillus中的某些菌种通过直接氧化葡萄糖产生葡萄糖酸(GA)对土壤无机磷进行溶解[35],葡萄糖在葡萄糖脱氢酶(glucose dehydrogenase,GDH)催化下发生直接氧化反应产生葡萄糖酸进而直接酸化途径溶解磷矿石,即使葡萄糖酸含量相对较低的情况下,也能释放大量的磷;另外极优势类群Pseudomonas某些菌种通过呼吸作用或NH4+同化作用产生质子氢[36];而Sphingomonas主要通过产磷酸酶溶解土壤无机磷[37]。
综上所述,不同演替时期的土壤理化性质与细菌群落结构均存在一定差异,细菌与土壤碳氮磷含量关系密切,细菌群落结构的差异可对土壤营养物质含量产生一定的影响。结合母质碳酸盐岩特性,可培养细菌多样性随土壤演替进行、淋溶程度加强而降低,与碳循环相关的功能菌较多地出现在石灰土演替初期,通过分解腐殖质等活动进而促进富含有机质黑色石灰土的形成,黑色石灰土和棕色石灰土存在较丰富的溶磷菌类群,在开展岩溶区治理石漠化等时添加该类细菌促进碳氮磷循环,改善土壤质量,加速石漠化治理速度。
此外,本研究得到的可培养细菌结果与前人对棕色岩溶水稻石灰土可培养细菌工作结果相比[38],本次得到的可培养菌株数较少,一方面可能是与外源营养物质的添加使岩溶水稻土中细菌可利用营养物质增多有关;另一方面本次选择的培养基可能不是最适培养基,造成一部分可培养细菌没有培养出来,在后续实验中将会考虑使用其他类型的分离培养基以及改进现用培养基配方以提高培养效率。
4 结论 岩溶石灰土演替过程中,SOC和TN呈现出黑色石灰土 > 棕色石灰土 > 黄色石灰土 > 红色石灰土的变化趋势。Pseudomonas、Cupriavidus和Bacillus等是岩溶石灰土中可培养菌的优势属,各演替阶段土壤细菌优势类群存在差异,黑色石灰土中优势类群为Arenimonas、Flavobacterium、Achromobacter和Bacillus等,棕色石灰土中优势类群为Cupriavidus、Bacillus和Sphingomonas,Pseudomonas、Cupriavidus和Nocardioides是黄色石灰土中的优势类群,Pseudomonas和Sphingobium为红色石灰土中的优势类群。随着石灰土演替过程的进行、土壤淋溶程度的增加,岩溶石灰土理化性质和可培养细菌多样性呈现降低的趋势。基于母质碳酸盐岩的特性,富含有机质的黑色石灰土在参与碳氮磷循环细菌的作用下形成。潜在溶磷菌较多地出现在黑色石灰土和棕色石灰土中,这为开展岩溶区治理石漠化等工作提供了参考依据与治理思路。
致谢
感谢中国地质科学院岩溶地质研究所张美良研究员提供石灰土地质背景资料及鉴定。
References
| [1] | Jiang ZC, Lian YQ, Qin XQ. Rocky desertification in Southwest China: Impacts, causes, and restoration. Earth-Science Reviews, 2014, 132: 1-12. DOI:10.1016/j.earscirev.2014.01.005 |
| [2] | Cao JH, Yuan DX, Pan GX. Some soil features in Karst ecosystem. Advance in Earth Sciences, 2003, 18(1): 37-44. (in Chinese) 曹建华, 袁道先, 潘根兴. 岩溶生态系统中的土壤. 地球科学进展, 2003, 18(1): 37-44. DOI:10.3321/j.issn:1001-8166.2003.01.006 |
| [3] | Zhang ML, Deng ZQ. The soil and soil-forming processes in Karst area of South China. Journal of Guizhou University of Technology (Natural Science Edition), 1994, 23(1): 67-75. (in Chinese) 张美良, 邓自强. 我国南方喀斯特地区的土壤及其形成. 贵州工学院学报, 1994, 23(1): 67-75. |
| [4] | Liang YH, Zhang JY, Fan YL. Study on diagnostic characteristics and risk evaluation of degraded ecosystem in Karst area-A case study of Bijie Karst rocky desertification. Research of Soil and Water Conservation, 2013, 20(1): 240-245. (in Chinese) 梁玉华, 张军以, 樊云龙. 喀斯特生态系统退化诊断特征及风险评价研究——以毕节石漠化为例. 水土保持研究, 2013, 20(1): 240-245. |
| [5] | Yuan DX. Rock desertification in the subtropical karst of south China. Geomorph N F, 1997, 108(2): 81-90. |
| [6] | Pan GX, Cao JH. Karstification in epikarst zone: the earth surface ecosystem processes taking soil as a MEDIUM-case of the yaji Karst experiment site, Guilin. Carsologica Sinica, 1999, 18(4): 289-296. (in Chinese) 潘根兴, 曹建华. 表层带岩溶作用: 以土壤为媒介的地球表层生态系统过程——以桂林峰丛洼地岩溶系统为例. 中国岩溶, 1999, 18(4): 289-296. |
| [7] | Zhu MN, Liang YM, Liu C, Jin ZJ, Li Q. Influential factors and indicative significance of microbial abundance in Karst limestone soil. Ecology and Environmental Sciences, 2018, 27(3): 484-490. (in Chinese) 朱美娜, 梁月明, 刘畅, 靳振江, 李强. 岩溶石灰土微生物丰度的影响因素及其指示意义. 生态环境学报, 2018, 27(3): 484-490. |
| [8] | Sait M, Hugenholtz P, Janssen PH. Cultivation of globally distributed soil bacteria from phylogenetic lineages previously only detected in cultivation-independent surveys. Environmental Microbiology, 2002, 4(11): 654-666. DOI:10.1046/j.1462-2920.2002.00352.x |
| [9] | Lu RK. Agrochemical analysis of soil. Beijing: China Agriculture Scientech Press, 2000: 146-195. (in Chinese) 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000: 146-195. |
| [10] | Vladimir Ilinkin, Simeon Bogdanov, Antonia Goleva. Characteristics of Rendzinas in the Ludogorie Region. Bulgarian Journal of Soil Science, 2017, 2(1): 32-41. |
| [11] | Wu QF, Xie GX, Wang JW, Zhang MK. The stability of organic carbon and aggregates of three limestone soils in the western Zhejiang. Chinese Journal of Soil Science, 2018, 49(3): 567-574. (in Chinese) 邬奇峰, 谢国雄, 王京文, 章明奎. 浙西3类石灰岩发育土壤有机碳和团聚体稳定性的研究. 土壤通报, 2018, 49(3): 567-574. |
| [12] | Pan FJ, Jin ZJ, Liang YM, Li Q, Li Z. Ecological stoichiometric characteristics of different calcareous soils in Karst regions. Journal of Guilin University of Technology, 2018, 38(4): 738-743. (in Chinese) 潘复静, 靳振江, 梁月明, 李强, 李臻. 喀斯特地区不同类型石灰土的生态化学计量特征. 桂林理工大学学报, 2018, 38(4): 738-743. DOI:10.3969/j.issn.1674-9057.2018.04.016 |
| [13] | Xie JX, Li Y, Zhai CX, Li CH, Lan ZD. CO2 absorption by alkaline soils and its implication to the global carbon cycle. Environmental Geology, 2009, 56(5): 953-961. DOI:10.1007/s00254-008-1197-0 |
| [14] | Waring BG, Sulman BN, Reed S, Smith AP, Averill C, Creamer CA, Cusack DF, Hall SJ, Jastrow JD, Jilling A, Kemner KM, Kleber M, Liu XJA, Pett-Ridge J, Schulz M. From pools to flow: The PROMISE framework for new insights on soil carbon cycling in a changing world. Global Change Biology, 2020, 26(12): 6631-6643. DOI:10.1111/gcb.15365 |
| [15] | Yuan HZ, Ge TD, Wu XH, Liu SL, Tong CL, Qin HL, Wu MN, Wei WX, Wu JS. Long-term field fertilization alters the diversity of autotrophic bacteria based on the ribulose-1, 5-biphosphate carboxylase/oxygenase (RubisCO) large-subunit genes in paddy soil. Applied Microbiology and Biotechnology, 2012, 95(4): 1061-1071. DOI:10.1007/s00253-011-3760-y |
| [16] | Eichorst SA, Kuske CR. Identification of cellulose-responsive bacterial and fungal communities in geographically and edaphically different soils by using stable isotope probing. Applied and Environmental Microbiology, 2012, 78(7): 2316-2327. DOI:10.1128/AEM.07313-11 |
| [17] | Li JL, Chen WD, Feng GD, Zhou Y, Liu Y, Chen M, Zhu HH. Diversity of culturable bacteria isolated from forest soils in the Nanling National Nature Reserve, Guangdong Province. Biotic Resources, 2020, 42(5): 593-601. (in Chinese) 李佳丽, 陈稳迪, 冯广达, 周杨, 刘阳, 陈猛, 朱红惠. 广东南岭森林土壤中可培养细菌多样性. 生物资源, 2020, 42(5): 593-601. |
| [18] | Zhang CS, Kong FY. Isolation and identification of potassium-solubilizing bacteria from tobacco rhizospheric soil and their effect on tobacco plants. Applied Soil Ecology, 2014, 82: 18-25. DOI:10.1016/j.apsoil.2014.05.002 |
| [19] | Lladó S, López-Mondéjar R, Baldrian P. Forest soil bacteria: diversity, involvement in ecosystem processes, and response to global change. Microbiology and Molecular Biology Reviews, 2017, 81(2): e00063-16. DOI:10.1128/mmbr.00063-16 |
| [20] | Chen XB, Su YR, He XY, Wei YW, Wei WX, Wu JS. Soil bacterial community composition and diversity respond to cultivation in Karst ecosystems. World Journal of Microbiology and Biotechnology, 2012, 28(1): 205-213. DOI:10.1007/s11274-011-0809-0 |
| [21] | Franzluebbers AJ, Arshad MA. Soil microbial biomass and mineralizable carbon of water-stable aggregates. Soil Science Society of America Journal, 1997, 61(4): 1090-1097. DOI:10.2136/sssaj1997.03615995006100040015x |
| [22] | Shen RF, Sun B, Shi WM, Zhao XQ. Interactions between above-and below-ground organisms for nutrient-efficient utilization. Bulletin of Chinese Academy of Sciences, 2017, 32(6): 566-574. (in Chinese) 沈仁芳, 孙波, 施卫明, 赵学强. 地上-地下生物协同调控与养分高效利用. 中国科学院院刊, 2017, 32(6): 566-574. |
| [23] | Zhang ZW, Han YX, Xu CY, Han HJ, Zhong D, Zheng MQ, Ma WW. Effect of low-intensity direct current electric field on microbial nitrate removal in coal pyrolysis wastewater with low COD to nitrogen ratio. Bioresource Technology, 2019, 287: 121465. DOI:10.1016/j.biortech.2019.121465 |
| [24] | Zhang L, Lv J. Land-use change from cropland to plantations affects the abundance of nitrogen cycle-related microorganisms and genes in the Loess Plateau of China. Applied Soil Ecology, 2021, 161: 103873. DOI:10.1016/j.apsoil.2020.103873 |
| [25] | Zhao H, Zhou YC. Characteristics of structure and abundance of the nitrogen-fixing bacterial community in Pinus massoniana soil developed from different parent rocks. Acta Ecologica Sinica, 2020, 40(17): 6189-6201. (in Chinese) 赵辉, 周运超. 不同母岩发育马尾松土壤固氮菌群落结构和丰度特征. 生态学报, 2020, 40(17): 6189-6201. |
| [26] | Cerozi BDS, Fitzsimmons K. Use of Bacillus spp. to enhance phosphorus availability and serve as a plant growth promoter in aquaponics systems. Scientia Horticulturae, 2016, 211: 277-282. DOI:10.1016/j.scienta.2016.09.005 |
| [27] | Pajares S, Bohannan BJ. Ecology of nitrogen fixing, nitrifying, and denitrifying microorganisms in tropical forest soils. Frontiers in Microbiology, 2016, 7: 1045. |
| [28] | Xiao CS, Liu DL, Zhou PJ. Preliminary approach on the soil microbial ecological effect in the Great Wall Station area, Antarctic. Chinese Biodiversity, 1995, 3(3): 134-138. (in Chinese) 肖昌松, 刘大力, 周培瑾. 南极长城站地区土壤微生物生态作用的初步探讨. 生物多样性, 1995, 3(3): 134-138. DOI:10.3321/j.issn:1005-0094.1995.03.003 |
| [29] | Yang Y, Cheng H, Liu LX, Dou YX, An SS. Comparison of soil microbial community between planted woodland and natural grass vegetation on the Loess Plateau. Forest Ecology and Management, 2020, 460: 117817. DOI:10.1016/j.foreco.2019.117817 |
| [30] | Wahid F, Fahad S, Danish S, Adnan M, Yue Z, Saud S, Siddiqui MH, Brtnicky M, Hammerschmiedt T, Datta R. Sustainable management with mycorrhizae and phosphate solubilizing bacteria for enhanced phosphorus uptake in calcareous soils. Agriculture, 2020, 10(8): 334. DOI:10.3390/agriculture10080334 |
| [31] | Sharma SB, Sayyed RZ, Trivedi MH, Gobi TA. Phosphate solubilizing microbes: sustainable approach for managing phosphorus deficiency in agricultural soils. SpringerPlus, 2013, 2(1): 587. DOI:10.1186/2193-1801-2-587 |
| [32] | Liang JH, Cao JH, Yang H, Huang F. Effects of calcium, iron and aluminum fractions on the phosphorus bioavailability in limestone soil of Karst region. Carsologica Sinica, 2016, 35(2): 211-217. (in Chinese) 梁建宏, 曹建华, 杨慧, 黄芬. 钙、铁、铝形态对岩溶石灰土磷有效性的影响. 中国岩溶, 2016, 35(2): 211-217. |
| [33] | Jones SE, Elliot MA. 'Exploring' the regulation of Streptomyces growth and development. Current Opinion in Microbiology, 2018, 42: 25-30. DOI:10.1016/j.mib.2017.09.009 |
| [34] | Zhang YC, Liu FZ, Wang HB. Research progress on plant-growth-promoting mechanisms of phosphate-solubilizing rhizosphere microbes. Soil and Fertilizer Sciences in China, 2020(2): 1-9. (in Chinese) 张艺灿, 刘凤之, 王海波. 根际溶磷微生物促生机制研究进展. 中国土壤与肥料, 2020(2): 1-9. |
| [35] | Zhao K, Penttinen P, Zhang XP, Ao XL, Liu MK, Yu XM, Chen Q. Maize rhizosphere in Sichuan, China, hosts plant growth promoting Burkholderia cepacia with phosphate solubilizing and antifungal abilities. Microbiological Research, 2014, 169(1): 76-82. DOI:10.1016/j.micres.2013.07.003 |
| [36] | Yang L, Wang XH, Xiao Q, Ren YX, Chen N, Cui S. Kinetic characteristics and N2O production of a heterotrophic nitrifying bacterium Pseudomonas putida YH capable of tolerating adverse environmental conditions. Journal of Chemical Technology & Biotechnology, 2019, 94(12): 3941-3950. |
| [37] | Chen DY, Li HQ, Zhang BH, Zha DM, Yang JY. Phosphate solubilization activities and action mechanisms of two phosphate-solubilizing bacteria. Chinese Journal of Eco-Agriculture, 2017, 25(3): 410-418. (in Chinese) 陈丹阳, 李汉全, 张炳火, 查代明, 杨建远. 两株解磷细菌的解磷活性及作用机制研究. 中国生态农业学报, 2017, 25(3): 410-418. |
| [38] | Yan JH, Zhou QH, Jiang YW, Chen JY, Li Q, Li ZY. Variation of cultivable bacterial community structure and the main influencing factors in Karst paddy soil under different fertilization regimes. Microbiology China, 2020, 47(9): 2833-2847. (in Chinese) 严嘉慧, 周岐海, 蒋云伟, 陈济宇, 李强, 李忠义. 长期不同施肥措施下岩溶水稻土可培养细菌群落变化及其主要影响因素. 微生物学通报, 2020, 47(9): 2833-2847. |
