唐诚业1,2,3, 秦琴1,2,3, 颜正飞1,2,3, 吴敬1,2,3


1. 江南大学食品科学与技术国家重点实验室, 江苏无锡 214122;
2. 江南大学生物工程学院工业生物技术教育部重点实验室, 江苏 无锡 214122;
3. 江南大学教育部食品安全国际合作联合实验室, 江苏 无锡 214122
收稿日期:2020-05-27;修回日期:2020-07-28;网络出版日期:2020-08-11
基金项目:江南大学基本科研计划(青年基金)(JUSRP11968);江苏省基础研究计划(青年基金)(BK20200599)
*通信作者:吴敬, E-mail: jingwu@jiangnan.edu.cn.
摘要:[目的] 旨在分离、筛选并鉴定具有大米蛋白降解作用的菌株及其关键蛋白酶,为高效制备大米寡肽提供制备酶及最优制备条件。[方法] 以"水解圈"为评价指标,从粮食仓库附近土壤筛选获得具有降解大米蛋白能力的菌株;通过16S rRNA序列分析确定菌株归属;利用单因素实验获得最佳氮源并初步分析酶学性质;利用HPLC检测寡肽得率,并对制备条件进一步优化。[结果] 经鉴定具有大米蛋白降解作用的菌株为沙雷氏菌(Serratia sp.JWG-D15),以大米蛋白为氮源培养菌株JWG-D15,蛋白酶SoPRO产量最高,其最适温度40℃,最适pH 8.0;在加酶量20 U/mg,大米蛋白浓度40 mg/mL,40℃,4 h条件下寡肽得率最高72.38%。[结论] 以大米蛋白为氮源培养菌株JWG-D15,蛋白酶SoPRO产量最高;蛋白酶SoPRO制得的大米寡肽,其得率是目前行业最高。本研究既丰富了大米寡肽的制备用酶的种类,又为深入大米寡肽产业化提供一定理论基础。
关键词:大米蛋白寡肽蛋白酶沙雷氏菌
Screening of rice proteolytic protease-producing strain for preparing rice oligopeptides
Chengye Tang1,2,3, Qin Qin1,2,3, Zhengfei Yan1,2,3, Jing Wu1,2,3


1. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu Province, China;
2. Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Bioengineering, Jiangnan University, Wuxi 214122, Jiangsu Province, China;
3. Joint Laboratory of Food Safety International Cooperation, Ministry of Education, Jiangnan University, Wuxi 214122, Jiangsu Province, China
Received: 27 May 2020; Revised: 28 July 2020; Published online: 11 August 2020
*Corresponding author: Jing Wu, E-mail: jingwu@jiangnan.edu.cn.
Foundation item: Supported by the Fundamental Research Funds for the Central Universities (JUSRP11968) and by the Natural Science Foundation of Jiangsu Province (BK20200599)
Abstract: [Objective] To isolate, screen and identify strains with rice protein degradation activity and their key proteases, so as to provide ideal enzymes for the preparation of rice oligopeptides. [Methods] Strains with the ability to degrade rice protein were screened from the soil near grain warehouse by "hydrolysis circle", and identified by 16S rRNA analysis. Single factor experiment was done to obtain optimal nitrogen source. Enzymes were then characterized. The yield of rice oligopeptides was detected by HPLC, and the preparation conditions were further optimized. [Results] The best strain was identified as Serratia sp. JWG-D15. The highest protease SoPRO production was achieved by using rice protein as nitrogen source with optimal temperature at 40℃ and optimal pH of 8.0. The highest yield of rice oligopeptides was 72.38%, with 20 U/mg protease SoPRO, and 40 mg/mL rice protein at 40℃ for 4 hours. [Conclusion] Strain JWG-D15 had highest protease SoPRO production by using rice protein as nitrogen source, and the yield of rice oligopeptides was the highest. This study enriched enzyme sources for the preparation of rice oligopeptide.
Keywords: rice proteinoligopeptideproteaseSerratia sp.
大米蛋白是公认的优质食品蛋白之一,符合WHO/FAO推荐的理想模式[1]。其合理的氨基酸组成及高生物价可以和牛奶、鸡蛋相媲美[2]。同时,大米蛋白具有低抗原性,是唯一免于过敏测试的植物蛋白[3-4]。相比于其他植物蛋白,大米蛋白既具备优质蛋白的特性又不含任何抗性因子、毒性物质及酶阻物质。故大米蛋白作为添加剂广泛应用于婴幼儿配方食品行业。
相对于大米蛋白的低溶解度、强聚集性,大米肽不仅保留大米蛋白本来的营养价值,而且溶解性,乳化性、起泡性和表面疏水性等性质均得到显著改善[5]。其中氨基酸残基数目在10个以内,分子量180–1000 Da的大米肽,统称“大米寡肽”。普遍具有特殊生物活性,例如寡肽Oryzatensin (GYPMYPLPR)能够引起豚鼠回肠收缩、抗吗啡和提高免疫活性[6]。寡肽易被肠道吸收,其吸收速率大于游离氨基酸,且不受氨基酸的影响,具有不易饱和的特点。这种独特的吸收优势赋予了大米寡肽潜在的营养价值[7]。
目前制备大米寡肽主要有分离提取法、化学法、酶法。其中,酶法安全性高、生产条件温和、易控制、成本低,是制备大米寡肽的最优方法。寡肽的酶法制备用酶以商业蛋白酶为主,如碱性蛋白酶、胃蛋白酶、胰蛋白酶和酸性蛋白酶等。目前用于大米寡肽制备的特异性蛋白酶挖掘研究鲜有报道,仅Schmidt等报道利用微生物发酵液制备大米寡肽,得率仅约16%[8]。研究者曾尝试从天然微生物中分离纯化蛋白酶制备大米寡肽,然而得率却不尽人意,如从Aspergillus melleus分离纯化出具有大米蛋白水解活性的蛋白酶P,制备的寡肽得率约24%[9]。
本研究兼顾大米寡肽的优异营养价值以及酶法制备大米寡肽的低成本、高可控性等优势,旨在分离、筛选获得具有大米蛋白降解活性的菌株及其关键蛋白水解酶,并为大米寡肽提供制备酶及最优制备条件。
1 材料和方法 1.1 材料和仪器 福林酚购于索莱宝公司;琼脂粉购于Sigma公司;三氯乙酸购于国药;商业蛋白酶(中性蛋白酶、风味酶、碱性蛋白酶、胰蛋白酶、胃蛋白酶、酸性蛋白酶)购于博美公司;大米蛋白购于无锡金农生物科技有限公司;1100型高效液相色谱购于安捷伦公司;Waters 2695高效液相色谱仪(配2487紫外检测器和Empower工作站GPC软件)。
1.2 培养基
1.2.1 种子培养基(g/L): MgSO4·7H2O 0.2,NaCl 5.0,CaCl2 0.1,K2HPO45.0,大米蛋白粉10.0,pH 7.0。
1.2.2 发酵培养基(g/L): MgSO4·7H2O 0.2,NaCl 5.0,CaCl2 0.1,K2HPO45.0,大米蛋白粉15.0,pH 7.0。
1.2.3 大米蛋白筛选平板(g/L): MgSO4·7H2O 0.2,NaCl 5.0,CaCl2 0.1,K2HPO45.0,大米蛋白粉10.0,琼脂粉20.0,pH 7.0。
1.2.4 基础培养基(g/L): MgSO4·7H2O 0.2,NaCl 5.0,CaCl2 0.1,K2HPO45.0,pH7.0。
1.3 产大米蛋白水解酶菌株的筛选 在无锡市各地粮食仓库附近土壤取得10份土样,经生理盐水溶解成1 g/mL溶液,于30 ℃、180 r/min培养30 min。分别取200 μL的10–4、10–5和10–6稀释液均匀涂布到大米蛋白筛选平板,在37 ℃培养箱培养7 d,挑取有明显透明圈的菌株继续在大米蛋白筛选平板上划线纯化。将单菌落接种到种子培养基培养24 h,取2 mL种子液接入发酵培养基同样条件培养48 h。10000 r/min离心5 min获得发酵上清液,于4 ℃保存备用。用打孔器在大米蛋白筛选平板上打孔(孔径0.4 cm,3个孔/平板),将200 μL上清液注入孔内,以无菌水为空白对照[10]。培养24 h,测量水解圈直径,其中菌株JWG-D15的水解圈直径最大。
1.4 菌株JWG-D15的鉴定 参照细菌基因组抽提试剂盒提取DNA。采用细菌通用引物27F和1492R进行PCR扩增16S rRNA[11]。扩增产物经过1%琼脂糖凝胶电泳检测后,送至苏州金维智生物科技有限公司测序。在NCBI数据库Blast进行同源性分析,并选取同源性较高菌株的16S rRNA序列构建系统进化树[12]。
1.5 酶活力测定 采用轻工业部颁布的标准QB/T1803-93,Folin-酚试剂比色法测定蛋白酶的酶活力。
1.6 产大米蛋白水解酶SoPRO的摇瓶发酵优化 挑取菌株JWG-D15的单菌落,接种于种子培养基中,于37 ℃培养24 h。10000 r/min离心10 min获得菌体,利用无菌水重悬菌体至菌液OD600值为1.0。以此为菌株JWG-D15种子液,并采取1%的接种量用于后续实验中。
1.6.1 氮源对SoPRO酶活的影响: 分别将大米蛋白、酵母粉、胰蛋白胨、大豆蛋白、牛肉粉和脱脂奶粉按1.5% (W/V)加到基础培养基中。将菌株JWG-D15接种于上述培养基中,于37 ℃、180 r/min培养48 h取上清液测酶活并进行SDS-PAGE分析。
1.6.2 发酵时间对SoPRO酶活的影响: 将菌株JWG-D15接种于最适氮源的基础培养基中,于37 ℃、180 r/min培养84 h。每12 h取上清液测酶活。
1.7 SoPRO酶学性质
1.7.1 最适pH及稳定性: 配制不同pH值(pH 6.0–12.0)的缓冲液,代替1.5蛋白酶酶活测定方法中的缓冲液,40 ℃测定SoPRO活力,考察最适pH。将SoPRO在pH 7.0–9.0缓冲液中40 ℃保温0、2、4、6、8、12、24、36、48、60、72h,测定SoPRO残留酶活。所用的缓冲体系分别为:醋酸缓冲体系(pH 4.0–6.0);磷酸缓冲体系(pH 6.0–7.0);Tris-HCl缓冲体系(pH 7.0–9.0);甘氨酸-NaOH缓冲体系(pH 9.0–12.0)。
1.7.2 最适温度及热稳定性: 在25–60 ℃温度下,测定SoPRO酶活以确定其最适反应温度。为研究SoPRO的热稳定性,将SoPRO于40、50、55 ℃保温,每隔一段时间取出部分酶液于冰浴中冷却后,测定SoPRO残留酶活。
1.7.3 底物特异性研究: 用1%偶氮酪蛋白、血红蛋白、牛血清蛋白、大米蛋白、胶原蛋白和纤维蛋白代替1.4中酪蛋白底物,测定SoPRO残留酶活。
1.7.4 金属离子对SoPRO酶活的影响: 50 mmol/L Tris-HCl缓冲液,pH 8.0的SoPRO酶液分别加入1 mmol/L不同的金属离子(CaCl2、CuSO4、MgCl2、MnCl2、ZnSO4、CoCl2、NiCl2、BaCl2、KCl和FeCl3),40 ℃保温5 min后,测定SoPRO酶活力。以无金属离子的酶活为100%。
1.7.5 化学物质对SoPRO酶活的影响: 50 mmol/L Tris-HCl缓冲液,pH 8.0的SoPRO酶液中加入化学物质(SDS、EDTA、DTT、甘油和乙醇),40 ℃保温5 min后,测定SoPRO酶活力。以无表面活性剂的酶活为100%。
1.8 SoPRO制备大米寡肽的条件优化
1.8.1 加酶量对寡肽得率的影响: 将50 mmol/L Tris-HCl缓冲液,pH 8.0的SoPRO酶液,按照2、3、12、20、32 U/mg的添加量加入到40 mg/mL大米蛋白溶液中,总反应体系4 mL。在40 ℃、180 r/min水浴摇床中反应4 h,反应结束立即取出沸水灭活5 min。于8000 r/min离心10 min,上清液放4 ℃保存待测寡肽得率。
1.8.2 大米蛋白底物浓度对寡肽得率的影响: 按最适加酶量将SoPRO酶液分别加入10、20、40、50、80 mg/mL的大米蛋白底物中,反应总体系4 mL,其余操作同1.8.1。
1.8.3 酶解时间对寡肽得率的影响: 按1.8.1和1.8.2中最适条件,在40 ℃、180 r/min水浴摇床中反应5 h,每1 h取1次样,其余操作同1.8.1。
1.8.4 酶反应温度对寡肽得率的影响: 选择适合的酶与底物比和底物浓度,分别在30、40、50、60、70 ℃、180 r/min水浴摇床中反应4 h,其余操作同1.8.1。
1.9 蛋白酶种类对大米寡肽得率的影响 除了SoPRO,选取中性蛋白酶、酸性蛋白酶、碱性蛋白酶、胰蛋白酶、风味酶、胃蛋白酶等6种商业蛋白酶在相同加酶量、底物浓度、酶解时间的条件下,分别在各自最适pH,最适温度下180 r/min水浴摇床中反应,其余操作同1.8.1。
1.10 大米寡肽得率的测定 上清液和标准品过0.22 μmol/L滤膜,滤液进行高效液相(HPLC)分析。
色谱条件:色谱柱:TSKgel 2000 SWXL 300 mm×7.8 mm,流动相:乙腈/水/三氟乙酸,40/60/0.1 (V/V),检测:UV 220 nm,流速:0.5 mL/min,柱温:30 ℃。
分子量校正曲线所用标准品:(1) 细胞色素C (MW12384),(2) 杆菌酶(MW1422),(3) 乙氨酸-乙氨酸-酪氨酸-精氨酸(MW451),(4) 乙氨酸-乙氨酸-乙氨酸(MW189),(5) 抑肽酶(MW6500)。
2 结果和分析 2.1 产大米蛋白水解酶菌株的筛选与鉴定 从大米蛋白筛选平板上共挑取50株有明显水解圈的单菌落并继续划线纯化。上述菌株经水解圈直径测定发现,菌株JWG-D15的水解圈直径最大。菌株JWG-D15的16S rDNA序列与沙雷氏菌属同源性大于99%,其中与Serratia marcescens ATCC 274 [AP021873.1]的相似率达99.79%。系统进化树中,菌株JWG-D15与Serratia marcescens subsp. marcescens ATCC13880 [JMPQ01000005]处于同一支,具有高同源性(图 1),故菌株JWG-D15鉴定为Serratia sp. JWG-D15。
 |
| 图 1 基于16S rRNA系列的系统进化树 Figure 1 Phylogenetic tree based on 16S rRNA sequences. Establishment of phylogenetic tree of different gene sequences of strain JWG-D15 and other strains. Numbers in parentheses represent accession number of the sequences in GenBank. Numbers on the branches are bootstrap values based on 1000 replicates. Only the bootstrap values greater than 50% are shown. |
| 图选项 |
2.2 产大米蛋白水解酶SoPRO的摇瓶发酵优化 将菌株JWG-D15种子液接种到不同氮源的发酵培养基中培养48 h,结果表明以大米蛋白作为氮源时,上清液酶活最高,477.3 U/mL (表 1)。SDS-PAGE分析表明,SoPRO分子量在50 kDa左右,其中大米蛋白为氮源的条带较其他氮源的更为清晰,粗大(图 2)。将其条带切割后经肽指纹图谱鉴定,与Serratia marcescens来源蛋白酶的同源性最高,即50 kDa处清晰条带为SoPRO。以大米蛋白为氮源进行发酵时间的优化,每12 h取样测上清液酶活(图 3),培养48 h后的SoPRO酶活最高。
表 1. 不同氮源对酶活的影响 Table 1. Effects of different nitrogen sources on enzyme activity
| Nitrogen sources | Enzyme activity/(U/mL) |
| Rice protein | 477.3±6.1 |
| Tryptone | 237.5±3.3 |
| Yeast | 139.1±4.4 |
| Beef powder | 119.8±1.3 |
| Non-fat milk | 104.3±6.5 |
| Soybean protein | 73.3±3.2 |
表选项
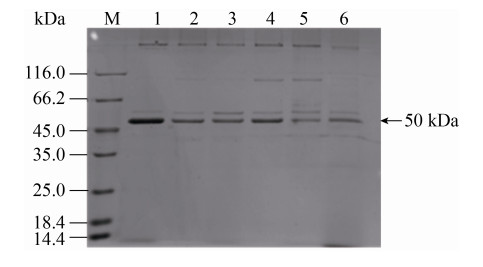 |
| 图 2 不同氮源进行发酵后的上清液SDS-PAGE凝胶电泳分析 Figure 2 SDS-PAGE gel electrophoresis analysis of supernatant by different nitrogen sources. M: standard molecular weight protein; lane 1: rice protein; lane 2: tryptone; lane 3: yeast powder; lane 4: beef powder; lane 5: skim milk powder; lane 6: soy protein. |
| 图选项 |
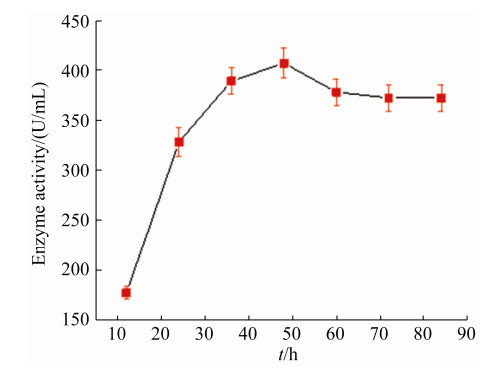 |
| 图 3 发酵时间对SoPRO酶活的影响 Figure 3 Effect of fermentation time on SoPRO activity. Each test was repeated three times in parallel, and the results were expressed as "mean standard deviation". |
| 图选项 |
2.3 SoPRO酶学性质
2.3.1 最适pH及稳定性: SoPRO在pH 7.0–9.0的缓冲液中酶活较接近,在pH 8条件下SoPRO酶活最高498.6 U/mL (图 4-A),表明SoPRO在中性、弱碱性环境下酶活较高;在pH 7.0–9.0下的半衰期分别是60、58、1 h (图 4-B),表明在pH 7.0和8.0条件下,其半衰期接近。
 |
| 图 4 SoPRO最适pH和pH稳定性 Figure 4 Optimal pH of SoPRO and pH stability of SoPRO. A: Optimal pH of SoPRO; B: pH stability of SoPRO. Each test was repeated three times in parallel, and the results were expressed as "mean standard deviation". |
| 图选项 |
2.3.2 最适温度及热稳定性: 在40–55 ℃,SoPRO的相对酶活均能达到最大酶活的92%以上,说明SoPRO能在中温环境下很好生存。温度超过55 ℃时,SoPRO酶活急剧下降(图 5)。40 ℃下保温48 h,其SoPRO酶活保持在50%以上,具有较好的热稳定性(图 6)。50 ℃和55 ℃条件下,SoPRO热稳定性较差,仅保温20 min后,SoPRO酶活为0 U/mL。综合考虑选择40 ℃作为SoPRO最适温度。
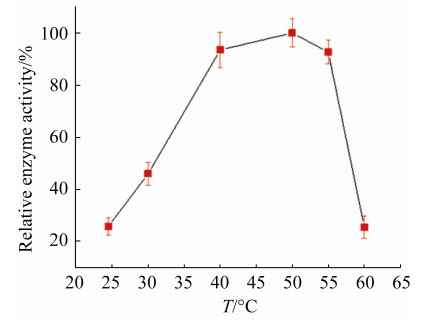 |
| 图 5 SoPRO最适温度 Figure 5 Optimum temperature of SoPRO. Each test was repeated three times in parallel, and the results were expressed as "mean standard deviation". |
| 图选项 |
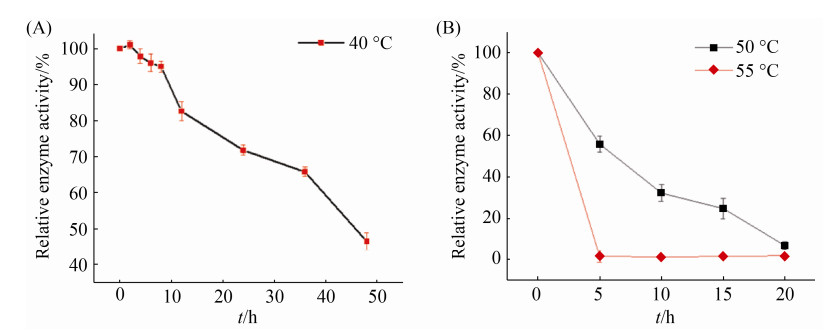 |
| 图 6 SoPRO温度稳定性 Figure 6 Temperature stability of SoPRO. A: Temperature stability at 40 ℃; B: Temperature stability at 50 ℃ and 55 ℃. Each test was repeated three times in parallel, and the results were expressed as "mean standard deviation". |
| 图选项 |
2.3.3 底物特异性研究: 以不同类型蛋白为底物验证了SoPRO的底物特异性,如表 2所示,SoPRO对多种底物均具有活性,其底物谱较广泛。SoPRO对酪蛋白的酶活最高,其次纤维蛋白、血红蛋白、偶氮酪蛋白。但SoPRO对大米底物的酶活较低。
表 2. 不同蛋白酶底物下SoPRO的酶活 Table 2. SoPRO activity under different protease substrates
| Substrates (1%) | Relative enzyme activity (±SD%) |
| Casein | 100±0 |
| Collagen | 0.5±0.1 |
| Fibrin | 9.5±1.2 |
| BSA | 0.3±0.1 |
| Hemoglobin | 6.9±1.0 |
| Rice protein | 0.4±0.1 |
| Azo casein | 24.8±1.4 |
表选项
2.3.4 金属离子对SoPRO酶活的影响: 将多种金属离子分别加到SoPRO酶液中保温5 min,考察其SoPRO酶活(表 3)。其中Co2+和Ca2+能够提高SoPRO酶活,说明Co2+和Ca2+能够稳定SoPRO的结构有助于提升酶活;Ba2+、K+、Fe3+、Mg2+、Zn2+和Mn2+对SoPRO活力无明显作用;Cu2+和Ni2+对SoPRO活力有显著抑制作用。
表 3. 金属离子对SoPRO的影响 Table 3. Effect of metal ions on SoPRO
| Metal ions | Relative enzyme activity (±SD%) |
| Control | 100±0 |
| Ba2+ (BaCl2) | 106.8±12.3 |
| K+ (KCl) | 100.2±12.2 |
| Fe3+ (FeCl3) | 90.9±4.1 |
| Mg2+ (MgCl2) | 102.1±12.4 |
| Ca2+ (CaCl2) | 114.0±2.1 |
| Zn2+ (ZnCl2) | 98.5±5.1 |
| Cu2+ (CuCl2) | 23.6±1.1 |
| Ni2+ (NiCl2) | 0.0±0 |
| Co2+ (CoCl2) | 149.1±21.1 |
| Mn2+ (MnCl2) | 93.0±12.1 |
表选项
2.3.5 化学物质对SoPRO酶活的影响: 如表 4所示,1 mmol/L浓度下DTT,EDTA对SoPRO有激活作用提高了酶活。甘油对SoPRO酶活无显著作用,故甘油可以作为SoPRO保存剂。阴离子表面活性剂SDS对SoPRO有较强的抑制作用;另外5%乙醇几乎完全抑制SoPRO活性。
表 4. 化学物质对SoPRO的影响 Table 4. Effect of chemicals on SoPRO
| Chemical materials (1 mmol/L) | Relative enzyme activity (±SD%) |
| Control | 100±0.1 |
| SDS | 3.2±0.2 |
| EDTA | 211.3±21.2 |
| DTT | 340.3±34.1 |
| Glycerin | 109.7±12.3 |
| Ethanol | 0.0±0 |
表选项
2.4 SoPRO制备大米寡肽的条件优化
2.4.1 加酶量对寡肽得率的影响: SoPRO按照2、3、12、20、32 U/mg添加到40 mg/mL大米蛋白溶液中,40 ℃水解4 h后。寡肽得率如图 7所示。加酶量20 U/mg大米蛋白时,寡肽达到最高占比70.38%,并随加酶量增大出现减小趋势。
 |
| 图 7 加酶量对寡肽得率的影响 Figure 7 Effect of enzyme addition on yield of oligopeptides. Each test was repeated three times in parallel, and the results were expressed as "mean standard deviation". |
| 图选项 |
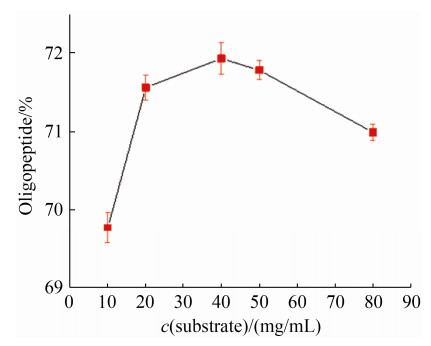
2.4.2 底物浓度对寡肽得率的影响: 为了研究底物浓度对SoPRO水解大米蛋白得到寡肽得率的影响,在10–80 mg/mL的底物中加入SoPRO (20 U/mg大米蛋白),40 ℃水解4 h。寡肽得率如图 8示。底物浓度40 mg/mL时,寡肽得率达到最高71.93%。
 |
| 图 8 底物浓度对寡肽得率的影响 Figure 8 Effect of substrate concentration on yield of oligopeptides. Each test was repeated three times in parallel, and the results were expressed as "mean standard deviation". |
| 图选项 |
2.4.3 反应时间对寡肽得率的影响: 为研究反应时间对SoPRO水解底物后的寡肽得率的影响,在40 mg/mL底物中加入SoPRO (20 U/mg大面蛋白) 在40 ℃分别水解1、2、3、4、5 h。寡肽得率如图 9所示,水解4 h时寡肽得率达到最高72.08%,之后开始降低。
 |
| 图 9 反应时间对寡肽得率的影响 Figure 9 Effect of reaction time on yield of oligopeptides. Each test was repeated three times in parallel, and the results were expressed as "mean standard deviation". |
| 图选项 |
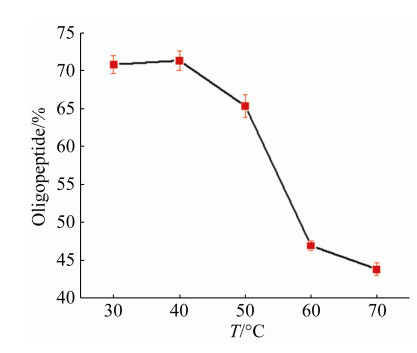
2.4.4 反应温度对寡肽得率的影响: 为研究反应温度对SoPRO水解底物后的寡肽得率的影响,分别在30–70 ℃,40 mg/mL底物中加入SoPRO (20 U/mg大米蛋白) 反应4 h。寡肽得率如图 10所示,反应温度为40 ℃时,寡肽得率最高为72.38%,随着温度升高酶渐渐失活,寡肽得率也随之降低。
 |
| 图 10 反应温度对寡肽得率的影响 Figure 10 Effect of reaction temperature on yield of oligopeptides. Each test was repeated three times in parallel, and the results were expressed as "mean standard deviation". |
| 图选项 |
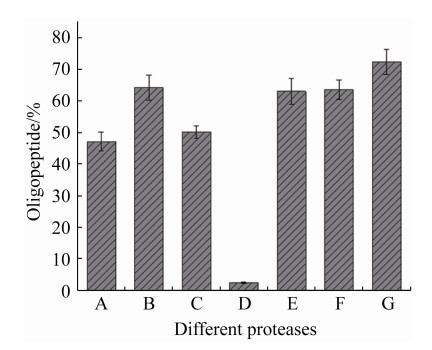
2.4.5 SoPRO与商业蛋白酶的比较: 为了考察商业蛋白酶与SoPRO对制备寡肽的情况,在20 U/mg加酶量、40 mg/mL底物、反应4 h条件下各自最适温、最适pH水解大米蛋白,寡肽得率如图 11所示,SoPRO制备的寡肽得率为72.38%,
 |
| 图 11 SoPRO与商业蛋白酶制备大米寡肽 Figure 11 Preparation of oligopeptide by SoPRO and commercial proteases. A: Flavor enzyme; B: Neutral protease; C: Trypsin; D: Pepsin; E: Alkaline protease; F: Acid protease; G: SoPRO. Each test was repeated three times in parallel, and the results were expressed as "mean standard deviation". |
| 图选项 |
高于中性蛋白酶(64.13%)、酸性蛋白酶(63.55%)、碱性蛋白酶(63.05%)、胰蛋白酶(50.2%)、风味酶(47.13%)和胃蛋白酶(2.41%)。经分子量分布检测发现,SoPRO和商业蛋白酶制得的寡肽分子量分布并无显著差异,即180–500Da的寡肽得率均高于500–1000Da部分。
3 讨论 沙雷氏菌属广泛存在于土壤、水体和植物体内,李志琳获得的1株具有柴油降解活性的Serratia sp. J-3,对柴油降解率可达到62.0%[13]。Manas等发酵Serratia nematodiphila获得大量色素,将其用于染料敏化太阳能电池[14]。随后陆续发现Serratia sp.具有丰富的酶系,如几丁质酶、胶原蛋白酶等。目前,也有报道将野生型菌株Serratia marcescens作为生产菌株,大规模工业化生产医药行业广泛应用的灵菌红素[15]。正常情况下,沙雷氏菌不具有致病性,其与大肠杆菌类似。本研究首次报道了Serratia sp.具有高效降解大米蛋白的活性。大米蛋白作为氮源培养Serratia sp. JWG-D15,其SoPRO产量及酶活明显高于胰蛋白胨、酵母粉、牛肉粉、脱脂奶粉和大豆蛋白培养基。可见,大米蛋白能够促进Serratia sp. JWG-D15高效分泌SoPRO,是最适氮源。
Serratia sp. JWG-D15来源的SoPRO与其他文献报道的Serratia sp.蛋白酶有相近的最适温度,最适pH,在40 ℃保温40 h,残留酶活均在50%以上,且pH通过改变酶的空间结构,影响酶分子活性中心基团的解离来调节酶活性。Co2+和Ca2+能提高SoPRO的酶活,与Nadeem等[16]的研究结果一致(Ca2+能够增加碱性蛋白酶的稳定性)。Cu2+和Ni2+抑制SoPRO活性,可能的原因是Cu2+和Ni2+属于重金属能够使蛋白变性,从而导致酶变性失活。EDTA和DTT能够提升SoPRO活性,其核心在于两者都属于还原剂,通过防止SoPRO的活性中心-SH键之间的交联,促使其活性中心处于激活状态。
目前市面常见的大米寡肽制品多用胰蛋白酶,碱性蛋白酶等商业蛋白酶制剂,但寡肽得率普遍偏低。如徐敏等利用胰蛋白酶水解米渣制备的寡肽,其得率为60.7%[17];吕志佳通过双酶分步法制得的寡肽得率为48.8%[18];玄国东利用胰蛋白酶水解米渣蛋白得到的寡肽得率为50.9%[19]。本文筛选获得1株高效水解大米蛋白,且高产SoPRO的菌株Serratia sp. JWG-D15,优化SoPRO制备寡肽的条件,其得率72.38%远高于目前报道的商业酶制备大米寡肽得率。综合Serratia sp. JWG-D15来源的SoPRO在制备大米寡肽上拥有的众多优势,能够更好地应用到其他蛋白肽工业生产中,为今后蛋白肽工业化生产提供了理论依据。
References
| [1] | Chen JW, Yao HY. Rice protein: its development and applications. Science and Technology of Food Industry, 2002, 23(6): 87-89. (in Chinese) 陈季旺, 姚惠源. 大米蛋白的开发利用. 食品工业科技, 2002, 23(6): 87-89. DOI:10.3969/j.issn.1002-0306.2002.06.032 |
| [2] | Fiocchi A, Travaini M, D'Auria E, Banderali G, Bernardo L, Riva E. Tolerance to a rice hydrolysate formula in children allergic to cow's milk and soy. Clinical & Experimental Allergy, 2003, 33(11): 1576-1580. |
| [3] | Morita T, Kiriyama S. Mass production method for rice protein isolate and nutritional evaluation. Journal of Food Science, 1993, 58(6): 1393-1396. DOI:10.1111/j.1365-2621.1993.tb06190.x |
| [4] | Morita T, Oh-hashi A, Takei K, Ikai M, Kasaoka S, Kiriyama S. Cholesterol-lowering effects of soybean, potato and rice proteins depend on their low methionine contents in rats fed a cholesterol-free purified diet. The Journal of Nutrition, 1997, 127(3): 470-477. DOI:10.1093/jn/127.3.470 |
| [5] | Wang ZC, Shen RL, Yao HY. Progress of study on rice protein. Journal of the Chinese Cereals and Oils Association, 2004, 19(2): 11-15. (in Chinese) 王章存, 申瑞玲, 姚惠源. 大米蛋白研究进展. 中国粮油学报, 2004, 19(2): 11-15. DOI:10.3321/j.issn:1003-0174.2004.02.003 |
| [6] | Chen JW, Tao GJ, Yao HY. Isolation and purification of opioid antigonist peptides from rice bran soluble protein. Food Science, 2004, 25(12): 47-50. (in Chinese) 陈季旺, 陶冠军, 姚惠源. 米糠蛋白类阿片拮抗肽的分离纯化. 食品科学, 2004, 25(12): 47-50. DOI:10.3321/j.issn:1002-6630.2004.12.005 |
| [7] | 张君慧. 大米蛋白抗氧化肽的制备、分离纯化和结构鉴定. 江南大学博士学位论文, 2009. |
| [8] | Schmidt CG, Gon?alves LM, Prietto L, Hackbart HS, Furlong EB. Antioxidant activity and enzyme inhibition of phenolic acids from fermented rice bran with fungus Rizhopus oryzae. Food Chemistry, 2014, 146: 371-377. DOI:10.1016/j.foodchem.2013.09.101 |
| [9] | Adebiyi AP, Adebiyi AO, Yamashita J, Ogawa T, Muramoto K. Purification and characterization of antioxidative peptides derived from rice bran protein hydrolysates. European Food Research and Technology, 2009, 228(4): 553-563. DOI:10.1007/s00217-008-0962-3 |
| [10] | 薛荣涛. 产米渣蛋白水解酶菌株的筛选、鉴定、发酵条件优化及酶活稳定性研究. 贵州大学硕士学位论文, 2015. |
| [11] | Nie M, Zhang XD, Wang JQ, Jiang LF, Yang J, Quan ZX, Cui XH, Fang CM, Li B. Rhizosphere effects on soil bacterial abundance and diversity in the Yellow River Deltaic ecosystem as influenced by petroleum contamination and soil salinization. Soil Biology and Biochemistry, 2009, 41(12): 2535-2542. DOI:10.1016/j.soilbio.2009.09.012 |
| [12] | Thompson JD, Higgins DG, Gibson TJ. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. Nucleic Acids Research, 1994, 22(22): 4673-4680. DOI:10.1093/nar/22.22.4673 |
| [13] | Li ZL, Xie YF, Wu J, Xu JY, Wang J, Jiang JY. Isolation and identification of a high efficiency diesel oil degrading strain Serratia sp. J-3 and its degradation characteristics. Journal of Nanjing Agricultural University, 2019, 42(6): 1098-1107. (in Chinese) 李志琳, 解宇峰, 吴杰, 徐佳迎, 王珏, 蒋静艳. 一株高效柴油降解菌Serratia sp.J-3的筛选、鉴定和降解特性. 南京农业大学学报, 2019, 42(6): 1098-1107. |
| [14] | Manas NHA, Chong L, Tesfamariam YM, Zulkharnain A, Mahmud H, Mahmod DSA, Fuzi SFZM, Azelee NIW. Effects of oil substrate supplementation on production of prodigiosin by Serratia nematodiphila for dye sensitized solar cell. Journal of Biotechnology, 2020, 317: 16-26. DOI:10.1016/j.jbiotec.2020.04.011 |
| [15] | Chen XY, Cao LL, Yang PZ, Wang KL, Zhang H, Cao XM, Zheng Z, Jiang ST. Response surface optimization of prodigiosin production of Serratia marcescens using rapeseed meal. Food Science, 2017, 38(4): 231-236. (in Chinese) 陈新颜, 操丽丽, 杨培周, 王康林, 章华, 操新民, 郑志, 姜绍通. 响应面试验优化黏质沙雷氏菌利用菜籽饼粕产灵菌红素工艺. 食品科学, 2017, 38(4): 231-236. |
| [16] | Nadeem M, Qazi JI, Baig S, Syed QUA. Effect of medium composition on commercially important Alkaline protease production by Bacillus licheniformis N-2. Food Technology and Biotechnology, 2008, 46(4): 388-394. |
| [17] | Xu M, Du XF. Optimization of hydrolyzing rice residue for preparing oligopeptide by pancreatin. Journal of Anhui Agricultural University, 2012, 39(5): 714-720. (in Chinese) 徐敏, 杜先锋. 胰酶水解米渣制备寡肽工艺的优化. 安徽农业大学学报, 2012, 39(5): 714-720. |
| [18] | 吕志佳. 大米肽酶法制备方法的研究. 天津科技大学硕士学位论文, 2014. |
| [19] | Xuan GD, He GQ, Xiong HP, Xu Y. Study on the modification of rice by protease and the functional characteristics of enzymatic hydrolysate. Journal of the Chinese Cereals and Oils Association, 2005(3): 1-4. (in Chinese) 玄国东, 何国庆, 熊皓平, 徐莹. 大米蛋白酶法改性及酶解物功能特性研究. 中国粮油学报, 2005(3): 1-4. DOI:10.3321/j.issn:1003-0174.2005.03.001 |
