李明家, 刘冉, 钟永嘉, 李欣欣


福建农林大学根系生物学研究中心/资源与环境学院, 福建 福州 350002
收稿日期:2020-05-19;修回日期:2020-07-31;网络出版日期:2020-12-11
基金项目:福建省自然科学基金(2017J01603)
*通信作者:李欣欣, Tel: +86-591-88260952; E-mail: lixinxin0476@163.com.
摘要:在农业生产中,化学氮肥的投入大幅度增加了粮食产量,然而过量或不合理的施肥措施对农业生态环境造成了严重破坏。因此,挖掘植物自身的生物学特性,寻求其他有效的氮素来源,对农业减肥增效至关重要。其中,植物与微生物之间的生物固氮作用,能为宿主提供大量的清洁氮源,在农业生产中发挥着不可替代的作用。本文以甘蔗为代表,综述了植物联合固氮的研究进展和应用潜力,包括联合固氮作用的提出、联合固氮菌的筛选、侵染机制及功能研究,并总结了联合固氮复合菌在甘蔗生产中的应用,以期为作物养分高效的品种改良及推动生物固氮作用在农业生产中的实践提供理论依据和参考。
关键词:联合固氮固氮菌甘蔗减肥增效生态农业
Current progress on the associative nitrogen fixation in sugarcane and its application potentials
Mingjia Li, Ran Liu, Yongjia Zhong, Xinxin Li


Root Biology Center/College of Resources and Environment, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian Province, China
Received: 19 May 2020; Revised: 31 July 2020; Published online: 11 December 2020
*Corresponding author: Xinxin Li, Tel: +86-591-88260952; E-mail: lixinxin0476@163.com.
Foundation item: Supported by the Natural Science Foundation of Fujian Province (2017J01603)
Abstract: The introduction of chemical nitrogen fertilizer has greatly increased the crop yield. However, the excessive fertilization or improper fertilizer use will cause severe damage to the agro-ecology system. Understanding characteristics of plants and seeking alternative nitrogen (N) sources are crucial to reduce the use of fertilizer and increase nutrient efficiency. The biological nitrogen fixation established between plants and microorganisms can provide a large amount of clean N sources for the host, which plays an irreplaceable role in agricultural production. Here, we take sugarcane as an example to summarize the progresses of the associative N2 fixation, including the discovery, screening, infection mechanisms and functional study of plant-associated N2-fixing bacteria, and the application of the mixed inoculations with diazotrophic bacteria in sugarcane production. We predict that these will provide theoretical basis and reference value for improvement of nutrient efficiency and promotion of biological nitrogen fixation in agricultural production.
Keywords: associative nitrogen fixationnitrogen-fixing bacteriasugarcanereducing fertilization while increasing efficiencyeco-agriculture
氮是植物完成整个生命周期不可或缺的大量营养元素之一,然而在农业生产中,土壤中的氮往往不能满足作物生长发育的需要。为了增加粮食产量,农田中投入了大量的化学氮肥,并且随着人口的增长,对氮肥的需求仍在增加。Tilman等[1]预测,到2050年全球氮肥需求量将达到2.36亿t。虽然,氮肥的投入在粮食增产及提高农业生产力方面具有突出贡献,但是近年来,粮食产量增长缓慢,甚至出现增肥不增产的现象。其中,氮肥的施入量约占总施肥量的2/3,而肥料利用率却不足50%[2],并且流失的氮肥对我国生态环境产生了一系列影响。例如,导致我国农田土壤酸化,水域因氮淋失引起水体富营养化[3],并且加剧了氮沉降进而造成大气污染[4]等。因此,挖掘植物自身生物学特性,利用氮素来源的其他有效途径,配合合理的栽培措施,对环境友好型生态农业建设具有重要意义。
虽然大气中含有78.1%的氮气(N2),却不能被植物直接利用,除了工业固氮,即在高温高压催化条件下将N2转化为NH3外,自然界还存在一种绿色、环保、无污染的固氮途径——生物固氮。生物固氮是指在固氮微生物的作用下,将N2还原为NH3为自身或宿主提供氮源的过程。据统计,生物固氮占全球年固氮总量的85%,而植物所需氮素的60%来自于生物固氮[5]。因此,生物固氮堪称是世界上最大规模的天然“氮肥工厂”,充分利用生物固氮作用,不仅可以减少化学氮肥投入、降低农业成本,还能降低空气污染,保护生态环境。
生物固氮主要包括自生固氮、共生固氮和联合固氮三种类型[6]。其中,自生固氮是指固氮微生物与植物没有依存关系,可以自行固定空气中的N2,以蓝细菌和圆褐固氮菌为典型。共生固氮是指植物与土壤微生物相互作用,形成根瘤而进行固氮反应的过程,以豆科植物-根瘤菌以及非豆科植物-弗兰克氏菌共生为主。而联合固氮则是固氮微生物与宿主不形成根瘤,就能进行生物固氮作用。联合固氮菌可以定殖于宿主根系、茎和叶片,是一种松散的结合,广泛存在于甘蔗、水稻和玉米等禾本科作物中[5]。
甘蔗是世界范围内重要的糖料和能源作物。根据中国统计局数据显示,我国糖料作物主要为甘蔗和甜菜,据统计,成品糖的90%由甘蔗制成[7],因此,甘蔗在我国国民经济中占有重要地位。目前,中国甘蔗播种面积约140万hm2,年产甘蔗1.08亿t,位居世界第三。甘蔗生长周期长,需氮量高,巴西种植甘蔗每年施氮仅60-100 kg/hm2,而中国种植甘蔗每年施氮需要100-755 kg/hm2[8],在巴西甘蔗产业中,在较少氮肥施用的同时,却能保持连年高产且土壤肥力不减,究其原因,是对甘蔗联合固氮的充分利用。此外,研究表明,联合固氮作用获得的氮素最高可达甘蔗积累氮素的70%[9]。可见,禾本科作物生物固氮具有较大的发展潜力和应用价值。
近年来,随着不断增长的人口对粮食的需求的增加,以及由于盲目或过量施肥等不合理的农业措施所引起的生态环境问题之间的矛盾日益突出,我国现代农业面临巨大挑战[3]。如何解决粮食供求矛盾、保障粮食安全的同时维护生态环境,越来越受到人们的关注。本研究综述了联合固氮的发现过程、联合固氮菌的种类、分离及功能研究,以及联合固氮联盟菌在农业减肥增效中的应用潜力,以期为从挖掘和利用植物自身生物学特性角度和作物养分高效的改良与生产实践提供理论依据和参考。
1 联合固氮菌的发现、分类与进展 生物固氮作用的研究已有百余年,并且在固氮酶学、固氮分子生物学以及固氮菌与植物相互作用机制等基础性研究方面取得了重要进展。联合固氮作为其中的一个分支,相关研究也已经有60多年的历史。自1958年,D?bereiner等从甘蔗的根际分离到两株拜叶林克氏菌属的固氮细菌Beijerinckia fluminensis,证实了禾本科植物存在生物固氮潜能[10]。到1976年,D?bereiner实验室再次发现联合固氮菌、固氮螺菌(Azospirillum sp.),并进一步提出根际联合固氮的概念[11]。随后,发现这些固氮细菌粘附于植物的根表,有些则会侵入植物根的皮层或维管组织中,甚至可以在植物叶片以及茎中定殖,靠宿主提供的碳源生存,这种植物与固氮细菌之间的相互作用关系称为联合固氮[11]。
随着联合固氮作用的关注与研究,大量的联合固氮菌从不同的禾本科作物中被分离获得,并且种类丰富。例如,织片草螺菌(Herbaspirillum seropedicae)、固氮醋酸杆菌(Gluconacetobacter diazotrophics)、固氮螺菌(Azospirillum spp.)、芽孢杆菌(Bacillus spp.)、肠杆菌(Enterobacter spp.)、假单胞菌(Pseudomonas spp.)、产碱菌(Alcaligenes spp.)、伯克霍尔德菌(Burkholderia spp.)及固氮菌(Azotobacter spp.)等[12]。近年来,科学家们相继发现了一些新的固氮菌株,其中与豆科植物共生的根瘤菌属也存在甘蔗根系中,在没有形成根瘤的情况下,仍然具有较强的固氮酶活性[13],暗示了禾本科植物-联合固氮菌相互作用的复杂性和多样性。进一步根据联合固氮菌的生理生态特征,可将其分为3类:根际固氮菌、兼性内生固氮菌和专性内生固氮菌[14]。其中,根际固氮菌只定殖于植物根表,包括雀稗固氮菌(A. paspali) 和拜叶林克氏菌(Beijerinckia spp.)等,除了具有固氮能力外,还能促进宿主根系的生长[15-16]。兼性内生固氮菌是指既能在植物体内,又能在根表和土壤中定殖的固氮菌。目前已经分离鉴定的固氮螺菌属,例如产脂固氮螺菌(A. lipoferum)、巴西固氮螺菌(A. brasilense)和亚马逊固氮螺菌(A. amazomense)等属于此类细菌[17]。而专性内生固氮菌是定殖于宿主体内,在土壤中存在的丰度很低,甚至不能生存的一类固氮菌,例如固氮醋酸杆菌(G. diazotrophicus)、草螺菌(H. seropedicae)和固氮弧菌(Azoarus spp.)等[18-19]。随着新固氮菌的发现与鉴定,不断丰富甘蔗联合固氮微生物的种类,为生产应用提供基础。
目前,关于联合固氮作用的研究,在菌株的分离纯化、菌落和菌体形态特征分析、Biolog细菌鉴定及16S rRNA基因测序鉴定菌株的分类等方面已经取得较大进展。此外,高通量测序技术的应用,也推动了联合固氮作用的研究。尤其对固氮菌株如CBAmC、Ppe8、SP1T、KvMx1/2和Pal5等的测序[20-24],揭开了甘蔗内生固氮菌的基因组信息,并鉴定了多个控制固氮能力的基因,为菌株改良、固氮分子机理及应用的研究奠定了基础。同时,不同甘蔗品种所招募的内生固氮菌种类不同。利用16S rRNA和nifH测序发现甘蔗内生菌共7198个OTUs (operational taxonomic units),包括1734个固氮菌分属于43个科,其中6个科在品种间明显不同[25]。最近,通过对甘蔗微生物组的测序,初步探究了甘蔗不同组织部位包括根、茎和叶的微生物群落结构以及在响应外界养分/环境条件时微生物组的改变[26-27],进一步结合培养组学技术,挖掘甘蔗微生物群落核心组成,并通过细菌培养的模式可以得到相应的分离物[28]。另一方面,接种联合固氮菌后,参与甘蔗代谢途径、次级代谢物合成及类苯基丙烷代谢途径的蛋白被显著上调,一些参与光合和糖酵解、免疫系统及非特异脂类转移蛋白在固氮菌侵染后也发生明显改变[29]。说明联合固氮菌与甘蔗之间相互作用、相互调控,共同影响固氮菌群变化和甘蔗生长代谢过程。此外,研究者们在对内生固氮菌进行鉴定的基础上,分析了主要菌种的固氮和促生能力,为禾本科作物联合固氮作用的基础及应用研究奠定基础。
2 碳源供给类型对联合固氮菌分离及纯培养的影响 尽管在宏基因组技术的支持下,利用高通量分离技术可以大幅度提高微生物获取的效率[30],但固氮微生物的纯培养、分离与鉴定,是研究单一微生物细胞形态结构、生理和遗传特性、微生物功能及其调控等的基础。影响固氮微生物高效分离的因素有很多,例如,微生物本身的生理特点、营养需求、能量利用类型、温度、pH等。目前多采用传统微生物纯培养技术,对联合固氮菌进行分离鉴定。
固氮微生物-植物联合固氮体系的建立,除了微生物为宿主提供氮源外,也需要宿主供给微生物碳源(C),以保障细菌自身生长及固氮作用对能量的需求。在甘蔗联合固氮作用的研究中,外界供给碳源的不同,根、茎和叶中所呈现的固氮能力不同[31],说明不同固氮菌种对外界碳源具有一定的选择性,暗示了分离获得的菌株往往是某种培养介质筛选的优势菌种。因此,根据供碳源种类不同,本文总结了目前培养甘蔗联合固氮菌所使用的培养基,主要包括:以蔗糖为碳源的SH、LGI-P、HXN和SNX培养基[31-32];以DL-苹果酸为碳源的Mal、JNFb和NFb培养基[31, 33];以甘露醇为碳源的Ashby培养基[34];以葡萄糖为碳源的DYGS培养基[35];以及同时以葡萄糖、柠檬酸、葡萄糖酸为碳源的DF培养基[33](表 1)。此外,不同培养基也适当供给了不同矿质元素,除DYGS供给氮源外,其他均为无氮培养基。
表 1. 不同培养基的碳源及营养元素汇总表 Table 1. Summary of carbon sources and nutrient elements in different culture medium
| Carbon source | Culture medium | Nutrient elements | |||||||||||||
| N | P | K | Ca | Mg | S | Fe | Mn | Cu | Zn | Mo | Cl | B | Na | ||
| Sucrose | SH | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| LGI-P | - | + | + | + | + | + | + | - | - | - | + | + | - | - | |
| HXN | - | - | - | + | + | + | - | - | - | - | + | + | - | + | |
| SNX | - | - | - | + | + | + | - | - | - | - | + | + | - | + | |
| DL-malic acid | Mal | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| JNFb | - | + | + | + | + | + | + | + | + | + | + | + | + | + | |
| NFb | - | + | + | + | + | + | + | + | - | - | + | + | - | + | |
| Mannitol | Ashby | - | + | + | + | + | + | - | - | - | - | - | + | - | + |
| Glucose | DYGS | + | - | - | - | + | + | - | - | - | - | - | - | - | - |
| Glucose, citric acid, gluconic acid | DF | - | + | + | - | + | + | + | + | + | + | + | - | + | + |
| +/-: represents with or without the nutrient element in given culture medium, respectively. | |||||||||||||||
表选项
研究发现,不同培养基筛选的固氮菌存在明显差异并且不同固氮菌对C源选择也不同[31, 35]。例如,G. diazotrophicus Pal 5是最耐糖的细菌之一,能在高达876 mmol/L的蔗糖中生长[36];H. seropedicae嗜有机酸,不能利用蔗糖;Azospirillum spp.属于兼性内生固氮菌,能利用的碳源较多,同时对pH适应范围较广[12]。此外,植物不同生长发育时期、不同组织甚至包括不同叶/茎位,由于碳合成代谢的不同,固氮酶活性明显不同,说明植物供给的碳源直接定向筛选定殖的固氮菌。
联合固氮菌体外培养时,培养基通常使用蔗糖作为C源,蔗糖被认为是联合固氮菌与甘蔗共生过程中重要的C源[37],然而细菌不能直接利用蔗糖,G. diazotrophicus虽然可以耐受30%的蔗糖浓度,但其对蔗糖的利用需要果聚糖转移酶将蔗糖转化为β-1, 2-低聚果糖和果聚糖[38]。当培养基中存在最适C源时,微生物会优先利用最适C源,并启动一种复杂且严格的碳代谢抑制调控机制(catabolite repression control,CRC),当最优C源消耗殆尽后,微生物会解除CRC,利用其他C源作为能源[39]。因此,某些联合固氮菌对C源同样具有广适性,G. diazotrophicus以甘油为C源时固氮能力最强,而在蔗糖、葡萄糖酸盐或山梨醇为C源的环境下G. diazotrophicus的生长素分泌比在葡萄糖为C源时更多[37]。由此可见,C源供给类型直接影响内生固氮菌的种类、生长状态及激素分泌,能否为固氮微生物提供理想的碳源,是分离甘蔗联合固氮菌及其功能研究和生产应用的主要因素之一。
3 联合固氮菌的侵染途径及机制 随着现代分子生物学技术的发展,利用荧光标记和电子显微镜等技术,发现一些细菌通过甘蔗侧根侵染,分散或成团的粘附在植物细胞间隙和维管组织中[40],使其具有良好的氧分压和碳、氮交换条件,有利于发挥固氮菌的促生功能[41]。部分细菌可能随着蒸腾作用而遍布在茎和叶中[42],以及从栽培生理角度分析,有些研究者认为,内生固氮菌可以通过传统的栽培方法,如甘蔗种茎切段或机械损伤侵染而定殖于植物体内,有的则通过借助传播媒介包括VA菌根和介壳虫传递或扩散给其他禾本科植物[43-44]。
从侵染机制分析,第一,植物根系分泌多糖等粘性物质覆盖在根表或根冠,并招募大量联合固氮菌的聚集,部分细菌则从根尖或侧根原基的发生部位侵染植物,同时聚集的固氮微生物会刺激植物根毛的产生和发育,诱导其形态发生变化,形成类侵染线的结构[45-48]。第二,内生联合固氮菌存在Ⅵ型分泌系统,分泌的效应因子对植物与微生物的互作具有促进作用,研究发现多种内生固氮菌均有Ⅵ型分泌系统,但也存在例外,如G. diazotrophicus Pal 5中存在Ⅳ型分泌系统[24, 49]。N. amazonense strain CBAmC具有多种调控N-聚糖的基因,这些基因可能在固氮菌侵染过程中发挥与病原体相似的作用,但不会引发植物病害[20]。可能的机制是固氮菌在侵染植物时,效应因子可以抑制编码植物细胞壁、膜和包膜成分基因的表达,进而调整固氮菌的脂多糖(LPS)、胞外多糖(EPS)和肽聚糖等结构,绕过植物的防御机制,促进微生物的高效定殖[50]。研究表明,突变固氮菌株的LPS或EPS合成相关的基因,显著抑制了固氮微生物的定殖,说明完整的LPS或EPS是某些固氮菌附着于植物根表或定殖于植物体内所必需的[51-52]。
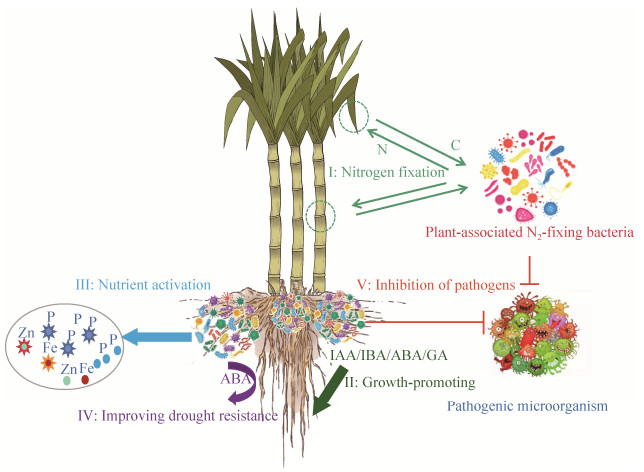
4 联合固氮菌的功能研究 植物联合固氮菌的发现,为禾本科作物进行“减肥增效”的实践开辟了新途径。许多研究报道证实了内生固氮菌的存在,显著提高了宿主的氮营养。联合固氮菌除了具有较强的固氮能力外,还具有溶磷、抗逆、抗病等作用(图 1)。因此,接种联合固氮菌后能促进植物的生长,提高作物产量,是联合固氮菌开发与应用的重要依据。
 |
| 图 1 植物联合固氮菌的功能研究 Figure 1 Functional studies of plant associated nitrogen fixing bacteria. |
| 图选项 |
4.1 联合固氮菌的固氮能力 联合固氮菌的应用,显著提高了禾本科植物的氮素积累(图 1-Ⅰ)。利用15N和氮素平衡法测定联合固氮菌对甘蔗氮效率的贡献,发现生物固氮可以为甘蔗提供生长发育所需60%的氮,有些品种甚至可达80%[5, 9]。接种联合固氮菌,可以提高植株氮含量,减少氮肥施用。Enterobacter sp.回接甘蔗组培苗,整株氮含量提高了17.9%,相当于180 kg尿素/ha[53];Raoultella sp.菌株L03回接甘蔗幼苗,使其氮含量升高了171.5%[54];B. gladioli回接甘蔗155 d后,甘蔗生物量平均增加66%,叶片氮浓度和叶绿素浓度都有显著提升[55];固氮复合菌回接甘蔗后,茎秆田间产量提高了22.3-42.4 t/ha[56]。
联合固氮菌的固氮过程受到一系列固氮基因调控作用。首先,氮气在NifHDK作用下转化为氨,固氮产物则进一步通过谷氨酰胺合成酶/谷氨酸合成酶途径进行同化[24, 57]。通过比较内生固氮醋酸杆菌(G. diazotrophicus)的野生菌株与nifD-突变株对甘蔗氮含量及生物量的影响发现,在低氮条件下,接种野生型菌株的甘蔗显著提高了植株的氮含量并促进了分蘖数和叶片数目的增加[58]。某些联合固氮菌如G. diazotrophicus,还可通过NAD合成酶、氨甲基转移酶、组氨酸解氨酶、D-氨基酸脱氢酶等几种替代途径将氨同化成不同的化合物[24]。Cojho等[59]将A. diazotrophicus与酵母(Lipomyces kononenkoae)在无氮培养基下共培养,发现酵母的蛋白质积累量提高了50%,暗示了该菌固定的氮素能转移至酵母,供其生长所需,由此可见,联合固氮菌可通过外排固氮产物到菌体外,同时菌体死亡后也会释放出氮为宿主提供氮源[60]。此外,联合固氮菌定殖的宿主植物同样会引起植物氮代谢的变化,甘蔗表达序列标签(expressed sequence tag,EST)分析表明,内生固氮菌定殖的植物氮代谢非常活跃,并发现与氮代谢相关的基因包括编码天冬酰胺合成酶、天门冬氨酸转氨酶、谷氨酰胺合成酶、谷氨酸脱氢酶、谷氨酸合成酶、硝酸还原酶、硝酸转运蛋白、亚硝酸盐还原酶、亚硝酸盐转运蛋白、铵离子转运蛋白、氨基酸转运蛋白、肽转运蛋白等的基因高度上调表达[61]。
4.2 联合固氮菌的促生作用 根际联合固氮菌在不同环境和土壤条件下,能够显著促进植物的生长。研究发现,接种G. diazotrophicus Pal 5丧失固氮能力的nif-突变体及野生型菌株,在高氮条件下均能促进甘蔗苗的生长[58],暗示了联合固氮菌除了为宿主提供氮源外,还能通过其他因子调控植株的生长发育。而这些固氮菌主要通过分泌植物激素,包括吲哚乙酸(IAA)、吲哚丁酸(IBA)、脱落酸(ABA)和赤霉素(GA)等[62-63],促进植株的根系的伸长与发育,影响植物对土壤矿质养分和水分的吸收,进一步促进植物生物量的增加(图 1-Ⅱ)。研究表明,分离筛选出的植物根际促生菌种大多数都具有分泌IAA的能力[64]。例如,从甘蔗根内分离的固氮菌XD20 (Pantoea agglomerans),IAA分泌能力为36.71 μg/mL[65];在广西主要蔗区根际土中分离的联合固氮菌菌株GX0798 (B. megaterium),IAA的分泌能力较强,可达14.32 μg/mL[66]。同时,研究表明,联合固氮菌具有多条合成IAA的途径,其中以吲哚-3-丙酮酸途径为主,即通过吲哚-3-丙酮酸,在色氨酸转氨酶和吲哚丙酸氧化还原酶的催化下合成IAA[67]。由于联合固氮菌的促生作用,筛选甘蔗联合固氮菌时,分泌植物激素的能力也被视为一项优良菌株的筛选条件。
4.3 联合固氮菌活化土壤养分的作用 磷、铁和锌是植物生长发育所必需的矿质养分,其在土壤中的有效性直接影响作物的生产力。固氮微生物可以通过多种途径将土壤中难溶性的养分活化,供宿主植物利用(图 1-Ⅲ)。其中,土壤中的磷扩散系数低、难以移动且易被固定,这些固定在土壤中的磷被称为“难溶性磷”,主要包括无机态难溶磷和有机态难溶磷两类,导致90%以上的土壤磷不能被植物直接吸收利用,磷在土壤中的有效性低,严重抑制了作物的生产力。然而,部分微生物可以通过分泌物,例如有机酸和酸性磷酸酶类等,将难溶性磷分解为植物可以吸收利用的无机磷,达到溶磷/解磷的效果[68]。研究发现,在联合固氮体系中,接种G. diazotrophicus可以显著提高草莓的植株磷含量,改善缺磷状况[69];从广西甘蔗茎中分离筛选的一株内生固氮泛菌属(Pantoea sp.)菌株NN08200的溶磷能力明显优于甘蔗固氮模式菌株G. diazotrophicus Pal 5[70];属于假单胞菌的甘蔗内生固氮D5菌株(P. extremorientalis)对不同难溶磷的溶解能力表现不同,呈现磷酸三钙 > 植酸钙 > 磷酸铁的状态,并伴随培养基pH不同程度的降低,说明酸化介质可能是微生物溶磷的机制之一[71]。此外,研究发现G. diazotrophicus产生的葡萄糖酸是溶解难溶磷的必要途径,同时还能溶解难容锌化物,对提高锌的有效性也具有重要作用[68, 72]。
除了磷外,微量元素铁在土壤中的有效性也较低。禾本科植物和微生物均能通过分泌铁载体,螯合土壤中的铁元素。微生物分泌的铁载体是一类与Fe3+具有高亲和性且能与之螯合的小分子次级代谢产物,并通过氧化还原反应将其转化为可溶铁,为生物体提供充足的铁元素[73]。与此同时,微生物铁载体的释放对植物微生物群落构建具有一定影响,合理利用铁载体同样有利于植物抗病能力的提升[74]。
4.4 联合固氮菌的抗逆能力 在农业生产中,作物的生产力会面临不同逆境环境的挑战。其中,干旱是造成全世界作物减产最严重的限制性因素[75]。干旱会直接影响根系发育及根系分泌物的改变,进而会直接影响微生物菌群结构,与此同时,微生物的存在也可以提高宿主植物的抗旱性(图 1-Ⅳ)。研究表明,水稻接种联合固氮菌G. diazotrophicus Pal 5能提高植物地上部气体交换和保护性溶质水平提升,并通过增强干旱胁迫基因的表达来提高水稻的抗旱性,进而提高作物产量[76-77];有些联合固氮菌能够编码1-氨基环丙烷-1-羧酸(ACC)脱氢酶基因,ACC能够分解植物产生的乙烯合成前体,通过降低植物在逆境下产生乙烯的水平,进而调控植物对逆境的适应性[78]。此外,也有研究表明,接种联合固氮菌后,亦可通过调节植物的气孔开度来保持叶片水势,以达到抗旱效果[76]。
4.5 联合固氮菌的抑病能力 病害是影响作物产量的重要因素之一,联合固氮菌能够通过与植物病原菌拮抗,有效抑制多种植物病害的发生,明显提高宿主的抗病性(图 1-Ⅴ)。研究发现,成团肠杆菌(E. agglomerans) 能抑制假单胞菌丁香致病变种(P. syringae pv. Syringae) 引起的小麦疫病,防治效果可达45%-74%[79]。de Silveira[80]分离获得的13种能够促进甘蔗生长及氮素积累的内生固氮菌,其中1株草螺菌(H. frinsingense) 和3株分散泛菌(P. dispersa) 对病原真菌具有明显拮抗作用。联合固氮菌对植物病原菌的竞争抑制作用是保护作物抵制病菌侵染、减轻发病率、增强抗性的主要原因[81]。此外,微生物分泌的初生或次生代谢产物直接影响微生物与微生物的种间关系,以及微生物与宿主之间的群体或共生关系[82],例如,葡萄糖酸与G. diazotrophaus的抗菌活性有关[83],G. diazotrophaus Pal 5菌株甚至可以向培养基中分泌类似溶菌酶的细菌素,在体外能不同程度地抑制多种致病细菌的生长[84]。
5 固氮复合菌的研究及应用 联合固氮作用对禾本科植物整个生长期氮素的供给具有重要贡献,随着联合固氮菌的分离与鉴定,发现植物内生固氮菌资源非常丰富,种类多并且分布广[85]。暗示了禾本科作物的联合固氮作用可能是多种固氮菌共同参与进行的,并且联合固氮作用的应用极有可能成为农、林及畜牧业氮素来源的重要途径。近年来,联合固氮菌的功能逐渐被揭晓,除了可以为宿主提供氮素外,同时还具有分泌植物激素、溶磷、增强植株抗病、抗逆能力等多方面促生作用,但不同菌属具有不同的生物学特性与功能,同时他们在植物体中定殖的位置也有区别,因而所表现的固氮和促生能力不同[12, 14]。因此,探索植物联合固氮的核心菌群,结合生产需要并制备固氮复合菌,对充分发挥联合固氮作用具有重要意义。
Oliveira等[86]利用5种甘蔗联合固氮菌,包括固氮醋酸杆菌(G. diazotrophicus)、织片草螺菌(H. seropedicae)、红苍白草螺菌(H. rubrisubalbicans)、亚马逊固氮螺菌(A. amazonense) 和伯克氏菌(Burkholderia sp.)混合接种于甘蔗,协同促进了甘蔗的生长。在巴西,这5种菌的混合菌剂已进入生产试验阶段[87]。固氮复合菌的配制,可以利用不同时空固氮并结合不同程度的促生效应,为植物生长长期供应氮素,维持植物健康,提高抗逆性,具有很大的应用潜力。大量的研究表明,甘蔗联合固氮菌的组合接种显著提高了固氮菌在植物体内的定殖数目、固氮率均比单独接种高[86],并且在不施氮肥的贫瘠土壤中,新植蔗和宿根蔗接种固氮复合菌均能提高固氮量和甘蔗产量[56, 87],说明组合接种对甘蔗生产具有协同增效的作用。此外,复合菌接种能明显促进甘蔗根系生长、增加细根数、根长、根系体积和表面积,进而显著增加了根系干重[88]。Armanhi等[28]利用一种高通量微生物分离方法(community-based culture collection,CBC),结合微生物组数据分析,将甘蔗核心固氮微生物收集并混合成菌剂,回接到玉米,使玉米生物量提高了3.4倍,说明复合菌剂在农业生产中蕴藏着巨大应用潜力。然而,不同甘蔗品种对固氮复合菌具有一定的选择性[56, 88],因此,开发广适性的复合菌还需要进一步的实践验证。
6 问题和展望 广泛开发非豆科植物的固氮菌资源,扩大固氮菌群种类、筛选和培育高效优良菌株,建立植物的联合固氮体系,对减肥增效的可持续农业具有重要意义。内生固氮菌种类丰富,具有不同的生物学特性,在应用方面,功能型核心菌群或联合固氮复合菌的组装需要明确联合固氮菌的功能、生长需要的碳源及侵染/传播途径。因此,应加强固氮菌的高效筛选、分析其固氮效率和促生机制,为固氮复合菌的配制与应用提供参考,并进一步探究内生固氮菌的定殖模式,尤其是在地上部叶片和茎中的分布。随着测序技术的发展与应用,联合固氮菌在空间上的分布越来越明晰,但其定殖于植物体内后随时间发生的变化仍有待探究。此外,高通量微生物培养技术的出现,势必加速联合固氮菌的分离和功能研究,同时使微生物组分析获得的差异菌群结果将更容易通过回接实验被验证,这也意味着利用微生物大数据分析指导高效促生固氮复合菌剂的制备与应用成为可能。
联合固氮亦是微生物与宿主之间C/N养分交换互惠互利的共生关系,特别在高光合C4作物甘蔗中,微生物如何提供N以及N的供应形态,甘蔗又为固氮菌提供什么C源,在甘蔗生长及糖分形成的整个过程中,微生物群落结构的变化、两者之间C-N的平衡如何调控等均需要进一步试验挖掘。
豆科植物与根瘤菌共生体系的建立,需要植物与微生物间的分子对话以及一系列基因/蛋白的级联响应,进而促进根瘤的形成、发育和固氮作用[89]。联合固氮未形成固氮根瘤,虽然一些研究表明植物分泌黏性物质、联合固氮菌的表面多糖和Ⅵ型分泌系统在联合固氮体统建立过程中起到重要作用,但从植物角度分析,刺激植物根系分泌多糖类黏性物质的信号、微生物表面多糖的受体和感知Ⅵ型分泌效应因子的蛋白及其调控路径等还未十分清楚。然而,随着微生物组的测序及蛋白组学的研究,在揭示联合固氮菌的固氮机制方面取得了较大进展。联合固氮能够在禾本科植物根、茎和叶等不同组织中发挥固氮功能,并且地上部的固氮能力往往会强于根系[31],微生物定殖于地上部的途径是否仅通过根系,以及在植物不同器官中存活或繁殖时是否存在反馈或自我调控以平衡细菌数目和养分的对等交换,这些均有待于进一步研究。
联合固氮菌除了具有固氮能力外,还具有分泌激素、活化土壤养分、抗逆、抗病等促生作用。一些研究者利用丧失IAA分泌能力的突变体菌株结合测序分析,阐述了编码细胞色素C合成的基因突变可能是导致IAA分泌异常的原因[90],尽管如此,关于固氮微生物分泌激素的机制以及植物对其响应的分子调控仍然存在很大的未知空间。此外,固氮微生物引起的抗逆和防御功能,植物如何整合这些分子信号,植物免疫系统又如何参与其中?固氮微生物在活化土壤养分时,是否也会诱导植物根系分泌物的增加,增强植物养分转运子的活性,进而提高养分吸收利用效率?由于联合固氮菌的种类繁多,其主要功能菌所引起的促生机制及其与植物互作的分子机制还需要进一步探索。
长久以来,巴西在甘蔗种植上投入了很低的氮肥,利用植物自身的生物学特性,选育出高效生物固氮的甘蔗品种,配合低氮施肥措施,在生产实践中取得了突出效果。而我国,长期以来,甘蔗种植施用了大量的化学氮肥,没有充分发挥甘蔗自身生物固氮作用的潜能,不仅增加了生产成本,而且严重浪费了资源,污染生态环境,同时也阻碍了高效生物固氮甘蔗品种的选育。因此,我国甘蔗生产真正达到减肥增效的目的,除了甘蔗固氮微生物资源的发掘与利用外,还应配合改进甘蔗肥水管理策略,并结合高效固氮优良甘蔗品种的选育和推广。
除甘蔗外,我国三大粮食作物小麦、水稻和玉米均属于禾本科植物,并且已有报道发现3种作物中存在并分离获得了联合固氮菌[14],说明在生产中,可以发掘和利用三大粮食作物的生物固氮能力。然而,联合固氮菌也存在宿主专一性的特点,所以开发宿主广适性和地区广适性的高效固氮、高效促生的优化菌群是禾本科植物生物固氮走向应用的基础,同时是联合固氮菌肥研发的重要方向。此外,内生固氮菌作为外源基因的载体,在植物基因功能的研究中也存在一定潜力。
References
| [1] | Tilman D, Fargione J, Wolff B, D'Antonio C, Dobson A, Howarth R, Schindler D, Schlesinger WH, Simberloff D, Swackhamer D. Forecasting agriculturally driven global environmental change. Science, 2001, 292(5515): 281-284. DOI:10.1126/science.1057544 |
| [2] | Ladha JK, Tirol-Padre A, Reddy CK, Cassman KG, Verma S, Powlson DS, van Kessel C, de B Richter D, Chakraborty D, Pathak H. Global nitrogen budgets in cereals: a 50-year assessment for maize, rice, and wheat production systems. Scientific Reports, 2015, 6(1): 19355. |
| [3] | Zhang FS, Chen XP, Vitousek P. Chinese agriculture: an experiment for the world. Nature, 2013, 497(7447): 33-35. DOI:10.1038/497033a |
| [4] | Liu XJ, Zhang Y, Han WX, Shen JL, Cui ZL, Vitousek P, Erisman JW, Goulding K, Christie P, Fangmeier A, Zhang FS. Enhanced nitrogen deposition over China. Nature, 2013, 494(7438): 459-462. DOI:10.1038/nature11917 |
| [5] | Boddey RM, Urquiaga S, Alves BJR, Reis V. Endophytic nitrogen fixation in sugarcane: present knowledge and future applications. Plant and Soil, 2003, 252(1): 139-149. DOI:10.1023/A:1024152126541 |
| [6] | Herridge DF, Peoples MB, Boddey RM. Global inputs of biological nitrogen fixation in agricultural systems. Plant and Soil, 2008, 311(1/2): 1-18. DOI:10.1007/s11104-008-9668-3 |
| [7] | 中国统计出版社. 2019中国统计年鉴. [2020-05-08]. http://www.stats.gov.cn/tjsj/ndsj/2019/indexch.htm. |
| [8] | Yang L, Qu HP, Liang YJ, Liu XH, Yang LT, Wang M, Huang DL, Li YR. The research progress of nitrogen physiology in sugarcane. Soil and Fertilizer Sciences in China, 2014, 56(6): 1-7. (in Chinese) 杨柳, 区惠萍, 梁永检, 刘昔辉, 杨丽涛, 汪淼, 黄东亮, 李杨瑞. 甘蔗氮素吸收利用的生理机制研究进展. 中国土壤与肥料, 2014, 56(6): 1-7. |
| [9] | Urquiaga S, Cruz KHS, Boddey RM. Contribution of nitrogen fixation to sugar cane: nitrogen-15 and nitrogen-balance estimates. Soil Science Society of America Journal, 1992, 56(1): 105-114. DOI:10.2136/sssaj1992.03615995005600010017x |
| [10] | Baldani J, Caruso L, Baldani VLD, Goi SR, D?bereiner J. Recent advances in BNF with non-legume plants. Soil Biology and Biochemistry, 1997, 29(5/6): 911-922. |
| [11] | D?bereiner J, Day JM. Associative symbiosis in tropical grasses: characterization of microorganisms and dinitrogen fixing sites//Proceedings of the 1st International Symposium on Nitrogen Fixation. Pullman: Washington State University Press, 1976: 518-538. |
| [12] | Mehnaz S. Microbes-friends and foes of sugarcane. Journal of Basic Microbiology, 2013, 53(12): 954-971. DOI:10.1002/jobm.201200299 |
| [13] | Rouws LFM, Leite J, de Matos GF, Zilli JE, Coelho MRR, Xavier GR, Fischer D, Hartmann A, Reis VM, Baldani JI. Endophytic Bradyrhizobium spp. isolates from sugarcane obtained through different culture strategies. Environmental Microbiology Reports, 2014, 6(4): 354-363. DOI:10.1111/1758-2229.12122 |
| [14] | Zhang LM, Fang P, Zhu RQ. Recent advances in research and application of associated nitrogen-fixation with graminaceous plants. Chinese Journal of Applied Ecology, 2004, 15(9): 1650-1654. (in Chinese) 张丽梅, 方萍, 朱日清. 禾本科植物联合固氮研究及其应用现状展望. 应用生态学报, 2004, 15(9): 1650-1654. |
| [15] | Bashan Y, Levanony H, Mitiku G. Changes in proton efflux of intact wheat roots induced by Azospirillum brasilense Cd. Canadian Journal of Microbiology, 1989, 35(7): 691-697. DOI:10.1139/m89-113 |
| [16] | Zimmer W, Roeben K, Bothe H. An alternative explanation for plant growth promotion by bacteria of the genus Azospirillum. Planta, 1988, 176(3): 333-342. DOI:10.1007/BF00395413 |
| [17] | Bashan Y, Holguin G. Azospirillum-plant relationships: environmental and physiological advances (1990-1996). Canadian Journal of Microbiology, 1997, 43(2): 103-121. DOI:10.1139/m97-015 |
| [18] | Boddey RM, D?bereiner J. Nitrogen fixation associated with grasses and cereals: recent progress and perspectives for the future. Fertilizer Research, 1995, 42(1/3): 241-250. DOI:10.1007/BF00750518 |
| [19] | Steenhoudt O, Vanderleyden J. Azospirillum, a free-living nitrogen-fixing bacterium closely associated with grasses: genetic, biochemical and ecological aspects. FEMS Microbiology Reviews, 2000, 24(4): 487-506. DOI:10.1111/j.1574-6976.2000.tb00552.x |
| [20] | Schwab S, Terra LA, Baldani JI. Genomic characterization of Nitrospirillum amazonense strain CBAmC, a nitrogen-fixing bacterium isolated from surface-sterilized sugarcane stems. Molecular Genetics and Genomics, 2018, 293(4): 997-1016. DOI:10.1007/s00438-018-1439-0 |
| [21] | da Silva PRA, Sim?es-Araújoa JL, Vidal MS, Cruz LM, de Souza EM, Baldani JI. Draft genome sequence of Paraburkholderia tropica Ppe8 strain, a sugarcane endophytic diazotrophic bacterium. Brazilian Journal of Microbiology, 2018, 49(2): 210-211. DOI:10.1016/j.bjm.2017.07.005 |
| [22] | Chen MY, Zhu B, Lin L, Yang LT, Li YR, An QL. Complete genome sequence of Kosakonia sacchari type strain SP1T. Standards in Genomic Sciences, 2014, 9(3): 1311-1318. DOI:10.4056/sigs.5779977 |
| [23] | Reyna-Flores F, Barrios-Camacho H, Dantán-González E, Ramírez-Trujillo JA, Beltrán LFLA, Rodríguez-Medina N, Garza-Ramos U, Suárez-Rodríguez R. Draft genome sequences of endophytic isolates of Klebsiella variicola and Klebsiella pneumoniae obtained from the same sugarcane plant. Genome Announcements, 2018, 6(12): e00147-18. |
| [24] | Bertalan M, Albano R, de Pádua V, Rouws L, Rojas C, Hemerly A, Teixeira K, Schwab S, Araujo J, Oliveira A, Fran?a L, Magalh?es V, Alquéres S, Cardoso A, Almeida W, Loureiro MM, Nogueira E, Cidade D, Oliveira D, Sim?o T, Macedo J, Valad?o A, Dreschsel M, Freitas F, Vidal M, Guedes H, Rodrigues E, Meneses C, Brioso P, Pozzer L, Figueiredo D, Montano H, Junior J, de Souza Filho G, Flores VMQ, Ferreira B, Branco A, Gonzalez P, Guillobel H, Lemos M, Seibel L, Macedo J, Alves-Ferreira M, Sachetto-Martins G, Coelho A, Santos E, Amaral G, Neves A, Pacheco AB, Carvalho D, Lery L, Bisch P, R?ssle SC, ürményi T, Pereira AR, Silva R, Rondinelli E, von Krüger W, Martins O, Baldani JI, Ferreira PC. Complete genome sequence of the sugarcane nitrogen-fixing endophyte Gluconacetobacter diazotrophicus Pal5. BMC Genomics, 2009, 10: 450. DOI:10.1186/1471-2164-10-450 |
| [25] | Dong M, Yang ZT, Cheng GY, Peng L, Xu Q, Xu JS. Diversity of the bacterial microbiome in the roots of four Saccharum species: S. spontaneum, S. robustum, S. barberi, and S. officinarum. Frontiers in Microbiology, 2018, 9: 267. DOI:10.3389/fmicb.2018.00267 |
| [26] | de Souza RSC, Okura VK, Armanhi JSL, Jorrín B, Lozano N, da Silva MJ, González-Guerrero M, de Araújo LM, Verza NC, Bagheri HC, Imperial J, Arruda P. Unlocking the bacterial and fungal communities assemblages of sugarcane microbiome. Scientific Reports, 2016, 6: 28774. DOI:10.1038/srep28774 |
| [27] | Yeoh YK, Paungfoo-Lonhienne C, Dennis PG, Robinson N, Ragan MA, Schmidt S, Hugenholtz P. The core root microbiome of sugarcanes cultivated under varying nitrogen fertilizer application. Environmental Microbiology, 2016, 18(5): 1338-1351. DOI:10.1111/1462-2920.12925 |
| [28] | Armanhi JSL, de Souza RSC, de Brito Damasceno N, de Araújo LM, Imperia J, Arruda P. A community-based culture collection for targeting novel plant growth-promoting bacteria from the sugarcane microbiome. Frontiers in Plant Science, 2018, 8: 2191. DOI:10.3389/fpls.2017.02191 |
| [29] | Lery LMS, Hemerly AS, Nogueira EM, von Krüger WMA, Bisch PM. Quantitative proteomic analysis of the interaction between the endophytic plant-growth-promoting bacterium Gluconacetobacter diazotrophicus and sugarcane. Molecular Plant-Microbe Interactions, 2011, 24(5): 562-576. DOI:10.1094/MPMI-08-10-0178 |
| [30] | Bai Y, Müller DB, Srinivas G, Garrido-Oter R, Potthoff E, Rott M, Dombrowski N, Münch PC, Spaepen S, Remus-Emsermann M, Hüttel B, McHardy AC, Vorholt JA, Schulze-Lefert P. Functional overlap of the Arabidopsis leaf and root microbiota. Nature, 2015, 582(7582): 364-369. |
| [31] | Hu HN, Ao JH, Huang XC, Li XX, Liao H. Evaluation on associative nitrogen fixation capability in different tissues of sugarcane. Plant Physiology Journal, 2017, 53(3): 437-444. (in Chinese) 胡浩南, 敖俊华, 黄晓财, 李欣欣, 廖红. 甘蔗不同组织联合固氮能力评价. 植物生理学报, 2017, 53(3): 437-444. |
| [32] | 邢永秀. 甘蔗内生固氮细菌的分离、鉴定和生长特性. 广西大学博士学位论文, 2006. |
| [33] | 罗丽静. 广西甘蔗野生种质内生细菌及蔗豆间作内生根瘤菌的分离与鉴定. 广西大学硕士学位论文, 2014. |
| [34] | Wang YQ, Wang SG, Shen AL, Lv AY, Xue YF. Preliminary identification of strains after the separation and purification of nitrogen-fixing bacteria. Journal of Henan Agricultural Sciences, 2004, 33(4): 46-49. (in Chinese) 王永歧, 王守刚, 沈阿林, 吕爱英, 薛毅芳. 固氮菌分离纯化后菌株的初步鉴别. 河南农业科学, 2004, 33(4): 46-49. |
| [35] | Aguiar NO, Medici LO, Olivares FL, Dobbss LB, Torres-Netto A, Silva SF, Novotny EH, Canellas LP. Metabolic profile and antioxidant responses during drought stress recovery in sugarcane treated with humic acids and endophytic diazotrophic bacteria. Annals of Applied Biology, 2016, 168(2): 203-213. DOI:10.1111/aab.12256 |
| [36] | de Oliveira MVV, Intorne AC, de S Vespoli L, Andrade LF, de M Pereira L, Rangel PL, de Souza Filho GA. Essential role of K+ uptake permease (Kup) for resistance to sucrose-induced stress in Gluconacetobacter diazotrophicus PAL 5. Environmental Microbiology Reports, 2017, 9(2): 85-90. DOI:10.1111/1758-2229.12503 |
| [37] | Tejera NA, Ortega E, Rodés R, Lluch C. Influence of carbon and nitrogen sources on growth, nitrogenase activity, and carbon metabolism of Gluconacetobacter diazotrophicus. Canadian Journal of Microbiology, 2004, 50(9): 745-750. DOI:10.1139/w04-066 |
| [38] | Alvarez B, Martínez-Drets G. Metabolic characterization of Acetobacter diazotrophicus. Canadian Journal of Microbiology, 1995, 41(10): 918-924. DOI:10.1139/m95-126 |
| [39] | Lin WN, Li L, Wang R, Han YL, Dai SX, Ping SZ, Jin WJ, Yan YL. Research progress on carbon catabolite repression control in bacteria. Journal of Agricultural Science and Technology, 2011, 13(2): 46-52. (in Chinese) 林文娜, 李亮, 王瑞, 韩云蕾, 代淑贤, 平淑珍, 金芜军, 燕永亮. 细菌碳代谢抑制作用的研究进展. 中国农业科技导报, 2011, 13(2): 46-52. |
| [40] | Dong ZM, Canny MJ, McCully ME, Roboredo MR, Cabadilla CF, Ortega E, Rodés R. A nitrogen-fixing endophyte of sugarcane stems (a new role for the apoplast). Plant Physiology, 1994, 105(4): 1139-1147. DOI:10.1104/pp.105.4.1139 |
| [41] | James EK. Nitrogen fixation in endophytic and associative symbiosis. Field Crops Research, 2000, 65(2/3): 197-209. |
| [42] | James EK, Reis VM, Olivares FL, Baldani JI, D?bereiner J. Infection of sugar cane by the nitrogen-fixing bacterium Acetobacter diazotrophicus. Journal of Experimental Botany, 1994, 45(6): 757-766. DOI:10.1093/jxb/45.6.757 |
| [43] | Ashbolt NJ, Inkerman PA. Acetic acid bacterial biota of the pink sugar cane mealybug, Saccharococcus sacchari, and its environs. Applied and Environmental Microbiology, 1990, 56(3): 707-712. DOI:10.1128/AEM.56.3.707-712.1990 |
| [44] | Paula MA, Reis VM, D?bereiner J. Interactions of Glomus clarum with Acetobacter diazotrophicus in infection of sweet potato (Ipomoea batatas), sugarcane (Saccharum spp.), and sweet sorghum (Sorghum vulgare). Biology and Fertility of Soils, 1991, 11(2): 111-115. DOI:10.1007/BF00336374 |
| [45] | Cocking EC. Endophytic colonization of plant roots by nitrogen-fixing bacteria. Plant and Soil, 2003, 252(1): 169-175. DOI:10.1023/A:1024106605806 |
| [46] | Liu XM, Zhao HX, Chen SF. Colonization of maize and rice plants by strain Bacillus megaterium C4. Current Microbiology, 2006, 52(3): 186-190. DOI:10.1007/s00284-005-0162-3 |
| [47] | Reis VM, Olivares FL, de Oliveira ALM, dos Reis Junior FB, Baldani JI, D?bereiner J. Technical approaches to inoculate micropropagated sugar cane plants were Acetobacter diazotrophicus. Plant and Soil, 1999, 206(2): 205-211. DOI:10.1023/A%3A1004436611397 |
| [48] | Elbeltagy A, Nishioka K, Sato T, Suzuki H, Ye B, Hamada T, Isawa T, Mitsui H, Minamisawa K. Endophytic colonization and in planta nitrogen fixation by a Herbaspirillum sp. isolated from wild rice species. Applied and Environmental Microbiology, 2001, 67(11): 5285-5293. DOI:10.1128/AEM.67.11.5285-5293.2001 |
| [49] | Ali S, Duan J, Charles TC, Glick BR. A bioinformatics approach to the determination of genes involved in endophytic behavior in Burkholderia spp. Journal of Theoretical Biology, 2014, 343: 193-198. DOI:10.1016/j.jtbi.2013.10.007 |
| [50] | da Silva PRA, Vidal MS, de Paula Soares C, Polese V, Tadra-Sfeir MZ, de Souza EM, Sim?es-Araújo JL, Baldanio JI. Sugarcane apoplast fluid modulates the global transcriptional profile of the diazotrophic bacteria Paraburkholderia tropica strain Ppe8. PLoS One, 2018, 13(12): e0207863. DOI:10.1371/journal.pone.0207863 |
| [51] | Balsanelli E, Serrato RV, de Baura VA, Sasaki G, Yates MG, Rigo LU, Pedrosa FO, de Souza EM, Monteiro RA. Herbaspirillum seropedicae rfbB and rfbC genes are required for maize colonization. Environmental Microbiology, 2010, 12(8): 2233-2244. |
| [52] | Meneses CHSG, Rouws LFM, Sim?es-Araújo JL, Vidal MS, Baldani JI. Exopolysaccharide production is required for biofilm formation and plant colonization by the nitrogen-fixing endophyte Gluconacetobacter diazotrophicus. Molecular Plant-Microbe Interactions, 2011, 24(12): 1448-1458. DOI:10.1094/MPMI-05-11-0127 |
| [53] | Lin L, Li ZY, Hu CJ, Zhang XC, Chang SQ, Yang LT, Li YR, An QL. Plant growth-promoting nitrogen-fixing Enterobacteria are in association with sugarcane plants growing in Guangxi, China. Microbes and Environments, 2012, 27(4): 391-398. DOI:10.1264/jsme2.ME11275 |
| [54] | Luo T, Ou-Yang XQ, Yang LT, Li Y, Song XP, Zhang GM, Gao YJ, Duan WX, An QL. Raoultella sp. strain L03 fixes N2 in association with micropropagated sugarcane plants. Journal of Basic Microbiology, 2016, 56(8): 934-940. DOI:10.1002/jobm.201500738 |
| [55] | Muthukumarasamy R, Revathi G, Vadivelu M, Arun K. Isolation of bacterial strains possessing nitrogen-fixation, phosphate and potassium-solubilization and their inoculation effects on sugarcane. Indian Journal of Experimental Biology, 2017, 55(3): 161-170. |
| [56] | Schultz N, Pereira W, de Albuquerque Silva P, Baldani JI, Boddey RM, Alves BJR, Urquiaga S, Reis VM. Yield of sugarcane varieties and their sugar quality grown in different soil types and inoculated with a diazotrophic bacteria consortium. Plant Production Science, 2017, 20(4): 366-374. DOI:10.1080/1343943X.2017.1374869 |
| [57] | Sant'Anna FH, Almeida LG, Cecagno R, Reolon LA, Siqueira FM, Machado MR, Vasconcelos AT, Schrank IS. Genomic insights into the versatility of the plant growth-promoting bacterium Azospirillum amazonense. BMC Genomics, 2011, 12(1): 409. DOI:10.1186/1471-2164-12-409 |
| [58] | Sevilla M, Burris RH, Gunapala N, Kennedy C. Comparison of benefit to sugarcane plant growth and 15N2 incorporation following inoculation of sterile plants with Acetobacter diazotrophicus wild-type and Nif- mutant strains. Molecular Plant-Microbe Interactions, 2001, 14(3): 358-366. DOI:10.1094/MPMI.2001.14.3.358 |
| [59] | Cojho EH, Reis VM, Schenberg ACG, D?bereiner J. Interactions of Acetobacter diazotrophicus with an amylolytic yeast in nitrogen-free batch culture. FEMS Microbiology Letters, 1993, 106(3): 341-346. DOI:10.1111/j.1574-6968.1993.tb05986.x |
| [60] | Bali A, Blanco G, Hill S, Kennedy C. Excretion of ammonium by a nifL mutant of Azotobacter vinelandii fixing nitrogen. Applied and Environmental Microbiology, 1992, 58(5): 1711-1718. DOI:10.1128/AEM.58.5.1711-1718.1992 |
| [61] | de Matos Nogueira E, Vinagre F, Masuda HP, Vargas C, de Pádua VLM, da Silva FR, dos Santos RV, Baldani JI, Ferreira PCG, Hemerly AS. Expression of sugarcane genes induced by inoculation with Gluconacetobacter diazotrophicus and Herbaspirillum rubrisubalbicans. Genetics and Molecular Biology, 2001, 24(1/4): 199-206. |
| [62] | Fallik E, Okon Y, Epstein E, Goldman A, Fischer M. Identification and quantification of IAA and IBA in Azospirillum brasilense-inoculated maize roots. Soil Biology and Biochemistry, 1989, 21(1): 147-153. DOI:10.1016/0038-0717(89)90024-2 |
| [63] | Bastián F, Cohen A, Piccoli P, Luna V, Bottini R, Baraldi R, Bottini R. Production of indole-3-acetic acid and gibberellins A1 and A3 by Acetobacter diazotrophicus and Herbaspirillum seropedicae in chemically-defined culture media. Plant Growth Regulation, 1998, 24(1): 7-11. DOI:10.1023/A:1005964031159 |
| [64] | Okon Y, Bloemberg GV, Lugtenberg BJJ. Biotechnology of biofertilization and phytostimulation//Altman A. Agricultural Biotechnology. New York: Marcel Dekker, 1998: 327-349. |
| [65] | Mao LY, Huang C, Zhu K, Yang LT, Li YR, Xing YX. Effect of nitrogen-fixing strain XD20 on the growth of different sugarcane varieties. Acta Botanica Boreali-Occidentalia Sinica, 2019, 39(1): 140-148. (in Chinese) 毛莲英, 黄婵, 祝开, 杨丽涛, 李杨瑞, 邢永秀. 固氮菌株XD20对不同甘蔗品种的促生效应. 西北植物学报, 2019, 39(1): 140-148. |
| [66] | Hu CJ, Lin L, Shi GY, Wang Q, Wang QS, Li YR. Screening and identification of associative nitrogen fixation bacteria in rhizosphere of sugarcane in Guangxi. Acta Ecologica Sinica, 2012, 32(15): 4745-4752. (in Chinese) 胡春锦, 林丽, 史国英, 汪茜, 王钱崧, 李杨瑞. 广西甘蔗根际高效联合固氮菌的筛选及鉴定. 生态学报, 2012, 32(15): 4745-4752. |
| [67] | Rodrigues EP, de Paula Soares C, Galv?o PG, Imada EL, Sim?es-Araújo JL, Rouws LF, de Oliveira AL, Vidal MS, Baldani JI. Identification of genes involved in indole-3-acetic acid biosynthesis by Gluconacetobacter diazotrophicus PAL5 strain using transposon mutagenesis. Frontiers in Microbiology, 2016, 7: 1572. |
| [68] | Crespo JM, Boiardi JL, Luna MF. Mineral phosphate solubilization activity of Gluconacetobacter diazotrophicus under P-limitation and plant root environment. Agricultural Sciences, 2011, 2(1): 16-22. DOI:10.4236/as.2011.21003 |
| [69] | Delaporte-Quintana P, Grillo-Puertas M, Lovaisa NC, Teixeira KR, Rapisarda VA, Pedraza RO. Contribution of Gluconacetobacter diazotrophicus to phosphorus nutrition in strawberry plants. Plant and Soil, 2017, 419(1/2): 335-347. DOI:10.1007/s11104-017-3349-z |
| [70] | Shi GY, Zeng Q, Nong ZM, Ye XL, Cen ZL, Li YR, Hu CJ. Identification of an endophytic nitrogen-fixing bacterium NN08200 from sugarcane and its growth promotion of sugarcane. Microbiology China, 2019, 46(6): 1336-1345. (in Chinese) 史国英, 曾泉, 农泽梅, 叶雪莲, 岑贞陆, 李杨瑞, 胡春锦. 一株高效甘蔗内生固氮菌NN08200的鉴定及其对甘蔗的促生长作用. 微生物学通报, 2019, 46(6): 1336-1345. |
| [71] | Di YN, Liu LF, Xie LY, Li YM, He PF, Cui WY, Li FS, He LL. Identification and characterization of a phosphate-solubilizing endophyte from sugarcane. Crops, 2018(6): 68-75. (in Chinese) 狄义宁, 刘鲁峰, 谢林艳, 李咏梅, 何鹏飞, 崔文艳, 李富生, 何丽莲. 一株甘蔗内生菌鉴定及其溶磷能力的研究. 作物杂志, 2018(6): 68-75. |
| [72] | Saravanan VS, Madhaiyan M, Thangaraju M. Solubilization of zinc compounds by the diazotrophic, plant growth promoting bacterium Gluconacetobacter diazotrophicus. Chemosphere, 2007, 66(9): 1794-1798. DOI:10.1016/j.chemosphere.2006.07.067 |
| [73] | Ahmed E, Holmstr?m SJM. Siderophores in environmental research: roles and applications. Microbial Biotechnology, 2014, 7(3): 196-208. DOI:10.1111/1751-7915.12117 |
| [74] | Gu SH, Wei Z, Shao ZY, Friman VP, Cao KH, Yang TJ, Kramer J, Wang XF, Li ML, Mei XL, Xu YC, Shen QR, Kümmerli R, Jousset A. Competition for iron drives phytopathogen control by natural rhizosphere microbiomes. Nature Microbiology, 2020, 5(8): 1002-1010. DOI:10.1038/s41564-020-0719-8 |
| [75] | de Vries FT, Griffiths RI, Knight CG, Nicolitch O, Williams A. Harnessing rhizosphere microbiomes for drought-resilient crop production. Science, 2020, 368(6488): 270-274. DOI:10.1126/science.aaz5192 |
| [76] | Filgueiras L, Silva R, Almeida I, Vidal M, Baldani JI, Meneses CHSG. Gluconacetobacter diazotrophicus mitigates drought stress in Oryza sativa L. Plant and Soil, 2020, 451(1/2): 57-73. DOI:10.1007/s11104-019-04163-1 |
| [77] | Silva R, Filgueiras L, Santos B, Coelho M, Silva M, Estrada-Bonilla G, Vidal M, Baldani JI, Meneses C. Gluconacetobacter diazotrophicus changes the molecular mechanisms of root development in Oryza sativa L. growing under water stress. International Journal of Molecular Sciences, 2020, 21(1): 333. DOI:10.3390/ijms21010333 |
| [78] | Porcel R, Zamarre?o áM, García-Mina JM, Aroca R. Involvement of plant endogenous ABA in Bacillus megaterium PGPR activity in tomato plants. BMC Plant Biology, 2014, 14(1): 36. DOI:10.1186/1471-2229-14-36 |
| [79] | Braun-Kiewnick A, Jacobsen BJ, Sands DC. Biological control of Pseudomonas syringae pv. syringae, the causal agent of basal kernel blight of barley, by antagonistic Pantoea agglomerans. Phytopathology, 2000, 90(4): 368-375. DOI:10.1094/PHYTO.2000.90.4.368 |
| [80] | da Silveira APD, de Paula Freitas Iório R, Marcos FCC, Fernandes AO, de Souza SACD, Kuramae EE, Cipriano MAP. Exploitation of new endophytic bacteria and their ability to promote sugarcane growth and nitrogen nutrition. Antonie van Leeuwenhoek, 2019, 112(2): 283-295. DOI:10.1007/s10482-018-1157-y |
| [81] | Qin LP, Huang SL, Li YR. Research progress in Endophytic diazotroph. Chinese Agricultural Science Bulletin, 2005, 21(2): 150-152, 159. (in Chinese) 覃丽萍, 黄思良, 李杨瑞. 植物内生固氮菌的研究进展. 中国农学通报, 2005, 21(2): 150-152, 159. |
| [82] | Hibbing ME, Fuqua C, Parsek MR, Peterson SB. Bacterial competition: surviving and thriving in the microbial jungle. Nature Reviews Microbiology, 2009, 8(1): 12-25. |
| [83] | Nieto-Pe?alver CG, Savino MJ, Bertini EV, Sánchez LA, de Figueroa LIC. Gluconic acid produced by Gluconacetobacter diazotrophicus Pal5 possesses antimicrobial properties. Research in Microbiology, 2014, 165(7): 549-558. DOI:10.1016/j.resmic.2014.06.003 |
| [84] | Pi?ón D, Casas M, Blanch M, Fontaniella B, Blanco Y, Vicente C, Solas MT, Legaz ME. Gluconacetobacter diazotrophicus, a sugar cane endosymbiont, produces a bacteriocin against Xanthomonas albilineans, a sugar cane pathogen. Research in Microbiology, 2002, 153(6): 345-351. DOI:10.1016/S0923-2508(02)01336-0 |
| [85] | Liu LH, Jiang HM, Wang PX, Tang XY, Peng GX, Tan ZY. Research progress on diversity of endophytic diazotrophs in wild rices. Current Biotechnology, 2017, 7(6): 567-579. (in Chinese) 刘丽辉, 蒋慧敏, 王佩旋, 唐小钰, 彭桂香, 谭志远. 野生稻内生固氮菌多样性研究进展. 生物技术进展, 2017, 7(6): 567-579. |
| [86] | Oliveira ALM, Stoffels M, Schmid M, Reis VM, Baldani JI, Hartmann A. Colonization of sugarcane plantlets by mixed inoculations with diazotrophic bacteria. European Journal of Soil Biology, 2009, 45(1): 106-113. DOI:10.1016/j.ejsobi.2008.09.004 |
| [87] | Fischer D, Pfitzner B, Schmid M, Sim?es-Araújo JL, Reis VM, Pereira W, Orme?o-Orrillo E, Hai B, Hofmann A, Schloter M, Martinez-Romero E, Baldani JI, Hartmann A. Molecular characterisation of the diazotrophic bacterial community in uninoculated and inoculated field-grown sugarcane (Saccharum sp.). Plant and Soil, 2011, 356(1/2): 83-99. |
| [88] | dos Santos SG, Chaves VA, da Silva Ribeiro F, Alves GC, Reis VM. Rooting and growth of pre-germinated sugarcane seedlings inoculated with diazotrophic bacteria. Applied Soil Ecology, 2019, 133: 12-23. DOI:10.1016/j.apsoil.2018.08.015 |
| [89] | Oldroyd GED, Murray JD, Poole PS, Downie JA. The rules of engagement in the legume-rhizobial symbiosis. Annual Review of Genetics, 2011, 45: 119-144. DOI:10.1146/annurev-genet-110410-132549 |
| [90] | Lee S, Flores-Encarnación M, Contreras-Zentella M, Garcia-Flores L, Escamilla JE, Kennedy C. Indole-3-acetic acid biosynthesis is deficient in Gluconacetobacter diazotrophicus strains with mutations in cytochrome c biogenesis genes. Journal of Bacteriology, 2004, 186(16): 5384-5391. DOI:10.1128/JB.186.16.5384-5391.2004 |
