张涵1, 孙珊珊2, 董浩2, 承磊3, 佘跃惠2


1. 长江大学化学与环境工程学院, 湖北 荆州 434023;
2. 长江大学石油工程学院, 湖北 武汉 430100;
3. 农业部沼气科学研究所, 四川 成都 610000
收稿日期:2019-11-28;修回日期:2020-01-17;网络出版日期:2020-02-29
基金项目:十三五国家科技重大专项(2017ZX05009-004);国家自然科学基金(51634008,51574038)
作者简介:佘跃惠, 男, 1965年6月生, 湖南省邵东县人, 二级教授, 博士生导师。SPE会员, 中国生物工程学会和微生物学会永久会员, 主要从事石油微生物生物技术研究。对我国大庆, 大港, 新疆等十多个油田60多个油田区块的本源微生物组成结构进行了深入研究, 分离了100多株采油功能菌, 提出循环激活本源微生物驱油方法, 研制的高盐采油污水微生物处理技术达到国家一级排放标准得到工业化应用, 研究的本源菌和生物技术产品在油田应用取得巨大经济效应。在Applied Microbiology & Biotechnology, RSC Advances, Scientific Reports, Energy & Fuels, 《微生物学报》, 《生态学报》等刊物发表相关研究论文100余篇, 作以项目负责人获得省部级科技成果奖励12项.
*通信作者:佘跃惠。Tel:+86-27-69111069;E-mail:sheyuehui@163.com.
摘要:铁还原菌是指能够利用细胞外Fe(Ⅲ)作为末端电子受体,通过氧化有机物将Fe(Ⅲ)还原为Fe(Ⅱ)微生物的总称。铁还原作用广泛存在于土壤、河流、海洋、地表含水层以及高温高压的地下深部油藏。在厌氧或兼性厌氧条件下,Fe(Ⅲ)还原耦合有机物的降解,对铁、碳元素的生物地球化学循环具有重要意义。本文介绍了铁还原菌的多样性和铁还原作用机理,综述了铁还原菌在石油烃降解方面的研究进展。此外,还总结了铁还原菌在生物修复中的潜在作用,并对未来的研究方向进行了展望。
关键词:铁还原菌多样性石油烃降解铁还原作用机理厌氧氧化生物修复
Degradation of petroleum hydrocarbons by using iron-reducing bacteria
Han Zhang1, Shanshan Sun2, Hao Dong2, Lei Cheng3, Yuehui She2


1. College of Chemistry and Environmental Engineering, Yangtze University, Jingzhou 434023, Hubei Province, China;
2. College of Petroleum Engineering, Yangtze University, Wuhan 430100, Hubei Province, China;
3. Biogas Institute of Ministry of Agriculture, Chengdu 610000, Sichuan Province, China
Received: 28 November 2019; Revised: 17 January 2020; Published online: 29 February 2020
*Corresponding author: Yuehui She, Tel: +86-27-69111069; E-mail:sheyuehui@163.com.
Foundation item: Supported by the National Science and Technology Major Project (2017ZX05009-004) and by the National Natural Science Foundation of China (51634008, 51574038)
Abstract: Iron-reducing bacteria can reduce Fe(Ⅲ) to Fe(Ⅱ) by using the extracellular Fe(Ⅲ) as a terminal electron acceptor and oxidizing organic compounds. The iron reduction widely occurs in soils, rivers, oceans, surface aquifers, and deep petroleum reservoirs at high temperatures and pressures. Anaerobic degradation of organic compounds coupled with Fe(Ⅲ)-reduction is of great importance to the biogeochemical cycle of iron and carbon. This paper examines a variety of iron-reducing bacteria and their mechanisms. It also summarizes the research and development (R & D) progresses of using iron-reducing bacteria in degradation of petroleum hydrocarbons. In addition, the potential role of iron-reducing bacteria in bioremediation is also discussed. Finally, some future studies of iron-reducing bacteria are recommended.
Keywords: iron-reducing bacteriapetroleum hydrocarbons degradationworking mechanism of iron reducing bacteriaanaerobic degradationbioremediation
铁是地球上第二大氧化还原活性金属,存在于两种氧化状态:二价铁氧化物和三价铁氧化物[1]。在中性pH下,Fe(Ⅱ)迅速氧化成Fe(Ⅲ),形成Fe(Ⅲ)固相矿物,如针铁矿、赤铁矿或磁铁矿[2]。相反,Fe(Ⅲ)还原为Fe(Ⅱ)的速度较慢,主要发生在厌氧环境中。此前,Fe(Ⅲ)还原一直被认为是非生物原因造成的,直到19世纪发现能够酶促还原Fe(Ⅲ)的微生物,才开启了人们对铁还原菌系统的研究[3]。在铁、碳、氮、硫和磷酸盐的生物地球化学循环过程中,这些微生物通过金属还原在矿物形成以及有机物的降解中起主要作用[4-6]。在缺氧的条件下,微生物能够还原晶态和非晶态的Fe(Ⅲ)氧化物,铁还原作用可追溯到前寒武纪时代,用来解释带状铁形成。
石油产品是工业和日常生活的主要能源。但在其勘探、开发、运输、储存和精炼过程中经常发生泄漏。天然原油渗漏量每年约120万t[7],泄露到环境的石油烃是造成水和土壤污染的主要原因。这些污染物在动植物中的积累可能导致其死亡或突变[8]。常用于石油烃修复的物理和化学方法效果有限,而且费用昂贵。生物修复是处理这些石油烃污染物的一种有前景的新技术。因为它具有成本低和效益高,并将导致完全矿化,且无二次污染的优点。
铁还原菌能够在厌氧环境下降解芳香烃、甲烷等烃类物质,有效减少石油烃泄漏造成的环境污染,抑制甲烷气体排放,减缓温室效应,这对于石油烃的生物修复具有重大意义。本文对石油烃生物修复中的铁还原菌修复研究展开综述。
1 铁还原细菌的多样性 具有Fe(Ⅲ)还原功能的微生物广泛存在于细菌和古细菌域。铁还原菌古大多属于嗜铁菌属,而铁还原细菌则属于不同的细菌类群[5]。20世纪初Fe(Ⅲ)还原就已被认知,但是直到1987年第一个具有Fe(Ⅲ)还原活性的金属还原地杆菌被分离出来后,这个微生物群才被人们详细了解[9]。迄今为止,已经在细菌域的9个门、15个纲、27个目、37个科、65个属及古细菌域的2个门、5个纲、7个目、7个科、10个属中发现有异化铁还原微生物的分布[7]。目前研究最深入的铁还原菌是Geobacter和Shewanella。图 1显示了在不同分类群下的各种铁还原菌,其中属于古菌的铁还原菌主要在极端环境下生长。这些微生物能够通过Fe(Ⅲ)的异化还原来获得能量生长,且能突破一系列化学和物理条件的限制[2]。
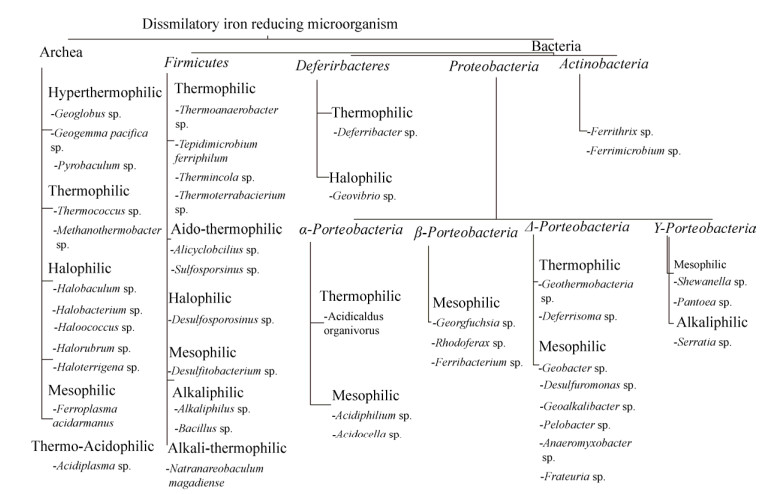 |
| 图 1 异化铁还原微生物的分类[5] Figure 1 Classification of dissimilated iron-reducing microorganisms[5] |
| 图选项 |
现已从多种环境中分离鉴定了各种Fe(Ⅲ)还原微生物[10]。它们对各种生态系统的金属元素和碳循环扮演着至关重要的角色。例如,在沉积物中目前发现的有土球菌、厌氧粘杆菌、梭菌属、脱硫单胞菌、铁杆菌地弧菌属、红育菌属、希瓦氏菌属和地杆菌属[11]。除已鉴定的还原Fe(Ⅲ)的发酵微生物外,一些硫酸盐还原菌和产甲烷菌[12]也能够还原Fe(Ⅲ)。这些微生物群落之间争夺可用的电子供体已被认为是抑制沉积环境中硫酸盐还原和甲烷生成的原因之一[13]。在油藏环境中直到1987年才分离出第一株具有异化铁还原活性的希瓦氏菌[14]。除此之外,大陆深部地层、大陆热泉环境、浅海热液环境以及深海热液环境中都发现了嗜热异化铁还原菌。在胡安德富卡洋中脊热液喷口发现的生命耐温极限菌株T121和东太平洋ELSC热液喷口培养的专性嗜热嗜酸性古菌T469是其中两株比较新奇的异化铁还原菌[15]。它们的生物膜和Fe(Ⅲ)氧化物之间的密切联系,不但拓展了我们对极端环境中异化铁还原微生物的理解,还暗示古老的热液岩石记录中可能保存着生命痕迹。
2 铁还原菌还原机制 一般电子受体(如硝酸盐、硫酸盐)在自然界中是可溶的,而Fe(Ⅲ)在土壤和沉积物中多以不溶性Fe(Ⅲ)氧化物形式存在。可溶性铁能够进入铁还原菌细胞内进行铁还原,但不溶性铁则需要借助于特定的蛋白把电子传递给铁氧化物。目前的研究表明不同种属的铁还原菌有不同的电子传递机制[16],可归纳以下四种(图 2),分别为直接接触机制、螯合机制、间接电子转移机制及纳米导线辅助机制。
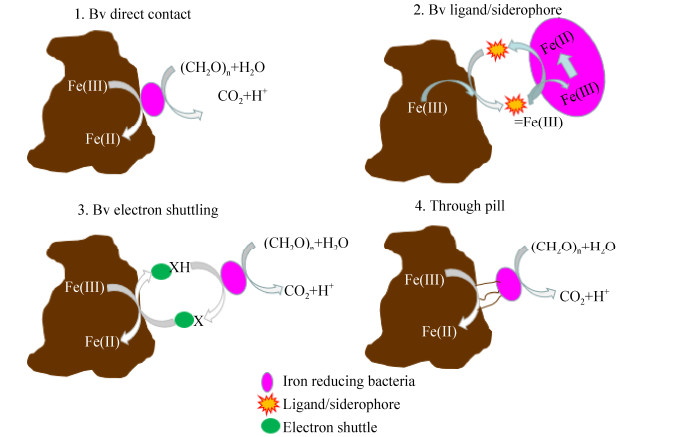 |
| 图 2 异化铁还原菌固相电子转移机制[5] Figure 2 Solid phase electron transfer mechanism of dissimilated iron reducing bacteria[5] |
| 图选项 |
2.1 直接接触机制 即通过细胞外膜蛋白,如Geobacter sulfurreducens外膜的c-型细胞色素(Omcs)将电子直接转移给铁氧化物,从而还原Fe(Ⅲ)。Geobacter大部分通过直接接触来还原不溶性铁氧化物[17]。在这个过程中,微生物通过趋化性接近铁氧化物,然后粘附到三价铁氧化物表面进行铁还原。
2.2 螯合机制 Fe((Ⅲ)氧化物与溶铁螯合剂,如NTA (氮三乙酸)或EDTA(乙二胺四乙酸)形成可溶性复合体,通过扩散作用被输送到微生物表面,细胞外膜的还原酶传递电子给螯合铁,进而使Fe(Ⅲ)氧化物被还原。
2.3 间接电子转移机制 间接电子转移又称“电子穿梭机制”,即铁还原菌将氧化型电子穿梭体还原,还原型电子穿梭体再把电子从细胞表面穿梭到不溶性三价铁氧化物内部[18],自身重新形成氧化型电子穿梭体。这种转移机制通常发生在Shewanella菌和Geothrix菌铁还原过程中。电子穿梭体可以是像腐殖质和硫化合物一样的外源物质,也可以是生物体本身分泌的内源性电子穿梭物。其中Shewanella可以产生内源性电子穿梭分子,如核黄素和黄素单核苷酸(FMN)[19]。
2.4 纳米导线辅助机制 纳米导线辅助机制指一定条件下某些铁还原菌会形成类似菌毛的导电附属体,其作为电子导管可远距离向Fe(Ⅲ)氧化物传递电子,从而避免了细胞表面与电子受体的直接接触[20]。目前发现在地杆菌、奥奈达希瓦式菌、光合蓝绿菌和喜温发酵菌在一定条件下都可以产生纳米导线。
3 铁还原菌对石油烃的降解 石油烃的生物降解是一个复杂的过程,取决于烃的性质和存在的碳氢化合物的量。长期以来,人们普遍认为石油烃的降解只有在氧气存在的条件下发生。但最近研究发现,存在生物降解的油藏、油污染的地下蓄水层等环境,石油烃的厌氧生物降解过程占主导地位,其中铁还原菌在此过程中发挥重大作用。2018年,苏三宝等[21]对不同油藏环境中的铁还原菌生物多样性进行分析,结果发现在青海油田分布的铁还原菌主要有梭菌、脱硫弧菌、希瓦氏菌、假单胞菌和热袍菌,在胜利油田为梭菌、嗜热厌杆菌、热袍菌、脱铁杆菌,在中海油天津为梭菌、芽孢杆菌和弧菌,这些都是典型的铁还原微生物。目前微生物降解石油烃存在两种方法[8]:(1)生物增强,即添加已知的石油降解细菌以补充现有的微生物种群;(2)生物刺激,即通过添加营养物或其他限制生长的辅基来刺激本源石油降解菌的生长。1987年Semple等[14]第一次在油田中发现嗜温铁还原细菌Shewanella putrefaciens,为革兰氏阴性杆菌兼性厌氧,能以Fe3+为电子受体,菌株表现出一定的耐高盐和耐低温特性,能够在7.5% NaCl以及4℃条件下生长良好。
3.1 石油烃的微生物降解特性 石油烃可分为饱和烃、芳香烃、沥青质、酚类、脂肪酸、酮类、酯类、卟啉类和树脂吡啶类、喹啉类、咔唑类、亚砜类和酰胺类[22]。Cooney等[23]曾报道了影响烃降解的不同因素,限制石油烃降解的重要因素之一是微生物对他们利用率有限。因为石油碳氢化合物与土壤组分结合,难以被去除或降解[24]。另外烃类自身结构对其降解的难易影响最大。微生物降解石油烃的难易顺序如下:直链烷烃>支链烷烃>小芳烃>环烷烃[25]。一些化合物如高分子量多环芳烃,很难被微生物降解[26]。
目前在厌氧环境中常见的电子受体如NO3–、Fe3+、SO42–等存在的条件下已有多个具有厌氧烃降解能力的富集培养和纯培养物[27]。本文主要综述了铁还原菌对石油烃中的饱和烃及芳香烃降解的研究进展。
3.2 铁还原菌对甲烷的降解 甲烷(CH4)是地球大气中一种强效温室气体,其全球变暖潜能值是二氧化碳(CO2)的28–34倍。抑制甲烷气体的产生与排放对于减轻温室效应具有重要意义。近年来,已证明在环境样品和富集培养物中均会发生金属驱动的甲烷厌氧氧化,甲烷厌氧氧化(Anaerobic oxidation of methane, AOM)被认为是海洋沉积物、淡水和湿地中甲烷氧化的重要途径之一[28]。
3.2.1 甲烷的厌氧氧化: 甲烷的厌氧氧化是一种微生物代谢作用,不管是在海洋环境还是在陆域环境,当沉积物呈现缺氧状态的时候,微生物会利用不同的电子受体进行氧化还原作用,例如硝酸根、亚硝酸根、硫酸根、金属离子、腐植酸等,在甲烷厌氧氧化的过程中,微生物会将甲烷氧化为二氧化碳,而电子受体则进行还原作用,借此过程产生能量,以维持自身生命所需[29]。AOM消耗了海洋沉积物中甲烷总量的90%以上,有效地控制了海洋中的甲烷排放,是全球碳循环的重要组成部分[30-31]。
3.2.2 铁驱动的甲烷厌氧氧化:: 地球化学研究表明,依赖于Fe(Ⅲ)的AOM可能是海洋和淡水环境中的一种普遍过程,其中大量的铁氧化物分布在整个沉积物中。对富含甲烷的厌氧环境中的沉积物进行的孵化研究表明,添加Fe(Ⅲ)氧化物可以增强微生物AOM活性[32]。
其实早在1980年,Zehnder和Brock [33]就推测铁和锰的还原可能与AOM有关。但AOM与高活性锰和铁相(例如水铁矿)的还原相结合这一过程近年才在实验室得到证明[34]。厌氧甲烷氧化菌能够利用Fe(Ⅲ)或Mn(Ⅳ)进行呼吸[35],与水铁矿相结合的AOM [简化为Fe(OH)3]在原位条件下产生?G=–270.3kJ/mol的潜在自由能。其氧化还原途径如公式(1)所示[33]。
 | 公式(1) |
尽管铁还原现象在许多环境中很重要,但与硫酸盐依赖的AOM相比,铁驱动的AOM可能不会消耗相似量的甲烷。但是,它可能对深层生物圈产生广泛影响,并在硫酸盐贫瘠的海洋环境中主导铁和甲烷循环。
3.3 铁还原菌对芳香烃的降解 芳香烃包括许多环境污染物,其去除往往依赖于微生物降解。目前在硝酸盐还原、Fe(Ⅲ)还原、硫酸盐还原和产甲烷条件下都观察到了单环芳烃(苯、甲苯、乙苯和二甲苯)或多环芳烃(萘、蒽、菲、芘)等芳香化合物的微生物降解[42]。根据欧洲环境机构地下水有机污染物数据显示,多环芳烃中的萘和2-甲基萘是最常见的30种新污染物[43]。虽然本源微生物群落能够降解这些化合物,但由于它们的低水溶性、芳香环的化学稳定性以及对沉积物的吸附使多环芳烃难以被微生物利用。另外沉积物和地下水中氧气的溶解度较低,在被碳氢化合物污染后好氧细菌迅速去除氧气。因此,多环芳烃的厌氧利用是沉积物和受污染含水层中普遍存在的过程。多环芳烃的厌氧生物降解可与硫酸盐还原、铁还原过程耦合。芳香烃降解与铁还原耦合氧化还原途径如公式(2)所示[44]。
 | 公式(2) |
添加铁螯合剂可以增加铁还原菌对芳香烃的降解。Lovley小组[51]曾详细地研究了在铁还原条件下的苯的降解,发现通过添加Fe(Ⅲ)鳌合剂(例如腈三乙酸)可以增强其效应。不溶性的Fe(Ⅲ)氧化物被硝基三乙酸溶解,使它们更容易被Fe(Ⅲ))还原微生物利用,从而增强苯的降解[52]。其他铁螯合剂[29]如EDTA、乙醇二甘氨酸、磷酸盐和腐殖酸,也能刺激苯的氧化,其中腐殖质的增强程度最大,因为腐殖质可以作为中间产物转移和接收电子受体且能发生多次循环,即使在腐殖酸浓度较低的情况下,铁的还原也可能发生。
现已从环境中分离出了多种降解多环芳烃的单菌。2009年,Weelink等[46]从受污染的含水层中分离出一种细菌(菌株G5G6),该细菌使用Fe(Ⅲ)、Mn(Ⅳ)和硝酸盐作为末端电子受体降解芳族化合物生长。G5G6菌株是第一株不属于地杆菌科的甲苯降解铁还原菌。菌株G5G6具有编码Bss亚单位的苄基琥珀酸合酶A(BssA)基因,其催化厌氧甲苯降解的第一步。2010年,Kunapuli等[53]分离了两株可以降解芳香烃的铁还原菌纯培养物,菌株TMJ1(T)属于Deltaproteobacteria的地杆菌属,菌株UKTL(T)属于梭菌属脱硫菌。这两种菌株都利用多种底物作为碳源,包括芳香族化合物甲苯、苯酚和对甲酚。2011年,Holmes等[54]利用纯培养物,研究了与Fe(Ⅲ)还原偶联的厌氧苯氧化。结果发现,在纯培养中嗜热性Ferroglobus placidus是唯一的将苯降解与铁还原相结合的古菌,这是第一次证明纯培养的微生物可以在严格厌氧条件下降解苯生长,并且有强有力的证据表明通过明确的厌氧代谢途径降解苯,从而为进一步研究微生物对苯的厌氧降解活性提供了一个急需的纯培养模型。目前已报道了多种利用三价铁作为电子受体来降解石油烃的微生物,部分总结如表 1所示。
表 1. 目前已报道的降解石油烃的微生物 Table 1. Microorganisms that have been reported to degrade petroleum hydrocarbons
| Source of bacteria | Electron acceptor | Main iron reducing functional bacteria | Metabolic substrate | Reference |
| Lovley group enrichment | Fe(Ⅲ) | Geobacter metallireducens (pure culture) | Phenol | [57] |
| Lovley group enrichment | Fe(Ⅲ) | Geobacter metallireducens GS-15 | Methylbenzene | [48] |
| Landfills (Netherlands) | Fe(Ⅲ) | Geobacteraceae | Phenol and benzoic acid | [58] |
| Gas field/Poland | Fe(Ⅲ) | Peptococcaceae, Desulfobulbaceae, Actinobacteria | Benzene, Phenol, benzoic acid | [59] |
| DSMZ strain | Fe(Ⅲ) | Ferroglobus placidus | Benzoate/ester | [54] |
| Chemostat | NO3–, SO42–, Fe(Ⅲ) | Peptococcaceae, Rhodocyclaceae | Benzene | [60] |
| Oil well sediment | Fe(Ⅲ) | Deltaproteobacteria Geobacter strain TMJ1T | Methylbenzene, Phenol | [53] |
| Freshwater aquatic sediment | Fe(Ⅲ) | Geobacter grbiciae, TACP-2T | Methylbenzene | [61] |
| Polluted aquifer | Fe(Ⅲ), Mn(Ⅳ) | Betaproteobacteria (strain G5G6) | Methylbenzene | [46] |
| Oil contaminated aquifers | Fe(Ⅲ), AQDS | Geobacter strain Ben (pure culture) | Benzene | [56] |
| Soil of the original coal gasification field | Fe(Ⅲ) | Clostridia Desulfitobacterium strain UKTLT | Methylbenzene, Phenol, p-cresol | [53] |
表选项
在实际应用中,含有烷烃、环烷烃和多环芳烃等的石油污染物的生物降解通常需要具有广泛代谢机制的多样性种群。因此,多种微生物混合系统在降解复杂化合物方面更有效[43]。如2016年,由Dhote等[55]从油罐底部油泥中分离出的四种不同菌株组成的细菌联合体达到了比所有单独菌株更高的总石油烃(75%)降解效率。2018年,Kumari等[56]的研究表明与单个菌株相比五个选定的细菌菌株的混合物在原油中降解萘、芴、菲和苯的降解效率明显提高。
4 铁还原菌降解石油烃的生态意义 4.1 促进有害污染物的降解,减少环境污染 微生物铁还原是一种广泛存在于淡水沉积物中的基本生物地球化学过程。它被认为是碳、氮、硫和磷循环中的关键介体[62]。此外,铁还原过程对石油烃的降解起重要作用,能有效地减少石油烃对环境的污染[57, 63]。例如,Tahara等[64]发现的一种革兰氏阴性菌Burkholderia cepacia G4能够有效地共代谢降解三氯乙烯。Michael等[65]发现铁还原菌Geobacter metallireducens不仅可以发生铁还原作用同时可以促进对四氯甲烷的脱氯作用。李晓敏等[66]利用脱色希瓦氏菌(Shewanelladecolorationis S12)添加针铁矿对三氯甲烷进行降解发现,铁还原菌与针铁矿体系中所形成的活性界面具有还原难降解毒性有机物的作用。
4.2 抑制甲烷气体排放,减少温室效应 在有机物降解中,Fe(Ⅲ)氧化物作为厌氧环境中重要的电子受体,比CO2更易于被还原,从而抑制CO2转化为甲烷,减少甲烷的排放[37]。Piepenbroc等[67]通过研究证明铁还原菌将Fe(Ⅲ)氧化物还原为Fe(Ⅱ)氧化物可与碳酸盐可形成化学性质稳定的菱铁矿,从而达到固定CO2、缓解温室效应的目的。除了抑制甲烷的产生,在厌氧环境中,铁还原作用与AOM相耦合,还能够促进甲烷的氧化降解,从而减少环境中甲烷排放量。在海洋沉积物环境所生成的甲烷,大约80%会在从沉积物向上扩散到海床的过程中被氧化,而在陆域环境中,天然湿地是温室气体甲烷的最大排放来源,每年向大气中排放110 Tg的甲烷,占全球甲烷排放总量的15%–30%[68]。甲烷产生作用和厌氧甲烷氧化作用之间的消长对于全球甲烷排放量影响重大,身为现今重要温室气体的甲烷而言,其温室效应的能力为二氧化碳的26倍,厌氧甲烷氧化作用提供了消耗甲烷的渠道,减少甲烷排放到大气中,对减缓温室效应所造成的气候变暖具有重要意义。
4.3 重金属和放射性核素固定 铁还原菌可用于有毒金属化合物的生物修复[63]。研究表明,铁还原菌在厌氧环境下不仅可以利用Fe(Ⅲ),还可以把很多重金属以及放射性元素当作电子受体还原,使之变为还原态降低毒性或与基团形成沉淀,这是地下沉积层中重金属污染修复的重要生物途径。例如,Hoden等[69]利用Mn(Ⅳ)作为嗜铁还原菌的电子受体,分离得到嗜热芽孢杆菌和嗜热杆菌纯培养物。该培养物可以将Mn(Ⅳ)氧化物还原产物为(MnCO3)[70]。毛晖等[63]通过实验证明了微生物Fe(Ⅲ)还原过程能使铬矿渣中的Cr(Ⅵ)完全被还原为Cr(Ⅲ),使其毒性降低。Fe(Ⅲ)还原的微量金属包括放射性金属铀[71]和氚[72]的氧化物,以及其他痕量金属和类金属,如铬,砷和硒[73]。
本项目组对国内十多个油气藏中的铁还原菌多样性进行了初步研究,从中筛选分离了10株典型铁还原菌如Clostridium swellfunianum、Shewanella algae、Shewanella chilikensis、Tessaracoccus lapidicaptus等。初步评价表明,油藏中铁还原菌在厌氧下对石油烃具有明显降解效果,目前正在进行油藏高温高压下的模拟试验。
5 结论和展望 目前石油烃污染的生物修复已从多方面逐步展开。现已在细菌和古菌中分离鉴定了多种烃降解铁还原菌,这些铁还原菌广泛地分布在油藏等沉积环境中。另外,铁还原菌的还原机理也已得到基本阐明,以不同石油烃为底物的代谢途径也有了较为深入的研究。分子生物学技术的发展为石油烃的生物修复提供了技术支持。然而,目前的报道主要集中在短链烷烃及低分子量芳烃的降解,如苯、萘、芴、蒽、菲等,对于长链及大分子的石油烃的生物降解还需进一步研究。
由于铁还原菌种类丰富,代谢类型多样,因此目前尚未得到通用的功能基因。这极大地阻碍了其在生态系统原位的研究。另外,目前大部分关于铁还原菌降解石油烃的研究都停留在基础方面,如果可以利用已获得的异化铁还原细菌的全基因组序列,将这些已知的遗传信息与相应的基因组水平的生理特性研究相结合,将有效地拓宽人们对这类微生物的认识,并且可以帮助我们预测不同环境条件下异化铁还原菌的代谢途径。同时,利用生物信息学技术将多种铁还原菌的基因组信息进行整合,有助于合成高效铁还原菌富集物,增加其现场利用效果,这对于石油烃污染的修复以及金属的回收具有重要意义。此外,大规模的研究,例如大型生物反应器或堆中的研究,也可以使用这种新的分子生物技术进行,从而为分子生物技术领域打开新的大门。我们相信,分子生物学技术在今后几年将在各种工业或危险废物处理领域发挥越来越重要的作用。
另外,铁还原菌纳米导线的可调节导电性能,特别是易接受电子受体的Shewanella菌株的导电能力,为铁还原菌纳米线在生物电子学领域生产廉价生物半导体开辟了新的途径,但对铁还原菌纳米线的大规模生产、纳米尺度集成等方面还需要进一步的研究。
References
| [1] | Lovley DR, Stolz JF, Nord GL Jr, Phillips EJP. Anaerobic production of magnetite by a dissimilatory iron-reducing microorganism. Nature, 1987, 330(6145): 252-254. DOI:10.1038/330252a0 |
| [2] | Weber KA, Achenbach LA, Coates JD. Microorganisms pumping iron:anaerobic microbial iron oxidation and reduction. Nature Reviews Microbiology, 2006, 4(10): 752-764. DOI:10.1038/nrmicro1490 |
| [3] | Lovley DR. Dissimilatory Fe(Ⅲ) and Mn(Ⅳ) reduction. Microbiological Reviews, 1991, 55(2): 259-287. DOI:10.1128/MMBR.55.2.259-287.1991 |
| [4] | Liu YF, Sun XM, Lu Y, Strauss H, Xu L, Chen TT, Lu HF, Peckmann J. Iron isotope constraints on diagenetic iron cycling in the Taixinan seepage area, South China Sea. Journal of Asian Earth Sciences, 2018, 168: 112-124. DOI:10.1016/j.jseaes.2018.01.007 |
| [5] | Esther J, Sukla LB, Pradhan N, Panda S. Fe(Ⅲ) reduction strategies of dissimilatory iron reducing bacteria. Korean Journal of Chemical Engineering, 2014, 32(1): 1-14. |
| [6] | Adhikari D, Zhao Q, Das K, Mejia J, Huang RX, Wang XL, Poulson SR, Tang YZ, Roden EE, Yang Y. Dynamics of ferrihydrite-bound organic carbon during microbial Fe reduction. Geochimica et Cosmochimica Acta, 2017, 212: 221-233. DOI:10.1016/j.gca.2017.06.017 |
| [7] | Lee AK, Newman DK. Microbial iron respiration:impacts on corrosion processes. Applied Microbiology and Biotechnology, 2003, 62(2/3): 134-139. |
| [8] | Das N, Chandran P. Microbial degradation of petroleum hydrocarbon contaminants:an overview. Biotechnology Research International, 2011, 2011: 941810. |
| [9] | Lovley DR, Phillips EJP. Novel mode of microbial energy metabolism:organic carbon oxidation coupled to dissimilatory reduction of iron or manganese. Applied and Environmental Microbiology, 1988, 54(6): 1472-1480. DOI:10.1128/AEM.54.6.1472-1480.1988 |
| [10] | Lenstra WK, Egger M, van Helmond NAGM, Kritzberg E, Conley DJ, Slomp C P. Large variations in iron input to an oligotrophic Baltic Sea estuary:impact on sedimentary phosphorus burial. Biogeosciences, 2018, 15(22): 6979-6996. DOI:10.5194/bg-15-6979-2018 |
| [11] | Holmes DE, Chaudhuri SK, Nevin KP, Mehta T, Methé BA, Liu A, Ward JE, Woodard TL, Webster J, Lovley DR. Microarray and genetic analysis of electron transfer to electrodes in Geobacter sulfurreducens. Environmental Microbiology, 2006, 8(10): 1805-1815. DOI:10.1111/j.1462-2920.2006.01065.x |
| [12] | Bond DR, Lovley DR. Reduction of Fe(Ⅲ) oxide by methanogens in the presence and absence of extracellular quinones. Environmental Microbiology, 2002, 4(2): 115-124. DOI:10.1046/j.1462-2920.2002.00279.x |
| [13] | Lovley DR, Phillips EJP. Competitive mechanisms for inhibition of sulfate reduction and methane production in the zone of ferric iron reduction in sediments. Applied and Environmental Microbiology, 1987, 53(11): 2636-2641. DOI:10.1128/AEM.53.11.2636-2641.1987 |
| [14] | Semple KM, Westlake DWS. Characterization of iron-reducing Alteromonas putrefaciens strains from oil field fluids. Canadian Journal of Microbiology, 1987, 33(5): 366-371. DOI:10.1139/m87-064 |
| [15] | Kashefi K, Lovley DR. Extending the Upper Temperature Limit for Life. Science, 2003, 301(5635): 934. DOI:10.1126/science.1086823 |
| [16] | Weng X, She YH, Wang ZC. Progress of Fe(Ⅲ)-reducing microorganisms in petroleum reservoirs. Microbiology China, 2019, 46(3): 645-653. (in Chinese) 翁雪, 佘跃惠, 王子琛. 油藏铁还原微生物的研究进展. 微生物学通报, 2019, 46(3): 645-653. |
| [17] | Nevin KP, Lovley DR. Lack of production of electron-shuttling compounds or solubilization of Fe(Ⅲ) during reduction of insoluble Fe(Ⅲ) oxide by Geobacter metallireducens. Applied and Environmental Microbiology, 2000, 66(5): 2248-2251. DOI:10.1128/AEM.66.5.2248-2251.2000 |
| [18] | Gralnick JA, Newman DK. Extracellular respiration. Molecular Microbiology, 2007, 65(1): 1-11. DOI:10.1111/j.1365-2958.2007.05778.x |
| [19] | Von Canstein H, Ogawa J, Shimizu S, Lloyd JR. Secretion of flavins by Shewanella species and their role in extracellular electron transfer. Applied and Environmental Microbiology, 2008, 74(3): 615-623. |
| [20] | Reguera G, McCarthy KD, Mehta T, Nicoll JS, Tuominen MT, Lovley DR. Extracellular electron transfer via microbial nanowires. Nature, 2005, 435(7045): 1098-1101. DOI:10.1038/nature03661 |
| [21] | Su SB, Zhang F, Yu GM, Gu YA, She YH. The biological diversity of dissimilated iron reducing bacteria in oil reservoirs. Science Technology and Engineering, 2018, 18(30): 30-34. (in Chinese) 苏三宝, 张凡, 喻高明, 顾永安, 佘跃惠. 油藏环境异化铁还原菌的生物多样性. 科学技术与工程, 2018, 18(30): 30-34. DOI:10.3969/j.issn.1671-1815.2018.30.005 |
| [22] | Colwell RR, Walker JD, Cooney JJ. Ecological aspects of microbial degradation of petroleum in the marine environment. CRC Critical Reviews in Microbiology, 1977, 5(4): 423-445. DOI:10.3109/10408417709102813 |
| [23] | Cooney JJ, Silver SA, Beck EA. Factors influencing hydrocarbon degradation in three freshwater lakes. Microbial Ecology, 1985, 11(2): 127-137. DOI:10.1007/BF02010485 |
| [24] | Barathi S, Vasudevan N. Utilization of petroleum hydrocarbons by Pseudomonas fluorescens isolated from a petroleum-contaminated soil. Environment International, 2001, 26(5/6): 413-416. |
| [25] | Kumar R, Das AJ, Lal S. Petroleum hydrocarbon stress management in soil using microorganisms and their products//Chandra R. Environmental Waste Management. Boca Raton: Taylor and Francis, CRC Press, 2015. |
| [26] | Atlas R, Bragg J. Bioremediation of marine oil spills:when and when not-the Exxon Valdez experience. Microbial Biotechnology, 2009, 2(2): 213-221. |
| [27] | Zengler K, Richnow HH, Rosselló-Mora R, Michaelis W, Widdel F. Methane formation from long-chain alkanes by anaerobic microorganisms. Nature, 1999, 401(6750): 266-269. DOI:10.1038/45777 |
| [28] | Cai C, Leu AO, Xie GJ, Guo JH, Feng YX, Zhao JX, Tyson GW, Yuan ZG, Hu SH. A methanotrophic archaeon couples anaerobic oxidation of methane to Fe(Ⅲ) reduction. The ISME Journal, 2018, 12(8): 1929-1939. DOI:10.1038/s41396-018-0109-x |
| [29] | Valenzuela EI, Avenda?o KA, Balagurusamy N, Arriaga S, Nieto-Delgado C, Thalasso F, Cervantes FJ. Electron shuttling mediated by humic substances fuels anaerobic methane oxidation and carbon burial in wetland sediments. Science of The Total Environment, 2019, 650: 2674-2684. DOI:10.1016/j.scitotenv.2018.09.388 |
| [30] | Knittel K, Boetius A. Anaerobic oxidation of methane:progress with an unknown process. Annual Review of Microbiology, 2009, 63(1): 311-334. DOI:10.1146/annurev.micro.61.080706.093130 |
| [31] | Schout G, Hartog N, Hassanizadeh SM, Griffioen J. Impact of an historic underground gas well blowout on the current methane chemistry in a shallow groundwater system. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(2): 296-301. DOI:10.1073/pnas.1711472115 |
| [32] | Sivan O, Antler G, Turchyn AV, Marlow JJ, Orphan VJ. Iron oxides stimulate sulfate-driven anaerobic methane oxidation in seeps. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(40): E4139-E4147. DOI:10.1073/pnas.1412269111 |
| [33] | Zehnder AJB, Brock TD. Anaerobic methane oxidation:occurrence and ecology. Applied and Environmental Microbiology, 1980, 39(1): 194-204. |
| [34] | Beal EJ, House CH, Orphan VJ. Manganese- and iron-dependent marine methane oxidation. Science, 2009, 325(5937): 184-187. DOI:10.1126/science.1169984 |
| [35] | He ZF, Zhang QY, Feng YD, Luo HW, Pan XL, Gadd GM. Microbiological and environmental significance of metal-dependent anaerobic oxidation of methane. Science of The Total Environment, 2018, 610-611: 759-768. DOI:10.1016/j.scitotenv.2017.08.140 |
| [36] | Riedinger N, Formolo MJ, Lyons TW, Henkel S, Beck A, Kasten S. An inorganic geochemical argument for coupled anaerobic oxidation of methane and iron reduction in marine sediments. Geobiology, 2014, 12(2): 172-181. DOI:10.1111/gbi.12077 |
| [37] | Qu D, Ratering S, Schnell S. Microbial reduction of weakly crystalline iron (Ⅲ) oxides and suppression of methanogenesis in paddy soil. Bulletin of Environmental Contamination and Toxicology, 2004, 72(6): 1172-1181. |
| [38] | Sivan O, Adler M, Pearson A, Gelman F, Bar-Or I, John SG, Eckert W. Geochemical evidence for iron-mediated anaerobic oxidation of methane. Limnology and Oceanography, 2011, 56(4): 1536-1544. DOI:10.4319/lo.2011.56.4.1536 |
| [39] | Caldwell SL, Laidler JR, Brewer EA, Eberly JO, Sandborgh SC, Colwell FS. Anaerobic oxidation of methane:mechanisms, bioenergetics, and the ecology of associated microorganisms. Environmental Science & Technology, 2008, 42(18): 6791-6799. |
| [40] | Scheller S, Yu H, Chadwick GL, McGlynn SE, Orphan VJ. Artificial electron acceptors decouple archaeal methane oxidation from sulfate reduction. Science, 2016, 351(6274): 703-707. DOI:10.1126/science.aad7154 |
| [41] | Fu L, Li SW, Ding ZW, Ding J, Lu YZ, Zeng RJ. Iron reduction in the DAMO/Shewanella oneidensis MR-1 coculture system and the fate of Fe(Ⅱ). Water Research, 2016, 88: 808-815. DOI:10.1016/j.watres.2015.11.011 |
| [42] | Zhuang L, Tang ZY, Ma JL, Yu Z, Wang YQ, Tang J. Enhanced anaerobic biodegradation of benzoate under sulfate-reducing conditions with conductive iron-oxides in sediment of Pearl River Estuary. Frontiers in Microbiology, 2019, 10: 374. DOI:10.3389/fmicb.2019.00374 |
| [43] | Mikesková H, Novotny ?, Svobodová K. Interspecific interactions in mixed microbial cultures in a biodegradation perspective. Applied Microbiology and Biotechnology, 2012, 95(4): 861-870. DOI:10.1007/s00253-012-4234-6 |
| [44] | Vogt C, Kleinsteuber S, Richnow HH. Anaerobic benzene degradation by bacteria. Microbial Biotechnology, 2011, 4(6): 710-724. DOI:10.1111/j.1751-7915.2011.00260.x |
| [45] | Qin SS, Zhu MX, Yang GP, Wang D. Atypical diagenesis of sulfur and iron in sediments of the river-dominated Bohai Sea (China). Journal of Marine Systems, 2019, 189: 116-126. DOI:10.1016/j.jmarsys.2018.10.004 |
| [46] | Weelink SAB, Van Doesburg W, Saia FT, Rijpstra WIC, R?ling WFM, Smidt H, Stams AJM. A strictly anaerobic betaproteobacterium Georgfuchsia toluolica gen. nov., sp. nov. degrades aromatic compounds with Fe(Ⅲ), Mn(Ⅳ) or nitrate as an electron acceptor. FEMS Microbiology Ecology, 2009, 70(3): 575-585. DOI:10.1111/j.1574-6941.2009.00778.x |
| [47] | Prakash O, Gihring TM, Dalton DD, Chin KJ, Green SJ, Akob DM, Wanger G, Kostka JE. Geobacter daltonii sp. nov., an Fe(Ⅲ)- and uranium(Ⅵ)-reducing bacterium isolated from a shallow subsurface exposed to mixed heavy metal and hydrocarbon contamination. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(3): 546-553. DOI:10.1099/ijs.0.010843-0 |
| [48] | Lovley DR, Lonergan DJ. Anaerobic oxidation of toluene, phenol, and p-cresol by the dissimilatory iron-reducing organism, GS-15. Applied and Environmental Microbiology, 1990, 56(6): 1858-1864. DOI:10.1128/AEM.56.6.1858-1864.1990 |
| [49] | Kunapuli U, Lueders T, Meckenstock RU. The use of stable isotope probing to identify key iron-reducing microorganisms involved in anaerobic benzene degradation. The ISME Journal, 2007, 1(7): 643-653. DOI:10.1038/ismej.2007.73 |
| [50] | Kleemann R, Meckenstock RU. Anaerobic naphthalene degradation by Gram-positive, iron-reducing bacteria. FEMS Microbiology Ecology, 2011, 78(3): 488-496. DOI:10.1111/j.1574-6941.2011.01193.x |
| [51] | Lovley DR, Woodward JC, Chapelle FH. Stimulated anoxic biodegradation of aromatic hydrocarbons using Fe(Ⅲ) ligands. Nature, 1994, 370(6485): 128-131. DOI:10.1038/370128a0 |
| [52] | Lovley DR, Woodward JC. Mechanisms for chelator stimulation of microbial Fe(Ⅲ)-oxide reduction. Chemical Geology, 1996, 132(1/4): 19-24. |
| [53] | Kunapuli U, Jahn MK, Lueders T, Geyer R, Heipieper HJ, Meckenstock RU. Desulfitobacterium aromaticivorans sp. nov. and Geobacter toluenoxydans sp. nov., iron-reducing bacteria capable of anaerobic degradation of monoaromatic hydrocarbons. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(3): 686-695. DOI:10.1099/ijs.0.003525-0 |
| [54] | Holmes DE, Risso C, Smith JA, Lovley DR. Anaerobic oxidation of benzene by the hyperthermophilic archaeon Ferroglobus placidus. Applied and Environmental Microbiology, 2011, 77(17): 5926-5933. DOI:10.1128/AEM.05452-11 |
| [55] | Dhote M, Kumar A, Juwarkar A. Petroleum contaminated oil sludge degradation by defined consortium:influence of biosurfactant production. Proceedings of the National Academy of Sciences, India Section B:Biological Sciences, 2016, 88(3): 517-523. |
| [56] | Kumari S, Regar RK, Manickam N. Improved polycyclic aromatic hydrocarbon degradation in a crude oil by individual and a consortium of bacteria. Bioresource Technology, 2018, 254: 174-179. DOI:10.1016/j.biortech.2018.01.075 |
| [57] | Zhang T, Tremblay PL, Chaurasia AK, Smith JA, Bain TS, Lovley DR. Anaerobic benzene oxidation via phenol in Geobacter metallireducens. Applied and Environmental Microbiology, 2013, 79(24): 7800-7806. DOI:10.1128/AEM.03134-13 |
| [58] | Botton S, Parson JR. Degradation of BTEX compounds under iron-reducing conditions in contaminated aquifer microcosms. Environmental Toxicology and Chemistry, 2006, 25(10): 2630-2638. DOI:10.1897/06-004R.1 |
| [59] | Abu Laban N, Selesi D, Rattei T, Tischler P, Meckenstock RU. Identification of enzymes involved in anaerobic benzene degradation by a strictly anaerobic iron-reducing enrichment culture. Environmental Microbiology, 2010, 12(10): 2783-2796. |
| [60] | Van Der Zaan BM, Saia FT, Stams AJM, Plugge CM, De Vos WM, Smidt H, Langenhoff AA, Gerritse J. Anaerobic benzene degradation under denitrifying conditions:Peptococcaceae as dominant benzene degraders and evidence for a syntrophic process. Environmental Microbiology, 2012, 14(5): 1171-1181. DOI:10.1111/j.1462-2920.2012.02697.x |
| [61] | Coates JD, Bhupathiraju VK, Achenbach LA, Mclnerney MJ, Lovley DR. Geobacter hydrogenophilus, Geobacter chapellei and Geobacter grbiciae, three new, strictly anaerobic, dissimilatory Fe(Ⅲ)-reducers. International Journal of Systematic and Evolutionary Microbiology, 2001, 51(2): 581-588. DOI:10.1099/00207713-51-2-581 |
| [62] | Lentini CJ, Wankel SD, Hansel CM. Enriched Iron(Ⅲ)-Reducing Bacterial Communities are Shaped by Carbon Substrate and Iron Oxide Mineralogy. Frontiers in Microbiology, 2012, 3: 404. |
| [63] | Qu D, Mao H, Zeng C. Effect of chromate, ferrihydrite and glucose on dissimilatory Fe(Ⅲ) reduction in paddy soil. Journal of Northwest Sci-tech University of Agriculture and Forestry (Natural Science Edition), 2004, 32(10): 43-46. (in Chinese) 曲东, 毛晖, 曾辰. 添加铬、铁及葡萄糖对土壤中异化铁还原的影响. 西北农林科技大学学报(自然科学版), 2004, 32(10): 43-46. DOI:10.3321/j.issn:1671-9387.2004.10.010 |
| [64] | Tahara T, Oshimura M, Umezawa C, Kanatani K. Isolation, partial characterization, and mode of action of Acidocin J1132, a two-component bacteriocin produced by Lactobacillus acidophilus JCM 1132. Applied and Environmental Microbiology, 1996, 62(3): 892-897. |
| [65] | McCormick M, Gerdenich, Kao LS, Adriaens P. Geochemistry of hydrous ferric oxide reduction by Geobacter metallireducens:Implications for Sustained Dechlorination of Tetrachloromethane//Goldschmidt 2000. Oxford:Cambridge Publications, 2000: 685-689. |
| [66] | Li XM, Li YT, Li FB, Zhou SG, Feng CH, Liu TX. Interactively interfacial reaction of iron-reducing bacterium and goethite for reductive dechlorination of chlorinated organic compounds. Chinese Science Bulletin, 2009, 54(16): 1880-1884. (in Chinese) 李晓敏, 李永涛, 李芳柏, 周顺桂, 冯春华, 刘同旭. 有机氯脱氯转化的铁还原菌与铁氧化物界面的交互反应. 科学通报, 2009, 54(13): 1880-1884. |
| [67] | Piepenbrock A, Dippon U, Porsch K, Appel E, Kappler A. Dependence of microbial magnetite formation on humic substance and ferrihydrite concentrations. Geochimica et Cosmochimica Acta, 2011, 75(22): 6844-6858. DOI:10.1016/j.gca.2011.09.007 |
| [68] | Sturm A, Fowle DA, Jones C, Leslie K, Nomosatryo S, Henny C, Canfield DE, Crowe SA. Rates and pathways of CH4 oxidation in ferruginous Lake Matano, Indonesia. Geobiology, 2019, 17(3): 294-307. DOI:10.1111/gbi.12325 |
| [69] | Holden JF, Adams MWW. Microbe-metal interactions in marine hydrothermal environments. Current Opinion in Chemical Biology, 2003, 7(2): 160-165. DOI:10.1016/S1367-5931(03)00026-7 |
| [70] | Roh Y, Liu SV, Li GS, Huang HS, Phelps TJ, Zhou JZ. Isolation and characterization of metal-reducing thermoanaerobacter strains from deep subsurface environments of the Piceance Basin, Colorado. Applied and Environmental Microbiology, 2002, 68(12): 6013-6020. DOI:10.1128/AEM.68.12.6013-6020.2002 |
| [71] | Lovley DR, Roden EE, Phillips EJP, Woodward JC. Enzymatic iron and uranium reduction by sulfate-reducing bacteria. Marine Geology, 1993, 113(1/2): 41-53. |
| [72] | Lloyd JR, Macaskie LE. A novel phosphorimager-based technique for monitoring the microbial reduction of technetium. Applied and Environmental Microbiology, 1996, 62(2): 578-582. DOI:10.1128/AEM.62.2.578-582.1996 |
| [73] | Caccavo F Jr, Lonergan DJ, Lovley DR, Davis M, Stolz JF, McInerney MJ. Geobacter sulfurreducens sp. nov., a hydrogen-and acetate-oxidizing dissimilatory metal-reducing microorganism. Applied and Environmental Microbiology, 1994, 60(10): 3752-3759. DOI:10.1128/AEM.60.10.3752-3759.1994 |
