刘晶1, 徐美娟1

 , 满在伟2, 高惠芳1, 张显1, 杨套伟1, 许正宏1, 饶志明1
, 满在伟2, 高惠芳1, 张显1, 杨套伟1, 许正宏1, 饶志明1

1. 江南大学生物工程学院, 工业微生物教育部重点实验室, 江苏 无锡 214122;
2. 常州大学石油化工学院, 食品学院, 江苏 常州 213164
收稿日期:2019-12-07;修回日期:2020-02-09;网络出版日期:2020-05-08
基金项目:国家重点研发计划(2018YFA0900300);国家自然科学基金(31770058);江苏省自然科学基金(BK20181205);宁夏回族自治区重点研发计划(2019BCH01002);国家轻工技术与工程一流学科自主课题资助(LITE2018-06)
*通信作者:徐美娟, E-mail:xumeijuan@jiangnan.edu.cn;
饶志明, Tel/Fax:+86-510-85916881, E-mail:raozhm@jiangnan.edu.cn.
摘要:L-精氨酸是一种半必需氨基酸,广泛应用于食品、制药、饲料等行业。[目的] 当前对L-精氨酸生产菌株的研究,极少涉及离子转运领域。在本研究中,发现在发酵时适量添加外源K+有利于促进钝齿棒杆菌(Corynebacterium crenatum)SYPA5-5合成L-精氨酸。[方法] 在C. crenatum SYPA5-5发酵培养基外源添加0.5 g/L和2.5 g/L的K3PO4,取对数期发酵样品进行转录组数据分析,挖掘出K+转运相关的阳离子转运ATP酶CTAP1以及单价阳离子/H+逆转运蛋白Mrp1A,研究其在C. crenatum SYPA5-5快速合成L-精氨酸阶段,对菌株生长及L-精氨酸合成的影响。[结果] 对基因ctap1和mrp1分别进行敲除和过表达,深入研究突变株对L-精氨酸合成的影响。研究发现同时过表达离子转运蛋白CTAP1和Mrp1A更有利于胞内离子、pH稳态和渗透压调节,最终提高L-精氨酸的产量。在补料分批发酵中分别过表达Mrp1A、CTAP1以及同时过表达Mrp1A和CTAP1的菌株L-精氨酸产量分别达到61.4 g/L、63.9 g/L和65.3 g/L,产率分别为0.383 g/g、0.392 g/g和0.395 g/g,比C. crenatum SYPA5-5分别提高了34.9%、38.0%和39.1%。[结论] 段CTAP1是特异性的K+转运ATP酶,可以将培养基中的K+运输到胞内。同时Mrp1A可将胞内K+和Na+等单价阳离子运输到胞外,将胞外H+运输至胞内,中和胞内L-精氨酸所导致的碱性环境,从而维持胞内pH稳定。CTAP1和Mrp1A的研究为解析离子转运机制和L-精氨酸合成之间的联系奠定了基础。
关键词:钝齿棒杆菌SYPA5-5阳离子转运ATP酶CTAP1单价阳离子/H+逆转运蛋白Mrp1A钾离子
The ion transporter endows ion- and pH-homeostasis enhancing L-arginine synthesis in Corynebacterium crenatum
Jing Liu1, Meijuan Xu1

 , Zaiwei Man2, Huifang Gao1, Xian Zhang1, Taowei Yang1, Zhenghong Xu1, Zhiming Rao1
, Zaiwei Man2, Huifang Gao1, Xian Zhang1, Taowei Yang1, Zhenghong Xu1, Zhiming Rao1

1. The Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214000, Jiangsu Province, China;
2. School of Petrochemical Engineering, Changzhou University, Changzhou 213164, Jiangsu Province, China
Received: 7 December 2019; Revised: 9 February 2020; Published online: 8 May 2020
*Corresponding author: Meijuan Xu, E-mail:xumeijuan@jiangnan.edu.cn;
Zhiming Rao, Tel/Fax: +86-510-85916881, E-mail:raozhm@jiangnan.edu.cn.
Foundation item: Supported by the National Key Research and Development Program (2018YFA0900300), by the National Natural Science Foundation of China (31770058), by the Natural Science Foundation of Jiangsu Province (BK20181205), by the Key Research and Development Program of Ningxia Hui Autonomous Region (2019BCH01002), and by the National First-class Discipline Program of Light Industry Technology and Engineering (LITE2018-06)
Abstract: L-arginine is a semi-essential amino acid that is widely used in food, pharmacy and feed industries. In recent years, the metabolic engineering of L-arginine producing strains is rarely involved in the field of ion transport. [Objective] In this study, we found that adding appropriate K+ in the medium was beneficial to Corynebacterium crenatum SYPA5-5 to increase L-arginine production. [Methods] Transcriptome of C. crenatum SYPA5-5 was analyzed under the concentrations of 0.5 g/L and 2.5 g/L K3PO4. We selected significant monovalent cation/H+ antiporter Mrp1A and cation transport ATPase CTAP1 to investigate the relation among K+ transport, growth and L-arginine synthesis in C. crenatum SYPA5-5. [Results] The genes mrp1 and ctap1 were deleted and overexpressed to analyze their effects on the production of L-arginine in C. crenatum SYPA5-5. The overexpression of Mrp1A and CTAP1 was beneficial to ion homeostasis, pH tolerance and osmoregulation, ultimately increasing L-arginine production. In fed-batch fermentation, L-arginine production of 5-5(mrp1), 5-5(ctap1) and 5-5(mrp1ctap1) strains reached 61.4 g/L, 63.9 g/L and 65.3 g/L. The yield reached 0.383, 0.392 and 0.395 g/g, which were 34.9%, 38.0% and 39.1% increase compared with C. crenatum SYPA5-5, respectively. [Conclusions] The CTAP1 is K+ transporter that can transport K+ from extracellular to intracellular. Meanwhile, the Mrp1A can transport K+ and Na+ to the extracellular, and the extracellular H+ was transported into the cell, thus maintaining the intracellular pH stability. The study of Mrp1A and CTAP1 provide a foundation for understanding the relationship between ion transport mechanisms and L-arginine synthesis.
Keywords: Corynebacterium crenatum SYPA5-5cation transport ATPase CTAP1monovalent cation/H+ antiporter Mrp1AK+
L-精氨酸是一种天然碱性氨基酸,水溶液呈强碱性,pH 10.5–12.0。其在食品添加剂、调味品和制药行业有着广泛的应用[1-2]且有益于人类的生长发育[3]。L-精氨酸生产方法之一为水解法,但由于大量使用腐蚀性化学物质,该方法对环境有害。而利用微生物发酵生产L-精氨酸相对简单且对环境的影响较小[4-5]。在本研究中,C. crenatum SYPA5-5又称SDNN403,为课题组通过诱变选育得到的一株L-精氨酸高产菌株[6]。课题组前期研究发现C. crenatum SYPA5-5的argR基因发生终止突变,导致阻遏蛋白ArgR失去活性,这是C. crenatum SYPA5-5高产L-精氨酸的前提[7-8]。在C. crenatum SYPA5-5中过表达基因簇argCJBDFRGH,可提高L-精氨酸产量[7, 9]。定点突变C. crenatum SYPA5-5中的N-乙酰谷氨酸激酶(NAGK),NAGK对L-精氨酸具有抗反馈抑制作用,因此过表达NAGK可提高L-精氨酸产量[7, 10]。通过调控C. crenatum SYPA5-5中的6-磷酸葡萄糖异构酶、天冬氨酸激酶和谷氨酸激酶的酶活水平,可以促进胞内NADPH再生同时弱化副产物合成,从而进一步提高L-精氨酸产量[2]。
前期研究发现C. crenatum SYPA5-5在无K+存在的情况下添加磷酸根,L-精氨酸合成明显下降,且添加浓度越高产量下降越显著,摇瓶发酵L-精氨酸产量由不加K+的20 g/L降至5 g/L。且据文献报道K+是胞内含量最丰富的离子,参与多种细胞生理活动[11]。K+可以控制质膜电位,调节胞内pH,激活胞内酶[11-13]。在酸性条件下,棒杆菌的生长完全取决于K+的有效性和内部积累[13]。此外,K+还可以作为一种渗透溶质,在高渗透压胁迫下,许多细菌迅速积累K+以恢复其膨胀压[12, 14]。Wilson等报道,棒杆菌在胞内外形成离子梯度,在细菌的离子转运过程中发挥着至关重要的作用,尤其是H+、K+和Na+是细菌中最关键、最重要的一价阳离子[15]。细菌的转运系统也在不同的胞外环境下发挥作用,如碱性pH和高渗透压条件[16]。H+用于调节胞内pH,从而保证适宜的胞内环境。Na+对细菌细胞的重要性通常归因于其在溶质吸收中的作用[16]。因此离子在胞内外的分布影响着菌体的存活。
呼吸链对细菌很重要,质子跨膜转移产生的初级电化学电位,是许多重要转运的驱动力。沈锡辉等报道质子通过电化学电位进入细胞,随着运输,离子被暂时困在胞内和胞外[17]。一旦外部通道打开,如图 1所示,3个Na+输出到胞外,随之2个K+运输到胞内。如前所述,电化学质子电位是一些重要的细胞过程如ATP合成或代谢物运输的驱动力。这种由电化学质子电位驱动的交换受H+-ATP酶的调节,且有助于维持离子梯度[18-19],证实了Na+/H+或K+/H+的转运在调节离子浓度、pH和渗透压稳态等重要生理功能中的作用[20]。
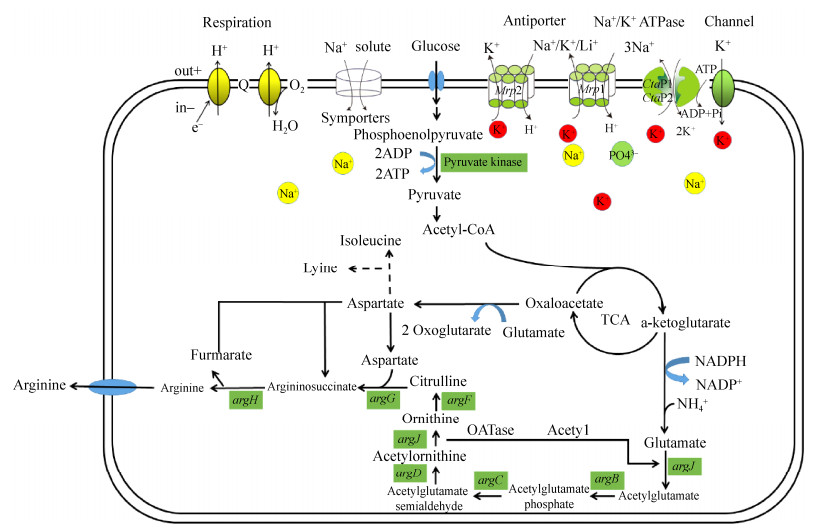 |
| 图 1 钝齿棒杆菌SYPA5-5离子转运蛋白的转运机理 Figure 1 The mechanism of ion transporter in C. crenatum SYPA5-5. |
| 图选项 |
前期研究发现,C. crenatum SYPA5-5外源添加2.5 g/L K3PO4时L-精氨酸产量较外源添加0.5 g/L K3PO4高。通过转录组数据分析,发现C. crenatum SYPA5-5的大部分单价阳离子/H+逆转运蛋白和阳离子转运ATP酶在L-精氨酸合成阶段转录水平明显提高,因此我们挖掘了表达水平显著提高的离子转运蛋白Mrp1A和CTAP1,并以C. crenatum SYPA5-5为模板,扩增出目的基因片段mrp1和ctap1,测序后,与野生型菌株进行序列比对,发现转运蛋白Mrp1A和CTAP1并未发生突变,进而探讨其对维持C. crenatum SYPA5-5胞内离子浓度和pH稳定、促进L-精氨酸合成的作用。
1 材料和方法 1.1 材料
1.1.1 菌株和质粒: 本研究所用的菌株、质粒和引物见表 1和表 2。
表 1. 本研究所用菌株和质粒 Table 1. Strains and plasmids used in this study
| Strain/Plasmid | Description | Source |
| Escherichia coli | ||
| E. coli JM109 | General cloning host | TaKaRa |
| E. coli BL21(DE3) | Host for recombinant protein production | Novagen |
| Corynebacterium crenatum | ||
| SYPA5-5 | L-arginine-producing strain | Our lab |
| 5-5Δctap1 | SYPA5-5 with deletion of ctap1 | This study |
| 5-5Δmrp1 | SYPA5-5 with deletion of mrp1 | This study |
| 5-5(p10) | SYPA5-5 derivative harboring pDXW-10 | This study |
| 5-5(ctap1) | SYPA5-5 derivative harboring pDXW-10-ctap1 | This study |
| 5-5(mrp1) | SYPA5-5 derivative harboring pDXW-10-mrp1 | This study |
| 5-5(mrp1ctap1) | SYPA5-5 derivative harboring pDXW-10-ctap1 and pDXW-10-mrp1 | This study |
| Plasmids | ||
| pK18mobsacB | Kanr; vector for in-frame deletions | [21] |
| pK18Δctap1 | For in-frame deletion of ctap1 | This study |
| pK18Δmrp1 | For in-frame deletion of mrp1 | This study |
| pDXW-10 | Kanr; shuttle vector between E. coli and C. crenatum | [22] |
| pDXW-10-ctap1 | Derived from pDXW-10, for constitutive expression of ctap1 | This study |
| pDXW-10-mrp1 | Derived from pDXW-10, for constitutive expression of mrp1 | This study |
| pDXW-10-mrp1ctap1 | Derived from pDXW-10, for constitutive expression of mrp1 and ctap1 | This study |
表选项
表 2. 本研究所涉及的引物 Table 2. Primers used in this study
| Primers | DNA Sequence (5′–3′)a |
| Δctap1-1 | CGCGGATCCCCAAATCCCTGGATGTTATTC(BamH I) |
| Δctap1-2 | CTTTTGCGCCCTCACGAATCGCGTCACCCGTGAGATAAGACTCATC |
| Δctap1-3 | GACGCGATTCGTGAGGGCGCAAAAG |
| Δctap1-4 | CCCAAGCTTTGCTTCGGACGTGACATCGGAG(Hind III) |
| Δmrp1-1 | ATTCGAGCTCGGTACCCGGGGATCCTGCACCGTCAGCCGC |
| Δmrp1-2 | CCCATCCACTAAACTTAAACAGCATTATCCCTAATCGCCCAT |
| Δmrp1-3 | TGTTTAAGTTTAGTGGATGGGTTCTCGCACTGACAGTCGC |
| Δmrp1-4 | CGACGGCCAGTGCCAAGCTTCGCGAAAGGCACGATGATGT |
| 10-ctap1-F | GCAGCTTAAGCCGCGGAATGCTGGTCAGGGACATTTTTAT |
| 10-ctap1-R | CGCTAGCGAGCTCCCACTAAGAAACTTTTTCTTGCGTATC |
| 10-mrp1-F | CGCCAAAACAGAAGCTTATGAGTTTGCTATTTGTTGTGGC |
| 10-mrp1-R | CAGATCTCCGCGGCTTAAGTCATCGGTTTGCCTCCTCTTT |
| 10-mrp1ctap1-1 | GCCAAAACAGAAGCTTATGAGTTTGCTATTTGTTGTGGCG |
| 10-mrp1ctap1-2 | AATGTCCCTGACCAGCATTCATCGGTTTGCCTCCTCTTTG |
| 10-mrp1ctap1-3 | CAAAGAGGAGGCAAACCGATGAATGCTGGTCAGGGACATT |
| 10-mrp1ctap1-4 | GGGTACCAGATCTCCGCGGCTAAGAAACTTTTTCTTGCGTATCAAAAT |
| a The underlined part is the restriction site. The italicized part is the reverse complementary sequence. | |
表选项
1.1.2 主要试剂: 酵母提取物、蛋白胨、酵母浸粉等,各种分子操作工具酶,总RNA提取、反转录和荧光定量PCR试剂盒,细菌基因组和质粒提取试剂盒。
1.1.3 主要实验仪器: 本研究所用实验仪器主要包括美国瓦里安有限公司的ICP-MS,美国安捷伦公司液相色谱,南京江南光电电子显微镜,德国Eppendorf公司5 L发酵罐,日本东芝公司超声波破碎仪,山东省科学院生物研究所SBA生物传感器,上海尤尼柯仪器有限公司紫外可见分光光度计和德国徕卡显微系统公司激光共聚焦显微镜等。
1.1.4 培养基: LB培养基:酵母提取物0.5%,蛋白胨1%,NaCl 1%;LB0培养基:酵母提取物0.5%,蛋白胨1%;LBG培养基:LB+葡萄糖0.5%;LBGS培养基:LBG+蔗糖20%。
摇瓶发酵培养基:葡萄糖11% (与其他组分分开灭菌),酵母浸粉1%,KCl 0.1%,KH2PO4 0.15%,MgSO4·7H2O 0.05%,(NH4)2SO4 4%,FeSO4·7H2O 0.002%,MnSO4·H2O 0.002%,CaCO3 2%。
发酵罐发酵种子培养基:葡萄糖5%,酵母浸粉2%,KCl 0.1%,KH2PO4 0.15%,MgSO4·7H2O 0.05%,(NH4)2SO4 2%,CaCO3 0.1%。
发酵罐发酵初始培养基:葡萄糖7%,酵母浸粉0.8%,KCl 0.1%,KH2PO4 0.15%,MgSO4·7H2O 0.05%,(NH4)2SO4 2%,FeSO4·7H2O 0.002%,MnSO4·H2O 0.002%。
发酵罐发酵补料培养基:葡萄糖50%,酵母浸粉0.8%,(NH4)2SO4 2%。
钝齿棒杆菌电转感受态培养基:蛋白胨1%,酵母提取物0.5%,NaCl 1%,葡萄糖1%,甘氨酸0.4%,异烟肼0.4%,吐温80 0.1%。
1.2 菌株的生长 挑一环平板活化的钝齿棒杆菌菌落接入液体LBG培养基中,30 ℃、180 r/min回旋式摇床培养至OD600≈10.0。
1.3 转录组数据分析 C. crenatum SYPA5-5发酵至对数中后期,收集发酵样品,立即4 ℃、8000 r/min离心10 min,弃上清后,液氮速冻,–80 ℃保存,转录组样本送南京诺唯赞有限公司进行RNA提取,RNA质检合格后用于转录组测序。获得原始测序数据后,进行基因表达分析、基因差异表达分析、KEGG Pathway功能富集分析等。
1.4 重组菌的构建
1.4.1 敲除质粒的构建: 以C. crenatum SYPA5-5基因组为模板,利用引物对Δmrp1-1/Δmrp1-2和Δmrp1-3/Δmrp1-4扩增出mrp1基因上下游片段各500 bp。回收后,以上下游片段为模板,利用mrp1-1和mrp1-4引物融合PCR扩增出mrp1基因缺失片段。纯化回收PCR产物获得mrp1基因缺失片段,pK18质粒酶切产物纯化回收,利用同源重组酶进行连接。连接产物经热激转化E. coli JM109感受态,卡那霉素抗性平板培养筛选转化子,并进行质粒提取、酶切、PCR和测序验证。验证正确,表明质粒pK18Δmrp1构建成功。
以C. crenatum SYPA5-5基因组为模板,利用引物对Δctap1-1/Δctap1-2和Δctap1-3/Δctap1-4同样方法扩增出ctap1基因缺失片段。PCR产物和pK18质粒纯化后利用限制性内切酶BamH I和Hind III双酶切,纯化回收ctap1基因缺失片段和pK18质粒酶切产物并进行过夜连接。用相同的方法进行转化、筛选、验证,成功获得质粒pK18Δctap1。
1.4.2 过表达质粒的构建: 以C. crenatum SYPA5-5基因组为模板,利用表 2所列引物进行PCR扩增即可获得mrp1基因片段,pDXW-10质粒利用限制性内切酶在MCS (多克隆位点处)进行酶切。酶切结束后,纯化回收mrp1基因和pDXW-10线性化载体,同源重组酶进行连接。连接产物热激转化至E.coli BL21感受态细胞中,卡那霉素抗性平板培养筛选转化子,并进行质粒提取、酶切、PCR和测序验证。验证正确,表明质粒pDXW-10-mrp1构建成功。同样方法构建质粒pDXW-10-ctap1。
以C. crenatum SYPA5-5基因组为模板,利用引物对10-mrp1ctap1-1/2和10-mrp1ctap1-3/4分别扩增出上游mrp1和下游ctap1基因片段。回收后,以上下游片段为模板,利用引物对10-mrp1ctap1-1/4融合PCR扩增出串联基因mrp1ctap1。纯化回收PCR产物获得mrp1ctap1基因片段,pDXW-10质粒酶切产物纯化回收,利用同源重组酶进行连接。连接产物经热激转化E.coli BL21感受态,卡那霉素抗性平板培养筛选转化子,并进行质粒提取、酶切、PCR和测序验证。验证正确,表明质粒pDXW-10-mrp1ctap1构建成功。
1.4.3 重组菌株的构建: 敲除质粒pK18Δmrp1电击转化至C. crenatum SYPA5-5菌株感受态细胞,培养2 h后离心收集细胞涂布于卡那霉素(15 μg/L)抗性平板。30 ℃培养36–48 h进行第一轮筛选,所长转化子即为发生第一次同源重组的菌株。挑取相应转化子菌落于无抗生素的LBG培养基中摇瓶培养12 h,培养过程中极少数细胞发生第二次同源重组。吸取20–50 μL培养液涂布于含有20%蔗糖无抗生素的LBG固体培养基,36–48 h后进行第二轮筛选,随机对蔗糖平板上发生第二次同源重组的转化子进行菌落PCR鉴定,鉴定正确的菌株即为5-5Δmrp1菌株。同样的方法构建突变株5-5Δctap1。
过表达质粒pDXW-10-mrp1电击转化至C. crenatum SYPA5-5菌株感受态细胞,培养2 h后离心收集细胞涂布于卡那霉素(15 μg/L)抗性平板。30 ℃培养36–48 h,随机挑取LBG平板上的转化子进行PCR鉴定,鉴定正确的菌株即为5-5 (mrp1)菌株。同样的方法构建突变株5-5 (ctap1)和5-5 (mrp1ctap1)。
1.5 胞内[Na+]/[K+]测定 取1 mL菌液8000 r/min离心2 min。弃上清,蒸馏水洗涤菌体3次,60 ℃烘干,称细胞干重,1 OD562=0.375 g/L细胞干重。取烘干菌体,用1 mL浓硝酸完全消化至澄清,再稀释100倍。将稀释后的液体经膜过滤,用ICP-MS法检测胞内[Na+]/[K+]的含量。用超纯水进行校准。
1.6 BCECF-AM荧光探针检测胞内pH 按照东仁化学科技BCECF-AM试剂盒说明书,取1 mL发酵液1000 r/min离心3 min,弃上清液,用HEPES制备细胞悬液,细胞浓度为4×107个/mL。将1 mmol/L的BCECF-AM/DMSO溶液加入细胞悬液中,37 ℃培养30 min。用HEPES缓冲液清洗细胞3次,制成3×106个/mL的细胞悬液。使用激光共聚焦显微镜在激发波500 nm、发射波530 nm处检测细胞的荧光强度。制作不同pH值对应的FIR (荧光强度比值)标准曲线,通过荧光强度判断胞内酸碱性[23]。
1.7 胞内丙酮酸激酶活性测定 取摇瓶发酵24 h的样品,离心后弃上清,按照索莱宝-丙酮酸激酶活性检测试剂盒说明书加入试剂,在340 nm处,记录各管吸光值变化。根据说明书公式计算丙酮酸激酶的活力。
1.8 重组菌株发酵 取方法1.2中培养的种子液1.5 mL接入含30 mL摇瓶发酵培养基CgXII[24]的250 mL摇瓶中或取2.5 mL接入含50 mL摇瓶发酵培养基的500 mL摇瓶中,30 ℃、180 r/min往复式摇床发酵培养。
取方法1.2中培养的种子液15 mL全部转接入1000 mL带挡板含150 mL发酵罐发酵种子培养基的摇瓶中,30 ℃、180 r/min回旋式摇床培养至OD600≈25.0作为二级种子液。二级种子液全部接入装有1.5 L发酵罐发酵初始培养基的5 L发酵罐中。当葡萄糖残留浓度小于10 g/L时,补料。通过监测发酵液的残余葡萄糖浓度,控制进料速度。补料分批发酵30 ℃,通过自动添加50%氨水,pH值维持在7.0。搅拌速度600 r/min,空气流量1 m3/(m3·min)。
1.9 产物分析 根据菌体OD562与DCW的线性关系1 OD562= 0.375 g/L DCW,由OD562计算细胞干重(DCW)。发酵液8000 r/min离心10 min后,上清用于测定葡萄糖和氨基酸。生物传感分析仪SBA-40C测定残糖量。高效液相色谱测定[25]氨基酸浓度。
2 结果和分析 2.1 K+和PO43–对L-精氨酸合成的影响 前期研究对C. crenatum SYPA5-5发酵培养基优化实验,发现在菌株合成L-精氨酸阶段,无K+存在的情况下添加磷酸根(Na3PO4)L-精氨酸合成有明显的下降,且添加浓度越高产量下降越明显,摇瓶发酵L-精氨酸产量由不加K+的20 g/L降至5 g/L。而含有K3PO4摇瓶发酵L-精氨酸产量保持在20 g/L以上。因此发酵培养基中缺乏K+导致L-精氨酸产量明显降低(图 2)。
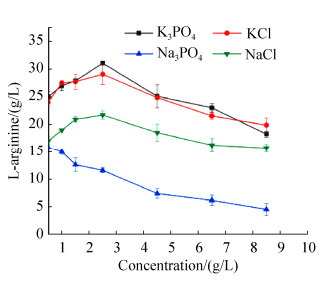 |
| 图 2 K+和PO43–对L-精氨酸合成的影响 Figure 2 The effects of K+ and PO43– on L-arginine synthesis. The data of L-arginine represents the mean values and standard deviations obtained from at least three independent experiments under different concentrations. |
| 图选项 |
2.2 转录组数据分析 C. crenatum SYPA5-5的L-精氨酸发酵培养基优化实验发现存在钾盐对发酵非常重要。转录组研究发现,C. crenatum SYPA5-5的大部分Na+、K+/H+逆转运蛋白和K+转运ATP酶表达水平在外源添加2.5 g/L K3PO4时达到最高。用‘0.5 g/L K3PO4’表示C. crenatum SYPA5-5外源添加0.5 g/L K3PO4的摇瓶发酵,‘2.5 g/L K3PO4’表示C. crenatum SYPA5-5外源添加2.5 g/L K3PO4的摇瓶发酵,每个样品具有2个独立的生物学重复。
如图 3所示,在0.5 g/L K3PO4vs·2.5 g/L K3PO4中,逆转运蛋白Mrp1相关基因Cgl0264–Cgl0269均有所上调,且Cgl0269相对显著。阳离子转运ATP酶相关基因Cgl0482、Cgl1176、Cgl0386和Cgl2962基因分别上调28.8、8.4、4.7和6.0倍。挑选相对显著上调基因Cgl0269 (mrp1)和Cgl0482 (ctap1)进行离子转运机制探究。
 |
| 图 3 C. crenatum SYPA5-5外源添加不同浓度K+转录组数据分析 Figure 3 Transcriptome data analysis of C. crenatum SYPA5-5 on different concentrations of K+ medium. Transcriptome of C. crenatum SYPA5-5 was analyzed under the concentrations of 0.5 g/L and 2.5 g/L K3PO4. Each sample has two independent biological replicates. |
| 图选项 |
2.3 重组菌株的构建 按照1.4.1和1.4.3所述方法构建敲除菌株5-5Δmrp1,基因大小为2895 bp,左右同源臂各500 bp,对所获得的转化子进行PCR验证,结果如图 4-A所示。泳道1阳性对照大小为3895 bp,泳道2为敲除整个基因后的大小为1000 bp。敲除菌株5-5Δctap1,基因大小为1953 bp,敲除中间493 bp后,对所获得的转化子进行PCR验证,结果如图 4-B所示。按照1.4.2和1.4.3所述方法构建过表达菌株5-5 (mrp1)、5-5 (ctap1)和5-5 (mrp1ctap1),对所获得的转化子进行PCR验证,结果如图 4-C、D和E所示。验证正确的提取质粒送天霖公司进行测序,测序结果显示重组菌株构建成功。
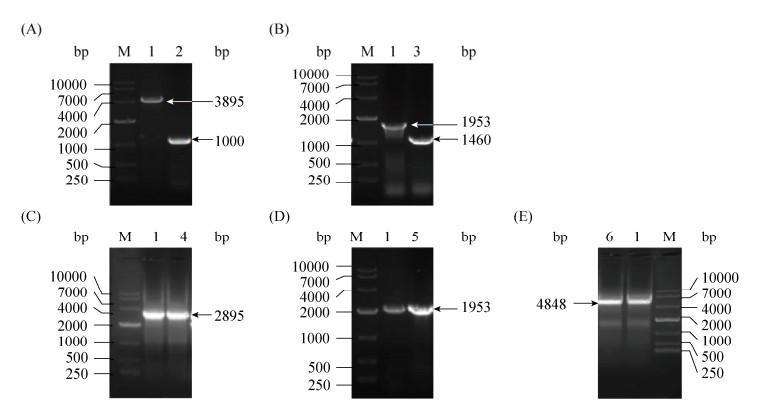 |
| 图 4 重组菌株PCR验证 Figure 4 PCR verification of recombination strains. M: DL10000 marker; lane 1: PCR result of C. crenatum SYPA5-5; lane 2: PCR result of 5-5Δmrp1; lane 3: PCR result of 5-5Δctap1; lane 4: PCR result of 5-5 (mrp1); lane 5: PCR result of 5-5(ctap1); lane 6: PCR result of 5-5 (mrp1ctap1). |
| 图选项 |
2.4 Mrp1A和CTAP1对胞内[Na+]和[K+]的影响 离子转运蛋白参与调节细胞的重要生理功能如通过Na+/K+转运维持胞内外的Na+/K+梯度,从而维持离子稳态。在碱性pH环境下,离子转运还有助于防止细胞质碱化。为了研究钝齿棒杆菌离子转运蛋白的调节功能,对C. crenatum SYPA5-5和突变株的6个不同时间点进行胞内阳离子浓度测定。如图 5所示,在pH 7.0时,与C. crenatum SYPA5-5相比,5-5?mrp1和5-5?ctap1突变株的胞内Na+浓度显著升高,而K+浓度降低。这是由于离子转运蛋白缺失使细胞内Na+无法运出细胞,胞内Na+积累导致浓度显著增加,细胞需要调节胞内离子强度,导致胞内K+浓度降低[12, 18-19]。如图 5-A所示,5-5?mrp1胞内[Na+]较C. crenatum SYPA5-5、5-5 (mrp1)和5-5 (mrp1ctap1)急速增加,且随着发酵,敲除菌株与过表达菌株胞内[Na+]差异性越显著。在发酵96 h时,5-5?mrp1胞内[Na+]分别是C. crenatum SYPA5-5、5-5 (mrp1)和5-5(mrp1ctap1)的2.48、2.09和2.35倍,而胞内[K+]随着[Na+]的升高而降低。如图 5-B所示,当离子转运蛋白CTAP1缺失时,5-5?ctap1胞内[K+]较C. crenatum SYPA5-5、5-5 (ctap1)和5-5 (mrp1ctap1)明显下降,而5-5 (ctap1)和5-5 (mrp1ctap1)胞内[K+]含量较C. crenatum SYPA5-5丰富,证明CTAP1是K+偏好性转运蛋白。
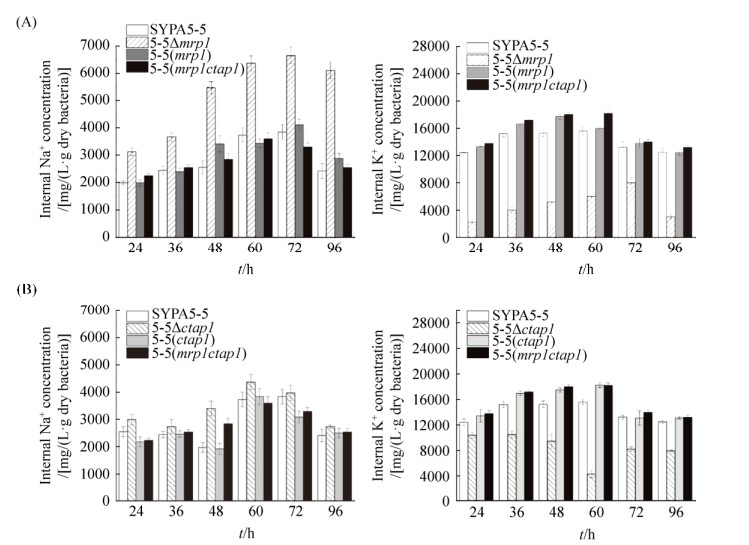 |
| 图 5 Mrp1A和CTAP1对胞内[Na+]和[K+]的影响 Figure 5 The effects of Mrp1A and CTAP1 on intracellular [Na+] and [K+]. Intracellular Na+/K+ content was determined by ICP-MS analysis as described in Materials and Methods. A: Intracellular Na+/K+ concentrations of C. crenatum SYPA5-5, 5-5?mrp1, 5-5(mrp1) and 5-5(mrp1ctap1). B: Intracellular Na+/K+ concentrations of C. crenatum SYPA5-5, 5-5?ctap1, 5-5(ctap1) and 5-5(mrp1ctap1). The results of intracellular Na+/K+ concentrations are shown as the mean of three biological replicates±standard. |
| 图选项 |
CTAP1可将培养基中的K+运输至胞内,Mrp1A逆转运蛋白将胞内Na+和K+运输至胞外,胞外H+运输至胞内,从而维持胞内外的离子稳态[18-19],同时H+进入胞内还可调节胞内pH。显然,Na+/K+,Na+/H+和K+/H+转运蛋白参与了胞内离子稳态和pH调节,为钝齿棒杆菌的生长和发酵提供了生理调节基础。
2.5 BCECF-AM荧光探针检测胞内pH C. crenatum SYPA5-5及重组菌株发酵合成L-精氨酸阶段,对胞内pH进行测定更有利于准确分析离子转运蛋白对于L-精氨酸合成的影响机制。在外源添加2.5 g/L K3PO4的摇瓶发酵培养基中发酵C. crenatum SYPA5-5及突变株,取稳定期的发酵样品,利用BCECF-AM荧光探针检测法观察荧光亮度,碱性越强,荧光强度越高,根据不同FIR(荧光强度比值)对应不同pH值,确定胞内酸碱状态。从图 6-B可以看到,Mrp1A逆转运蛋白失活时,K+/H+逆转运能力减弱,稳定期胞内合成L-精氨酸,胞内pH 8.5,呈碱性状态,荧光强度高。而图 6-E过表达Mrp1A逆转运蛋白后,H+运输到胞内,中和胞内碱性环境,胞内呈中性几乎不显荧光。敲除K+转运ATP酶CTAP1后,菌株5-5?ctap1从培养基中转运K+进入胞内的能力减弱,导致没有充足的K+进行K+/H+逆转运,导致胞内H+减少呈碱性状态,pH 8.2,荧光强度高(图 6-C)。反之过表达CTAP1后胞内呈中性,无荧光(图 6-F)。比较图 6-A和6-D,发现在稳定期,外源添加0.5 g/L K3PO4的C. crenatum SYPA5-5 (pH 8.0)荧光亮度较2.5 g/L K3PO4 (pH 7.4)高。以上实验结果证明稳定期胞内合成L-精氨酸呈碱性,只有培养基中含有充足的K+进行Na+/K+、K+/H+转运,才能中和胞内碱性环境。
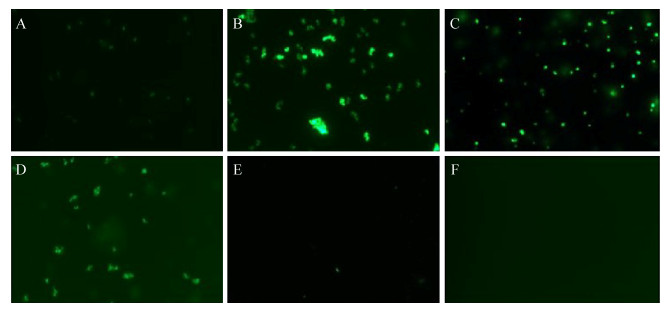 |
| 图 6 BCECF-AM荧光探针检测C. crenatum SYPA5-5及突变株胞内pH Figure 6 Detect intracellular pH of C. crenatum SYPA5-5 and mutant strains by BCECF-AM. Intracellular pH levels were measured by using the pH-sensitive fluorescent probe BCECF as described in Materials and Methods. A: C. crenatum SYPA5-5 + 2.5 g/L K3PO4, FIR 16, pH 7.4; B: 5-5?mrp1 + 2.5 g/L K3PO4, FIR 20, pH 8.5; C: 5-5?ctap1 + 2.5 g/L K3PO4, FIR 19.5, pH 8.2; D: C. crenatum SYPA5-5 + 0.5 g/L K3PO4, FIR 18.5, pH 8.0; E: 5-5(mrp1) + 2.5 g/L K3PO4, FIR 12.5, pH 7.0; F: 5-5(ctap1) + 2.5 g/L K3PO4, FIR 12.5, pH 7.0. |
| 图选项 |
2.6 探究Mrp1A和CTAP1对L-精氨酸合成的影响 在含30 mL摇瓶发酵培养基的250 mL摇瓶中对菌株进行发酵,5-5 (mrp1ctap1)菌体量明显提高,发酵前50 h,5-5 (ctap1)菌体量增加较快,到96 h,5-5 (mrp1)和5-5 (ctap1)菌体量较C. crenatum SYPA5-5均有一定程度增加。同时5-5 (mrp1)、5-5 (ctap1)和5-5 (mrp1ctap1)的L-精氨酸产量达32.5、33.0、34.9 g/L,比C. crenatum SYPA5-5分别提高了33.2%、35.8%和43.1%。5-5 (ctap1)和5-5 (mrp1ctap1)耗糖速率明显提高,在发酵85 h,将发酵液中的葡萄糖完全耗尽,产率为0.307 g/g和0.316 g/g,较C. crenatum SYPA5-5提高了35.8%和39.8%。5-5 (mrp1)在发酵结束时几乎耗尽发酵液中葡萄糖,L-精氨酸产率为0.299 g/g,较C. crenatum SYPA5-5提高了32.7%。
在5 L发酵罐补料分批发酵96 h,发酵参数分析结果如图 7所示。Mrp1A和CTAP1过表达菌株耗糖速度明显提高。发酵前期,5-5 (mrp1ctap1)和5-5 (ctap1)菌体量增加较快,明显高于原始菌株。三株过表达菌株与原始菌株相比,对L-精氨酸产量影响较大。5-5 (mrp1)、5-5 (ctap1)和5-5 (mrp1ctap1)菌株L-精氨酸产量分别达到61.4、63.9和65.3 g/L。产率分别为0.383、0.392、0.395 g/g,比C. crenatum SYPA5-5分别提高了34.9%、38.0%和39.1%。
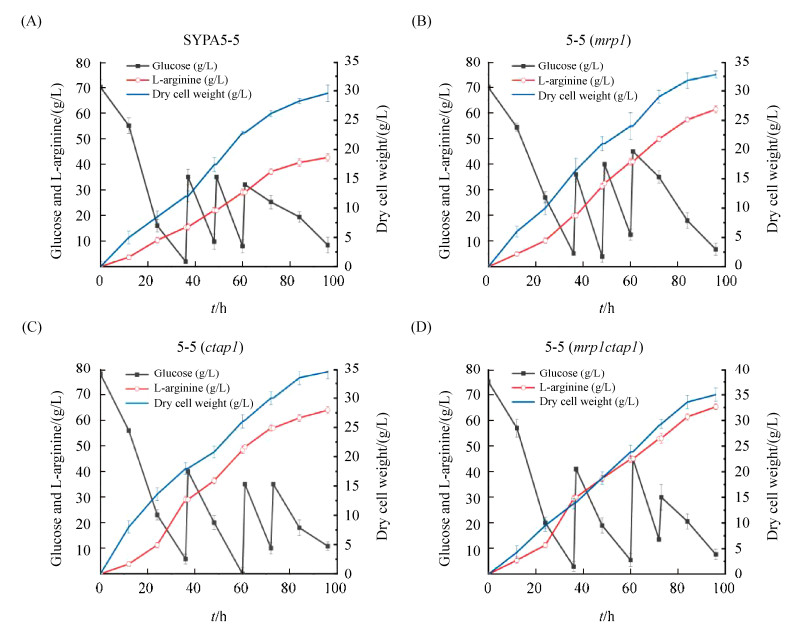 |
| 图 7 C. crenatum SYPA5-5及突变株补料分批发酵 Figure 7 Fed-batch fermentation of C. crenatum SYPA5-5 and mutant strains. Comparison of cell dry weight, glucose concentration and L-arginine production in the C. crenatum SYPA5-5 (A), 5-5 (mrp1) (B), 5-5 (ctap1) (C) and 5-5 (mrp1ctap1) (D) strains under 5 L fermentation. The results of the fermentation are shown as the mean of three biological replicates±standard. |
| 图选项 |
在发酵过程中,高浓度的底物和产物会导致渗透压和pH变化,从而影响重要的生产参数[26]。在高渗透压和pH条件下,生物量的形成速率降低,产量和产率也受到影响[27]。此时离子转运蛋白CTAP1可从培养基中运输足够的K+到胞内,然后Mrp1A逆转运蛋白将K+运输到胞外同时将胞外H+运输至胞内[18-19],中和L-精氨酸所导致的碱性环境,起到维持胞内pH稳定的作用。同时K+还可以作为一种渗透溶质且相对灵活,可以适应不同的离子通道孔[28],在发酵时高浓度的底物和产物造成高渗透压胁迫,CTAP1可迅速运输K+至胞内以恢复其膨胀压[12, 14],因此K+是维持L-精氨酸高水平产量和产率的关键。
2.7 K+对丙酮酸激酶活性及精氨酸的合成的影响 在发酵过程中,充足的能量供应也是保证L-精氨酸高效合成关键因素之一,因此ATP在L-精氨酸生物合成过程中扮演着重要角色。C. crenatum SYPA5-5通过底物水平的磷酸化和氧化磷酸化获得ATP [29]。底物水平磷酸化主要由糖酵解途径中的磷酸甘油酸激酶和丙酮酸激酶以及柠檬酸循环中的琥珀酰辅酶A合成酶催化含有高能键的化合物产生ATP等高能分子。
由表 3可以看出,过表达CTAP1的菌株丙酮酸激酶活力较C. crenatum SYPA5-5有显著提高,而逆转运蛋白Mrp1A对丙酮酸激酶活力影响不大。CTAP1可以将培养基中的K+运输到胞内,而丙酮酸激酶催化磷酸烯醇式丙酮酸生成丙酮酸的反应中需要K+的参与[30]。Agar和Bashan等认为糖酵解中丙酮酸激酶的活性依赖于钾离子[30-32]。参与精氨酸合成相关代谢途径糖酵解中丙酮酸激酶依赖K+获得最佳活性[30-32],催化含有高能键的化合物获得能量,从而为C. crenatum SYPA5-5生长提供能量。
表 3. 丙酮酸激酶活性(n=3) Table 3. The activity of PK (n=3)
| Strains | PK/(U/mg protein) | |
| 0.5 g/L K3PO4 | 2.5 g/L K3PO4 | |
| C. crenatum SYPA5-5 | 0.48±0.031 | 0.71±0.026 |
| 5-5?mrp1 | 0.39±0.017 | 0.67±0.024 |
| 5-5?ctap1 | 0.21±0.040 | 0.40±0.019 |
| 5-5(mrp1) | 0.50±0.013 | 0.73±0.030 |
| 5-5(ctap1) | 0.63±0.022 | 0.83±0.015 |
| 5-5(mrp1ctap1) | 0.66±0.041 | 0.85±0.021 |
表选项
3 讨论 当前,国内外规模化合成L-精氨酸主要集中在对生产菌株代谢工程改造如L-精氨酸合成途径的优化、辅因子NADPH优化、直接前体以及辅前体的供应等[1]。极少有涉及离子转运蛋白对L-精氨酸生产菌株生长和发酵过程中离子浓度、pH稳态和渗透压调节方面的研究。
在发酵过程中,C. crenatum SYPA5-5细胞受到各种应激因素的影响,胞内外的渗透压和pH发生改变,从而导致产量和产率也受到影响[27]。本研究旨在探究C. crenatum SYPA5-5单价阳离子/H+逆转运蛋白Mrp1A和阳离子转运ATP酶CTAP1在发酵过程中如何调节胞内离子浓度、pH和渗透压。通过过表达Mrp1A和CTAP1,L-精氨酸生成率明显提高,发酵96 h后,5-5 (mrp1ctap1)菌株L-精氨酸产量达65.3 g/L,产率为0.395 g/g,产率比C. crenatum SYPA5-5提高了39.1%。
对发酵不同时间段的胞内[Na+]和[K+]进行测定,分析发现Na+/K+和K+/H+转运蛋白参与了pH的调节和胞内阳离子的动态平衡。转运蛋白CTAP1是K+偏好性转运蛋白,其可从培养基中运输足够的K+到胞内。K+相对灵活,相比Na+可以适应不同的离子通道孔,众多单价阳离子/H+逆转运蛋白中K+特异性的K+/H+逆转运蛋白占绝大多数[28],这些K+/H+逆转运蛋白将胞内K+运输到胞外同时将胞外H+运输至胞内,中和L-精氨酸所导致的碱性环境,起到维持胞内pH稳定和离子稳态的作用。不同逆转运蛋白在碱性的胞内环境下活性并不相同,逆转运蛋白Mrp1在碱性条件下具有相对较高的Na+、K+/H+转运活力[18]。在发酵过程中,适量的PO43–有利于菌株的生长。磷是某些蛋白质和核酸的组成成分,ATP和ADP是重要的能量传递者,参与一系列的代谢反应,同时磷酸盐在培养基中还具有缓冲作用[30]。
通过对钝齿棒杆菌逆转运蛋白Mrp1A和阳离子转运ATP酶CTAP1的研究,证实其具有调节离子浓度、pH和渗透压稳态等重要生理功能,有利于提高C. crenatum SYPA5-5生产菌株的性能。本研究的离子转运蛋白为解析离子转运机制和L-精氨酸合成关系奠定了基础。
References
| [1] | Shin JH, Lee SY. Metabolic engineering of microorganisms for the production of L-arginine and its derivatives. Microbial Cell Factories, 2014, 13: 166. DOI:10.1186/s12934-014-0166-4 |
| [2] | Man ZW, Xu MJ, Rao ZM, Guo J, Yang TW, Zhang X, Xu ZH. Systems pathway engineering of Corynebacterium crenatum for improved L-arginine production. Scientific Reports, 2016, 6(1): 28629. DOI:10.1038/srep28629 |
| [3] | Zhan ML, Kan BJ, Dong JJ, Xu GC, Han RZ, Ni Y. Metabolic engineering of Corynebacterium glutamicum for improved L-arginine synthesis by enhancing NADPH supply. Journal of Industrial Microbiology & Biotechnology, 2019, 46: 45-54. |
| [4] | Wenda S, Illner S, Mell A, Kragl U. Industrial biotechnology-the future of green chemistry?. Green Chemistry, 2011, 13(11): 3007-3047. DOI:10.1039/c1gc15579b |
| [5] | Becker J, Wittmann C. Systems and synthetic metabolic engineering for amino acid production-the heartbeat of industrial strain development. Current Opinion in Biotechnology, 2012, 23(5): 718-726. DOI:10.1016/j.copbio.2011.12.025 |
| [6] | 陶文沂, 许正宏, 熊筱晶, 窦文芳, 史劲松.一种生产L-精氨酸的菌株及其诱变方法与利用该菌株生产L-精氨酸的方法.中国: CN03112896.3. 2003-02-25. |
| [7] | 徐美娟. 钝齿棒杆菌SYPA5-5发酵产L-精氨酸的代谢工程改造. 江南大学博士学位论文, 2012. |
| [8] | Xu MJ, Rao ZM, Dou WF, Xu ZH. The role of ARGR repressor regulation on L-arginine production in Corynebacterium crenatum. Applied Biochemistry and Biotechnology, 2013, 170(3): 587-597. DOI:10.1007/s12010-013-0212-4 |
| [9] | Xu MJ, Rao ZM, Yang J, Xia HF, Dou WF, Jin J, Xu ZH. Heterologous and homologous expression of the arginine biosynthetic argC~H cluster from Corynebacterium crenatum for improvement of L-arginine production. Journal of Industrial Microbiology & Biotechnology, 2012, 39(3): 495-502. |
| [10] | Xu MJ, Rao ZM, Dou WF, Yang J, Jin J, Xu ZH. Site-directed mutagenesis and feedback-resistant N-acetyl-L-glutamate kinase (NAGK) increase Corynebacterium crenatum L-arginine production. Amino Acids, 2012, 43(1): 255-266. DOI:10.1007/s00726-011-1069-x |
| [11] | Corratgé-Faillie C, Jabnoune M, Zimmermann S, Véry AA, Fizames C, Sentenac H. Potassium and sodium transport in non-animal cells:the Trk/Ktr/HKT transporter family. Cellular and Molecular Life Sciences, 2010, 67(15): 2511-2532. DOI:10.1007/s00018-010-0317-7 |
| [12] | Epstein W. The roles and regulation of potassium in bacteria. Progress in Nucleic Acid Research and Molecular Biology, 2003, 75: 293-320. DOI:10.1016/S0079-6603(03)75008-9 |
| [13] | Follmann M, Becker M, Ochrombel I, Ott V, Kr mer R, Marin K. Potassium transport in Corynebacterium glutamicum is facilitated by the putative channel protein CglK, Which is essential for pH homeostasis and growth at acidic pH. Journal of Bacteriology, 2009, 191(9): 2944-2952. DOI:10.1128/JB.00074-09 |
| [14] | Record MT Jr, Courtenay ES, Cayley DS, Guttman HJ. Responses of EE. coli to osmotic stress:large changes in amounts of cytoplasmic solutes and wate. Trends in Biochemical Sciences, 1988, 23(4): 143-148. |
| [15] | Slonczewski JL, Fujisawa M, Dopson M, Krulwich TA. Cytoplasmic pH measurement and homeostasis in bacteria and archaea. Advances in Microbial Physiology, 2009, 55: 1-79. DOI:10.1016/S0065-2911(09)05501-5 |
| [16] | Wilson TH, Ding PZ. Sodium-substrate cotransport in bacteria. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2001, 1505(1): 121-130. DOI:10.1016/S0005-2728(00)00282-6 |
| [17] | Si MR, Zhang L, Yang ZF, Xu YX, Liu YB, Jiang CY, Wang Y, Shen XH, Liu SJ. NrdH redoxin enhances resistance to multiple oxidative stresses by acting as a peroxidase cofactor in Corynebacterium glutamicum. Applied and Environmental Microbiology, 2014, 80(5): 1750-1762. DOI:10.1128/AEM.03654-13 |
| [18] | Bartsch AM. Identification and functional characterization of cation/proton antiport systems in Corynebacterium glutamicum. Doctor Dissertation of der Universit t zu K ln, 2015. |
| [19] | Xu N, Zheng YY, Wang XC, Krulwich TA, Ma YH, Liu J. The Lysine 299 residue endows the multisubunit Mrp1 antiporter with dominant roles in Na+ resistance and pH homeostasis in Corynebacterium glutamicum. Applied and Environmental Microbiology, 2018, 84(10): e00110-18. |
| [20] | Fujisawa M, Kusumoto A, Wada Y, Tsuchiya T, Ito M. NhaK, a novel monovalent cation/H+ antiporter of Bacillus subtilis. Archives of Microbiology, 2005, 183(6): 411-420. DOI:10.1007/s00203-005-0011-6 |
| [21] | Sch?fer A, Tauch A, J?ger W, Kalinowski J, Thierbach G, Pühler A. Small mobilizable multi-purpose cloning vectors derived from the Escherichia coli plasmids pK18 and pK19:selection of defined deletions in the chromosome of Corynebacterium glutamicum. Gene, 1994, 145(1): 69-73. |
| [22] | Xu DQ, Tan YZ, Shi F, Wang XY. An improved shuttle vector constructed for metabolic engineering research in Corynebacterium glutamicum. Plasmid, 2010, 64(2): 85-91. |
| [23] | Corvini PFX, Gautier H, Rondags E, Vivier H, Goergen JL, Germain P. Intracellular pH determination of pristinamycin-producing Streptomyces pristinaespiralis by image analysis. Microbiology, 2000, 146(10): 2671-2678. DOI:10.1099/00221287-146-10-2671 |
| [24] | Reddy GK, Wendisch VF. Characterization of 3-phosphoglycerate kinase from Corynebacterium glutamicum and its impact on amino acid production. BMC Microbiology, 2014, 14(1): 54. |
| [25] | Xu H, Dou WF, Xu HY, Zhang XM, Rao ZM, Shi ZP, Xu ZH. A two-stage oxygen supply strategy for enhanced L-arginine production by Corynebacterium crenatum based on metabolic fluxes analysis. Biochemical Engineering Journal, 2009, 43(1): 41-51. DOI:10.1016/j.bej.2008.08.007 |
| [26] | Gong JH, Ding JY, Chen Q, Zheng CF, Liu ZQ. Studies on the scaling-up of the L-arginine fermentation process. Acta Microbiologica Sinica, 1991, 31(6): 460-465. (in Chinese) 龚建华, 丁久元, 陈琦, 郑翠凤, 刘增强. 发酵法生产L-精氨酸放大过程的工艺研究. 微生物学报, 1991, 31(6): 460-465. |
| [27] | R?nsch H, Kr?mer R, Morbach S. Impact of osmotic stress on volume regulation, cytoplasmic solute composition and lysine production in Corynebacterium glutamicum MH20-22B. Journal of Biotechnology, 2003, 104(1/3): 87-97. |
| [28] | Carrillo-Tripp M, Saint-Martin H, Ortega-Blake I. A comparative study of the hydration of Na+ and K+ with refined polarizable model potentials. The Journal of Chemical Physics, 2003, 118(15): 7062-7073. DOI:10.1063/1.1559673 |
| [29] | Koch-Koerfges A, Kabus A, Ochrombel I, Marin K, Bott M. Physiology and global gene expression of a Corynebacterium glutamicum ΔF1FO-ATP synthase mutant devoid of oxidative phosphorylation. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2012, 1817(2): 370-380. DOI:10.1016/j.bbabio.2011.10.006 |
| [30] | Sadowska-Bartosz I, Stefaniuk I, Cieniek B, Bartosz G. Tempo-phosphate as an ESR tool to study phosphate transport. Free Radical Research, 2018, 52(3): 335-338. |
| [31] | Agar NS, Gruca MA, Hellquist LNB, Harley JD, Roberts J. Red blood cell glycolysis and potassium type in sheep. Experientia, 1977, 33(5): 670-671. DOI:10.1007/BF01946566 |
| [32] | Bashan N, Moses S, Gross Y, Livine A. The effect of Na+ and K+ on glycolytic enzymes:differential response of pyruvate kinase from dog and human erythrocytes. FEBS Letters, 1975, 54(3): 323-326. DOI:10.1016/0014-5793(75)80931-8 |
